Базовые виды горения. Характеристики процесса горения
Процесс горения и его виды
| Наименование параметра | Значение |
| Тема статьи: | Процесс горения и его виды |
| Рубрика (тематическая категория) | Население |
Горение - одно из интереснейших и жизненно необходимых для людей явлений природы. Горение является полезным для человека до тех пор, пока оно не выходит из подчинения его разумной воле. В противном случае оно может привести к пожару. Пожар - это неконтролируемое горение вне специального очага, приводящее к материальному ущербу, угрозе жизни и здоровью людей. Для предотвращения пожара и его ликвидации необходимы знания о процессе горения.
Горение - это химическая реакция окисления, сопровождающаяся выделением тепла. Для возникновения горения крайне важно наличие горючего вещества, окислителя и источника зажигания. Горючее вещество - это всякое твёрдое, жидкое или газообразное вещество, способное окисляться с выделением тепла.
Окислителями бывают, хлор, фтор, бром, Йод, окислы азота и другие вещества. В большинстве случаев при пожаре окисление горючих веществ происходит кислородом воздуха.
Источник зажигания обеспечивает энергетическое воздействие на горючее вещество и окислитель, приводящее к возникновению горения. Источники зажигания принято делить на открытые (светящиеся) - молния, пламя, искры, накалённые предметы, световое излучение; и скрытые (несветящиеся) - тепло химических реакций; микробиологические процессы, адиабатическое сжатие, трение, удары и т. п, Οʜᴎ имеют различную температуру пламени и нагрева. Всякий источник зажигания должен иметь достаточный запас теплоты или энергии, передаваемой реагирующим веществам. По этой причине на процесс возникновения горения влияет и продолжительность воздействия источника зажигания. После начала процесса горения оно поддерживается тепловым излучением из его зоны,
Горючее вещество и окислитель образуют горючую систему, которая должна быть химически неоднородной или однородной. В химически неоднородной системе горючее вещество и окислитель не перемешаны и имеют поверхность раздела (твёрдые и жидкие горючие вещества, струи горючих газов и паров, поступающих в воздух). При горении таких систем кислород воздуха непрерывно диффундирует сквозь продукты горения к горючему веществу и затем вступает в химическую реакцию. Такое горение принято называть диффузионным. Скорость диффузионного горения невелика, так как она замедляется процессом диффузии. В случае если горючее вещество в газообразном, парообразном или пылеобразном состоянии уже перемешано с воздухом (до поджигания его), то такая горючая система является однородной и процесс ее" горения зависит только от скорости химической реакции. В этом случае горение протекает быстро и принято называть кинетическим.
Горение должна быть полным и неполным. Полное горение происходит в том случае, когда кислород поступает в зону горения в достаточном количестве, В случае если кислорода недостаточно для окисления всех продуктов, участвующих в реакции, происходит неполное горение. К продуктам полного горения относятся углекислый и сернистый газы, пары воды, азот, которые неспособны к дальнейшему окислению и горению. Продукты неполного горения - окись углерода, сажа и продуты разложения вещества под действием тепла. В большинстве случаев горение сопровождается возникновением интенсивного светового излучения - пламенем.
Различают ряд видов возникновения горения: вспышка, возгорание, воспламенение, самовозгорание, самовоспламенение, взрыв.
Вспышка ~ это быстрое сгорание горючей смеси без образования повышенного давления газов. Количества тепла, ĸᴏᴛᴏᴩᴏᴇ образуется при вспышке, недостаточно для продолжения горения.
Возгорание - это возникновение горения под воздействием источника зажигания.
Воспламенение - возгорание, сопровождающееся появлением пламени. При этом вся остальная масса горючего вещества остаётся относительно холодной.
Самовозгорание - явление резкого увеличения скорости экзотермических реакций окисления в веществе, приводящее к возникновению его горения при отсутствии внешнего источника зажигания. Учитывая зависимость отвнутренних причин процессы самовозгорания делятся на химические, микробиологические и тепловые. Химическое самовозгорание происходит от воздействия на вещества кислорода воздуха, воды или от взаимодействия веществ. Самовозгораются промасленные тряпки, спецодежда, вата и даже металлическая стружка. Причиной самовозгорания промасленных волокнистых материалов является распределение жировых веществ гонким слоем на их поверхности и поглощение кислорода из воздуха. Окисление масла сопровождается выделением тепла. В случае если образуется тепла больше, чем теплопотери в окружающую среду, то возможно возникновение пожара без всякого подвода тепла. Некоторые вещества самовозгораются при взаимодействии с водой. К ним относятся калий, натрий, карбид кальция и карбиды щелочных металлов. Кальций загорается при взаимодействии с горячей водой. Окись кальция (негашеная известь) при взаимодействии с небольшим количеством воды сильно разогревается и может воспламенить соприкасающиеся с ней горючие материалы (к примеру, дерево). Некоторые вещества самовозгораются при смешивании с другими. К ним относятся в первую очередь сильные окислители (хлор, бром, фтор, йод), которые, контактируя с некоторыми органическими веществами, вызывают их самовозгорание. Ацетилен, водород, метан, этилен, скипидар под действием хлора самовозгораются на свету. Азотная кислота͵ также являясь сильным окислителем, может вызывать самовозгорание древесной стружки, соломы, хлопка. Микробиологическое самовозгорание состоит по сути в том, что при соответствующей влажности и температуре в растительных продуктах, торфе интенсифицируется жизнедеятельность микроорганизмов. При этом повышается температура и может возникнуть процесс горения. Тепловое самовозгорание происходит в результате продолжительного действия незначительного источника тепла. При этом вещества разлагаются и в результате усиления окислительных процессов самонагреваются. Полувысыхающие растительные масла (подсолнечное, хлопковое и др.), касторовая олифа, скипидарные лаки, краски и грунтовки, древесина и ДВП, кровельный картон, нитро линолеум и некоторые другие материалы и вещества могут самовозгораться при температуре окружающей среды 80 -100 °С.
Самовоспламенение ‣‣‣ это самовозгорание, сопровождающееся появлением пламени. Самовоспламеняться могут твёрдые и жидкие вещества, пары, газы и пыли в смеси с воздухом.
Взрыв (взрывное горение) - это чрезвычайно быстрое горение, ĸᴏᴛᴏᴩᴏᴇ сопровождается выделением большого количества энергии и образованием сжатых газов, способных производить механические разрушения.
Виды горения характеризуются температурными параметрами, основными из них являются следующие. Температура вспышки - это наименьшая температура горючего вещества, при которой над его поверхностью образуются пары или газы, способные кратковременно вспыхнуть в воздухе от источника зажигания. При этом скорость образования паров или газов ещё недостаточна для продолжения горения. Температура воспламенения это наименьшая температура горючего вещества, при которой оно выделяет горючие пары или газы с такой скоростью, что после воспламенения их от источника зажигания возникает устойчивое горение. Температура самовоспламенения - это самая низкая температура вещества, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся воспламенением. Температура самовоспламенения у исследованных твёрдых горючих материалов и веществ 30 - 670 °С. Самую низкую температуру самовоспламенения имеет белый фосфор, самую высокую - магний. У большинства пород древесины эта температура равна 330 - 470 °С.
Процесс горения и его виды - понятие и виды. Классификация и особенности категории "Процесс горения и его виды" 2014, 2015.
Он может родиться, окрепнуть и вырасти. Или зачахнуть и умереть. Он может быть трепетным и ласковым или коварным, жадным и яростным. Он набрасывается, пожирает, проглатывает. С ним борются - он отступает побежденный. Он может принести спасение или обернуться ужасной трагедией.
Огонь! - это и возглас надежды заплутавшего путника и суровая команда, несущая смерть врагу.
Огненные волосы, горящие глаза, испепеляющий взгляд. Взрыв смеха, вспышка гнева, огонь желаний. Загореться мыслью, пылать энтузиазмом, гореть страстью, играть с огнем.
Достаточно примеров. Они лишь должны напомнить, какую роль играет этот дар природы в нашей жизни. Наш язык (вспомним, кстати, и о языках пламени) наделил его чертами живого существа и, наоборот, внешность человека, его эмоции и поведение часто связываются со свойствами огня, пламени, горения. Можно представить, как изумлялись первобытные люди, наблюдая со страхом и недоверием случайное возникновение огня, его изменчивость, напоминающую необычное живое существо и его бесследное исчезновение. Недаром почти у всех народов мира в первобытном обществе существовал культ огня. Его почитали, ему поклонялись. Его похищали и тщательно хранили - ведь добывать огонь научились много позже, чем его приручили.
Одно из величайших событий в истории человечества - открытие способа добывать огонь по археологическим данным произошло около ста тысяч лет назад, в эпоху среднего палеолита. Применение же природного огня, случайно возникшего от молний или вулканической лавы, для защиты от холода и хищных зверей началось, конечно, гораздо раньше.
По мере развития человеческого общества значение процессов горения все возрастало. От применения огня для чисто бытовых целей (приготовление пищи, обогревание жилища) человек перешел к использованию его в качестве источника получения механической работы в различного рода тепловых двигателях, прежде всего в паровых машинах. Стремление улучшить качество паровых машин дало толчок к возникновению науки о тепле - термодинамике. Правильное понимание основных законов, лежащих в основе процесса горения, способствовало в свою очередь дальнейшему росту энерговооруженности человеческого общества. Несмотря на то, что в последние; десятилетия был открыт и стал служить человеку новый вид энергии - ядерная энергия, роль химических источников энергии - угля, газа, нефти - не уменьшилась. В наше время химическая энергия применяется во всех отраслях народного хозяйства - от индивидуальных газовых плит до двигателей космических кораблей.
Хотя тепловая энергия и является самым первым видом энергии, которым научился пользоваться человек, наука о горении зародилась совсем недавно. Только в XVIII веке Ломоносов и Лавуазье отвергли ошибочный взгляд алхимиков, утверждавших, что вещества, способные гореть, содержат особое "вещество огня" - флогистон. В 1773 г. Лавуазье пришел к правильному пониманию горения как процесса соединения вещества с кислородом воздуха. Систематические же исследования процессов горения были начаты лишь в конце прошлого века, когда катастрофические взрывы в шахтах побудили ученых ряда стран заняться тщательным изучением режимов распространения пламени. Из-за слабого развития смежных областей науки (кинетики химических реакций, гидродинамики, теории процессов переноса) результаты этого периода развития учения о горении носят качественный характер и не связаны с процессами, происходящими на молекулярном уровне.
К середине нашего столетия появились новые стимулы к развитию науки о горении, связанные с требованиями ракетной техники. В последние десятилетия было выполнено много теоретических и экспериментальных работ, опирающихся на новейшие достижения механики жидкости и газа и кинетики химических реакций. Сегодня уже нарисована четкая и логичная схема многообразных явлений горения, на основе которой инженеры могут целенаправленно влиять, например, на скорость распространения пламени и предсказывать, как будет вести себя то или иное топливо в конкретных условиях горения.
Фарадей в своей "Истории свечи" говорит: "Явления, наблюдающиеся при горении свечи, таковы, что нет ни одного закона природы, который при этом не был бы так или иначе затронут". Хотя прошло уже более ста лет, и наука шагнула далеко вперед, эти слова остаются в силе.
Поскольку основу процесса горения составляет химическое превращение - разложение одних молекул вещества и образование других, при его изучении нужно знать законы протекания химических реакций, их механизм, скорость и т. д. Этими вопросами заснимается наука, называемая химической кинетикой.
В свою очередь химическая кинетика является одним из разделов химической физики - науки, пограничной между химией и новыми разделами физики, возникшими в начале XX века (квантовая механика, электронная теория атомов и молекул). Химическая физика занимается изучением химических проблем с помощью теоретических и экспериментальных физических методов. Таким образом, процесс горения, как и любое другое химическое превращение, может быть по-настоящему понят лишь на основе изучения строения атомов н молекул и реакций между ними. Квантовая теория строения атомов и молекул возникла лишь в XX веке, поэтому и химическая кинетика в частности, и теория быстропротекающих химических реакций при горении получают настоящее обоснование только в наши дни.
Химические реакции, идущие с большим выделением тепла, почти всегда вызывают возникновение различного рода физических явлений. В процессе горения происходит перенос тепла реагирующих веществ и продуктов горения из одного места в другое. В связи с этим исследование процессов горения возможно только при правильном учете не только химических, но и физических закономерностей. При этом те и другие процессы взаимозависимы - скорость химических реакций определяется процессами теплопередачи и диффузии вещества, и наоборот, температура, давление вещества и скорость его перемещения зависят от интенсивности химических реакций.
Конечно, со времен Фарадея открыто много нового, в частности, новый вид превращения вещества - ядерные реакции. Хотя в обычном горении ядра атомов не изменяются и, казалось бы, эти явления природы не имеют отношения к горению, следует все-таки отметить, что в настоящее время можно говорить о возможности и существования горения на ядерном уровне. К нему, конечно, следует отнести процесс энерговыделения на Солнце и других звездах. Решение проблемы управляемого термоядерного синтеза, к которой приложено много усилий со стороны ученых высокоразвитых стран, сводится в конечном счете к созданию условий, при которых ядерный очаг станет самоподдерживающимся (высокие плотности вещества и сверхвысокие температуры - десятки миллионов градусов), и к возможности регулировать скорость горения на желаемом уровне. Однако это предмет особого разговора. Мы будем рассматривать только химическое горение.
Начиная исследовать какое-либо явление, обычно обращают внимание на основные его особенности. Понимание деталей можно отложить и на будущее. Поступим и мы так же.
Процесс горения, как правило, связан с выделением тепла и света. И в пламени горящей спички и в камере сгорания космической ракеты выделение энергии приводит к возникновению высоких температур - порядка одной-двух тысяч градусов. Таким образом, непременным условием существования горения является участие в процессе веществ, реакция между которыми экзотермична, т.е. идет с выделением тепла. В процессе перестройки молекул их внутренняя, химическая энергия переходит в тепловую энергию, т.е. кинетическую энергию движения.
Одна из особенностей явления горения знакома каждому, кто хоть раз пытался разжечь костер на ветру или под дождем. Довольно просто (при достаточном количестве дров) поддерживать огонь в костре и под проливным дождем. Совсем другое дело его разжечь - обязательно нужно создать достаточно большой очаг пламени, который, оставленный на мгновенье без внимания, не погас бы. Когда такой очаг создан, он начинается сначала медленно, а потом все быстрее и быстрее разгораться и увеличиваться, охватывая в конце концов все топливо, собранное в костре. Выражаясь на языке науки о горении, существуют некоторые критические условия зажигания или воспламенения. Если эти условия выполнены, горение поддерживает себя само. В противном случае происходит потухание.
Все разнообразные и часто очень хитроумные способы разжигания костра "с одной спички" сводятся к умению так расположить дрова и вспомогательный материал - бересту, сухие щепочки,- чтобы величина пламени горящей спички превышала критический размер, необходимый для воспламенения.
Наконец, важная особенность явления горения - способность его к пространственному распространению. Вспомним лесные и степные пожары. Недаром для охраны больших массивов леса создана специальная служба слежения. С вертолетов и самолетов регулярно осматриваются большие площади лесов, а при необходимости высаживается и парашютный десант. Основное - вовремя заметить очаг пожара. Иначе он быстро захватывает большую территорию, и борьба с ним многократно усложняется. В ветреную погоду скорости распространения лесных пожаров достигают десятков километров в час.
Это свойство горения применяется и на практике. Во взрывном деле раньше широко употреблялся огнепроводный, или бикфордов, шнур. Он представляет собой пропитанную селитрой нитку, заключенную наподобие фитиля в пороховую трубку. Горение распространяется по такому шнуру со скоростью сантиметра в секунду. Шнур длиной, например, в шестьдесят сантиметров приводит к взрыву присоединенного к нему заряда ровно через минуту.
В конце концов и горение свечи тоже пример пространственного распространения пламени сверху вниз. Все эти особенности горения тесно связаны с законами протекания химических реакций. Поэтому мы с них и начнем.
II
Все многообразие окружающих нас тел обусловлено существованием всего ста с небольшим разных типов атомов. Их различные комбинации образуют и очень простые молекулы (кислород, вода, углекислый газ), и молекулы-гиганты, построенные из очень большого числа атомов (например, белки или высокомолекулярные соединения-полимеры). Слово "гиганты" в отношении молекул следовало бы, конечно, взять в кавычки: ведь по сравнению с окружающими нас предметами молекулы малы.
Не утомляя читателя числами с огромным количеством нулей после запятой (от них суть дела не намного становится понятнее), приведем простое сравнение. Предположим, мы увеличиваем в одинаковое число раз молекулу воды и теннисный мяч. Если при этом молекула станет размером с мяч, то последний будет сравним с земным шаром.
Молекулы довольно неохотно поддаются расщеплению на атомы. Возьмем, к иримеру, обыкновенный лед. Его молекула содержит два атома водорода и один атом кислорода. Нагревая лед, его можно расплавить и превратить в воду. Вода будет состоять из тех же молекул. При кипячении воды она испаряется, но и пары воды-это те же самые молекулы. Лишь нагревая водяные пары до очень высокой температуры (несколько тысяч градусов), можно разрушить молекулы и получить отдельные атомй водорода и кислорода.
При дальнейшем повышении температуры и атомы разлагаются на их составные части -положительные ядра и отрицательные электроны. Таким образом, атомы в молекуле связаны между собой довольно мощными силами.
Голландский физик Ван-дер-Ваальс, исследуя поведение плотных газов при различных температурах и давлениях, установил, что для объяснения их свойств необходимо предположить существование сил притяжения между молекулами на больших расстояниях и отталкивание на малых.
Причину возникновения межатомных и межмолекулярных сил можно понять лишь на основе квантовой механики - науки, описывающей поведение микрочастиц. Не останавливаясь на подробностях, укажем лишь, что эти силы имеют электрическую природу. Однако для расчета межатомных взаимодействий недостаточно одного известного закона Кулона. Квантовый характер движения электронов приводит к специфическим особенностям взаимодействия атомов по сравнению со взаимодействием обычных классических заряженных частиц.
Если на больших расстояниях атомы притягиваются, а на малых отталкиваются, то должно быть положение, где сила взаимодействия между атомами равна нулю (силы притяжения при уменьшении расстояния в этой точке сменяются силами отталкивания). Это так называемое положение равновесия. Поместив два атома на таком расстоянии, мы получим устойчивую молекулу. Действительно, при малейшем изменении расстояния между атомами возникают силы, стремящиеся вернуть эти атомы в исходное состояние (если расстояние увеличилось, то появляются силы притяжения, которые вызывают сближение атомов; при случайном уменьшении расстояния возникнут силы отталкивания).
В физике обычно говорят не на языке сил, а на языке энергий. Это оказывается во многих случаях удобнее. Например, при изучении движения тел в поле тяжести Земли вместо закона тяготения Ньютона часто пользуются понятием потенциальной энергии. Величина потенциальной энергии тела в поле Земли зависит от высоты, на которую оно поднято. Чем больше расстояния от Земли, тем большую работу совершает тело при падении и тем, следовательно, больше его потенциальная энергия. На поверхности Земли потенциальная энергия меньше всего.
Рис. 1
Те же рассуждения можно применить и к молекулам. Раздвинутые на большое расстояние атомы обладают потенциальной энергией, так как они притягиваются. Точно так же из-за сил отталкивания имеется потенциальная энергия и у атомов, которые сблизились на расстояние меньше равновесного. Минимальная потенциальная энергия - у атомов, находящихся в положении равновесия. На рис. 1 изображена типичная кривая, показывающая, как изменяется потенциальная энергия в зависимости от расстояния между атомами. Точка r о отвечает положению равновесия атомов. Видно, что при отклонении от этого положения энергия быстро растет. Если сначала атомы находились в точке r о , то для удаления их друг от друга на большое расстояние нужно затратить энергию, равную D . При этом из молекулы мы получим два изолированных атома. D - энергия связи атомов в молекуле, или энергия связи молекулы.
Здесь уместно провести аналогию с механикой. Если некоторое тело, находящееся в поле тяжести, движется по поверхности, изображенной на рисунке, то его потенциальная энергия будет изменяться подобным же образом. Шарик всегда скатывается в углубление, и чтобы достать его оттуда, нужно затратить некоторую энергию, пропорциональную глубине ямы.
При химическом взаимодействии происходит превращение одних молекул в другие. При этом разрушаются старые связи и возникают новые. Рассмотрим в качестве примера реакцию между молекулами А и В (исходные вещества), которая приводит к образованию К и L (молекулы-продукты):
A + B =?K + L.
Если новые молекулы прочнее старых (их суммарная энергия связи больше, чем у исходных молекул), то в результате реакции выделяется энергия. Действительно, на разрушение молекул А и В мы должны затратить меньше энергии, чем ее выделяется при образовании К и L. Такие реакции называются экзотермическими, а количество выделяющейся энергии (на одну молекулу или на единицу массы вещества) носит название теплового эффекта. Например, тепловой эффект реакции горения бензина составляет сорок пять миллионов джоулей (около десяти тысяч килокалорий) на один килограмм. Этого тепла достаточно, чтобы нагреть продукты горения до температуры в несколько тысяч градусов.
Если реакция идет с выделением тепла, это не означает, что она пойдет быстро. Ведь прежне чем образовать новые связи, нужно разрушить старые. А для этого нужно где-то взять энергию. Так, туристская группа, маршрут которой проложен из одной долины в более глубокую, должна сначала подняться на перевал. Энергия, необходимая для разрыва или существенного ослабления (достаточного для протекания реакции) связей в исходных молекулах, называется энергией активации. На рис. 2 изображены энергетические барьеры для экзотермической (а ) реакции и реакции, идущей с поглощением тепла (б - эндотермический процесс). Величина Е -энергия активации, или тот барьер, который должны преодолеть исходные молекулы, чтобы вступить в реакцию, Q - тепловой эффект реакции.
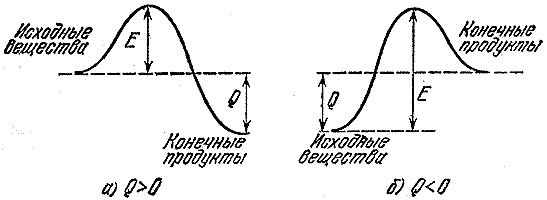
Рис. 2
Разрушение или ослабление химических связей может произойти под действием теплового (поступательного или колебательного) движения атомов и молекул. Природа устроена так, что энергия теплового движения при умеренных температурах обычно много меньше энергии активации. Так, для типичных реакций горения энергия активации в десятки тысяч раз превышает энергию теплового движения молекул. В этом причина столь малой скорости химического превращения при обычных температурах.
В газе при нормальных условиях каждая молекула испытывает в среднем десять миллиардов столкновений в секунду. Если бы каждое столкновение приводило к реакции, то она произошла бы мгновенно. Опыт не подтверждает этого. Например, смесь водорода и кислорода (гремучий газ) при комнатной температуре можно хранить совершенно спокойно. Все дело в том, что лишь очень малая доля столкновений оказывается эффективной, т.е. приводит к образованию воды. Большинство соударений оказываются бесполезными - химическая реакция идет лишь между теми молекулами, тепловая энергия которых намного превышает среднюю. А таких молекул очень мало. Из огромного числа молекул, содержащихся в кубическом сантиметре газа, лишь несколько имеют запас тепловой энергии, достаточный для того, чтобы пошла химическая реакция.
Однако доля активных молекул очень сильно возрастает с повышением температуры. Соответственно растет и скорость химической реакции. Чтобы почувствовать это, проще всего обратиться к числам. Реакция образования йодистого водорода из молекул водорода и йода при 290 К (комнатная температура) практически не идет: за миллион лет прореагировала бы всего одна тысячная процента смеси. Если же повысить температуру всего в два раза (до шестисот градусов Кельвина), то реакция в смеси закончилась вы всего за полтора часа. А при температуре в восемьсот градусов смесь прореагировала бы в течение секунды.
Для многих химических реакций справедливо следующее, довольно грубое, утверждение: повышение температуры на десять градусов приводит к удвоению скорости реакции.
Это свойство химических реакций природа использовала в процессе эволюции живых существ. Некоторые млекопитающие в трудное для них время года, зимние месяцы, впадают в спячку. При этом температура тела падает и лишь на несколько градусов превышает температуру окружающей среды. Жизненные процессы резко замедляются, что позволяет организму ограничить отдачу тепла наружу и преодолеть трудности, связанные с нехваткой питания. Наоборот, иногда выгодно повысить температуру тела (например, во время болезни) для того чтобы усилить обмен веществ и ускорить течение жизненных процессов. С этим успешно справляются органы терморегуляции организма.
Свойство химических реакций сильно ускоряться с повышением температуры лежит в основе объяснения и процессов горения.
III
Изучение горения лучше всего начать с какого-нибудь простого случая. Свеча для этого нам не годится - слишком много побочных факторов сопутствуют химической реакции горения. Топливо сначала должно расплавиться, затем подняться по фитилю, испариться и лишь потом, смешавшись с кислородом воздуха, сгореть. Вспомним слова Фарадея: "Как можно что-нибудь изучать, когда мешают трудности, не относящиеся к делу?"
Целесообразно начать с горения газов. Это связано с тем, что газовые химические реакции лучше изучены, чем реакции в конденсированных телах или на их поверхности. Кроме того, и многие физические процессы (теплопроводность, диффузия) в газовых системах мы можем рассчитывать лучше, чем в твердом теле или жидкости.
Пусть в некотором сосуде находится смесь газов, способная к экзотермической реакции. Если температура газа достаточно низка (например, комнатная), то лишь небольшая доля молекул может вступить в химическую реакцию. Для многих горючих смесей скорость реакции при комнатной температуре столь ничтожна, что они могут сохраняться очень долго. Повысим теперь температуру газа - возрастет скорость химической реакции, а вместе с нею и скорость выделения тепла. Это приведет к дальнейшему, уже самопроизвольному нагреву газа за счет его химической энергии.
Если бы не было потерь энергии через стенки сосуда, то произошел бы, как обычно говорят, тепловой взрыв. Повышение температуры вело бы к росту скорости химической реакции, а рост скорости реакции к увеличению температуры. Скорость этого процесса очень быстро возрастает во времени, так что он носит взрывной характер. Повышение температуры газа после завершения реакции пропорционально тепловому эффекту.
При учете потерь энергии газа через стенки сосуда могут осуществиться два случая. Если размеры сосуда достаточно велики, то теплопотери малы по сравнению с тепловыделением за счет химической реакции. Действительно, скорость выделения энергии пропорциональна объему сосуда, т.е. кубу его линейного размера, а теплопотери-поверхности, которая пропорциональна квадрату линейного размера.
Увеличение объема сосуда снижает роль теплопотерь. Взрыв будет происходить, но менее бурно, чем в неограниченном сосуде. Если же роль теплопотерь велика (небольшой объем газа), то взрыв не успеет развиться - после некоторого повышения температуры газа устанавливается стационарный режим, при котором тепловыделение равно теплопотерям и реакция идет с почти постоянной, обычно малой, скоростью.
Необходимо отметить, что переход от невзрывного, медленного протекания реакции ко взрыву носит резкий характер. Достаточно лишь на немного увеличить размер сосуда или температуру окружающей среды, как течение реакции радикально меняется. Это один из примеров существования критических условий в горении.
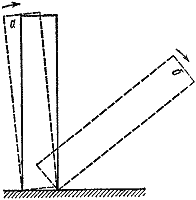
Рис. 3
Можно привести много примеров критических условий. Самые наглядные и понятные из них механические. Поставим на стол кость от домино (рис. 3). Если наклонить ее на угол, меньший некоторого, то предоставленная самой себе она вернется в начальное положение (а ). В противном случае исход опыта будет совсем иным (б ).
Читатели, знакомые с принципом действия атомного реактора, вспомнят, конечно, что там критические условия связаны с равенством скорости выделения нейтронов в объеме реактора и скорости их поглощения и вылета из реагирующей среды.
Есть критические условия и в животном мире. Чем крупнее животное, тем меньше у него отношение поверхности тела к его объему. У небольших животных потеря тепла на единицу массы очень велика, поэтому нужна очень высокая интенсивность обмена веществ. Это обстоятельство ставит предел уменьшению размеров тела теплокровного животного. Если человеку для поддержания жизни достаточно в сутки потреблять количество пищи, составляющее процент от его массы, то самое мелкое млекопитающее (землеройка массой три-пять граммов должно ежесуточно поглощать количество пищи, равное массе животного.
В рассмотренной выше постановке опыта скорость химической реакции почти постоянна по объему сосуда, поэтому тепловой взрыв охватывает весь газ. Представим теперь, что в достаточно широкой трубе находится смесь газов А и В , которые могут реагировать с выделением некоторого количества тепла Q :
А + В? K + L + Q.
Если газ холодный, то скорость реакции ничтожна, и смесь будет находиться в трубе сколь угодно долго. Нагревая газ у одного конца трубы, можно вызвать местное воспламенение смеси. Выделившееся при этом тепло будет передаваться соседним, холодным слоям газа, что приведет к распространению реакции вдоль трубы.
Если смесь прореагировала в одном конце трубы (скажем, в правом), то по ее длине будет меняться не только температура, но и концентрации исходных А и В и конечных К и L продуктов. Неравномерность температуры приводит к процессу теплопроводности, т.е. к передаче тепла от уже прореагировавших объемов газа к свежей, холодной смеси. Из-за переменности концентраций возникает явление диффузии - молекулярный перенос вещества из областей с большой его концентрацией в те места, где оно находится в недостатке. Исходные вещества диффундируют направо, конечные - налево, в несгоревшую смесь. Процессы диффузии и теплопроводности сглаживают распределения температур и концентраций. Между свежей смесью и продуктами горения появляется зона, где присутствуют конечные продукты, а температура повышена, несмотря на то, что химическая реакция здесь не идет. На левом конце этой зоны, называемой областью подогрева, температура близка к начальной температуре T 0 , а на правом - к температуре горения T 1 . Концентрация же исходного вещества падает слева направо и в конце зоны подогрева во много раз меньше начальной. Схематически распределение концентраций и температуры по длине трубы изображено на рис. 4.
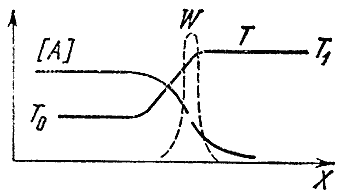
Рис. 4
Где происходит химическая реакция? Мы знаем, что ее скорость зависит от концентрации исходных веществ и температуры. Слева большая концентрация, но низкая температура, справа - наоборот.
Вспомним теперь, что скорость реакции очень сильно зависит от температуры и гораздо слабее от концентрации реагирующих веществ. Поэтому можно утверждать, что максимальная скорость химической реакции достигается в том месте, где температура наивысшая, т.е. равна T 1 . Прерывистой линией на рисунке нанесена скорость реакции W в фронте пламени. Кривая имеет резкий максимум при T 1 . Левее реакция не идет, так как там мала температура, правее - из-за нулевой концентрации исходных веществ.
Таким образом, наличие диффузии конечных продуктов реакции в исходную смесь приводит к тому, что реакция в основном идет в том месте, где исходное вещество сильно разбавлено продуктами реакции.
Приведем опять механическую аналогию. Расставим теперь в ряд много косточек от домино (рис. 5, а). Если они находятся не слишком далеко друг от друга, то достаточно уронить одну, чтобы "прореагировали" и соседние (рис. 5, б). Аналогия достаточно глубокая. Здесь можно различить и "свежую смесь", способную к реакции, но находящуюся в устойчивом состоянии (вертикально стоящие кости), "прореагировавшие" газы (лежащие кости), и "зону реакции" (падающие косточки). Так же как и в процессе горения, здесь распространяется "волна падения", которая движется со вполне определенной скоростью.
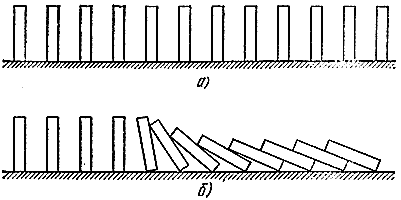
Рис. 5
Однако вернемся к газу. Проследим за судьбой некоторой порции свежей смеси. Зона химической реакции, называемая фронтом пламени (он обычно светится, так как газы нагреты), движется справа налево, поэтому выбранный нами объем газа рано или поздно попадает в зону подогрева, где он разбавляется продуктами горения и нагревается за счет тепла сгоревших ранее порций газа. Попадая же во фронт пламени и сгорая в нем, он выделяет тепло, которое идет не на саморазогрев (температура во фронте максимальна), а на нагрев следующих порций свежей смеси. Таким образом, тепловая энергия берется в долг, который погашается в процессе сгорания.
Хотя химические реакции при температурах горения порядка двух тысяч градусов протекают очень быстро, скорость распространения пламени обычно мала - порядка десятков сантиметров в секунду. Это связано с тем, что существенным элементом процесса горения является перенос тепла, который идет с незначительной скоростью.
Мы уже упоминали, что распространение пламени по трубе возможно лишь при достаточно большом ее диаметре. Если диаметр мал, то в игру вступают теплопотери из зоны реакции в стенки трубы. Существует минимальный (критический) диаметр, при котором пламя уже не может себя поддерживать - происходит срыв горения. Для обычных газовых смесей, скажем, водорода или природного газа с воздухом, значение критического диаметра составляет один-два миллиметра. Это свойство пламени и использовал Дэви в изобретенной им безопасной лампе. Медная металлическая сетка с ячейками, размер которых меньше критического, не позволяет пламени проникнуть из лампы во внешнюю среду.
На этом мы закончим рассмотрение простейшего случая горения заранее перемешанных газов. Упомянем только, что именно его демонстрировал на своих лекциях Фарадей, когда проводил удивительно красивый опыт зажигания свечи на расстоянии. От фитиля только что погашенной свечи поднимается тонкая струйка пара, который, перемешиваясь с воздухом, образует горючую смесь. Пламя от горящей лучинки проскакивает по этому огневоду к еще не успевшему остыть фитилю и зажигает свечу.
IV
Рассмотрим теперь другие типы процесса горения. На практике во многих случаях используется горение газов, которые смешиваются между собой в процессе горения. В качестве примера можно привести пламена различных газовых горелок. Горючий газ (обычно более или менее сложные углеводороды) подается через отверстие горелки в атмосферу, где и смешивается с воздухом, кислород которого необходим для горения.
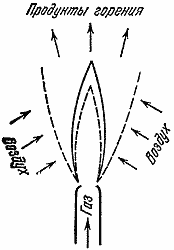
Рис. 6
Факел такой горелки состоит из нескольких зон. В центре факела находится чистый газ, снаружи - окислитель (воздух). В промежуточных зонах в процессе диффузии различных газов друг в друга происходит их смешивание. Именно здесь и находится фронт горения, т.е. область максимальной температуры и максимальной скорости химической реакции. Теплопроводность из фронта пламени обеспечивает подогрев горючего и окислителя (рис. 6). Не правда ли, факел газовой горелки напоминает пламя свечи? Однако горение свечи намного сложнее.
Если поступление газа в горелке регулируется извне, то свеча сама диктует темп подачи горючего. Иногда горелка состоит из двух концентрических труб, внутренняя из которых предназначена для подачи горючего, а через внешнюю поступает окислитель (воздух или чистый кислород).
Описывая физическую картину распространения пламени в газе, мы приняли, что плоский фронт его распространяется по неподвижной среде. В реальных тепловых установках обычно неподвижен фронт пламени, а смесь горючих газов подается в камеру сгорания с определенной скоростью.
Известно, что движение жидкости или газа может быть ламинарным (упорядоченным) или турбулентным. В первом случае движение послойное; перемешивание и теплопроводность осуществляются путем перехода отдельных молекул между слоями с различными концентрацией и температурой. При турбулентном движении газа с определенной средней скоростью существуют беспорядочные во времени и пространстве пульсации скорости как в направлении движения, так и поперек его. Эти пульсации приводят к интенсивному перемешиванию и теплопроводности путем беспорядочного перемещения макроскопических объемов газа из одного места в другое.
Естественно, что турбулентные процессы переноса во много раз эффективнее молекулярных. Турбулентное течение газа приводит к искажению плоской формы фронта горения и к расширению зоны протекания химических реакций, а следовательно, и к ускорению горения. Именно такие режимы сгорания осуществляются и в упомянутой Фарадеем игре в изюм, в костре и в камерах сгорания жидкостных ракетных двигателей.
Исследование горения газов во многом помогает понять и картину горения твердых и жидких тел, поскольку и в этих случаях очень часто химическая реакция происходит в газовой фазе. Это связано с тем, что роль окислителя при горении обычно применяемых топлив - угля, дров, нефтепродуктов - играет воздух. В этом случае процесс горения происходит на поверхности раздела: твердое тело - газ или жидкость - газ. Реакции между веществами, находящимися в разных фазах, конденсированной и газовой, называются гетерогенными. Поэтому горение твердых и жидких тел объединяется одним термином - гетерогенное горение (горение газов называется гомогенным горением). Скорость гетерогенного горения во многом определяется процессом диффузии. Действительно, чтобы происходила реакция на поверхности конденсированной фазы, необходим достаточный диффузионный подвод окислителя (например, кислорода воздуха) к поверхности тела и одновременное удаление продуктов горения.
Горение некоторых типов жидких топлив - керосина, бензина, спирта - осуществляются гомогенным образом. Такое легко испаряющееся топливо может быть без труда переведено в газообразное состояние и перемешано с воздухом. Этот процесс и осуществляется в карбюраторах двигателей внутреннего сгорания. Чтобы облегчить испарение, топливо сначала распыляют при помощи форсунок, а затем перемешивают в потоке воздуха, движущегося с большой скоростью. В результате получается однородная смесь паров горючего и воздуха.
В большинстве же случаев в процессе горения жидкого топлива ясно различаются две фазы - жидкость и газ, причем химическая реакция, как правило, идет в газообразной фазе. Дело в том, что температура испарения жидкости всегда меньше температуры пламени ее паров. Поэтому гетерогенное горение жидких топлив есть последовательность двух процессов: испарения жидкости и горения ее паров. При этом теплота, необходимая для испарения жидкости, поступает из зоны горения.
Очевидно, что ускорение сжигания жидкого топлива может быть достигнуто увеличением поверхности горения, например, при распылении его в капли. Если каплю радиусом один сантиметр разбить на капли радиуса порядка десяти микрометров, то их получится миллиард. Суммарная же поверхность капель будет превышать поверхность исходной капли в тысячу раз. Соответственно возрастет и скорость горения.
Все современные способы сжигания жидких горючих основаны на предварительном их разбрызгивании при помощи форсунок. Схема процесса горения отдельной капли состоит в следующем. Шарообразная капля окружена сферическим фронтом пламени, где достигается максимальная температура. Тепло, выделяемое химической реакцией, передается на поверхность капли, где происходит испарение жидкости. От капли к пламени диффундируют пары жидкости, а извне поступает окислитель. Навстречу ему диффундируют продукты горения. Аналогично горят и многие твердые топлива. Горючие газы получаются либо непосредственно при возгонке твердого тела (горение дров, спичка), либо при последовательном переходе твердое тело - жидкость - газ (свеча).
Горение самого распространенного твердого топлива - угля тоже обычно начинается с выделения газообразной "летучей" части. Всякое ископаемое твердое топливо содержит остатки органических веществ, которые при нагревании превращаются в газы. Большая же часть угля состоит из углерода, который и есть основной источник тепла. Хороший уголь содержит много углерода, в плохом его меньше. Так, донецкий антрацит, имеющий теплоту сгорания 7950 ккал/кг, на 96,5% состоит из углерода. При взаимодействии кислорода воздуха с углеродом на поверхности происходит чрезвычайно сложная реакция, детальный механизм которой еще окончательно не установлен. Однако важность проблемы привлекает к ней внимание со стороны многих исследователей.
Остановимся еще на важном случае горения - горении конденсированных систем, применяемых во взрывных работах и военном деле.
Пороха, или метательные взрывчатые вещества, составляющие особый класс взрывчатых веществ, предназначены для сообщения телам (снарядам, ракетам) большой скорости, имеющей вполне определенное направление. Пороха характеризуются большой устойчивостью процесса горения - даже при высоких давлениях горение их не переходит во взрыв.
С давних пор применялся для военных целей дымный, или черный порох, представляющий собой механическую смесь селитры, серы и древесного угля. При сгорании 1 кг дымного пороха образуется около трехсот литров газа. По сравнению с изобретенным в конце XIX века бездымным порохом это немного. Бездымные пороха, основа которых - пироксилин, дают гораздо больше газа - до восьмисот литров на килограмм. К бездымным порохам относятся и баллиститы, в которых вместо пироксилина используются нитроглицерин, нитродигликоль и другие вещества.
В последнее время в связи с бурным развитием ракетной техники повысился интерес к так называемым смесевым порохом. Подобно черному пороху они представляют собой смесь двух или большего числа компонентов. Один компонент является обычно окислителем - им может быть вещество, содержащее много кислорода, например, перхлорат аммония. В качестве горючего в порохе используются различные смолы и другие органические соединения. Смесевые пороха находят широкое применение в ракетной технике, так как скорость их горения может быть изменена путем варьирования состава, размеров частиц и т. п.
На этом мы закончим наш краткий обзор явлений горения.
В заключение следует отметить, что в последние годы горение оказалось связанным с рядом проблем, имеющих глобальный, общечеловеческий характер. Речь идет об энергетическом кризисе, охватившем ряд стран, и об экологических проблемах (охрана окружающей среды). Первый аспект возник в связи с истощением природных топливных ресурсов, а второй связан с вредным влиянием некоторых продуктов горения на биосферу. Решение этих проблем может быть достигнуто только совместными усилиями многих стран. Вот почему эти вопросы обсуждаются на самом высоком уровне. Понятен и тот огромный размах научных работ, которые ведутся в области горения как в нашей стране, так и за рубежом.
1. ОБЩИЕ СВЕДЕНИЯ О ПРОЦЕССАХ ГОРЕНИЯ
Процессы горения и взрыва играют большую роль в жизнедеятельности человека. С одной стороны, эти процессы широко используются в различных отраслях современной техники и технологии. Отметим лишь такие важнейшие отрасли как теплоэнергетика, двигателестроение, транспорт, ракетная техника и авиация, в которых основными источниками энергии являются управляемые процессы горения. С другой стороны, процессы горения и взрыва часто приводят к катастрофическим последствиям – лесные пожары, взрывы паровых котлов и газопроводов, ядерные взрывы и т.д. Для оценки характеристик и последствий этих явлений необходимо знать основные закономерности процессов, протекающих при горении и взрыве различных веществ.
1.1. ОСНОВНЫЕ ПОНЯТИЯ ФИЗИКИ ГОРЕНИЯ И ВЗРЫВА
Горение – это сложный физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением тепла, ярким свечением и тепломассообменом с окружающей средой. В большинстве случаев горение происходит в результате экзотермического окисления вещества, способного к горению (горючего), некоторым окислителем (кислородом воздуха, хлором, закисью азота и т.д.). При этом в процессе участвуют два основных компонента – горючее и окислитель. По этому механизму происходит горение газов, нефти, бензина, керосина, древесины, торфа и других горючих веществ – углеводородов, содержащих в химической формуле углерод и водород.
Однако процесс горения может протекать не только при реакциях соединения горючего вещества с окислителем, но и при других реакциях, связанных с выделением значительного количества теплоты и с быстрым химическим превращением. К ним относятся разложение взрывчатых веществ и озона, взаимодействие оксидов натрия и бария с диоксидом углерода, распад ацетилена и т. д.
Горение может начаться самопроизвольно в результате самовоспламенения (например, бурта зерна или торфяника), либо инициировано зажиганием (свеча автомобильного двигателя, спичка, искра короткого замыкания, раскаленные капли металла при электросварке и т. д.). Переход первоначально медленной химической реакции в режим горения обусловлен нелинейной зависимостью скорости реакции от температуры, определяемой законом Аррениуса.
Горение представляет собой комплекс взаимосвязанных химических и физических процессов. Важнейшие процессы при горении – это теплоперенос и массоперенос (перенос теплоты и вещества). Наиболее общим свойством горения является способность возникшего очага пламени перемещаться по всей горючей смеси путем передачи теплоты или путем диффузионного переноса нагретых частиц из зоны горения в свежую смесь. В первом случае механизм распространения пламени называется тепловым, во втором – диффузионным. Обычно горение протекает по комбинированному механизму, включающему как теплообмен, так и диффузию горючих компонентов и продуктов горения.
Для процессов горения характерно наличие критических условий возникновения и распространения пламени – некоторых фиксированных значений давления, температуры, размеров системы, состава горючей смеси и т.д., при достижении которых происходит воспламенение смеси, распространение пламени или его погасание. Во всех случаях для процесса горения характерны три стадии – возникновение, распространение и погасание пламени.
В зависимости от агрегатного состояния горючих компонентов (окислителя или горючего) различают три вида горения.
· Гомогенное горение – горение газов и парообразных горючих веществ в среде газообразного окислителя.
· Гетерогенное горение – горение жидких и твердых топлив (горючих веществ) в среде газообразного окислителя. Разновидностью гетерогенного горения является горение жидких капель топлива.
· Горение взрывчатых веществ и порохов.
По скорости распространения пламени горение подразделяется на дефлаграцию и детонацию. Дефлаграционное горение – это такой режим горения, при котором пламя распространяется с дозвуковой скоростью. При детонации пламя распространяется со сверхзвуковой скоростью, например, в воздухе – со скоростью более 300 м/с. Дозвуковое горение подразделяется на ламинарное и турбулентное. Скорость ламинарного горения зависит от состава смеси, начальных значений температуры и давления, а также от скорости химических превращений в пламени. Скорость распространения турбулентного пламени помимо указанных факторов зависит от скорости потока, степени и масштаба турбулентности.
Предельным случаем горения является взрыв – процесс чрезвычайно быстрого выделения большого количества энергии. В результате взрыва взрывоопасная смесь, заполняющая объем, в котором произошло выделение энергии, практически мгновенно превращается в сильно нагретый газ с высоким давлением. Этот газ с большой силой воздействует на окружающую среду, вызывая образование ударной волны. Разрушения, вызванные взрывом, обусловлены именно действием ударной волны. По мере удаления от места взрыва механическое воздействие ударной волны снижается. Источником взрыва может быть не только химическое превращение, но и любой высокоэнергетический процесс (атомная или термоядерная реакция, высокое давление пара в котле, молния в атмосфере, извержение вулкана, цунами, падение метеорита и т.д.).
Горение — это химическая реакция окисления, сопровождающаяся выделением большого количества теплоты и свечением. Окислителем чаще всего является кислород воздуха, иногда — другие химические элементы: хлор, фтор и др. Например, медь может гореть в парах серы, магний — в диоксиде углерода. Для возникновения процесса горения необходимо наличие горючего вещества, окислителя и источника зажигания. Горючим называется вещество (материал, смесь, конструкция), способное самостоятельно гореть после удаления источника зажигания. Под источником зажигания понимают горячее или раскаленное тело, а также электрический разряд, обладающие запасом энергии и температурой, достаточной для возникновения горения других веществ (пламя, искры, раскаленные предметы, выделяемая при трении теплота и др.).
Горение бывает полное и неполное. Полное горение протекает при достаточном количестве кислорода (не менее 14 %), в результате чего образуются вещества, неспособные к длительному окислению (диоксид углерода, вода, азот и др.). При недостаточном содержании кислорода (менее 10 %) происходит неполное беспламенное горение (тление), сопровождающееся образованием токсичных и горючих продуктов (спиртов, кетонов, угарного газа и т. п.).
Пожар — это неконтролируемое горение вне специального очага, наносящее материальный ущерб. Пожар следует отличать от сжигания, представляющего собой контролируемое горение внутри или вне специального очага.
Пожарная опасность объекта заключается в возможности возникновения пожара и вытекающих из такого события последствий.
Пожарная безопасность объекта — это такое его состояние, при котором с регламентируемой вероятностью исключается возможность возникновения и развития пожара, воздействия на людей опасных и вредных факторов пожара, а также обеспечивается защита материальных ценностей. К опасным и вредным факторам пожара относят открытый огонь, повышенную температуру окружающей среды и предметов, токсические продукты горения, дым, пониженную концентрацию кислорода, падающие части строительных конструкций; при взрыве — ударную волну, разлетающиеся части и вредные вещества.
Горение может быть диффузионное и кинетическое. Если кислород проникает в зону горения вследствие диффузии, то оно называется диффузионным. При этом высота пламени обратно пропорциональна коэффициенту диффузии, который, в свою очередь, пропорционален температуре в степени от 0,5 до 1. Кинетическое горение возникает при предварительном перемешивании горючего газа с воздухом. Однако в пламени одновременно могут происходить процессы диффузионного горения и горения предварительно смешанных компонентов горючей смеси.
Различают также гомогенное горение веществ одинакового агрегатного состояния (чаще всего газообразного) и гетерогенное горение горючих веществ, находящихся в различных агрегатных состояниях. Последний вид горения одновременно является диффузионным.
Разные горючие вещества могут сгорать быстрее или медленнее. Скорость горения характеризуется количеством горючего вещества, сгорающего в единицу времени с единицы площади. В зависимости от скорости процесса различают собственно горение, взрыв и детонацию.
Взрыв — это быстрое превращение вещества (взрывное горение), сопровождающееся образованием большого количества сжатых газов, под давлением которых могут происходить разрушения. Горючие газообразные продукты взрыва, соприкасаясь с воздухом, часто воспламеняются, что обычно приводит к пожару, усугубляющему негативные последствия взрыва.
Детонационное горение возникает во взрывоопасной среде при прохождении по ней достаточно сильной ударной волны. При ударном сжатии температура газа может повыситься до температуры самовоспламенения. Происходит химическая реакция. Часть выделившейся теплоты затрачивается на энергетическое развитие и усиление ударной волны, поэтому она перемещается по горючей смеси не ослабевая. Такой комплекс, представляющий собой ударную волну и зону химической реакции, называют детонационной волной, а само явление — детонацией. Детонационное горение вызывает сильные разрушения и поэтому представляет большую опасность при образовании горючих газовых систем. Однако оно может происходить только при определенном минимально необходимом начальном давлении и определенных концентрациях горючего вещества в воздухе или кислороде.
Следует различать термины "самовозгорание" и "самовоспламенение". Самовозгорание — это явление резкого увеличения скорости экзотермических реакций, приводящее к горению вещества, материала или смеси в отсутствие источника зажигания. Оно может быть тепловое, химическое и микробиологическое. Самовоспламенение представляет самовозгорание, сопровождающееся появлением пламени. Температура самовоспламенения большинства горючих жидкостей находится в пределах 250...700° С (исключения: сероуглерод — 112... 150 °С, серный эфир — 175...205 °С), а твердых горючих веществ — 150...700 °С, хотя, например, целлулоид способен самовоспламеняться уже при температуре 141 °С.
физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии, тепло- и массообменом с окружающей средой и, как правило, ярким свечением. В большинстве случаев Г. происходит в результате экзотермического взаимодействия (химическая реакция, сопровождающаяся выделением тепла) вещества, способного к Г. (горючего), и окислителя (кислорода воздуха, закиси азота, хлора и т.п.). Г. может начаться самопроизвольно (самовоспламенение) или возникнуть вследствие зажигания. Начало Г. называется возгоранием либо воспламенением.
Отличное определение
Неполное определение ↓
Горение
экзотермическая реакция окисления горючего вещества, сопровождающаяся, как правило, видимым электромагнитным излучением и выделением дыма. В основе г. Лежит взаимодействие горючего вещества с окислителем, чаще всего - кислородом воздуха. Различают г о м о г е н н о е г., когда компоненты горючей системы (горючее - окислитель), находясь в газовой или жидкой фазах, растворены друг в друге, и г е т е р о г е н н о е г., когда компоненты горючей системы находятся в разных агрегатных состояниях. Г. Бывает: Медленным(тление), нормальным(дефлаграция) или взрывным (взрыв), переходящим в детонацию; Пламенным или беспламенным (поверхностным); беспламенное г. только гетерогенное; Тепловым, при котором причиной самоускорения реакции окисления является повышение температуры, и автокаталитическим (цепным), когда ускорение процесса достигается накоплением активных промежуточных катализирующих продуктов. Г. Может возникать и развиваться спонтанно, приобретая признаки стихии огня (пожар), но может быть специально организованным, целесообразным (сжигание). При пожарах в закрытых объемах (в помещении) скорость г. Зависит от вентиляции помещения и от особенностей пожарной нагрузки. Эти факторы учитываются при выборе тактики тушения пожара. Горная болезнь - заболевание, развивающееся в условиях высокогорья вследствие снижения парциального напряжения атмосферных газов, гл. Обр. Кислорода. Может протекать в острой форме (разновидность высотной болезни) или хронически, проявляясь сердечной и легочной недостаточностью, др. Симптомами. См. Также атмосферное давление.


 Если вы решили заключить брак с гражданами кубы София хелльквист и принц карл филипп
Если вы решили заключить брак с гражданами кубы София хелльквист и принц карл филипп Игры друзья ангелов онлайн
Игры друзья ангелов онлайн Реальный расход топлива Опель Антара: все модификации бензиновых и дизельных двигателей Antara 2
Реальный расход топлива Опель Антара: все модификации бензиновых и дизельных двигателей Antara 2 Реальный расход горючего на Opel Antara по отзывам автовладельцев Опель антара 2
Реальный расход горючего на Opel Antara по отзывам автовладельцев Опель антара 2