Общая формула горения. Сущность процесса горения. Материальный баланс процесса горения. Составление уравнений реакций горения горючих веществ в воздухе
Горением называется сложный физико-химический процесс, представляющий собой окислительно-восстановительную реакцию между горючим веществом и окислителем, сопровождающийся выделением тепла и излучением света. Для горения необходимо наличие трёх составляющих: горючего вещества; окислителя (кислород воздуха, озон, перекись водорода, галогены, перманганат калия, хромовый ангидрид и т. д.) и благоприятствующего фактора (источник зажигания; физико-химический или биологический процесс, протекающий с выделением тепла, нагретая поверхность).
Рассмотрим уравнение реакции ниже. Это уравнение похоже на рецепт реакций. В нем говорится, что один метан реагирует с двумя молекулами кислорода с образованием одной молекулы двуокиси углерода и двух молекул воды. Стрелка, обозначенная как стрелка завершения, отделяет реагенты от продуктов. Реагенты представляют собой соединения слева от стрелки. Это соединения, используемые для инициирования реакции. Соединениями справа от стрелки являются продукты, соединения, полученные в результате реакции. Иногда формула или символ, подобный треугольнику выше, отображаются выше или ниже стрелки завершения.
С точки зрения электронной теории, горение – это перераспределение валентных электронов между горючим веществом и окислителем.
Горючим веществом называется вещество, атомы (молекулы) которого способны отдавать в процессе реакции свои валентные электроны. Горючее вещество в процессе реакции окисляется, образуя продукты окисления.
Эти символы или обозначения относятся к катализатору, который необходим для реакции. Использование треугольника, как видно выше, конкретно указывает на то, что тепло является катализатором. Это указывает на состояние вещества для конкретного реагента или продукта, в этом случае все соединения представляют собой газы. А обозначает твердое вещество, а обозначает жидкость и указывает, что вещество является водным, что означает растворение в воде.
Полный список реакций и их специфические свойства можно найти. Если элементы такие как и являются частью реагента, а также будут получены. Ниже приведены некоторые примеры реакций горения. Часто, когда вода показана как продукт в реакции горения, данное состояние вещества представляет собой жидкость. Это не так, поскольку продукты сгорания, если их оставить для охлаждения до комнатной температуры, позволят конденсировать водяной пар. Углекислый газ все еще будет намного выше точки сублимации и останется газом.
Окислителем называется вещество, атомы (молекулы) которого способны присоединять валентные электроны в процессе реакции. Окислитель в ходе реакции восстанавливается.
Процесс горения как одна из форм химического взаимодействия атомов и молекул может по-настоящему понятен только на основе изучения молекулярно-кинетической теории строения материи. Необходимо представлять, что в химических процессах, прежде чем образуются новые молекулы, разрушаются старые. Энергия, необходимая для разрыва связей в молекулах горючего и окислителя, называется энергией активации . Разрушение или ослабление химических связей в молекулах происходит под действием теплового движения атомов. Чем выше температура, тем выше доля активных молекул, тем эффективнее соударения и больше их число. Для реакции горения, как и для многих других химических реакций, справедливо положение: повышение температуры на 10 о С приводит к увеличению её скорости в 2–4 раза (правило Вант-Гоффа ). Кроме того, скорость реакции согласно закону действующих масс увеличивается с возрастанием концентрации реагентов. Скорость горения максимальна при стехиометрическом составе смеси – когда отношение реагентов соответствует коэффициентам в уравнении реакции.
Синтез
Захватывая зажженную свечу под стеклянной банкой, а затем позволяя ей остыть после погашения пламени, подтвердит наличие воды. Небольшие капли должны быть замечены на стороне стекла. Из-за большого количества молей газообразных продуктов наблюдается большое положительное изменение энтропии, также связанное с реакциями горения. Ниже приведены некоторые примеры реакций синтеза.
Часто реакции синтеза требуют катализатора, как видно из третьего примера выше. Это особенно справедливо, когда два твердых тела реагируют друг с другом. Твердые частицы не обеспечивают достаточного контакта или имеют достаточную энергию активации, чтобы реагировать самостоятельно. Катализаторы, такие как вода и тепло, помогают смягчить эти факторы. Поскольку синтетические реакции по определению имеют меньшее количество молей продуктов, чем реагенты, они обычно связаны с отрицательным изменением энтропии.
В условиях пожара горение чаще всего протекает в среде воздуха. При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Воздух состоит из азота, кислорода, водорода, углекислого и инертных газов. При ведении теоретических расчётов водород, углекислый газ и инертные газы (их вместе взятых в воздухе около 1 %) причисляют к азоту, которого в воздухе 78 %. Поэтому можно принять, что воздух состоит из 21 % кислорода и 79 % азота. Не трудно установить, что на 1 объём кислорода в воздухе приходится 3,76 объёма азота (79: 21 = 3,76) или на 1 моль кислорода приходится 3,76 моля азота и, таким образом, состав воздуха в уравнениях реакций горения – (О 2 + 3,76 N 2) .
Учтите, что во многих реакциях синтеза также образуются твердые вещества и жидкости, и иногда они потребляют газообразные реагенты для этого, и этот вопрос усугубляется. Разрушение соединения на его элементы или другие более мелкие соединения. Хлораты - разлагаются на хлориды металлов и кислород. Полученный металлический хлорид первоначально будет жидким сухом, чтобы нагреться, но в конечном итоге остынет обратно до твердого вещества.
Карбонаты - разлагаются на оксиды металлов и двуокись углерода. Разложение соединения всегда будет увеличивать количество частиц в реакции. То есть всегда будет больше молей продуктов, чем реагентов. Как и в особых случаях, отмеченных выше, карбонаты и хлораты при разложении дают газообразный продукт. Это причины реакции разложения, вызывающие очень положительное изменение энтропии. Это связано с тем, что эти реакции обычно эндотермичны, а это означает, что к реагенту необходимо добавить существенную энергию для продолжения разложения.
В реакции горения принимает участие только кислород. Азот в реакцию не вступает и выделяется из зоны горения вместе с продуктами горения. В левой части уравнения реакции горения записывают горючее вещество и воздух, в правой части – продукты горения. При уравнивании левой и правой частей уравнения реакции горения коэффициент перед горючим веществом для упрощения расчётов параметров процесса горения, как правило, не ставят, т.е. принимают равным единице, в связи с чем коэффициент перед воздухом может получаться дробным.
Скорость реакции горения и её зависимость от концентрации реагирующих веществ
Поймите, что тепло, необходимое для разложения, отличается от тепла, необходимого для сгорания. При сжигании тепло является просто катализатором, и как только начнется реакция, источник тепла не требует постоянного применения. Для реакций разложения реагент будет разлагаться только до тех пор, пока источник тепла будет постоянно применяться. Более активный металл или галоген заменяет другой металл или галоген в соединении. Более активный неметалл всегда будет заменять неметалл с более низкой реакционной способностью.
Для решения задач по определению основных параметров, характеризующих процесс горения, необходимо уметь составлять уравнения реакций горения горючих веществ в воздухе.
Обобщённая запись брутто-уравнения материального баланса реакции горения имеет вид:
n г.в. [г.в.] + n о [о]= n пг i [пг] , (1)
где n г.в, n о, n пг i – стехиометрические коэффициенты при соответствующих веществах: [г.в.] – горючее вещество, [о] – окислитель, [пг] – продукты горения.
Эта реакция работает, потому что магний более реактивный, чем металл, который он пытается заменить, медь. Точно так же эта реакция также работает, потому что бром является более реактивным, чем неметалл, который он пытается заменить, йодом. Реакция двойного смещения не будет работать, если оба продукта являются водными.
Задачи для самостоятельного решения
Однако из-за отсутствия стабильности углекислоты при комнатной температуре она сразу же разлагается на углекислый газ и воду. Однако из-за отсутствия стабильности сернистой кислоты при комнатной температуре она немедленно разлагается на газ двуокиси серы и воду.
Данное уравнение является обобщённым выражением материального баланса любой химической реакции окисления. Оно не несёт информации о промежуточных стадиях процесса, которых может быть великое множество, а выражает только начальное и конечное состояние системы. Поэтому его называют также суммарным или брутто-уравнением реакции горения. Для решения многих инженерно-технических задач этого уравнения бывает достаточно.
Однако из-за отсутствия стабильности гидроксида аммония при комнатной температуре он немедленно разлагается на газообразный аммиак и воду. Реакции с участием свободных элементов в качестве реагентов или продуктов являются окислительно-восстановительными. Посмотрите на многоатомные ионы, которые были разрушены, потому что они обычно содержат элемент, который был окислен или уменьшен.
Химические реакции газификации могут протекать в различной степени в зависимости от условий газификации и используемого сырья. Реакции горения происходят в процессе газификации, но, по сравнению с обычным горением, которое использует стехиометрический избыток окислителя, газификация обычно использует от одной пятой до одной трети теоретического окислителя. Это лишь частично окисляет углеродное сырье. В качестве процесса «частичного окисления» основными горючими продуктами газификации являются монооксид углерода и водород, при этом лишь незначительная часть углерода полностью окисляется до углекислого газа.
Рассмотрим примеры составления уравнений реакций горения горючих веществ в воздухе.
ПРИМЕР: Составить уравнение реакции горения пропана (С 3 Н 8) в воздухе.
При горении углеводородов в воздухе продуктами горения будут углекислый газ (СО 2), пары воды (Н 2 О) и азот (N 2) из воздуха:
С 3 Н 8 + (О 2 + 3,76 N 2) =CО 2 + Н 2 О + 3,76 N 2 .
Тепло, получаемое при частичном окислении, обеспечивает большую часть энергии, необходимой для проведения эндотермических реакций газификации. Другие важные реакции газификации включают. С учетом выше, реакции горения по существу выполняются до завершения в условиях нормальной газификации. И при условии высокой конверсии углерода три гетерогенные реакции могут быть сведены к двум гомогенным газофазным реакциям смены водного газа и парового метана, которые в совокупности играют ключевую роль в определении окончательного равновесного состава синтез-газа.
Уравняем эту реакцию, в результате чего число атомов каждого элемента в правой части уравнения будет равно числу атомов этих элементов в левой части.
Углерода в молекуле пропана 3 атома, следовательно, в продуктах горения образуется 3 молекулы углекислого газа. Атомов водорода в молекуле пропана 8, следовательно, в продуктах горения образуется 4 молекулы воды, так как в молекуле Н 2 О два атома водорода (8: 2 = 4). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода в правой части уравнения: число атомов кислорода в 3 молекулах СО 2 равно 6 (3 * 2 =6); число атомов кислорода в 4 молекулах воды равно 4 (4 * 1 = 4). Всего в правой части получается 10 атомов кислорода (6 + 4 = 10), следовательно, в левой части перед скобкой мы должны поставить коэффициент равный 5 (10: 2 = 5), т. к. в молекуле кислорода 2 атома. Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3,76.
В низкокислородной восстановительной среде газификатора большая часть сернистых покрытий исходного сырья до сероводорода с небольшим количеством образующегося карбонилсульфида. Азот, химически связанный в сырье, обычно превращается в газообразный азот с некоторым количеством аммиака и небольшое количество, образуя цианистый водород. Хлор первично превращается в хлористый водород. Элементы трассировки, связанные как с органическими, так и с неорганическими компонентами в корме, такие как ртуть, мышьяк и другие тяжелые металлы, появляются в различных фракциях золы и шлака, а также в газообразных выбросах и должны быть удалены из синтез-газа до дальнейшего использовать.
Окончательная запись уравнения реакции горения пропана в воздухе имеет вид:
С 3 Н 8 + 5 (О 2 + 3,76 N 2) = 3 CО 2 + 4 Н 2 О +5 *3,76 N 2 .
Коэффициент, стоящий перед скобкой воздуха, называется стехиометрическим коэффициентом реакции горения и обозначается β. В нашем случае β = 8.
При горении кислородосодержащих соединений в воздухе уравнивание реакции происходит аналогично. Однако при уравнивании атомов кислорода нужно учесть количество атомов кислорода, содержащихся в горючем веществе, которые тоже участвуют в реакции.
В таблице справа суммируются основные преобразования компонентов твердого топлива в газообразные виды как при газификации, так и при сжигании. Это ясно показывает заметные различия между газификацией и сгоранием. Они наиболее известны тем, что являются основной составляющей ископаемого топлива, а именно природного газа, нефти и угля. По этой причине часто упоминаются. Энергия получается из ископаемого топлива путем сжигания топлива. Несмотря на наличие примесей в ископаемом топливе, сжигание углеводородов является основным процессом сжигания ископаемого топлива.
Для этого из количества атомов кислорода в правой части уравнения реакции нужно вычесть количество атомов кислорода, содержащихся в горючем веществе, а потом уже делить на 2.
ПРИМЕР: Составить уравнение реакции горения пропилового спирта в воздухе.
С 3 Н 7 ОН + (О 2 + 3,76 N 2) = CО 2 + Н 2 О +3,76 N 2
Углерода в молекуле пропилового спирта 3 атома, следовательно, в продуктах горения образуется 3 молекулы углекислого газа. Атомов водорода в молекуле 8, следовательно, в продуктах горения образуется 4 молекулы воды, так как в молекуле Н 2 О два атома водорода (8: 2 = 4). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода в правой части уравнения: число атомов кислорода в 3 молекулах СО 2 равно 6 (3 * 2 =6); число атомов кислорода в 4 молекулах воды равно 4 (4 * 1 = 4). Всего в правой части получается 10 атомов кислорода (6 + 4 = 10), следовательно, в левой части перед скобкой мы должны поставить коэффициент равный 4,5 (10 - 1 = 9; 9: 2 = 4, 5). Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3, 76.
Пример сжигания углеводородов показан на рисунке. Моделирование в нижней части страницы для получения дополнительных примеров. Независимо от типа углеводорода, сжигание с кислородом дает 3 продукта: двуокись углерода, воду и тепло, как показано в общей реакции ниже. По этой причине процесс высвобождает значительные количества тепловой энергии. Эта тепловая энергия может быть использована напрямую или же она может быть преобразована в механическую энергию с использованием теплового двигателя, хотя это подлежит снижению эффективности, определяемому вторым законом термодинамики.
Окончательная запись уравнения реакции горения пропилового спирта в воздухе имеет вид:
С 3 Н 7 ОН +4,5 (О 2 + 3,76 N 2)= 3 CО 2 + 4 Н 2 О +4,5* 3,76 N 2 .
Если в состав горючего вещества входит галоген и горючее вещество не содержит водород, то в продуктах горения он будет выделяться в свободном виде (Cl 2 , Br 2 и т. д.). Если же горючее вещество содержит водород, то в продуктах горения он будет выделяться в соединении с водородом, например хлороводород (НCl ).
Сжигание углеводородов и ископаемое топливо
Если тепловая энергия преобразуется в механическую энергию, как в автомобильном двигателе, в процессе преобразования обязательно будут значительные потери энергии. Полученная полезная механическая энергия будет намного меньше начальной тепловой энергии, обеспечиваемой сжиганием углеводородов. Х относится к числу атомов углерода в углеводороде у относится к числу атомов водорода в углеводороде. По этой причине важно различать двуокись углерода и другие «отходы», которые возникают из-за примесей в топливе, таких как соединения серы и азота.
Если в состав горючего вещества входят сера, алюминий, кремний и др., то в продуктах горения будут выделяться оксиды этих элементов (SO 2 , Al 2 O 3 , SiO 2 ). При горении веществ, содержащих азот, он выделяется в виде чистого газа азота (N 2 ) и записывается отдельно от азота, содержащегося в воздухе.
C 2 H 5 Cl + 3(O 2 + 3,76 N 2) = 2 CO 2 + 2 H 2 O + HCl + 3 *3,76 N 2 ,
Так как различные углеводороды имеют разные отношения водорода к углероду, они, следовательно, производят различные соотношения воды и углекислого газа. В общем, чем дольше и сложнее молекула, тем больше отношение углерода к водороду. По этой причине сжигание равных количеств различных углеводородов приведет к различным количествам двуокиси углерода в зависимости от отношения углерода к водороду в молекулах каждого из них.
Вот уравнения, которые моделируют его полное сгорание. Метановый кислород → двуокись углерода. Свечи изготавливаются из углеводородов. На диаграмме показано, как они могут использоваться в лаборатории для исследования горения. Выделенный диоксид углерода может быть обнаружен с использованием. Это превращается в молочный, когда через него барботируется углекислый газ.
C 4 H 4 S + 6(O 2 + 3,76 N 2) = 4CO 2 + 2 H 2 O + SO 2 + 6* 3,76 N 2 ,
CH 3 NH 2 + 2,25(O 2 + 3,76 N 2) = CO 2 + 2,5 H 2 O + 0,5 N 2 + 2,25 *3,76 N 2 .
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Написать структурные формулы,составить уравнения реакций горения горючих веществ в воздухе и рассчитать стехиометрические коэффициенты.
1.1. амилбензол, абиетиновая кислота, аллиламин;
1.2. амилдифенил, адипиновая кислота, аллилизотиоцианат;
1.3. амилен, акриловая кислота, альнафт;
1.4. амилнафталин, аллилацетат, альтакс;
1.5. амилтолуол,аллилидендиацетат,амиламин;
1.6. антрацен, аллилкапроат, амилнитрат;
1.7. аценафтен, аллиловьiй спирт, амилнитрит;
1.8. ацетилен, амилацетат, амилсульфид;
1.9. бензол,амилбутират,амилтрихлорсилан;
1.10. бутилбензол, амилксилиловый эфир, амилхлорнафталин;
1.11. бутилциклогексан, амиллаурат, аминалон;
1.12. бутилциклопетан, амилметилкетон, аминоазокраситель;
1.13. гексадекан, амилолеат, аминокапроновая кислота;
1.14. гексан, амилсалицилат, аминопеларгоновая кислота;
1.15. гексилциклопентан, амилстеарат, аминоциклогексан;
1.16. гептадекан, амилфенилметиловый эфир, ампициллин;
1.17. гептан, амнлфениловый эфир, ангинин;
1.18. декан, амилформиат, анилин;
1.19. диамилбензол, анизол, антримид;
1.20. диамилнафталин, ацеталь, атофан;
1.21. дивинилацетилен, ацетальдегид, ацеклидин;
1.22. дигидроциклопентадиен, ацетилацетон, ацетанилид;
1.23. диизобутилен, ацетисалициловая кислота, ацетилхлорид;
1.24. диизопропилбензол, ацетилтрибутилцитрат, ацетоацетанилид;
1.25. диметиленциклобутан, ацетометоксан, ацетонитрил;
1.26. дитолилметан, ацетон, ацетоксим;
1.27. дифенил, ацетонилацетон, ацетоэтиламид;
1.28. дифенилметан, ацетопропиловый спирт, бензамид;
1.29. диэтилциклогексан, ацетоуксусный эфир, бензилдиэтиламин;
1.30. додекан, ацетофенон, бензилтиол;
1.31. изобутилбензол, бензальдегид, бензилхлорид;
1.32. изобутилциклогексан, бензантрон, бензилцианид;
1.33. изооктан, бензгидрол, бензимидазол;
1.34. изопентан, бензилацетат, бензоат натрия;
1.35. изопрен, бензилбензоат, бензоилхлорид;
1.36. изопропенилбензол, бензилсалицилат, бензоксазолон;
1.37. изопропилацетилен, бензилцеллозольв, бензолсульфазид;
1.38. метилциклогексан, бензилэтиловый эфир, бензолсульфамид;
1.39. метилциклопентан, бензилянтарная кислота, бензолсульфокислота;
1.40. октилтолуол, метоксибутилацетат, бензонитрил.
2. Написать структурные формулы и определить при сгорании какого горючего вещества выделится большее число молей продуктов горения?
2.1. бензофенон и бензофенонтетракарбоновая кислота;
2.2. борнеол и бутаналь;
2.3. бутановая кислота и бутилацетат;
2.4. бутилацетилрицинолеат и бутилацетоацетат
2.5. бутилбензилсебацинат и бутилбензоат;
2.6. бутилбутират и бутилвиниловый эфир;
2.7. бутилгликоль и бутилгликольацетат;
2.8. бутилглицидный эфир и бутилдиэтиладипинат;
2.9. бутилизовалериат и бутилкапронат;
2.10. бутилкарбитол и бутиллактат;
2.11. бутиллаурат и бутилметакрилат;
2.12. бутилметилкетон и бутилолеат;
2.13. бутилпропионат и бутилрициноолеат;
2.14. бутилстеарат и бутилфениловый эфир;
2.15. бутилформиат и бутилэтилацетальдегид;
2.16. бутилэтилкетон и бутилэтиловый эфир;
2.17. валериановая кислота и валериановый альдегид;
2.18. ванилин и ветиверилацетат;
2.19. ветиверовый спирт и ветинилацетат;
2.20. ветинон и винилаллиловый эфир;
2.21. винилацетат и винилбутират;
2.22. винилизобутиловый эфир и винилизооктиловый эфир;
2.23. винилизопропиловый эфир и винилкротонат;
2.24. винилметилкетон и винилоксиэтилметакрилат;
2.25. винилоктадециловый эфир и винилпропионат;
2.26. винилтриметилнониловый эфир и винилэтиловый эфир;
2.27. винилэтиловый эфир и винная кислота;
2.28. витамин А (ацетат) и витамин С;
2.29. галловая кислота и гексаналь;
2.30. гексановая кислота и гексилацетат;
2.31. гексилбутират и гексилдиэтилгексагидрофталат;
2.32. гексилметакрилат и гексилметилкетон;
2.33. гексиловый спирт и гексилпропионат;
2.34. гексилформиат и гексилцеллозольв;
2.35. гелиотропин и гептадециловый спирт;
2.36. гептаналь и гептилацетат;
2.37. гептилбутират и гептилдифенилкетон;
2.38. гептилизобутилкетон и гептилметилкетон;
2.39. гептиловый спирт и гептилпропионат;
2.40. гептилформиат и гидрохинон.
1 При сжигании топлива входящие в его состав горючие элементы ’ соединяются с кислородом воздуха. При этом происходит преобразование химической энергии топлива в тепловую, идущую на нагрев продук- ч тов сгорания топлива.
Принято различать Полное и неполное сгорание топли - В а, процесс протекания которых может идти одновременно, но Конечные результаты будут различны. Полное горение топлива мо Ж Но хар Актеризовать как быстро протекаюший Физико -химический Про Цесс взаимодействия горючего ¥ёШства Г с окислителем, сопровождающийся интенсивным выделением теплота.../
Химическую" реакцию между веществами А % Б, (протекающую с образованием продуктов М и Я, можно описать стехиометрическим уравнен ием сл Еду Ющего вид а:
Где А, б, м и н"-число молекул, участвующих в простейшем ходе реакции; Q-тепловой эффект реакции.
Подобные уравнения химических реакций отдельных горючих составляющих топлива дают лишь итоговый материальный баланс, но не отражают действительного механизма процесса. Скорость химической реакции зависит от концентрации реагирующих веществ, определяемых стехиометрическими уравнениями типа (2-1), и от температуры. О скорости реакции можно судить по изменению концентрации реагирующих или получаемых <в результате реакции веществ. Обычно реакции горения относятся к реакциям второго порядка (бимолекулярным). Ско - р©еть этих реакций Определяется в соответствии с законом действующих масс следующим образом:
Где K - константа скорости химической реакции; Сь С% - концентрация исходных веществ А и Б; а и Б - число молекул, участвующих
В реакции.
Когда прямая и обратная реакции осуществляются с одинаковыми скоростями, наступает химическое равновесие. Отношение концентраций реагирующих веществ в момент равновесия называют Константой равновесияКс, которая для газообразных веществ может быть выражена через парциальные давления реагирующих газов, и ее принято обозначать через /Ср. Величины Кс и /Ср связаны между собой уравнением
Kc = Kp(RTfn. (2-3)
В уравнении:
R- газовая постоянная, Дж/(моль-град) или икал/(моль*град);
Т - температура реакции, К;
Ап- изменение числа молей.
Зависимость константы скорости реакции от температуры можно характеризовать экспоненциальным уравнением Аррениуса:
K = k, + e RT, (2-4)
В уравнении:
Ko - предэкспоненциальный множитель;
Е - основание натуральных логарифмов;
R - газовая постоянная;
Е - энергия активации, Дж/моль или ккал/моль.
Из уравнения (2-4) следует, что протекание реакций возможно при столкновении реагирующих молекул, которые обладают определенным запасом энергии, достаточным для разрушения или ослабления внутримолекулярных связей. Величина энергии активации Е и есть этот минимальный запас энергии, обеспечивающий эффективность столкновения и химическое взаимодействие молекул; при отсутствии этой энергии химические реакции горения не происходят. Значение энергии активации для смеси газов обычно составляет величину от 83,8 до 168Х ХЮ3 КДж/моль или от 20 до 40-103 ккал/моль.
Величина предэкспоненциального множителя K0 с. изменением температуры меняется не сильно: примерно Ke=Const]/7
Для выяснения влияния температуры на скорость химической реакции используем способ, предложенный В. А. Спейше^ом [Л. 8], и объе-
В формуле:
Ха)± - скорость химической реакции при температуре Г1=500 К;
Ш2 - то же при 72=1000 К и £=168-103 КДж/моль.
Из расчета получим, что при увеличении температуры в 2 раза скорость реакции изменится в 5-10й раз. Значения констант равновесия зависят от температуры следующим образом:
^ 1п К (3 .(у
ЙТ “~ЯГ2 * Vй
В уравнении:
< 2- тепловой эффект реакции, КДж/моль или ккал/моль, при давлении /?=сопз1 или постоянном объеме;
& - константа равновесия, которую можно выразить через концентрации &с или парциальные давления реагирующих веществ £р.
Из последнего уравнения следует, что с ростам температуры величина & в реакциях с выделением теплоты (экзотермических) увеличивается, с отнятием теплоты (эндотермических) уменьшается. Отсюда
 Наиболее вероятен предложенный академиком Н. Н. Семеновым цепной характер протекания реакций^ горения с наличием промежуточных стадий реакций и соединений с активными центрами. Так, например, соединение водорода и кислорода начинается с распада молекул Н2 на атомы при их столкновении с поверхностью нагретого источника зажигания или другой молекулой М, обладающей
Наиболее вероятен предложенный академиком Н. Н. Семеновым цепной характер протекания реакций^ горения с наличием промежуточных стадий реакций и соединений с активными центрами. Так, например, соединение водорода и кислорода начинается с распада молекул Н2 на атомы при их столкновении с поверхностью нагретого источника зажигания или другой молекулой М, обладающей
/-Единичный и, и,ЛВЫСОКОЙ Энергией: Н2+М-^2Я+М, вслед-
1- И ствие чего каждый из возникших атомов во
![]() Дорода реагирует (рис. 2-1) затем с молекулой кислорода:
Дорода реагирует (рис. 2-1) затем с молекулой кислорода:
Н+02+ЗН2-^2Н20+ЗН, (2-7)
Образуя начало процесса цепной реакции горения водорода. Подобные процессы очень чувствительны к присутствию ускорителей - катализаторов, образующих промежуточные соединения типа ОН.
Если молекула, обладающая энергией активации, окисляясь, порождает одну новую активную молекулу, которая.продолжает цепь, то процесс называют Неразветвленной цепной реакцией. Если же активная молекула вызывает при реакции образование нескольких новых активных молекул, из которых одна продолжает начатую цепь, а Другие Начинают новые цепи, то такую реакцию называют Разветвленной цепной реакцией.
Схема подобной реакции показана на рис. 2-1 для водорода, как наиболее изученная спектроскопическим методом. Скорость течения цепных реакций превосходит скорость течения обычных химических реакций в сотни тысяч раз. Однако результирующая скорость реакции горения определяется скоростью самой медленной реакции, образующей данную цепь. Примерами таких реакций, кроме горения водорода, является горение углерода, имеющего более сложный характер, с участием атомарного водорода, гидроксильных радикалов и других активных центров.
 Г1/еение вкиси углереВа"
Г1/еение вкиси углереВа"
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Направление под б од а Воздуха и движения гш秧
Рис. 2-2. Схема горения твердого топлива.
Подогрев, испарение влаги; II - возгонка летучих; III - горение летучих, образование кокса; IV - горение кокса; V - выгорание кокса; VI - образование шлака.
Процесс горения любой частицы натурального твердого топлива протекает еще более сложным путем и сопровождается комплексом физико-химических явлений: начинается с подогрева топлива, сопровождающегося испарением влаги и возгонкой летучих и продолжающегося до момента воспламенения. Далее происходит горение летучих и кокса, зависящее от контакта с окислителем, зольности топлива, температур и других факторов, и заканчивается образованием шлака.
Схематически эти процессы показаны на рис. 2-2, где они искусственно разделены для возможности представления хода каждого процесса.
Все перечисленные процессы чаще протекают одновременно, чем и определяется сложность их исследования. Необходимо напомнить, что реакции веществ, находящихся в одинаковом агрегатном состоянии, называются Гомогенными; к ним относятся реакции горения газов. Реакции горения жидких и твердых топлив протекают при разном агрегатном состоянии веществ; такие реакции называются Гетерогенными.
Гетерогенные реакции сильно зависят от скорости подвода или переноса окислителя к поверхности горящей частицы - от скорости диффузии. Увеличение скорости подвода окислителя к горящей частице приводит к увеличению скорости реакции до определенных пределов. Если процесс сжигания топлива начинается с подогрева, удаления влаги и возгонки летучих, то в это время цепные реакции протекают медленно. С повышением температуры число активных центров растет, скорость реакции увеличивается, что приводит к вспышке топлива. Температуру, при которой происходит это явление, называют Температу-
Таблица 2*1 Температуры воспламенения некоторых видов топлива
|
800-850 540-594 525-588 490-570 400 380 30-90 125 |
|
80 90 90 110 140 300 230 250-400 400-500 500-600 6С0-700 700-750 |
Водород Н2 в смеси с воздухом
Окись углерода СО в смеси с воздухом Метан СН4 Этан С2Н6 Пропан С3Н8 Бутан С4Н10 Бензин Керосин
Дизельное топливо Соляровое масло
Мазут флотский Ф-12
Малосернистый 40 малосернистый 100 многосернистый 200 Древесина Торф
Бурый уголь Каменный уголь Полу антрацит Антрацит Кокс
Рой воспламенения; она зависит от свойств топлива, условий отвода теплоты и некоторых других факторов (табл. 2-1).
Развитие цепной реакции и повышение температуры ограничиваются присутствием замедлителей - ингибиторов, к которым нужно отнести инертные примеси в топочном устройстве - поверхности нагрева, негорящие частицы топлива, холодную обмуровку и другие препятствия, движению молекул. Время сгорания топлива зависит от того, сколь быстро горючая частица встретится с частицей окислителя, который содержится в поступающем воздухе. Иначе говоря, время, необходимое для сгорания топлива, складывается из времени, в течение которого достигается контакт горючего с окислителем, Тф и времени протекания химической реакции тх."
Т=тф+тх. (2-8)
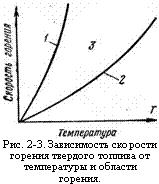 Если время контактирования больше времени химической реакции, то горение относят к диффузионному, в обратном случае горение относят к кинетическому. Изображая графически изменение скорости горения топлива (рис. 2-3) в зависимости от температуры при постоянной массовой концентрации окислителя, можно показать, что
В соответствии с уравнением Аррениуса (2-4) скорость реакции с ростом
Т Сильно увеличивается (кривая /). Область горения, ограниченная осью ординат и кривой
1, Называют
Кинетической; осью абсцисс и кривой
2 -
Диффузионной областью горения. Между кривыми
1 и 2 Существует область 3, в которой скорости химических реакций соизмеримы со скоростями диффузии.
Если время контактирования больше времени химической реакции, то горение относят к диффузионному, в обратном случае горение относят к кинетическому. Изображая графически изменение скорости горения топлива (рис. 2-3) в зависимости от температуры при постоянной массовой концентрации окислителя, можно показать, что
В соответствии с уравнением Аррениуса (2-4) скорость реакции с ростом
Т Сильно увеличивается (кривая /). Область горения, ограниченная осью ординат и кривой
1, Называют
Кинетической; осью абсцисс и кривой
2 -
Диффузионной областью горения. Между кривыми
1 и 2 Существует область 3, в которой скорости химических реакций соизмеримы со скоростями диффузии.
Представленная на рис. 2-1 схема цепного окисления водорода для случая окисленйя углерода сильно усложняется из-за образования окиси углерода СО, двуокиси углерода С02 (первичные реакции) и появления реакций типа С+СОг=2СО (вторичных реакций). При сжигании натуральных топлив количество параллельно идущих реакций значительно увеличивается, и они накладываются друг на друга. Горение жидкого и твердого топлива
Сопровождается его газификацией, когда процессу горения сопутствует термическое разложение органической массы топлива.
Воспламенение продуктов газификации Или газообразного топлива приводит к образованию Фронта пламени, состоящего из слоя смеси, обычно весьма тонкого, в котором идет процесс горения. Если фронт пламени перемещается в неподвижной среде, то протекающие в нем процессы, по данным В. А. Спейшера [Л. 8] и Н. Л. Стаскевича [Л. 9], могут быть охарактеризованы рис. 2-4.
Для возможности характеризовать горение газовоздушных смесей в ламинарном потоке пользуются понятием нормальной скорости распространения пламени:
Где ын - нормальная скорость распространения пламени, см/с; А - коэффициент температуропроводности смеси, см2/с.
Это приближенное выражение для определения ив получено из анализа размерностей в дифференциальном уравнении теплопроводности с источником и показывает, что нормальная скорость распространения пламени зависит от физических свойств смеси и ее химической активности, так как время сгорания обратно пропорционально скорости химической реакции при температуре горения.
Для движущейся горящей среды имеет значение характер ее движения. При переходе от ламинарного движения к турбулентному меняется не только очертание зоны горения, но и изменяется интенсивность процесса. Некоторое представление о влиянии режима движения смеси на скорость распространения пламени можно получить при рассмотрении рис. 2-5. Из-за больших трудностей проведения теоретических и экспериментальных исследований теория турбулентного горения еще находится в стадии разработки. Следует помнить, что в турбулентном потоке перемещивание происходит не только за счет хаотического движения молекул, но и за счет перемещений молей и значительных объемов газа
Из одного слоя в другой, что интенсифицирует процессы тепломассообмена. Поэтому рядом исследователей предлагается в отличие от модели с фронтом горения иметь модель объемного горения, показанную на рис. 2-6, или ей подобную схему.
|
Газовоздушная продукты смесь |
![]()
 Более сложным ф$ляется процесс горения твердого топлива даже в случае предварительного измельчения его до пылевидного состояния. Многочисленные исследования процесса горения частиц твердого топлива привели к установлению двух основных закономерностей -
Закона горения отдельной натуральной угольной частицы и закона распределения частиц полидисперсной угольной пыли по размерам.
Более сложным ф$ляется процесс горения твердого топлива даже в случае предварительного измельчения его до пылевидного состояния. Многочисленные исследования процесса горения частиц твердого топлива привели к установлению двух основных закономерностей -
Закона горения отдельной натуральной угольной частицы и закона распределения частиц полидисперсной угольной пыли по размерам.
Параллельное выгорание летучих и коксового остатка,-^наблюдаемое при горении угольной пыли, обусловлено различием размеров и форм частиц. Реакционной поверхностью коксового остатка можно считать сферу, к которой равномерно поступает кислород воздуха. Опытами установлено, что в реальных топочных условиях решающую роль играют реакции типа
2С + 02=2С0. (2-10);
Исходя из указанных положений наиболее вероятной схемой процесса горения является горение пылинки в топочной камере в объеме движущегося потока - выход летучих, горение летучих в движущейся среде и горение коксовой частицы с одновременными физико-химически - ми превращениями минеральной части топлива. Эти превращения происходят одновременно с диффузией окислителя к остатку частицы, горением остатка при протекании вторичных реакций продуктов сгорания на раскаленной поверхности частиц или вблизи от нее.
Схематизируя явление, можно исключить из него некоторые стадии и рассматривать горение угольной пыли после ее прогрева как Квази - ст ацио-н арный [процесс. Это позволяет записать ряд дифференциальных уравнений горения, решение которых можно выполнить с помощью электронно-вычислительных машин.
Из-за сложности этих уравнений и возможности решения технических задач с помощью более простых способов, эти уравнения в данном кур - 46
Се не приводятся, ознакомиться с ними можно в специальной литературе, например [Л. 10, 11].
Также представляет собой зону газификации с интенсивно идущим процессом слой топлива на колосниковой решетке с подачей под «его воздуха. В топку поступают газообразные продукты газификации топлива и мелкие твердые частицы горючих веществ, создающие над слоем факел. В факеле и происходит процесс сжигания, протекающий при наличии достаточного количества свободного кислорода в области диффузионного горения. Процесс, протекающий в слое, приводит к развитию высоких температур, что интенсифицирует процесс газификации топлива. По высоте слой принято делить на два участка: кислородный
Таблица 2-2
И восстановительный; толщина первого обычно мала, и свободный кислород отсутствует после прохода слоя высотой в два-трн куска топлива. При большом выходе летучих веществ эта зона сокращается, при малом - увеличивается. В той части слоя, где протекает процесс газификации топлива, свободный кислород отсутствует, отмечается даже его недостаток. Вследствие этого процесс горения выносится частично в объем над слоем, куда подается дополнительный воздух. Доступ окислителя к горючему затрудняется шлакообразованием, которое увеличивает газовое сопротивление слоя. Для слоевых топок это вызывает необходимость ограничивать содержание золы в топливе, особенно легкоплавкой, в камерных топках требует периодической очисткй поверхности нагрева от шлака.
В соответствии с изложенным процесс горения натурального топлива можно с некоторой условностью разделить на следующие стадии (табл. 2-2).
Такая разбивка на стадии условна потому, что эти стадии процесса протекают не только последовательно, но и параллельно, накладыва - ясь друг на друга, как это имеет место, например, при испарении влаги и возгонке летучих, возгонке и горении летучих, образовании и горении кокса и т. д. Продолжительность протекания отдельных стадий горения зависит от свойств топлива, конструктивных особенностей топочного устройства и ряда других факторов, из которых главными являются » процессы тепло - и массообмена.
Все это свидетельствует о большой сложности топочных, процессов
И необходимости рассмотрения любой из конструкций топки с позиций обеспечения наиболее полного сгорания топлива, наименьшего загрязнения поверхностей нагрева в топке, удобства, простоты и надежности работы устройства, быстрого регулирования производительности в достаточно широких пределах без снижения экономичности, обеспечения
Передачи наибольшего количества теплоты радиацией и возможности наиболее полной механизации и автоматизации всех процессов, связанных с работой данного топочного устройства. !


 Если вы решили заключить брак с гражданами кубы София хелльквист и принц карл филипп
Если вы решили заключить брак с гражданами кубы София хелльквист и принц карл филипп Игры друзья ангелов онлайн
Игры друзья ангелов онлайн Реальный расход топлива Опель Антара: все модификации бензиновых и дизельных двигателей Antara 2
Реальный расход топлива Опель Антара: все модификации бензиновых и дизельных двигателей Antara 2 Реальный расход горючего на Opel Antara по отзывам автовладельцев Опель антара 2
Реальный расход горючего на Opel Antara по отзывам автовладельцев Опель антара 2