Hlavná chemická reakcia procesu spaľovania. Spaľovacie procesy
Spaľovanie je fyzikálno-chemický proces charakterizovaný tromi znakmi: chemickou transformáciou, tvorbou tepla, emisiami svetla. Týmito znakmi je možné odlíšiť pálenie od iných javov. Napríklad "horenie" žiarovky nemožno nazvať horením, hoci produkuje teplo a svetlo. Tento jav nie je jedným zo znakov spaľovania - chemického procesu. Luminiscencia vlákna žiarovky je jeho žiariace prechodom elektrického prúdu na určitú teplotu s prechodom časti tepelnej energie na svetlo.
Spaľovanie je vo väčšine prípadov zložitý chemický proces. Pozostáva z elementárnych chemických reakcií redoxného typu, čo vedie k redistribúcii valenčných elektrónov medzi atómami interagujúcich molekúl. Oxidátory môžu byť rôzne látky: chlór, bróm, síra, kyslík, látky obsahujúce kyslík atď. Najčastejšie sa však musíte vysporiadať s horením v atmosfére vzduchu, zatiaľ čo oxidačným činidlom je kyslík. Je známe, že vzduch je zmesou plynov, ktorých hlavnými zložkami sú dusík (78%), kyslík (21%) a argón (0,9%). Argon obsiahnutý vo vzduchu je inertný plyn a nezúčastňuje sa procesu spaľovania.
Pri mnohých výpočtoch (určenie objemu vzduchu potrebného na spaľovanie jednej jednotky hmotnosti alebo objemu látky, zistenie objemu produktov spaľovania, teploty spaľovania atď.) Je potrebné vytvoriť rovnice pre reakcie spaľovania látok vo vzduchu. Pri zostavovaní týchto rovníc postupujte nasledovne: horľavá hmota a vzduch, ktorý sa zúčastňuje na spaľovaní, sa zapisujú do ľavej časti a za rovným znamienkom sa zapisujú produkty spaľovania. Napríklad je potrebné urobiť rovnicu pre reakciu spaľovania metánu vo vzduchu. Najprv napíšte ľavú stranu reakčnej rovnice: chemický vzorec metánu plus chemické vzorce látok, ktoré tvoria vzduch. Na uľahčenie výpočtu sa predpokladá, že vzduch pozostáva z 21% kyslíka a 79% dusíka, t. 79/21 = 3,76 objemu dusíka na jeden objem kyslíka vo vzduchu alebo 3,76 molekúl dusíka na každú molekulu kyslíka. Z tohto dôvodu môže byť zloženie vzduchu znázornené nasledovne: 02 + 3,76N2. Potom bude ľavá strana rovnice vyzerať takto:
CH4 + 02 + 3,76N2 =.
Aké produkty sa prejavia? Je potrebné zamerať sa na zloženie horľavých látok. Pri plnom spaľovaní sa uhlík s palivom vždy mení
uhlík uhlíka (CO 2), vodík - vo vode (H20). Pretože v tomto palive nie sú žiadne iné prvky, oxid uhličitý a voda budú v produktoch spaľovania. Dusík vzduchu (3,76 N 2) sa nezúčastňuje procesu spaľovania, bude úplne premenený na produkty spaľovania. Pravá strana rovnice reakcie na spaľovanie metánu bude mať nasledujúcu formu:
C02 + H20 + 3,76N2.
Po napísaní ľavej a pravej časti je potrebné nájsť koeficienty pred vzorcom. Je známe, že celková hmotnosť látok, ktoré vstupujú do reakcie, by sa mala rovnať hmotnosti všetkých látok, ktoré sú výsledkom reakcie.
Reakčná rovnica bude
CH4 + 2O2 + 2 '3.76N2 = CO2 + 2H20 + 2' 3.76N2.
Vzhľadom na to, že výpočet sa zvyčajne vykonáva na 1 mol alebo 1 m3 horľavej látky, koeficient horľavej látky sa do reakčnej rovnice nezapočítava. V niektorých rovniciach spaľovacích reakcií sa preto môžu pred parou kyslíka alebo inej látky objaviť zlomkové koeficienty, napríklad rovnica pre reakciu spaľovania acetylénu vo vzduchu bude mať podobu.
C2H2 + 2.5O2 + 2.5´3.76N2 = 2CO2 + H20 + 2.5´3.76N2.
Ak zloženie horľavej látky okrem uhlíka a vodíka zahŕňa dusík, uvoľňuje sa počas spaľovania vo voľnej forme N2, napríklad počas spaľovania pyridínu (C2H5N). Chlór, ktorý je súčasťou horľavej látky, sa emituje vo forme chloridu vodík (HCl). Síra, ktorá je súčasťou horľavej látky, je emitovaná vo forme SO2.
Pri spaľovaní látok bohatých na kyslík sa spravidla vyžaduje menej vzduchu. K spaľovaniu látok môže dôjsť aj v dôsledku kyslíka, ktorý je v zložení iných látok, ktoré ho ľahko uvoľňujú. Takéto látky sú kyselina dusičná HNO3, bertoletová soľ KCl03, nitrát KN03, NaN03, NH4NO3, manganistan draselný KMn04, peroxid bárnatý Ba02 a ďalšie. s výbuchom. Príkladmi takýchto zmesí sú čierny prášok, kompozície svetelných signálov a podobne.
Na to, aby mohlo dochádzať k spaľovaniu, sú potrebné určité podmienky: prítomnosť horľavej látky, oxidačného činidla (kyslíka) a zdroja vznietenia. Horľavá látka a okysličovadlo sa musí zohriať na určitú teplotu pomocou zdroja tepla (zdroj zapálenia): plameň, iskra, horúce telo alebo teplo vznikajúce pri akejkoľvek chemickej reakcii alebo mechanickej práci. V procese stabilného spaľovania je konštantným zdrojom vznietenia zóna spaľovania, t.j. oblasť, v ktorej prebieha reakcia, sa uvoľňuje teplo a svetlo. Aby sa mohol uskutočniť proces spaľovania, musí byť látka a oxidačné činidlo v určitom kvantitatívnom pomere.
Spaľovanie látok môže byť úplné a neúplné. V prípade úplného spaľovania vznikajú produkty, ktoré nie sú schopné ďalšieho spaľovania (C02, H20, HCl), ak nie úplne, výsledné produkty sú schopné ďalšieho spaľovania (CO, H2S, HCN, NH3, aldehydy atď.). ,
Pri požiari pri spaľovaní organických látok vo vzduchu najčastejšie nedochádza k úplnému spaľovaniu. Príznakom neúplného spaľovania je prítomnosť dymu obsahujúceho nespálené uhlíkové častice. Avšak bez ohľadu na to, ako prebieha proces horenia, je založený na chemickej interakcii medzi horľavou látkou a oxidačným činidlom.
Moderná teória oxidačno-redukčnej je založená na nasledujúcich ustanoveniach. Podstata oxidácie spočíva v uvoľnení valenčných elektrónov do oxidačného činidla oxidačnou látkou (redukčným činidlom), ktorá sa redukuje prijímaním elektrónov. Podstata redukcie spočíva v pripojení elektrónov redukčného činidla redukčnou substanciou (oxidačným činidlom), ktorá sa pri uvoľnení elektrónov oxiduje. V dôsledku prenosu elektrónov sa mení štruktúra vonkajšej (valenčnej) elektrónovej úrovne atómu. V tomto prípade sa každý atóm stane najstabilnejším stavom za daných podmienok.
V chemických procesoch môžu elektróny úplne prejsť z elektrónového obalu atómov jedného typu do obalu atómov iného typu. Počas spaľovania kovového sodíka v chlóre dávajú atómy sodíka jeden atóm elektrónov na atómy chlóru. Zároveň sa ukázalo, že osem elektrónov (stabilná štruktúra) je na úrovni vonkajšieho elektrónu atómu sodíka a atóm, ktorý stratil jeden elektrón, sa zmení na kladne nabitý ión. Pri atóme chlóru, ktorý dostal jeden elektrón, je vonkajšia úroveň naplnená ôsmimi elektrónmi, ale atóm sa mení na záporne nabitý ión. V dôsledku Coulombových elektrostatických síl sa opačne nabité ióny približujú k sebe a vytvára sa molekula chloridu sodného (iónová väzba).
Na + Cl - Na + Cl -.
V iných procesoch sa zdá, že elektróny vonkajších plášťov dvoch rôznych atómov sú všeobecne používané, čím sa atómy a molekuly sprísňujú (kovalentná väzba):
H + CL : H : cl :
A nakoniec, jeden atóm môže dať spoločnému používaniu svoj pár elektrónov:
: O + : Ca : ach : Ca
Vo všetkých prípadoch však atómy majú tendenciu získavať stabilné externé elektronické štruktúry.
Proces spaľovania je veľmi aktívny proces, ktorý prebieha s uvoľňovaním významného množstva energie (vo forme tepla a svetla). V dôsledku toho dochádza v tomto procese k transformácii látok, v ktorých sa získajú stabilnejšie látky z menej stabilných látok.
Spaľovanie je rýchly chemický proces oxidácie alebo spájania horľavej látky a kyslíka zo vzduchu, sprevádzaný uvoľňovaním plynu, tepla a svetla.
Známe horenie a bez kyslíka zo vzduchu s tvorbou tepla a svetla. Spaľovanie teda nie je len chemickou reakciou zlúčeniny, ale tiež rozkladom.
V skutočnosti dochádza k horeniu, výbuchu a výbuchu. Pri skutočnom spaľovaní rýchlosť šírenia plameňa nepresahuje desiatky metrov za sekundu, s explóziou - stovky metrov za sekundu, as detonáciou - tisíce metrov za sekundu.
S najvyššou rýchlosťou spaľovania dochádza k čistému kyslíku. Keď sa koncentrácia kyslíka znižuje, proces spaľovania sa spomaľuje, čo je najpomalšia rýchlosť horenia, keď je obsah kyslíka vo vzduchu 14 - 15%.
Na spaľovanie sú potrebné horľavé materiály, oxidačné činidlo a zdroj vznietenia.
V praxi rozlišujte medzi úplným a neúplným spaľovaním. Úplné spaľovanie sa dosahuje s dostatočným množstvom kyslíka a neúplným - s nedostatkom kyslíka. Neúplné spaľovanie, spravidla sa tvoria žieravé, jedovaté a výbušné zmesi.
Proces spaľovania sa v praxi zvažuje v podmienkach vznietenia horľavej látky. Samovznietenie (tepelná explózia) nastáva vtedy, keď vnútorné ohrievanie horľavej látky v dôsledku chemických procesov. Nebezpečenstvo požiaru horľavých látok je charakterizované indukčnou periódou alebo oneskorením pri samovoľnom zapálení. Pre spaľovanie a vznietenie je dôležitá koncentrácia plynov a pár vo vzduchu. Rozsah spaľovania a zapaľovania je charakterizovaný dolnými a hornými hranicami výbušnosti. Sú najdôležitejšou charakteristikou výbušnosti horľavých látok.
V prípade výbuchu určitých plynov, pár a zmesí sa spaľovanie mení na špeciálnu formu - detonáciu.
V súvislosti s protipožiarnou ochranou je dôležitá správna prevádzka elektrických sietí a zariadení.
Požiarne a výbušné predmety (POA) sú podniky, v ktorých sa výbušné produkty vyrábajú, skladujú, prepravujú a za určitých podmienok sú schopné vznietenia alebo výbuchu.
Všetky stavebné materiály a ich štruktúry sú rozdelené do troch skupín:
1) ohňovzdorný - Sú to materiály, ktoré sa pod vplyvom ohňa alebo tepla, nehoria, nehoria a nepožúvajú.
2) ťažko horieť - To sú materiály, ktoré pod vplyvom ohňa alebo tepla, sotva vznietia, tlejú alebo zuhoľnia, a naďalej horia, ak je zdroj ohňa;
3) horľavý - Ide o materiály, ktoré sa pod vplyvom ohňa alebo tepla vznietia alebo tlejú a po odstránení zdroja ohňa naďalej horia a tlejú.
Organizácia a riadenie požiarnej bezpečnosti v podnikuPožiarna bezpečnosť - stav objektu, v ktorom je vylúčená možnosť požiaru av prípade jeho vzniku je zabránené vplyvu nebezpečných faktorov požiaru na ľudí a sú chránené materiálne hodnoty. Požiarna bezpečnosť je zabezpečená protipožiarnym systémom a systémom protipožiarnej ochrany. Vo všetkých úradoch musí existovať plán evakuácie osôb v prípade požiaru.
Protipožiarna ochrana - je to komplex organizačných a technických opatrení zameraných na zaistenie bezpečnosti ľudí, na predchádzanie požiaru, na obmedzenie jeho šírenia a na vytváranie podmienok na úspešné hasenie požiaru.
Hasiace prostriedky určené na hasenie malých požiarov zahŕňajú požiarne tyče, vnútorné požiarne vodovodné potrubia, hasiace prístroje, suchý piesok, azbestové prikrývky atď.
Jednou z najdôležitejších úloh požiarnej ochrany je ochrana stavebných priestorov pred poškodením a zabezpečenie ich dostatočnej pevnosti v podmienkach vystavenia vysokým teplotám počas požiaru.
V budovách sú požiarne hydranty inštalované na chodbách, na miestach schodísk a vchodov. Voda sa používa na hasenie požiarov v knižniciach, pomocných a servisných priestoroch.
Hasiace prístroje sú široko používané na hasenie požiarov v počiatočných fázach. Podľa typu použitého hasiaceho prostriedku sú hasiace prístroje rozdelené do nasledujúcich hlavných skupín.
Penové hasiace prístroje sa používajú na hasenie horiacich kvapalín, rôznych materiálov, konštrukčných prvkov a zariadení, okrem elektrických zariadení, ktoré sú pod napätím. Plynové hasiace prístroje sa používajú na hasenie kvapalných a pevných látok, ako aj na živé elektrické inštalácie.
Používajú sa aj hasiace prístroje s oxidom uhličitým, ktorých výhodou je vysoká účinnosť hasenia, bezpečnosť elektronických zariadení.
úvod
Viac ako 90% všetkých núdzových situácií sú požiare alebo sú sprevádzané požiarmi po ich vzniku. Požiare sú najčastejšie núdzové situácie. Proces škodlivých účinkov požiaru a javy, ktoré ho sprevádzajú (explózie, zrútenie stavieb, zlyhanie technologických zariadení, prasknutie potrubí, zničenie nádrží atď.) Je mnohostranný. Môže zahŕňať radiačné a chemické znečistenie ovzdušia, pôdy, odumieranie flóry a fauny, sprevádzané spotrebou kyslíka vo vzduchu, tvorbou produktov spaľovania, vrátane \\ t a toxické a ich vstup do atmosféry, používanie vody na potlačenie požiaru, šírenie vodných pár a odpadových vôd v nich rozpustených toxických produktov na širokom území. Rozsah takéhoto znečistenia niekedy ide mimo krajiny (napríklad nehoda v jadrovej elektrárni v Černobyle).
Pri spaľovaní 1 kg dreva sa napríklad spotrebuje v priemere približne 4,2 m3 vzduchu, objem produktov spaľovania je približne 4,9 m3, v prípade ropy 11,8 a 11,9 m3.
Spaľovanie je hlavným a hlavným procesom požiaru a hasenie požiaru z fyzického hľadiska vždy končí zastavením horenia vo všetkých jeho formách a formách.
Spaľovanie je jedným z prvých komplexných fyzikálno-chemických procesov, s ktorými sa človek stretáva na začiatku svojho vývoja. Proces, pri ktorom sa zmocnil, získal obrovskú nadvládu nad živými tvormi a prírodnými silami, ktoré ho obklopovali.
Spaľovanie je jednou z foriem (hlavnej) získavania a premeny energie, základom mnohých technologických procesov výroby. Preto človek neustále študuje a učí sa procesom spaľovania.
História vedy o spaľovaní začína objavom M.V. Lomonosov: "Horenie je kombináciou látok so vzduchom." Tento objav bol základom pre objav zákona o zachovaní hmoty látok počas ich fyzikálnych a chemických transformácií. Lavoisier objasnil definíciu procesu spaľovania: "Spaľovanie je kombinácia látok, ktoré nie sú so vzduchom, ale so vzdušným kyslíkom."
V budúcnosti sovietsky a ruskí vedci A.V. významne prispeli k štúdiu a rozvoju vedy o spaľovaní. Michelson, N.N. Semenov, I.V. Zeldovich, Yu.B. Khariton, I.V. Blinov a iní.
Procesy spaľovania sú založené na exotermických redoxných reakciách, ktoré sa riadia zákonmi chemickej kinetiky, chemickej termodynamiky a ďalších základných prírodných zákonov (zákon o zachovaní hmoty, energie atď.).
Z chémie je známe, že oxidačno-redukčné reakcie sú základom procesu spaľovania, počas ktorého sa elektróny prenášajú z redukčných činidiel na oxidačné činidlá, čo je sprevádzané zmenou stupňov oxidácie zodpovedajúcich atómov.
V dôsledku prenosu elektrónov sa mení štruktúra vonkajšej (valentnej) úrovne elektrónov atómov. V tomto prípade sa každý atóm stane najstabilnejším stavom za daných podmienok.
V chemických procesoch môžu elektróny úplne prejsť z elektrónového obalu atómov jedného typu do obalu atómov iného typu.
Spaľovanie je chemická oxidačná reakcia sprevádzaná uvoľňovaním veľkého množstva tepla a zvyčajne luminiscencie.
Je možné poskytnúť presnejšiu definíciu procesu spaľovania, ktorá odráža jeho podstatu: „Spaľovanie je komplexný fyzikálno-chemický proces, v ktorom horľavé látky a materiály pod vplyvom vysokých teplôt vstupujú do chemickej interakcie s oxidačným činidlom (kyslík zo vzduchu), ktorý sa mení na produkty spaľovania, a ktoré sprevádzané intenzívnym teplom a svetelným žiarením.
Podmienky potrebné na vznik procesu spaľovania (Obr.): Prítomnosť horľavej látky (GV); prítomnosť oxidačného činidla (O.) - vzdušného kyslíka; prítomnosť zdroja vznietenia (I.Z.).
Obr. Mnemonic: klasický požiarny trojuholník
Tieto tri podmienky sú základné, sú vzájomne prepojené a vzájomne závislé.
Ale nestačia na proces horenia. Okrem toho musia byť splnené tieto podmienky: \\ t
a) horľavá látka sa musí zohriať na určitú teplotu, pri ktorej začne oxidačný proces;
b) na zahriatie horľavej látky na určitú teplotu je potrebná určitá sila zdroja vznietenia;
c) na zachovanie procesu spaľovania sú potrebné určité koncentrácie paliva a okysličovadla.
Spaľovanie je komplexom vzájomne súvisiacich chemických a fyzikálnych procesov. Najdôležitejšie procesy spaľovania sú prenos tepla a hmoty. Najbežnejšou vlastnosťou horenia je výskyt plameňa a jeho pohyb v horľavej zmesi prenášaním tepla alebo difúziou aktívnych častíc zo spaľovacej zóny do čerstvej horľavej zmesi.
Plameň je viditeľný prejav horenia. Nazýva sa aj horiaca zóna. Toto je časť priestoru, kde dochádza k premene horľavej zmesi na produkty úplného a neúplného spaľovania.
V podmienkach požiaru sú hlavnými parametrami procesu spaľovania, ktoré vedú k smrti a spôsobujú materiálne škody, veľké množstvo tepla vznikajúceho v zóne spaľovania, vysoká teplota vyplývajúca z intenzívneho vytvárania tepla a toxické zloženie produktov spaľovania, ktoré vo veľkej miere závisí od typu ( spaľovacieho materiálu a množstva vzduchu zapojeného do procesu spaľovania. V prípade požiaru dochádza k spaľovaniu vždy, keď je v spaľovacej zóne nedostatok vzduchu, čo prispieva k tvorbe neúplných produktov spaľovania (toxický oxid uhoľnatý CO, častice tuhého uhlíka C (vo forme sadzí), dym na ohni čierny a nepriehľadný a iné produkty pyrolýzy horľavých látok).
Podľa GOST oheňje to nekontrolované horenie mimo špeciálneho ohniska, ktoré spôsobuje materiálne škody. Spaľovanie je komplexný fyzikálno-chemický proces premeny horľavých látok a materiálov na produkty spaľovania sprevádzané intenzívnym teplom a svetelným žiarením.
Prevažná väčšina prípadov je založená na rýchlych chemických reakciách oxidácie horľavých materiálov s atmosférickým kyslíkom, predovšetkým uhlíkom, za vzniku CO2 (oxidu uhličitého) a vodíka za vzniku H20 (vodnej pary). V prípade požiarov s voľným prívodom vzduchu sa môže jeho zloženie konvenčne považovať za konštantné: 21% kyslíka a 79% dusíka (objemovo) alebo 23% a 77% (podľa hmotnosti).
Všetky požiare sú charakterizované:
Spaľovanie s uvoľňovaním tepla a produktov horenia;
Výmena plynu vykonávaná mechanizmom prúdenia konvekčného plynu, zabezpečujúca prívod kyslíka do spaľovacej zóny a odstraňovanie produktov spaľovania z neho;
Prenos tepla zo spaľovacej zóny do okolitej oblasti, vrátane horľavých materiálov, bez ktorých nie je možný kontinuálny proces spaľovania.
Druhy horenia počas požiarov.
Pod vplyvom tepelného zdroja zapaľovacích plynov sa kvapaliny, tuhé látky a prach správajú odlišne. Počas požiarov existujú dva hlavné typy spaľovania: homogénne a heterogénne.
Pri homogénnom spaľovaní sa oxidačné činidlo a palivo nachádzajú v plynnej fáze. Okrem toho, že pri spaľovaní horľavého plynu dochádza k homogénnemu spaľovaniu, všetky horľavé kvapaliny sa pred zapálením odparujú a vytvárajú plynné médium. Väčšina tuhých látok v procese zahrievania počas tavenia ohňa sa rozkladá a odparuje, čím sa uvoľňujú plynné frakcie. Plynné médium získané niektorou z týchto transformácií sa zmieša so vzduchom a popáleninami.
Pri heterogénnom spaľovaní je palivo v pevnom stave a oxidačné činidlo je v plynnom stave a oxidačná reakcia paliva prebieha v pevnej fáze. Pevné látky, ktoré sa zmenia na prach (uhlie, kov, textil), pri zmiešaní so vzduchom vytvárajú zmesi prachu a prachu s nebezpečenstvom požiaru a výbuchu.
Pretože pri spaľovaní pri požiaroch je úloha oxidačného činidla najčastejšie vykonávaná kyslíkom vo vzduchu obklopujúcom zónu chemickej reakcie, intenzita spaľovania nie je určená rýchlosťou týchto reakcií, ale rýchlosťou kyslíka z prostredia do spaľovacej zóny.
Požiarne zóny.
V priestore, v ktorom sa rozvíja oheň, sa konvenčne zvažujú tri zóny: spaľovanie, vystavenie teplu a dym.
Horiaca zóna je časťou priestoru, v ktorom prebieha príprava horľavých látok na spaľovanie (zahrievanie, odparovanie, rozklad) a ich spaľovanie.
Zóna vystavenia teplu je časťou priestoru, ktorý susedí so spaľovacou zónou, v ktorom vystavenie teplu spôsobuje výraznú zmenu stavu materiálov a konštrukcií a znemožňuje ľuďom zostať v ňom bez osobitnej ochrany. Vonkajšia hranica tejto zóny zodpovedá teplote 60-70 ° C.
Dymová zóna je časťou priestoru, v ktorom dym vytvára ohrozenie života a zdravia ľudí (štatistiky ukazujú, že väčšina ľudí v požiari zomiera na udusenie).
Látky podieľajúce sa na spaľovaní a charakterizujúce ich parametre.
Podľa stavu agregácie sa látky podieľajúce sa na spaľovaní delia na plynné, kvapalné a tuhé.
Plyny zahŕňajú látky, ktorých absolútny tlak pár pri teplote 50 ° C je rovný alebo vyšší ako 300 kPa, alebo ktorého kritická teplota je nižšia ako 50 ° C.
Pre kvapaliny - látky, ktorých teplota tavenia (pokles) je nižšia ako 50 ° C.
K tuhým látkam - látkam s teplotou topenia (pokles) 50 ° C a vyššou. V pevných látkach je prach špeciálnou skupinou, t. dispergované látky s veľkosťou častíc menšou ako 850 mikrónov.
Kedykoľvek je možné vznietenie látky rozdelené na nehorľavé, pomaly horiace a horľavé. Nehorľavé (ohňovzdorné) sú látky a materiály, ktoré nemôžu horieť vo vzduchu. Pomaly horiace (pomalé horenie) sú látky a materiály, ktoré sa môžu vznietiť vo vzduchu zo zdroja vznietenia, ale nie sú schopné samovoľného spaľovania po jeho odstránení. Horľavé (horľavé) sú látky a materiály, ktoré sa môžu samovoľne vznietiť a tiež sa vznietiť zo zdroja zapálenia a po odstránení sa samovoľne spaľujú.
Horľavé látky a materiály sú oddelené od skupiny horľavých látok, t. tie, ktoré sa môžu vznietiť z krátkodobého (až 30 sekundového) vystavenia nízkoenergetickému zdroju zapálenia (zápalný plameň, iskra, cigareta atď.). Horľavé kvapaliny sú kvapaliny s bodom vzplanutia nepresahujúcim 61 ° C v uzavretom tégliku alebo 66 ° C v otvorenom tégliku.
Výbuch je rýchle spaľovanie horľavej zmesi, ktorá nie je sprevádzaná tvorbou stlačených plynov a nestane sa stacionárnym horením.
Bod vzplanutia je najnižšia teplota horľavej látky, pod ktorou sa za špeciálnych skúšobných podmienok vytvárajú pary alebo plyny nad jej povrchom, ktoré sú schopné blikať zo zdroja zapálenia, ale ich rýchlosť tvorby je stále nedostatočná na vytvorenie stabilného spaľovania.
Teplota vznietenia sa nazýva najnižšia teplota látky, pri ktorej látka za osobitných skúšobných podmienok uvoľňuje výpary a plyny takou rýchlosťou, že po ich zapálení nastane trvalé horenie plameňom.
Teplota samovznietenia je najnižšia teplota látky, pri ktorej sa za špeciálnych testovacích podmienok vyskytne prudký nárast exotermických reakcií, čo má za následok ohnivé horenie. Táto teplota, ktorá nie je fyzikálno-chemická konštanta, významne závisí od tvaru a objemu látky, ako aj od množstva ďalších faktorov. Preto sa na stanovenie teploty samovznietenia používa špeciálna inštalácia.
Parametre požiarov.
Medzi hlavné parametre požiaru patria: požiarne zaťaženie, rýchlosť vyhorenia, miera šírenia požiaru, teplota ohňa, rýchlosť uvoľňovania tepla atď.
Požiarne zaťaženie charakterizuje energetický potenciál horľavých materiálov na jednotku príslušnej plochy (podlaha alebo pozemok). Požiarne zaťaženie sa meria v jednotkách energie alebo v množstve horľavých materiálov (z hľadiska dreva) na jednotku plochy, napríklad J / m2 (z hľadiska energie uvoľnenej počas spaľovania) alebo kg / m.sq (z hľadiska dreva - na základe z toho, že spaľovanie jedného kg dreva produkuje 18,8 MJ energie).
Požiarne zaťaženie miestnosti sa skladá z konštantnej (všetky horľavé konštrukcie konštrukcie) a dočasné (materiály v miestnosti). V budovách sa požiarne zaťaženie každého podlažia určuje samostatne a je obmedzené príslušnými normami.
Rýchlosť vyhorenia - strata hmotnosti spaľovacieho materiálu za jednotku času. Závisí to od pomeru povrchovej plochy spaľovania látok k ich objemu, hustote balenia, podmienkam výmeny plynov a ďalším dôvodom. (Napríklad rýchlosť vyhorenia nábytku 50 kg / m.kv.ch, guľatiny a veľké drevené prvky 25 kg / m.kv.ch; rezivo v stohoch 400 kg / m.kv.ch). Čím vyššia je rýchlosť vyhorenia, tým vyššia je teplota, ktorá sa vyvinula počas požiaru.
Rýchlosť šírenia ohňa je určená rýchlosťou šírenia plameňa po povrchu horľavého materiálu. Záleží na mnohých faktoroch (typ materiálu, schopnosť vznietenia, počiatočná teplota, smer prúdenia plynu, stupeň brúsneho materiálu atď.). Okrem toho je časom nestály. V praxi sa pri výpočtoch používajú priemerné hodnoty tohto parametra:
pri horení horľavých horľavých kvapalín 30 m / min,
na stohoch reziva 4 m / min
na drevených krytinách 1 m / min,
pre drevené konštrukcie dutiny do 2 m / min.
Rýchlosť šírenia plameňa na povrchu materiálov sa značne líši v závislosti od uhla sklonu tohto povrchu k horizontále. Ak je uhol sklonu 90 stupňov, rýchlosť šírenia plameňa smerom dole je menšia ako uvedené hodnoty 2-krát a smerom nahor - 8-10-krát viac.
Ako sa teplota zvyšuje, rýchlosť sa zvyšuje a keď sa dosiahne teplota samovznietenia materiálov, ich povrch je takmer okamžite pokrytý plameňom.
Nižšie sú uvedené hodnoty rýchlosti šírenia plameňa v rôznych plynoch pri atmosférickom tlaku a teplote miestnosti.
Zmesi uhľovodíkov so vzduchom 0,3-0,5 m / s, 18-30 m / min
Zmes vodíka so vzduchom 2,8 m / s, 168 m / min
Zmes vodíka a kyslíka 13,8 m / s, 828 m / min
Zmes Atsiteleno-kyslíka 15,4 m / s, 924 m / min
Spaľovanie znamená fyzikálno-chemický proces charakterizovaný nasledujúcimi znakmi: chemické premeny, uvoľňovanie tepla a svetla. Aby mohlo dôjsť k trvalému spaľovaniu, sú potrebné tri faktory: horľavá látka (materiál, zmes), oxidačné činidlo a zdroj vznietenia.
Chemická reakcia spaľovania, ktorá prebieha s uvoľňovaním významného množstva tepla, je takmer vždy sprevádzaná rôznymi druhmi fyzikálnych javov. V procese horenia dochádza teda k prenosu tepla reagujúcich látok a produktov spaľovania z jedného miesta na druhé. Všetky procesy prebiehajúce v reakčnej zóne spaľovania sú vzájomne prepojené - rýchlosť chemických reakcií je určená úrovňou prenosu tepla a rýchlosťou difúzie látky a naopak fyzikálne parametre (teplota, tlak, rýchlosť prenosu látky) závisia od rýchlosti chemickej reakcie.
Horľavá látka. Všetky látky a materiály cirkulujúce vo výrobe, používané ako suroviny, polotovary, stavebné prvky, sú rozdelené do troch skupín: nehorľavé, pomaly horiace a horľavé.
Nehorľavé sa nazývajú látky a materiály, ktoré nie sú schopné spaľovať vo vzduchu normálneho zloženia. Významnou skupinou sú nehorľavé látky a materiály. Patria sem všetky prírodné a umelé anorganické látky a materiály používané v stavebných kovoch, ako aj dosky zo sadry alebo sadry s obsahom organickej hmoty do 8%, dosky z minerálnej vlny na syntetickej, škrobovej alebo bitúmenovej väzbe s jej hmotnostným obsahom. 6%.
Látky (materiály), ktoré sa môžu vznietiť pôsobením zdroja vznietenia, ale nie sú schopné samovznietenia po jeho odstránení, sa nazývajú pomalé horenie. Patria sem látky a materiály pozostávajúce z nehorľavých a horľavých zložiek, napríklad: asfaltový betón, sadrovec a betónové materiály obsahujúce viac ako 8% hmotnosti organického kameniva; dosky z minerálnej vlny na bitúmenovom zväzku s obsahom od 7 do 15%; materiály s ílovitou soľou s objemovou hmotnosťou najmenej 900 kg / m3; plsť impregnovaná ílovým roztokom; drevo, hlboko impregnované retardérmi horenia; rohož z cementových vlákien; niektoré druhy technických plastov atď.
Horľavé látky sa nazývajú látky (materiály, zmesi), ktoré sú schopné samovznietenia na vzduchu normálneho zloženia. Patria sem všetky látky a materiály, ktoré nespĺňajú požiadavky na nehorľavé a pomaly horiace látky a materiály, napríklad: letecké palivá, alkoholy, organické a anorganické oleje, dekoratívne materiály na báze plastov, textílií, horčíka, sodíka, síry a iných látok. iných materiálov a chemikálií.
Všetky horľavé látky a materiály sú ďalej rozdelené do troch podskupín: horľavé, stredne horľavé, ohňovzdorné.
Horľavé látky sa nazývajú látky (materiály, zmesi), ktoré sa môžu vznietiť z krátkodobého vystavenia plameňu zápalu, iskry, vyhrievaného elektrického drôtu a podobných zdrojov vznietenia s nízkou energiou.
Látky (materiály, zmesi), ktoré sa môžu vznietiť z dlhodobého vystavenia nízkoenergetickému zdroju vznietenia, majú priemernú zápalnosť.
Látky spomaľujúce horenie sa nazývajú látky (materiály, zmesi), ktoré sa môžu vznietiť len pod vplyvom silného zdroja vznietenia, ktorý ohrieva podstatnú časť látky na teplotu vznietenia.
Podskupina horľavých látok a materiálov zahŕňa predovšetkým plyny a horľavé kvapaliny.
Horľavé kvapaliny (HLI) zo všetkých kvapalín cirkulujúcich vo výrobe zahŕňajú horľavé kvapaliny s bodom vzplanutia nepresahujúcim + 61 ° C v uzavretom tégliku. Sú rozdelené do troch kategórií:
I - najmä nebezpečné horľavé kvapaliny s bodom vzplanutia -18 ° C;
II - neustále nebezpečné horľavé kvapaliny s bodom vzplanutia od - 18 do 23 ° C;
III - PLHIV, nebezpečné pri zvýšených teplotách vzduchu alebo tekutiny s bodom vzplanutia od 23 ° do 61 ° C.
Bod vzplanutia sa nazýva najnižšia teplota (pri špeciálnych skúšobných podmienkach) horľavej látky, pri ktorej sa nad jej povrchom tvoria výpary alebo plyny, ktoré sú schopné blikať vo vzduchu zo zdroja vznietenia, ale ich rýchlosť tvorby je stále nedostatočná pre stabilné spaľovanie. Pri horľavých kvapalinách je bod vzplanutia o 1 - 5 ° C nižší ako bod vzplanutia.
Teplota vznietenia sa nazýva teplota horľavej látky, pri ktorej vyžaruje horľavé výpary a plyny takou rýchlosťou, že po vznietení zo zdroja vznietenia nastane trvalé horenie.
Prakticky všetky horľavé a pomaly horiace látky a materiály horia v plynnej alebo plynnej fáze, s výnimkou titánu, hliníka, antracitu a mnohých ďalších. Horľavé látky a materiály sa môžu líšiť chemickým zložením, stavom agregácie, inými vlastnosťami, na základe ktorých sa proces ich prípravy na spaľovanie uskutočňuje rôznymi spôsobmi. Plyny vstupujú do spaľovacej reakcie, ak sa prakticky nemenia, pretože ich zmiešanie s oxidačným činidlom (vzduchovým kyslíkom) nastáva pri akejkoľvek okolitej teplote a nevyžaduje značné dodatočné náklady na energiu. Tekutiny sa musia najprv odpariť a ísť do stavu pary, ktorý spotrebuje určité množstvo tepelnej energie, a iba v plynnej fáze sa zmiešajú s oxidantom a horia. Pevné látky a materiály v ich príprave na spaľovanie vyžadujú oveľa väčšie množstvo energie, pretože najprv sa musia buď roztopiť alebo rozložiť. Roztopené alebo rozložené látky a materiály by sa mali odpariť a zmiešať s oxidačným činidlom, po ktorom sa proces spaľovania uskutočňuje pod vplyvom zdroja vznietenia. Kaučuk, guma a iné plastové materiály, ako aj horčík a jeho zliatiny sa pred zapálením topia a odparujú (zároveň sa rozkladajú plasty). Materiály, ako je papier, drevo, bavlnené tkaniny a určité typy technických plastov sa rozkladajú pri zahrievaní na plynné produkty a tuhé zvyšky (zvyčajne uhlie).
Oxidačné činidlo.Oxidačným činidlom je zvyčajne vzdušný kyslík. Vzduch v jeho zložení je zmesou mnohých plynov, z ktorých hlavnými sú: dusík (N2) - 78,2% objemu a 75,5% hmotnosti; kyslík (02) - 20,9% obj. a 23,2% hmot .; inertné plyny (He, Ne, Ar, kg) - 0,9% obj. a 1,3% hmot. Okrem týchto plynov sú v objeme vzduchu vždy prítomné nevýznamné množstvá oxidu uhličitého, vodných pár a prachu. Všetky tieto zložky vzduchu, s výnimkou kyslíka, prakticky nevstupujú do spaľovacej reakcie pri spaľovaní organických látok a materiálov. Kyslík, dusík a inertné plyny sa považujú za trvalé zložky vzduchu. Obsah oxidu uhličitého, vodnej pary a prachu nie je konštantný a môže sa líšiť v závislosti od podmienok, v ktorých sa tento proces spaľovania uskutočňuje.
Zdroj zapaľovania.To môže byť horiace alebo horúce telo, rovnako ako elektrický výboj, s zásobou energie a teploty dostatočnej na to, aby spôsobili spaľovanie iných látok.
V praxi existujú alebo vznikajú rôzne javy, ktoré zvyšujú teplotu látok a materiálov, ktoré sú vo výrobe alebo pri skladovaní, čo vo väčšine prípadov vedie k vzniku procesu spaľovania, a to ako lokálne, tak v celom objeme horľavej látky alebo materiálu. Medzi zdroje vznietenia patria: iskry vznikajúce pri úderoch kovu alebo iné pevné materiály; iskry a kvapky roztaveného kovu v prípade skratov v elektrických zariadeniach a pri výrobe zváračských a iných požiarnych prác; ohrev elektrických vodičov v prípade preťaženia elektrickej siete; mechanické zahrievanie trecích častí strojov, biologické zahrievanie počas oxidácie rastlinných olejov a handier navlhčených týmito olejmi; pálenie reči, nedopalky cigariet atď. Povaha týchto zdrojov vznietenia sa mení. Iskry, ktoré vznikajú vplyvom kovových predmetov ako zdroj vznietenia, majú veľmi nízky výkon a sú schopné vznietiť iba zmesi plynu a vzduchu: metán-vzduch, acetylén-vzduch, uhlík-uhlík-uhlík a iné. horľavosť a môže spôsobiť spaľovanie takmer všetkých horľavých látok a materiálov bez ohľadu na ich stav agregácie.
Horľavé prostredie. V prípade výskytu a priebehu spaľovacieho procesu horľavá látka a oxidačné činidlo reagujú s látkami a predstavujú horľavé médium a zdrojom vznietenia je štartér procesu spaľovania. Pri stálom horení je zdrojom vznietenia ešte nespálených látok a materiálov teplo uvoľnené z reakčnej zóny spaľovania.
Horľavé médiá môžu byť fyzikálne homogénne (homogénne) a heterogénne (heterogénne). Prvými sú prostredia, v ktorých sa rovnomerne mieša horľavá látka a oxidačné činidlo (vzduch): zmesi horľavých plynov, pár a prachu so vzduchom. Príklady homogénneho spaľovania prostredia zahŕňajú: spaľovanie pár stúpajúcich z voľného povrchu kvapaliny (rozliate prúdové palivo TC-1 pri nehode); horiaci plyn prúdiaci z poškodeného valca alebo potrubia; výbuchy zmesí plynu, pary a prašného vzduchu. Medzi heterogénne médiá patria prostredia, v ktorých horľavá látka (materiál) a okysličovadlo nie sú zmiešané a majú rozhranie: tuhé horľavé látky a materiály, prúdy horľavých plynov a kvapalín vstupujúcich do vzduchu pod vysokým tlakom atď. spaľovanie titánu, hliníka, antracitu alebo olejových a plynových fontán, keď príde olej a plyn, v spaľovacej zóne pod vysokým tlakom a majú veľmi významné prietokové rýchlosti.
Flames. Priestor, v ktorom výpary, plyny a suspenzie vyhoria, sa nazýva plameň. Plameň môže byť kinetický alebo difúzny, v závislosti od toho, či vopred pripravená zmes pary, plynov alebo prachu horí vzduchom, alebo sa takáto zmes vytvára priamo v zóne plameňa počas spaľovania. Procesy prebiehajúce v kinetickom plameni sú charakterizované vysokými rýchlosťami spaľovacej reakcie (lineárna rýchlosť plameňa môže presiahnuť 1000 m / s) a spravidla predstavuje explóziu horľavého média, sprevádzanú vysokou úrovňou tvorby tepla a prudkým zvýšením tlaku v spaľovacej zóne.
Pri požiari takmer všetky plyny, pary, kvapaliny a pevné látky a materiály horia difúznym plameňom. Štruktúra tohto plameňa výrazne závisí od prierezu prúdenia horľavých pár alebo plynov a jeho rýchlosti. Charakterom tohto prúdenia je rozlíšenie laminárneho a turbulentného difúzneho plameňa. Prvé sa vyskytujú pri malých prierezoch prietoku horľavých pár alebo plynov pohybujúcich sa od nízka rýchlosť (plameň sviečky, zápalky, plyn v horáku, atď.). Pri požiari pri spaľovaní rôznych látok a materiálov sa vytvára turbulentný difúzny plameň, minar a turbulentný plameň je zónou reakcie spaľovania, ktorá obklopuje parnú alebo plynovú zónu, ktorá zaberá takmer celý objem spaľovacej zóny. Reakčná zóna spaľovania difúznym plameňom je veľmi tenká (len niekoľko mikrometrových) vrstiev, v ktorých sa vytvára teplo a na rozdiel od laminárneho plameňa je svetelný turbulentný plameň charakterizovaný I, ktorý nemá jasné obrysy, konštantné úseky a polohy čela plameňa.
Teplota v parnej zóne je výrazne nižšia ako v reakčnej zóne.
V plameňoch leteckých palív sa teplota prúdu pary v blízkosti povrchu kvapaliny blíži k bodu varu (pre prúdové palivo TC-1 je táto teplota v rozsahu 150 - 280 ° C). Ako sa prúd pary pohybuje do reakčnej zóny, ich teplota stúpa najprv v dôsledku tepelného vyžarovania plameňa a potom difúzie z reakčnej zóny horúcich produktov spaľovania. V dôsledku zahrievania dochádza k tepelnému rozkladu (disociácii) parných látok a výsledné voľné atómy a radikály spolu s produktmi spaľovania idú priamo do reakčnej zóny, t.j. do plameňa. Uhlíkové atómy, vstupujúce do spaľovacej reakčnej zóny, sa zahrejú a začnú svietiť, čím vytvárajú takzvaný svetelný plameň. Teplota reakčnej zóny horenia sa mení vo výške plameňa. V spodnej časti plameňa klesá teplota v dôsledku spotreby významného množstva tepla na ohrievanie hmoty studeného vzduchu vstupujúceho do zóny spaľovania a je minimálna pre každý typ spaľovania. Najvyššia teplota sa vyvíja v strednej časti plameňa, pretože v hornej časti klesá reakčná rýchlosť v dôsledku poklesu koncentrácie reagujúcich zložiek (vyhorenia), a preto sa úroveň uvoľňovania tepla znižuje a teplota klesá.
Za normálnych podmienok je parciálny tlak kyslíka vzduchu 228,72 kPa a 0 v reakčnej zóne spaľovania, preto v dôsledku rozdielu parciálneho tlaku kyslík z okolitého vzduchu difunduje (filtruje, presakuje) cez lôžko produktov spaľovania do reakčnej zóny. Vstup horľavých zložiek do reakčnej zóny je prakticky neobmedzený. Reakčná rýchlosť spaľovania v priebehu vyvinutého procesu teda závisí hlavne od množstva kyslíka vstupujúceho do reakčnej zóny, t.j. od rýchlosti jeho difúzie. V prípade spaľovania nerovnomerného média je prienik kyslíka do reakčnej zóny tiež obmedzovaný produktmi spaľovania uvoľňovanými do priestoru susediaceho s reakčnou zónou.
Nedostatok dostatočného množstva kyslíka v spaľovacej reakčnej zóne inhibuje rýchlosť jeho prúdenia. Ak by sa táto inhibícia nevyskytla, potom by všetky spaľovacie reakcie prebiehajúce v atmosfére pokračovali stále rastúcou rýchlosťou a končili explóziou reagujúcich látok. Procesy spaľovania, ako aj všetky chemické procesy prebiehajú rôznymi rýchlosťami v závislosti od podmienok, v ktorých sa uskutočňujú, od povahy reagujúcich látok, od ich stavu agregácie. Napríklad výbušniny sa rozkladajú v tisícinách sekundy a chemické procesy v kôre trvajú stovky a tisíce rokov. Vzájomné pôsobenie látok v plynnej a parnej fáze prebieha oveľa rýchlejšie ako v kvapaline a pevnejšie. Teda rozliaty letecký benzín TS-1 spaľuje relatívne pomaly, pričom vytvára dymový plameň (neúplné spaľovanie) a pripravenú zmes parného vzduchu s týmto spaľovaním vzduchu s explóziou. Rýchlosť interakcie tuhých látok a materiálov s okysličovadlom sa dramaticky mení v závislosti od stupňa ich rozomletia. Napríklad hliník a titán, ktoré sa za špeciálnych podmienok pomaly spaľujú v ingotoch, môžu v práškovom stave vytvárať výbušné zmesi prachu a vzduchu, ktoré vyvíjajú tlak v explózii 0,62 resp. 0,49 MPa.
Spaľovanie ako chemický proces vo všetkých prípadoch je rovnaké. Ako fyzikálny proces sa však líši v povahe spaľovacej reakcie, preto sa počiatočné spaľovacie procesy delia na tieto typy: spontánne spaľovanie, zapaľovanie a samovznietenie.
Spontánne spaľovanieSamostatné látky (materiály, zmesi) počas skladovania a počas prevádzky procesného zariadenia sa môžu samovoľne vznietiť. Spontánne horenie je fenoménom prudkého nárastu exotermických reakcií, čo vedie k výskytu látky spaľujúcej v neprítomnosti zdroja vznietenia. Látky, ktoré sa môžu samovoľne vznietiť, zahŕňajú rastlinné a mastné oleje, handry a handry navlhčené rastlinnými olejmi, sulfidmi železa a inými jednotlivými chemikáliami. Rastlinné a mastné oleje (slnečnica, ľanové semeno, konope, kukurica, živočíšne tuky atď.) Patria do triedy tukov a sú zmesou glyceridov mastných kyselín s vysokou molekulovou hmotnosťou. Molekuly týchto kyselín majú nenasýtené (dvojité) väzby, ktoré za určitých podmienok prispievajú k spontánnemu spaľovaniu týchto látok. Podľa peroxidovej teórie A. N. Bacha môže nastať oxidácia v dôsledku pridania kyslíka do metylénovej skupiny v polohe vzhľadom na dvojitú väzbu, s tvorbou hydroperoxidu. Ako je známe, všetky peroxidy a hydroperoxidy sú nestabilné chemické zlúčeniny. Počas ich rozkladu vznikajú voľné radikály, ktoré sa polymerizujú do väčších organických molekúl. Počas polymerizácie sa vždy uvoľňuje určité množstvo tepla, čo môže v konečnom dôsledku viesť k spontánnemu spaľovaniu oxidujúcej organickej hmoty. Za určitých podmienok dochádza k spontánnemu spaľovaniu organických látok. Patrí medzi ne: obsah glyceridov s vysokou molekulovou hmotnosťou oleja v oleji alebo mastnotách bočných kyselín nie je nižší ako určité minimálne množstvo; prítomnosť veľkého povrchového kontaktu s oxidačným činidlom a nízky prenos tepla; určitý pomer tukov a olejov a porézneho alebo vláknitého materiálu impregnovaného s nimi.
Sulfidy železa FeS, Fe2S3 sa môžu vytvoriť v technologickom zariadení skladov pohonných hmôt leteckých podnikov. Môžu sa samovoľne vznietiť vo vzduchu, najmä v prítomnosti horľavých výparov a plynov. Zvážte mechanizmus spojenia sulfidov železa s kyslíkom v príklade oxidačnej reakcie prírodnej pyritovej zlúčeniny FeS2:
FeS2 + 2O2 = FeS + 2SO2 + 222,3 kJ.
Okrem sulfidov železa sa takéto materiály môžu samovoľne vznietiť. očakávanýako hnedé uhlie, rašelina, výrobky rastlinného pôvodu: seno, slama, siláž atď.
Najnebezpečnejšie je spontánne spaľovanie jednotlivých chemických látok v prípade nesprávneho skladovania, pretože tento proces môže viesť k požiaru v zariadení, kde sa tieto látky skladujú. Podľa ich chemických vlastností sú tieto látky rozdelené do troch skupín: samovznietivé pri kontakte so vzduchom, vodou a navzájom. priateľa.
Nepovažujeme látky patriace do prvej skupiny, pretože sa prakticky nevyskytujú v technológiách leteckých podnikov.
Druhá skupina zahŕňa množstvo látok, z ktorých najzaujímavejšie sú karbid vápenatý CaC2 a oxid vápenatý CaO. Pri interakcii s karbidom vápnika sa uvoľňuje acetylén, ktorý je horľavým plynom, a značné množstvo tepla. S relatívne malým množstvom vody môže systém karbidu vápnika - voda vzplanúť až na 920 K, čo môže spôsobiť, že zmes acetylénu a vzduchu exploduje:
CaC2 + 2H20 = C2H2 + Ca (OH) 2 + 127 kJ.
Okrem karbidu vápenatého má oxid vápenatý CaO schopnosť ohriať sa na luminiscenčnú teplotu, keď sa do neho dostanú malé množstvá vody, čo môže tiež viesť k zapáleniu nádoby a horľavých konštrukčných prvkov skladu:
CaO + H20 = Ca (OH) 2 + 64,5 kJ.
Tretia skupina zahŕňa silné oxidačné činidlá, jednotlivé chemikálie a tiež organické látky a materiály. Napríklad látky, ako je manganistan draselný a glycerín, nie je možné skladovať spoločne; koncentrovaná kyselina dusičná s terpentínom, etylalkoholom a sírovodíkom; halogény s horľavými plynmi a horľavými kvapalinami; kyselina sírová s dusičnanmi, chlorečnany, chloristany, pretože v tomto prípade je možná chemická reakcia medzi nimi, pričom sa uvoľňuje veľké množstvo tepla.
Zápal.Okrem samovznietenia je možné jednoducho zapáliť, to znamená výskyt horenia pod vplyvom zdroja vznietenia. Oheň s plameňom sa nazýva zapálenie. Keď k tomu dôjde, ohrievanie objemu v blízkosti bodu tepelného vystavenia. V dôsledku zvýšenia teploty v špecifikovanom objeme sa teplo distribuuje do oblastí (objemov) horľavého média, ktoré je k nemu priľahlé. Čím väčšie množstvo horľavého materiálu (materiálu, zmesi), ktoré je súčasťou procesu spaľovania, tým viac tepla sa uvoľňuje do okolitého priestoru. Proces spaľovania sa tak vyvíja spontánne. Zdroj zapálenia v tomto prípade spočiatku zohrieva iba malý objem horľavej zmesi, pričom teplota celého objemu horľavého média môže zostať nezmenená.
Proces zapálenia sa líši svojou povahou v závislosti od typu horľavej zmesi. Najnebezpečnejšie sú zmesi plyn-vzduch. Avšak pre ne je minimálna energia zdroja vznietenia závislá na mnohých parametroch, z ktorých hlavnými sú percentuálne zloženie zmesi, druh horľavej látky, tlak zmesi, pretože teplota vznietenia, normálna rýchlosť šírenia plameňa a teplota spaľovania závisia od týchto hodnôt. Okrem toho je minimálna teplota zdroja vznietenia ovplyvnená dobou jeho kontaktu s horľavým médiom.
Zápal kvapalín je možný len vtedy, ak je teplota prostredia alebo samotná kvapalina dostatočná na odparenie toľko pary, aký je potrebný na vznik stabilného spaľovania. Pre rôzne horľavé kvapaliny táto teplota nie je rovnaká. Pri teplotách pod teplotou vznietenia nie je horenie možné, pretože rýchlosť odparovania kvapaliny je v tomto prípade príliš nízka. So zvyšujúcou sa teplotou vonkajšieho vzduchu alebo samotnej horľavej kvapaliny, čo je iné, sa odparovanie kvapalín zvyšuje a množstvo pary je dostatočné na výskyt stabilného spaľovania.
Samovznietenia. Nazýva sa spontánne horenie, sprevádzané objavením sa plameňa. Okrem procesov spontánneho spaľovania a zapaľovania v praxi existuje aj proces samovznietenia rôznych horľavých médií. Všetky tieto tri procesy sa svojou chemickou povahou navzájom nelíšia. Rozdiel medzi nimi spočíva vo fyzickej podstate procesu spaľovania, pretože na rozdiel od procesov spontánneho spaľovania a vznietenia proces samovznietenia prebieha okamžite v celom objeme reakčného horľavého média. Z hľadiska fyziky ide o kinetický proces horenia už zmiešanej a pripravenej zmesi s vysokými rýchlosťami šírenia plameňa. Pri spaľovaní zmesí pary, prachu a plynu sú to spravidla rýchlosti explózie. Aby sa dosiahol proces samovznietenia, je nevyhnutné, aby celý objem horľavej zmesi mal teplotu samovznietenia zmesi. Pod teplotou samovznietenia sa rozumie najnižšia teplota látky (materiálu, zmesi), pri ktorej dochádza k prudkému zvýšeniu rýchlosti exotermických reakcií, čo má za následok vznik horenia plameňom. Teplota samovznietenia horľavej látky nie je konštantná. Závisí to od rýchlosti vytvárania tepla a odvodu tepla, čo zase závisí od objemu zmesi, koncentrácie, tlaku a ďalších faktorov. Teplota samovznietenia zmesí horľavých pár a plynov so vzduchom sa mení v závislosti od ich percentuálneho zloženia. Najnižšia teplota samovznietenia je pre stechiometrickú zmes alebo zmesi v jej blízkosti v koncentráciách reaktantov. Teplota samovznietenia tuhých látok alebo materiálov je nepriamo úmerná stupňu ich mletia: čím vyšší je stupeň mletia látky, tým nižšia je teplota samovznietenia. Je to spôsobené tým, že pri brúsení látok a materiálov sa plocha kontaktného povrchu týchto horľavých zložiek a oxidačného činidla prudko zvyšuje.
pálenie v peci a petroleji. Najvýraznejším príkladom chemických reakcií, ktoré sa vyskytujú za účasti kyslíka vo vzduchu, je spaľovanie, proces, ktorým prijímame teplo a svetlo. čokoľvek
Nespálili sme palivo - uhlie alebo palivové drevo, petrolej alebo benzín, alkohol alebo svetelný plyn - hlavná chemická reakcia počas spaľovania je rovnaká: uhlík a vodík, ktoré sú súčasťou molekúl paliva, sa kombinujú s kyslíkom vo vzduchu a vytvárajú oxid uhličitý a vodu. Je dobre známe, že petrolejová lampa dáva žltý, svetelný plameň a primusový kachlík dáva modrý alebo fialový, takmer nesvetelný plameň. V oboch prípadoch je palivo rovnaké - petrolej. Prečo sa to deje?
Petrolej je zmes rôznych uhľovodíkov, zlúčenín uhlíka s vodíkom. Vezmime si napríklad jeden z petrolejových uhľovodíkov - nonán, ktorý má zloženie SuNgo. Pri horení sa nonán kombinuje s kyslíkom a tvorí sa oxid uhličitý a voda. Počiatočný a konečný stav tohto procesu môže byť reprezentovaný chemickou rovnicou:
C9H20 + 1402 - 9 C02 + 10 H20 (para) + teplo,
Po napísaní takejto rovnice sme predpokladali, že uhľovodík úplne horí. To je to, čo sa deje v dobrom primuse. V peci vstupuje petrolej do horáka pod tlakom. Keď sa odparuje vo vyhrievanom horáku, praskne silným prúdom cez dýzu, petrolej sa dobre mieša so vzduchom. Zmes je tak bohatá na kyslík, že kerozín úplne horí. Okrem toho, petrolejové pary, prechádzajúce horúcou časťou horáka, sa nielen zohrievajú, ale aj chemicky menia: komplexné molekuly uhľovodíkov pri teplote 400-500 stupňov sa rozpadajú na jednoduchšie, ktoré horia ľahšie. Tento rozklad je zvyčajne sprevádzaný uvoľňovaním malého množstva tuhého uhlíka - koksu; Koks postupne upcháva horák, takže čas od času musí byť „spálený“.
Vieme, že petrolej vždy dáva sadze alebo sadze, to znamená veľmi malé častice uhlia. To znamená, že petrolej nie je v petroleji úplne spálený. Petrolej sa odparuje z povrchu knôtu a potom sa zmieša so vzduchom. Množstvo vzduchu vo vnútri plameňa je nedostatočné. Preto sa vytvárajú najmenšie červeno-horúce častice uhlia, z ktorých plameň jasne svieti.
Prečo palivové drevo a uhlie horí, keď horí, a horí drevené uhlie bez plameňa? Rôzne druhy tuhých palív horia inak: palivové drevo a kameň
Uhlie je tvorené horiacimi plameňmi a drevené uhlie neprodukuje plamene. Aký je rozdiel medzi nimi?
Drevná buničina a uhlie sú zmesi komplexných látok bohatých na uhlík. Obsahujú tiež kyslík a vodík. Keď sa drevo a uhlie zohrieva, sú komplexné látky rozdelené na jednoduchšie a zároveň viac prchavé látky. Tieto látky, horiace a tvoria plameň. Palivové drevo dáva viac ohňa ako uhlie: produkujú viac prchavých látok.
Drevené uhlie sa získava neúplným spaľovaním dreva. Dobré uhlie je takmer čistý uhlík; Miešajú sa s ňou len minerálne látky, ktoré dávajú popol po horení. Preto drevené uhlie netvorí prchavé produkty a horí bez plameňa.
Všetky kvapalné látky a horľavé plyny, rozkladajúce sa pri vysokej teplote pri uvoľňovaní prchavých látok, pri horení vytvárajú plameň. Pevné látky, ktoré nie sú schopné produkovať prchavé produkty rozkladu, horia bez plameňa. V prípade neúplného spaľovania sa vždy vytvára dym, ktorý pozostáva z tuhých častíc nespáleného uhlia a plynných produktov spaľovania - oxidu uhoľnatého, oxidu uhličitého a vodných pár.
Prečo sa fajčí petrolejová lampa a horiaci plynový horák sa vyhorí. Môžeme kontrolovať chemické reakcie, spôsobovať ich prúdenie tak, ako chceme. Príklady tohto ľahko nájdete v našom každodennom živote.
Keramínová lampa začala fajčiť. Je jasné, že ak sa uvoľnia sadze, spaľovanie nie je úplné. Znížili sme knot - sadze prestali tvoriť. Prečo? Pretože sme zmenili podmienky horenia. Vypnutím knôtu sme znížili rýchlosť odparovania petroleja. Množstvo vzduchu vstupujúceho do lampy zostalo nezmenené. Preto sa pálenie stalo úplnejším.
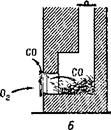
A prečo predčasné zatvorenie pece dáva odpad? - Pretože režim horenia je porušený a namiesto jednej reakcie ide o ďalší. Pri nedostatku vzduchu vstupujúceho do pece nie je spaľovanie na konci: namiesto oxidu uhličitého vzniká CO2, oxid uhoľnatý alebo, ako sa to nazýva inak, oxid uhoľnatý CO. Oxid uhoľnatý je neviditeľný, pretože na rozdiel od dymu neobsahuje tuhé častice. Je veľmi jedovatý.
Oxid uhoľnatý sa tiež vytvára, keď je rúra otvorená, ale pretože prívod kyslíka do pece je dostatočný, spaľuje a vytvára oxid uhličitý, ktorý ide do potrubia.
(Obr. 7, A). Keď je rúra zatvorená, produkty spaľovania vystupujú cez dvere rúry do miestnosti. Ak v peci zostáva príliš veľa červenohnedého uhlia, potom prúdenie vzduchu postačuje len na tvorbu oxidu uhoľnatého a v miestnosti sa vyskytuje odpad (obr. 7, £).
Tieto jednoduché príklady ukazujú, že zmenou pomerov medzi množstvami reaktantov môžete riadiť chemickú reakciu.
Aký je rozdiel medzi spaľovaním v peci a horením v živom organizme? V peci spaľuje palivo. Pre telo je palivo. Ako v tele, tak aj v peci sa uhlíkaté látky spaľujú a premieňajú na oxid uhličitý a vodu.
Toto je podobnosť.
Rozdiel je v tom, že v peci dochádza k horeniu pri vysokej teplote av živom organizme - na nízkej a oveľa pomalšej úrovni.
V peciach, najmä priemyselnom type - výbuch, sklo, atď., Teplota presahuje 1000 stupňov. Ľudské telo má priemernú teplotu 36,6 stupňov. Chemici zistili, že zvýšenie teploty o 10 stupňov takmer zdvojnásobuje reakčnú rýchlosť. Znamená to, že spaľovanie v peci je mnohonásobne rýchlejšie ako v tele.
Nie je to však len to. Pri vysokých teplotách môže reakcia prebiehať úplne iným spôsobom. Pri 1000 stupňoch sa niektoré molekuly kyslíka (približne 1,5%) rozpadajú na atómy: 02 ^ 20. To znamená, že spaľovanie pri vysokých teplotách sa dá vysvetliť skutočnosťou, že voľné atómy kyslíka reagujú s palivom, ktorého počet sa pri spotrebovaní doplňuje rozkladom, disociáciou a novými molekulami kyslíka. Ale v živých organizmoch sa molekuly kyslíka nemôžu rozpadať na atómy. Ako sa spaľovanie v organizmoch?
Všeobecnú teóriu takýchto procesov vyvinul koncom minulého storočia ruský akademik A.N. Bach. Série experimentov s jednoduchými zlúčeninami uhlíka as látkami obsiahnutými v živočíšnych a rastlinných organizmoch A.N. Bach dokázal, že pri bežných teplotách sú molekuly kyslíka pripojené k molekulám týchto látok. Zároveň sa vytvárajú také zlúčeniny, ktoré sú schopné oxidovať iné látky rovnako ľahko ako atómový kyslík. Tieto zlúčeniny, nazývané peroxidy, sú medziprodukty oxidácie.
Ako sú postavené molekuly peroxidu a aké majú vlastnosti?
Najprv sa zoznámime s najjednoduchším peroxidom - peroxidom vodíka Н202. Jeho štruktúra je znázornená vzorcom HOOOH. Peroxid vodíka je nestabilný, počas skladovania sa pomaly rozkladá na vodu a kyslík: H202 = H20 + 0. To znamená, že jeden z atómov kyslíka v peroxide je „mobilný“, „aktívny“. Peroxid vodíka je teda dobrým oxidačným činidlom.
U zvierat a rastlín nie je peroxid vodíka, ale uhlíkové atómy organických zlúčenín môžu byť spojené s –O - O– skupinou atómov charakteristických pre peroxidy. Takéto peroxidy sa nazývajú peroxidy organických zlúčenín a nachádzajú sa v živých organizmoch. Práve tieto majú mimoriadnu úlohu v procesoch pomalej oxidácie v tele, na čo poukázal A. N. Bach.
U zvierat dochádza v krvi k oxidácii potravinových materiálov. V červených krvinkách je komplexná proteínová substancia, hemoglobín, farbiaca krvnú červenú. Zloženie hemoglobínu zahŕňa železo, ktoré mu dáva schopnosť kombinovať sa s kyslíkom. Pri dýchaní sa hemoglobín oxiduje (v pľúcach) a mení sa na oxyhemoglobín. Oxyhemoglobin sám o sebe nie je pravý peroxid, pretože sa vzdáva všetkého viazaného kyslíka, nie polovice, ako to robia pravé peroxidy. Ale ľahko premieňa niektoré potravinové látky do krvi do peroxidu, dáva jej vlastný kyslík a opäť ide do hemoglobínu. Kyslík sa spotrebuje na oxidáciu potravinových materiálov, na výrobu energie potrebnej na udržanie života.
Existuje rozdiel medzi spaľovaním a oxidáciou? na
Podobne ako pri spaľovaní paliva je prirodzené uvažovať o spaľovaní všetkých chemických procesov prebiehajúcich s emisiou tepla a svetla. Slovo "pálenie" opisuje vonkajšie znaky a len jednu stranu chemickej reakcie - premenu chemickej energie na teplo a svetlo.
Na to, aby chemik len opísal túto stranu reakcie, nestačí. Chce vedieť, čo sa stane s každým z atómov, ktoré tvoria substanciu, ako sa tieto atómy menia počas reakcie. A ak sa pozriete na reakcie, ktoré sa vyskytujú počas horenia z tejto strany, ukazuje sa, že vždy jeden z atómov spaľujúcej molekuly zvyšuje svoju pozitívnu valenciu. Napríklad pri spaľovaní CO v C02 sa pozitívna valencia uhlíka zvyšuje z 2 na 4, pretože atóm uhlíka už nie je spojený s jedným, ale s dvoma atómami kyslíka. Uhlík sa počas spaľovania oxiduje. Preto nazývame oxidáciu reakciu, v ktorej je prvok pre prvok, ktorý zvyšuje jeho pozitívnu valenciu.
A čo sa stane, keď oxidujete samotným oxidačným činidlom? V našom príklade je oxidujúcou látkou kyslík zo vzduchu, jednoduchá substancia, na ktorej sme sa dohodli (s. 22) priradiť reakcii nulu. Pri vstupe do molekuly CO2 sa atóm kyslíka stane bivalentným záporným. Reakcia, v ktorej atóm kakog-l pre prvok zvyšuje svoju negatívnu valenciu, nazývanú regenerácia. V dôsledku toho sa kyslík zo vzduchu oxidáciou uhlíka CO znižuje. Z nášho príkladu vidíme, že oxidácia a redukcia sú dva dvojité procesy: vždy sa navzájom sprevádzajú a jeden nie je možný bez druhého.
Pokračuje všetka oxidácia ako pálenie? Železo, hrdzavenie, hrdza. Môžeme však skutočne povedať, že v tomto prípade horí železo. Samozrejme, že nie. Je oxidácia sprevádzaná emisiou svetla v živom organizme? - Nie, vytvára sa iba teplo. Oxidácia teda nie je vždy sprevádzaná horením. Ale spravidla sú všetky procesy spaľovania oxidované.
Môže dôjsť k spaľovaniu a oxidácii bez kyslíka? Atóm, ktorý sa oxiduje, nemusí nutne poskytovať svoje valenčné elektróny atómu kyslíka. Veľmi ľahko sa to deje s inými prvkami. Vráťme sa k skúsenostiam opísaným na strane 12. Železo, ktoré ponoríme do roztoku síranu meďnatého, je jednoduchá látka s nulovou valenciou. Železo je účinnejšie ako meď a vytesňuje meď z roztoku. V tejto premene reakcie, atóm železa vzdáva atóm medi 2 elektróny a sám získava valenciu + 2. Takže aj tu je železo oxidované! Atóm medi, ktorý odoberá 2 elektróny z atómu železa, mení valenciu z + 2 na nulu a obnovuje sa.
Podobne je možné uvažovať o reakcii medzi sírou a železom (s. 9). Obidve sú jednoduché látky s nulovou valenciou. Po reakcii sa teda valencia železa + 2 a síra-2 oxidovala železom a regenerovala síra. Pripomeňme, že reakcia medzi sírou a železom je sprevádzaná uvoľňovaním tepla a svetla, to znamená spaľovaním, hoci kyslík sa na ňom nezúčastňuje. To znamená, že bez kyslíka môže nastať nielen oxidácia, ale aj spaľovanie.
Prečo železná hrdza a zlato a striebro nemajú? Zo všetkých kovov sa najčastejšie používa železo v technológiách av každodennom živote. Veľký nedostatok železa je, že sa ľahko kombinuje s kyslíkom vo vzduchu a vo vode, hrdzavie. Pretože hrdza je voľne spojená s povrchom kovu, je ľahko vymazateľná a striekaná, čo vedie k veľkým stratám kovu. Rez a podobné procesy deštrukcie kovov sa nazývajú corrosa a e.
Odhaduje sa, že v dôsledku korózie na celom svete sa ročne stratí viac ako 30 miliónov ton kovov. Toto je skutočná katastrofa. Preto chemici a fyzici tvrdo pracujú na boji proti korózii.
Rust je zmesou vodného oxidu železitého Fe (OH) g, oxidu železitého Fe203, stupnice Pe304 a niektorých ďalších látok. Skutočnosť, že sa železo oxiduje pri nízkej teplote, sa vysvetľuje jeho významnou chemickou aktivitou.
Ďalšou vecou je striebro, zlato, platina a iné drahé kovy. Ich aktivita je veľmi malá. Jadrá ich atómov pevne držia valenčné elektróny, a preto sa ťažko oxidujú. Zlúčeniny týchto kovov sú krehké, ľahko sa rozkladajú uvoľňovaním voľných kovov. Chloridy a metylové striebro sa napríklad rozkladajú vo svetle. Celá foto-kinematografia je založená na tejto reakcii.
Nestabilitu solí striebra dokazuje zaujímavý zážitok. V skle zahrejeme amoniak (to je vodný roztok amoniaku) na 50-60 stupňov a za stáleho miešania do neho nalejeme niekoľko kvapiek roztoku lyapisu (dusičnanu strieborného). Potom pridajte niekoľko kvapiek formalínu alebo roztok hroznového cukru - glukózy. Po niekoľkých minútach sa na stenách pohára vytvorí strieborné zrkadlo a v roztoku sa objaví tmavá šupina. Formalín alebo glukóza obnovujú striebro z jeho soli. Táto reakcia sa používa na výrobu zrkadiel.
Tak sme sa zoznámili so zložením ovzdušia a poukázali na zvláštnu úlohu kyslíka v prírode, ktorý zabezpečuje jeho veľkú chemickú aktivitu. Ale veľmi veľa reakcií zahŕňajúcich kyslík by išlo veľmi odlišne a niektoré by dokonca neboli možné, ak by voda nebola schopná pomôcť kyslíku, keď by bola vystavená iným látkam. Voda, podobne ako kyslík, má v prírode obrovskú úlohu a má mnoho veľmi dôležitých vlastností. V nasledujúcej časti sa na ne pozrieme.


 Litmus test - meranie pH
Litmus test - meranie pH Odoslať odčítanie údajov
Odoslať odčítanie údajov Fyzikálno-chemické základy procesov spaľovania
Fyzikálno-chemické základy procesov spaľovania