Oxidácia spaľovania. Fyzikálno-chemické základy procesov spaľovania
Rozdiely vo výklade pojmu spaľovacie spôsobené vedeckými záujmami autorov. Podľa nášho názoru táto definícia spaľovania najviac zodpovedá praktickým záujmom zamestnancov GPA:
horiace - Ide o komplexný fyzikálno-chemický proces, ktorý je založený na rýchlo sa vyvíjajúcich chemických oxidačných reakciách, sprevádzaných uvoľňovaním veľkého množstva tepla a svetla.
Dominantným procesom pri spaľovaní je chemická oxidačná reakcia, ktorá spôsobuje vznik rôznych fyzikálnych procesov: prenos tepla, prenos reaktantov, žiarenie, atď. Tieto fyzikálne procesy sa vyvíjajú podľa svojich zákonov. Chemické oxidačné procesy majú veľký potenciál, pokiaľ ide o ich prietok, ale skutočná rýchlosť horenia pri skutočných požiaroch je nižšia, pretože obmedzená rýchlosťou fyzikálnych procesov.
Chemické reakcie počas spaľovania sú viacstupňové, ... \\ t
a čo je najdôležitejšie, reťazec. Bez pochopenia mechanizmu prebiehajúcich procesov nie je možné pochopiť príčiny šírenia plameňa, rozdiel v jeho rýchlostiach, veľkosť teploty horenia atď.
Mechanizmus chemických reakcií počas spaľovania
V téme "Chemická kinetika" sme zistili, že chemické reakcie sa vyskytujú pri priamom kontakte reagujúcich zložiek (molekúl, atómov, radikálov), ale len v prípadoch, keď ich energia presahuje určitý energetický limit, nazývaný aktivačná energia Ea. Graficky zmeňte energiu reagujúcich zložiek (palivo a okysličovadlo) a reakčných produktov počas spaľovania (Obrázok 1.1.).
Os osi x znázorňuje dráhu reakcie horenia a osa osi predstavuje energiu. - priemerná počiatočná energia reagujúcich zložiek, - priemerná energia produktov spaľovania.
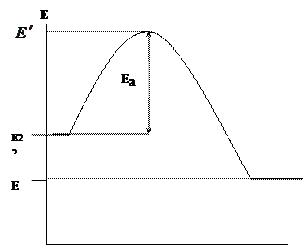 |
Obrázok 1.1. Zmena energie reaktantov a reakčných produktov počas spaľovania
Iba aktívne častice paliva a oxidačného činidla, ktoré budú mať energiu potrebnú na vstup do interakcie, t.j. schopný prekonať energetickú bariéru. Prebytočná energia aktívnych častíc v porovnaní s priemernou energiou sa nazýva aktivačná energia. Pretože reakcie prebiehajúce počas horenia sú exotermické ![]() , Rozdiel energií vznikajúcich produktov spaľovania a východiskových materiálov (palivo a okysličovadlo) určuje tepelný účinok reakcie:
, Rozdiel energií vznikajúcich produktov spaľovania a východiskových materiálov (palivo a okysličovadlo) určuje tepelný účinok reakcie:
 |
Podiel aktívnych molekúl sa zvyšuje so zvyšujúcou sa teplotou horľavej zmesi.
Na ris.1.2. ukazuje distribúciu energie medzi molekulami pri teplote.Ak zistíme pozdĺž energetickej osi hodnotu rovnajúcu sa aktivačnej energii, potom získame frakciu aktívnych molekúl v zmesi pri danej teplote. Ak sa pri pôsobení zdroja tepla teplota zmesi zvýši na hodnotu, potom sa zvýši podiel aktívnych molekúl a následne rýchlosť spaľovacej reakcie.
Existujú však chemické reakcie, ktoré nepotrebujú svoj vývoj v zreteľnom predhriatí. Toto sú reťazové reakcie.
Základom teórie reťazových reakcií je predpoklad, že východiskové materiály nie sú okamžite transformované do konečného produktu, ale s tvorbou aktívnych medziproduktov.
Produkt primárnej chemickej reakcie má veľké množstvo energie, ktorá môže byť dispergovaná v okolitom priestore počas kolízie molekúl reakčných produktov alebo v dôsledku žiarenia a môže byť prenesená do molekúl reagujúcich zložiek, čím sa uvedie do aktívneho stavu. Tieto aktívne molekuly (atómy, radikály) reaktantov vytvárajú reťazec reakcií, pri ktorých sa energia prenáša z jednej molekuly do druhej. Preto sa takéto reakcie nazývajú reťazové reakcie.

Chemicky aktívne molekuly, atómy, radikály vytvorené v elementárnych fázach reťazovej reakcie - reťazové väzby - sa nazývajú aktívne centrá. Väčšina aktívnych centier sú atómy a radikály, ktoré sú najviac reaktívne. Ale kvôli tomu sú nestabilné, pretože môžu vstupovať do rekombinačných reakcií s tvorbou neaktívnych produktov.
Dĺžka reťazca, tvorená jedným počiatočným aktívnym centrom, môže dosiahnuť niekoľko sto tisíc odkazov. Kinetické zákony reťazových reakcií v podstate závisia od toho, koľko aktívnych centier je vytvorených v jednom reťazovom reťazci. Ak sa s účasťou pôvodného aktívneho centra vytvorí len jedno aktívne centrum, potom sa takáto reťazová reakcia nazýva nerozvetvená, ale ak sa v jednom reťazci vytvoria dve alebo viac aktívnych centier, potom sa táto reťazová reakcia nazýva vetvená. Rýchlosť rozvetvených reťazových reakcií sa zvyšuje ako lavína, čo je dôvod pre samo-zrýchlenie oxidačných chemických reakcií počas spaľovania, pretože pre väčšinu z nich je charakteristický mechanizmus rozvetvených reťazových reakcií.
Prakticky každá spaľovacia reakcia môže mať súčasne príznaky tak mechanizmu tepelnej, ako aj reťazovej reakcie. Pôvod prvých aktívnych centier môže byť termickej povahy a reakcia aktívnych častíc reťazovým mechanizmom vedie k tvorbe tepla, zahrievaniu horľavej zmesi a tepelnej nukleace nových aktívnych centier.
Akákoľvek reťazová reakcia pozostáva zo základných fáz nukleace, pokračovania a ukončenia reťazca.
Pôvod reťazcaje endotermická reakcia. Tvorba voľných radikálov (t.j. atómov alebo skupín atómov, ktoré majú voľné valencie, napr. ![]() ) z molekúl východiskových látok, pravdepodobne v dôsledku monomolekulárnej alebo bimolekulárnej interakcie, ako aj v dôsledku akýchkoľvek vedľajších účinkov na horľavú zmes - zasvätenia.
) z molekúl východiskových látok, pravdepodobne v dôsledku monomolekulárnej alebo bimolekulárnej interakcie, ako aj v dôsledku akýchkoľvek vedľajších účinkov na horľavú zmes - zasvätenia.
Iniciáciu možno vykonať pridaním špeciálnych látok. iniciátori, ľahko tvoriace voľné radikály (napríklad peroxidy, chemicky aktívne plyny), pôsobením ionizujúceho žiarenia, pôsobením svetla - fotochemická iniciácia. Napríklad interakcia vodíka s chlórom
![]()
za normálnych podmienok postupuje veľmi pomaly a pri silnom osvetlení (slnečným svetlom, horením horčíkom) pokračuje výbuchom.
K reakciám pokračovanie reťazca zahŕňajú základné stupne reťazovej reakcie, ktoré sú spojené so zachovaním voľnej valencie a vedú k výdaju východiskových látok a tvorbe reakčných produktov.
inicializácia reťazca:
![]()
vetvenie reťazca:
![]()
![]()
otvorený okruh:
homogénna
![]()
heterogénne
S rozvojom reťazca, keď sa koncentrácia aktívnych centier stane dostatočne veľkou, je možné vytvorenie takého spojenia, v ktorom bude aktívne centrum reagovať bez vytvárania nového aktívneho centra. Tento jav sa nazýva prerušenie reťazca.
Otvorený okruh môžu byť homogénne a heterogénne.
Homogénne ukončenie reťazca je možné buď interakciou radikálov alebo atómov navzájom za vzniku stabilných produktov, alebo reakciou aktívneho centra s molekulou, ktorá je cudzia hlavnému procesu bez vytvárania nových aktívnych centier.
Heterogénny otvorený okruh sa vyskytuje na stenách nádoby, kde dochádza k spaľovacej reakcii alebo povrchu tuhých mikročastíc prítomných v plynnej fáze, ktoré sú niekedy špeciálne zavedené (napríklad ako pri hasení práškov). Mechanizmus narušenia heterogénneho reťazca je spojený s adsorpciou aktívnych centier na povrchu tuhých častíc alebo materiálov. Rýchlosť ukončenia heterogénneho reťazca silne závisí od pomeru povrchovej plochy stien k objemu nádoby, kde dochádza k spaľovaniu. Zníženie priemeru nádoby teda významne znižuje rýchlosť spaľovacej reakcie až do jej úplného zastavenia. Vychádza z toho vytvorenie požiarnych bariér.
Príkladom rozvetvenej reťazovej reakcie je reakcia horenia vodíka v kyslíku.
inicializácia reťazca:
![]()
vetvenie reťazca:
![]()
![]()
otvorený okruh:
homogénna
![]()
heterogénne
Spaľovanie uhľovodíkov
Skúmanie procesov spaľovania vodíka a oxidu uhoľnatého ukazuje zložitosť mechanizmu spaľovacej reakcie. V prípade H2 a CO reakcia prebieha ako reťazec s účasťou mnohých základných fáz a medziproduktov. Preto je prirodzené očakávať, že mechanizmus spaľovacích reakcií komplexnejších látok - uhľovodíkov - je ešte zložitejší a účinky sprevádzajúce procesy zapálenia a spaľovania týchto zlúčenín sú rôznorodejšie.
V súčasnosti dostupné informácie o povahe chemických transformácií uhľovodíkov v procese ich spaľovania nám umožňujú vysvetliť pozorované účinky s určitou aproximáciou.
Bolo zistené, že v uhľovodíkových plameňoch spolu s už známymi aktívnymi časticami H ×, OHx, Ox existuje veľký počet medziproduktov zložitejšej štruktúry. V niektorých prípadoch sa stávajú zdrojom vzniku nových reťazcov. Hlavnú úlohu v procesoch vznietenia a spaľovania uhľovodíkov zohrávajú nasledujúce typy medziproduktov:
1. Uhľovodíkové radikály, čo je molekula uhľovodíka, ktorá má jeden alebo viac atómov vodíka odstránených. Tieto zvyšky sa nazývajú alkyl (CH3-metyl; C2H5-etyl; C3H7-propyl, atď.). Vzhľadom na ich vysokú reaktivitu voľné alkyly už dlho neexistujú. Prítomné v plameňoch ako medziprodukty. Pri interakcii s inými molekulami sa správajú ako nezávislá štruktúrna skupina. Uhľovodíkové radikály
zvyčajne predstavuje písmeno R.
2. Peroxidy sú zlúčeniny všeobecného vzorca R-OO-R “.
3. Aldehydy - zlúčeniny typu
Najjednoduchšími aldehydmi sú mravčan (formaldehyd) HCOOH a octan (acetaldehyd) CH3COOH. Tieto látky sú vždy prítomné v produktoch neúplného spaľovania uhľovodíkov.
Tvorba reťazcov počas spaľovania uhľovodíkov môže byť akákoľvek reakcia, pri ktorej sa tvoria uhľovodíkové zvyšky. To môže byť rozkladná reakcia molekuly etánu s tvorbou dvoch voľných metylových skupín:
C2H6® × CH3
alebo reakcia uhľovodíka s kyslíkom:
RH + 02® × HO2 + xR
Pokračovanie reťazcov nastáva v dôsledku reakcií tvorby peroxid alebo hydroperoxid:
R + O 2® ROO ×
ROO × + RH® ROOH + R ×
Reťazenie vetvenia sa vykonáva počas rozkladu hydroperoxidu:
ROOH® × RO + x OH
Uvedená sekvencia reakcií vedie k postupnému zvyšovaniu koncentrácie peroxidových zlúčenín v reakčnom systéme.
Súčasne s hromadením peroxidov, radikálov, OH a H sa začínajú vyskytovať paralelné reakcie:
ROOH + x OH® ROO × + H20
Tieto reakcie sú exotermické; keď prúdia veľké množstvo tepla.
Pri zvýšení teploty reakčnej zmesi prechádza úloha aktívnych centier z jedného medziproduktu na druhý v nasledujúcom poradí: alkylhydroperoxidy, acylhydroperoxidy, aldehydy.
Experimentálne štúdie zmien v zložení reakčnej zmesi v priebehu času vo vysokoteplotnej oblasti (600-800 ° C) ukazujú, že proces transformácie počiatočných uhľovodíkov na konečné produkty spaľovania CO 2 a H20 je rozdelený do dvoch stupňov: prvý, vyskytujúci sa veľmi vysokou rýchlosťou, nastáva oxidácia uhľovodíkov na CO. Pri druhom pomalom stupni sa CO oxiduje na C02
Vplyv rôznych faktorov na rýchlosť chemických reakcií počas spaľovania
Závislosť reakčnej rýchlosti horenia na koncentrácii reagujúcich látok môže byť vyjadrená výrazom
![]() (1)
(1)
kde: k 0 - konštanta rýchlosti reakcie,
Z hôr - koncentrácia horľavej látky, kmol / m 3,
OK - koncentrácia oxidačného činidla, kmol / m 3,
x, y sú poradie reakcií pre palivo a oxidačné činidlo.
Ako je uvedené vyššie, súhrnná rovnica reakcie (1) neodráža skutočný mechanizmus spaľovacej reakcie, ktorý je viacstupňový a často reťazový, preto reakčné rády v rovnici (2) nie sú vždy zhodné s hodnotou stechiometrických koeficientov v rovnici (1).
Z toho vyplýva, že čím vyššia je koncentrácia horľavého materiálu, tým vyššia je rýchlosť horenia.
Rýchlosť reakcie horenia závisí od teploty:
e - základ prirodzeného logaritmu
E a - aktivačná energia, kJ / kmol,
R je univerzálna plynová konštanta, R = 8,314 kJ / (K.kmol)
T - teplota, K.
Táto rovnica je vyjadrením Arrheniovho zákona o závislosti rýchlosti chemických reakcií na teplote. V zjednodušenej forme pre úzky rozsah teplôt môžete použiť pravidlo Vant-Hoff: rýchlosť chemickej reakcie narastá 2-4 krát so zvyšujúcou sa teplotou na každých 10 ° C.
Rýchlosť chemickej oxidačnej reakcie horľavej látky počas spaľovania sa teda prudko zvyšuje so zvyšujúcou sa teplotou a čím vyššia, tým nižšia je aktivačná energia.
Rýchlosť oxidačných reakcií počas spaľovania závisí aj od tlaku.
Zvýšenie tlaku vedie k zvýšeniu objemovej koncentrácie horľavých plynných látok a oxidačného činidla. V praxi to vedie k tomu, že s rastúcim tlakom sa zvyšuje rýchlosť spaľovacích reakcií väčšiny látok.
Pri vysokých tlakoch dochádza k horúcim plameňom.
Ako je uvedené vyššie, chemické oxidačné reakcie sú vysoko exotermické, takže horenie je sprevádzané uvoľňovaním veľkého množstva tepla a preto prebieha pri vysokej teplote. Napríklad, teplota horenia dreva je 700-800 0 С, ropné produkty - ešte vyššie - 1300-1500 0 С.
Pri nízkych tlakoch sa môžu vyskytnúť tzv. Studené plamene. V tomto prípade dochádza k samovoľnému zrýchleniu chemickej reakcie reťazca v izotermickom režime. To sa deje s určitým zložením horľavej zmesi a určitým stavom životného prostredia. Izotermické samovoľné zrýchľovanie je typické pre zmesi s dostatočne vysokou koncentráciou aktívnych, ale pomerne stabilných medziproduktov, čo vedie k zníženiu rozvetvenia reťazcov a následne k zníženiu tvorby tepla, ktoré je odvádzané do okolitého prostredia v dôsledku chladiča a je čiastočne spotrebované na vykurovanie stabilných medziproduktov. Tam je žiara, čo je chemiluminiscencia, a nie tepelné vyžarovanie horúcich produktov spaľovania, ku ktorému dochádza v horúcich plameňoch.
Okrem toho, vzhľad studených plameňov je značne ovplyvnený stenami nádoby, v ktorej dochádza k spaľovaniu. Majú katalytický účinok na proces deštrukcie aktívnych centier, t.j. existuje heterogénny otvorený okruh. Intenzita tohto procesu je určená rýchlosťou difúzie aktívnych centier smerom k stenám cievy. K tomuto procesu prispieva aj znižujúci sa tlak. Zníženie tlaku môže viesť nielen k vytvoreniu studených plameňov namiesto horúcich, ale za určitých podmienok (napríklad v úzkych nádobách) aj pri úplnom zastavení spaľovania.
Ako je uvedené vyššie, chemické premeny v procese spaľovania vedú k vzniku rôznych fyzikálnych procesov: prenosu tepla v dôsledku konvekcie, tepelnej vodivosti a žiarenia, prenosu reaktantov atď.
To znamená, horiace môže byť charakterizovaný ako komplexný fyzikálno-chemický proces, ktorý je charakterizovaný tromi znakmi: chemickou transformáciou, uvoľňovaním tepla a žiarením (vrátane najčastejšie svetla, tj vo viditeľnej časti spektra). Absencia žiadneho z týchto označení naznačuje, že predmetný proces nezahŕňa napríklad "spaľovanie" žiarovky (nie je chemická transformácia), koróziu kovov (nedochádza k vyžarovaniu svetla a je to prakticky zanedbateľné vytváranie tepla) atď.
Zdieľať s priateľmi:zavlažovanie je vždy sprevádzané chemickými transformáciami. Spaľovanie vo vzduchu - interakcia horľavej látky s kyslíkom. Je však potrebné mať na pamäti, že oxidy dusíka, halogenidov a ozónu môžu v procese spaľovania pôsobiť ako oxidačné činidlá. Známe procesy spaľovania, ku ktorým dochádza len s jedným zdrojom produktu - zlúčeniny schopné rýchleho rozkladu. Príkladmi takýchto zlúčenín sú acetylén a hydrazín.
Chemické procesy prebiehajúce počas spaľovania sú mimoriadne zložité. Aj pre najjednoduchší prípad - spaľovanie vodíka v kyslíku, ktorého všeobecná rovnica má formu
2H2 + 0 = 2H2O,
bolo vytvorených a študovaných niekoľko desiatok základných štádií.
Doteraz sa dostatočne podrobne skúmali mechanizmy chemických transformácií počas spaľovania len niekoľkých látok, ako je vodík, oxid uhoľnatý, metán a etán. Tieto poznatky sa používajú na predpovedanie podmienok vznietenia a spaľovania mnohých látok.
2.1. Reťazové reakcie
Reťazové reakcie, na rozdiel od bežných chemických transformácií, sa vyznačujú tým, že sa v každom elementárnom akte vyskytuje aktívna častica: atóm s nepárovým elektrónom, voľný radikál alebo ión. Vzhľad aktívnych častíc spôsobuje reťazec transformácie východiskových materiálov na reakčné produkty. Atómy, voľné radikály a ióny sú reaktívnejšie ako valenciou nasýtené molekuly. Preto aj napriek značným nákladom na energiu, ktoré sú potrebné na rozbitie chemických väzieb a tvorbu aktívnych častíc, sa vývoj reťazca v reakcii často ukazuje ako energeticky výhodnejší ako priama interakcia medzi molekulami.
Spaľovacie procesy sa vyskytujú hlavne prostredníctvom reťazového mechanizmu. Reťazové reakcie - komplexné reakcie, ktoré prebiehajú v niekoľkých etapách a predstavujú:
Pôvod reťazcov (iniciácia), v ktorých sa tvoria aktívne častice;
Pokračovanie reťazcov, v ktorých aktívne častice vstupujú do chemickej interakcie s východiskovými materiálmi, v dôsledku čoho vznikajú nové aktívne častice;
Rozbitie reťazcov, pri ktorých dochádza k "smrti" aktívnych častíc pri tvorbe konečných reakčných produktov
Vznik reťazcov môže nastať za rôznych podmienok. Napríklad v dôsledku disociácie molekúl pôsobením tepelnej energie alebo ionizujúceho žiarenia v elektrickom výboji. Smrť aktívnych častíc nastáva, keď rekombinujú *, keď voľné radikály interagujú (homogénne zlomenie reťazca), keď aktívne častice interagujú s pevnými povrchmi (heterogénne zlomenie reťazca) alebo v dôsledku ich reakcie s inhibítormi horenia.
Existujú nerozvetvené a rozvetvené reťazové reakcie. V nerozvetvenej pre každú aktívnu časticu spotrebovanú v reakciách pokračovania reťazca existuje jeden znovu objavujúci sa. Počet molekúl produktu vytvorených na počiatočnú aktívnu časticu sa nazýva dĺžka reťazca. Dĺžka reťazí v reakciách spaľovania sa pohybuje od stoviek tisíc do desiatok miliónov. Rýchlosť reakcií nerozvetvených reťazcov môže byť ovplyvnená malými prímesami látok, ktoré môžu účinne interagovať s aktívnymi časticami, ako sú inhibítory spaľovania.
Niektoré látky - iniciátory - uľahčujú tvorbu aktívnych častíc a tým urýchľujú nerozvetvené reťazové reakcie.
V rozvetvených reťazcových reakciách na jednu aktívnu časticu, spotrebovanú s pokračovaním reťazca, sa tvoria dve alebo viac aktívnych častíc. Jeden z nich pokračuje v primárnom reťazci, zatiaľ čo iní začínajú nové reťazce, ktoré tvoria vetvenie (obr. 2.1).
"Rekombinácia je proces tvorby neutrálnych atómov alebo molekúl z nabitých častíc. Atómy a molekuly vytvorené počas rekombinácie môžu byť v uzemnenom alebo excitovanom stave."
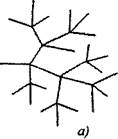
Obr. 2.1. Schematické znázornenie reakčných reťazcov:
a) rozvetvenie v každom článku reťazca
6) zriedkavé vetvenie
Napríklad pri spaľovaní vodíka v iniciačnej reakcii reťazca:
vzniká aktívny atóm. V reakcii na pokračovanie reťazca:

dochádza k nárastu počtu aktívnych atómov, ktoré sú začiatkom nových reťazcov.
Reakcie rozvetvených reťazcov môžu prebiehať v stacionárnom móde, v ktorom rýchlosť vetvenia je nižšia ako rýchlosť smrti aktívnych častíc a v nestacionárnom stave, v ktorom smrť prebieha pomalšie ako vetvenie. V druhom prípade sa rýchlosť reťazovej reakcie exponenciálne zvyšuje a je obmedzená iba spotrebou východiskových materiálov. Prechod zo stacionárneho do nestacionárneho režimu nastáva náhle s miernou zmenou podmienok reakcie: teplotou, tlakom alebo koncentráciou jedného z reaktantov. Takéto rýchle zrýchlenie sa považuje za samovznietenie reakčnej zmesi alebo explóziu reťazca.
Objav rozvetvených reťazových reakcií mal veľký význam pre vytvorenie teórie spaľovacích procesov. Je dokázané, že existujú dva typy zapaľovania: tepelné a reťazové. Vzory nastavené
Kapitola 2. Chemické procesy na horiace
teória reťazových procesov môže účinne ovplyvniť vývoj a potlačenie procesov spaľovania počas požiarov.
Pôvod reťazcov.Proces nukleace počiatočných aktívnych centier zohráva veľkú úlohu pri vývoji nerozvetvených reťazcových reakcií. Kompenzuje stratu aktívnych centier počas reakcií ukončenia reťazca. Tento mechanizmus určuje podmienky vzniku stacionárneho režimu v počiatočnom období akumulácie aktívnych centier. S malou mierou iniciácie môže byť toto obdobie významné.
Väčšina chemických reakcií v plameňoch má významnú energetickú rezervu aktívnych centier. Za týchto podmienok je začatie aktívnych centier spojené s prekonaním významnej energetickej bariéry.
V tomto prípade zohrávajú dôležitú úlohu faktory, ktoré zabezpečujú výrazný výskyt aktívnych centier: chemicky aktívne prísady, žiarenie, elektrický výboj, produkty rádioaktívneho rozkladu.
Medzi faktormi, ktoré veľmi uľahčujú tvorbu aktívnych centier, je potrebné poznamenať heterogénne reakcie. V molekulách horľavých látok adsorbovaných na pevnom povrchu sú interatomové väzby oslabené a ich lámanie vyžaduje menej energie. Za týchto podmienok je rýchlosť tvorby aktívnych centier výrazne vyššia ako v objeme plynu. Aktivačná energia v heterogénnej interakcii zložiek horľavej zmesi je tiež nižšia ako v prípade homogénnej zmesi. Heterogénna iniciácia aktívnych centier v podmienkach skutočných procesov spaľovania je dôležitým faktorom pri zrýchlenom dosahovaní stacionárneho režimu s nerozvetvenými reťazovými procesmi.
Niektoré vlastnosti charakterizujú nerozvetvené reťazové reakcie, ktoré sa vyskytujú za účasti atómových zložiek. V neprítomnosti nečistôt, ktoré sú v interakcii s aktívnymi centrami bez regenerácie, je ukončenie reťazca možné len vtedy, keď atómy rekombinujú trojnásobnými zrážkami a na povrchu.
Všetky plynné látky sú pri akejkoľvek teplote čiastočne disociované. Niektoré molekuly sa rozkladajú na atómy. V tomto prípade existuje rovnováha medzi procesmi disociácie a spojením atómov do molekúl. Stupeň disociácie exponenciálne závisí od teploty.
Ak v horľavej zmesi nie sú žiadne nečistoty, ktoré rozbíjajú reťazce, koncentrácia atómových zložiek reakcie zostáva prakticky nezmenená. Atómy, ktoré vstúpili do reakcie, sa okamžite regenerujú
Korolchenko A.Ya. Spaľovacie a explózne procesy
lichestve. Počiatočná iniciácia kompenzuje reaktívne atómy v rovnakom množstve ako v nereaktívnom systéme. Stacionárna reakcia nemá na tento proces vplyv. Charakteristickým znakom tohto režimu je rovnováha jednej zo zložiek reakcie, ktorá sa vyznačuje najmenej silnou väzbou medzi atómami v molekule. Koncentrácia inej atómovej zložky v tomto prípade je kvázistacionárna, ale viac rovnovážna.
S homogénnou iniciáciou spaľovacích reakcií sa stacionárny režim vytvorí až po určitom časovom období, pretože disociácia vyžaduje veľkú aktivačnú energiu. Počas tohto obdobia rýchlosť disociácie prevyšuje rýchlosť rekombinácie a aktívne centrá sa akumulujú v reakčnom systéme. Miera oboch procesov sa porovnáva len po zvýšení koncentrácie aktívnych centier na rovnováhu. Toto časové obdobie sa nazýva indukčné obdobie.
Prítomnosť pevného povrchu ako katalyzátora v reakčnej zóne nemení stav termodynamickej rovnováhy. Katalyzátor rovnako ovplyvňuje spätné a spätné reakcie. Aktívne centrá vznikajú nielen na pevnom povrchu, ale aj na ňom. Prítomnosť katalyzátora však urýchľuje dosiahnutie rovnovážneho disociačného stavu.
Ak sú v horľavej zmesi prítomné účinné látky, ktoré sú schopné podieľať sa na reakciách rozbitia reťazca, znižujú koncentráciu aktívnych centier. V tomto prípade je narušená rovnovážna disociácia jednej z počiatočných zložiek, ktorá spomaľuje reakciu a môže viesť k jej ukončeniu.
Experimenty ukazujú, že pri iniciácii nerozvetvenej reťazovej reakcie vonkajším zdrojom (napríklad svetelným zdrojom) môže koncentrácia aktívnych centier v počiatočnom štádiu vývoja procesu spaľovania významne prekročiť rovnovážnu.
V priebehu rozvetvených reťazcových reakcií majú podmienky počiatočnej iniciácie významný vplyv na vývoj reakcie. Pri pomaly sa pohybujúcich procesoch pridanie čiastočne zreagovanej zmesi k počiatočnej skráti indukčnú periódu a urýchli moment horenia plameňom.
Pokračovanie reťazcov.Charakteristickým znakom nerozvetvených reťazových reakcií je kvázi stacionarita koncentrácie aktívnych centier. V neprítomnosti otvoreného obvodu sa v ňom tvoria aktívne častice
Kapitola 2. Chemické procesy počas spaľovania
rovnaké množstvo, v akom sú použité. Nové vznikajú len pri počiatočnej iniciácii. Pri rovnakých rýchlostiach tvorby aktívnych centier a ukončenia reťazca sa stanovuje konštantná koncentrácia aktívnych centier a režim stacionárnej reakcie. Reakčná rýchlosť sa bude znižovať, keď sa spotrebujú počiatočné zložky.
V prípade rozvetvenej reťazovej reakcie sa koncentrácia aktívnych centier v reaktívnom systéme zvyšuje bez ohľadu na podmienky ich počiatočnej iniciácie. Realizovaný samočinný urýchľovací režim, ktorý má lavínový charakter. V tomto prípade je pre úplnú transformáciu východiskových zložiek do finálnych produktov reakcie postačujúce jedno počiatočné aktívne centrum.
Kinetická rovnica rozvetvenej hodnotnej reakcie je nasledovná. Zmena koncentrácie stabilných východiskových zložiek v priebehu času môže byť zanedbaná pri prvej aproximácii a môžu byť brané do úvahy iba rýchlejšie zmeny v koncentrácii aktívnych centier. n.Zmeny v tejto rýchlosti sú určené rýchlosťou počiatočnej iniciácie a pomerom rýchlostí reakcií vetvenia a ukončenia reťazca. Počiatočná rýchlosť iniciácie nezávisí od koncentrácie aktívnych centier prítomných v systéme. Rýchlosti procesov rozvetvenia a rozbitia sú úmerné koncentráciám aktívnych centier. Za týchto podmienok je celková rovnováha tvorby a výdavkov aktívnych centier určená súčtom rýchlostí procesov iniciácie, rozvetvenia a rozbitia:
![]() (2.1)
(2.1)
kde a sú rýchlostné konštanty rozvetvovacích a rozbíjacích reakcií. Označujeme:
![]() (2.2)
(2.2)
Keď čas derivácie koncentrácie aktívnych centier
je pozitívny. Rýchlosť reakcie sa s časom zvyšuje. Tento znak rozvetvených reťazcových reakcií je spôsobený násobením aktívnych centier v takých režimoch, keď rýchlosť vetviacej reakcie presahuje rýchlosť ukončovacej reakcie reťazca.
Korolchenko A.Ya. Spaľovacie a explózne procesy
Ak pred začiatkom reakcie systém neobsahoval aktívne centrá, t.j. nat= 0, n = 0 integrácia rovnice (2.2) dáva:
![]() (2.3)
(2.3)
Celková reakčná rýchlosť CO je určená rýchlosťou rozvetvovacieho procesu. Konečné produkty sa tvoria len počas tejto reakcie. Pre každý prípad vetvenia elementárneho reťazca sa tvoria molekuly konečného produktu. Nasleduje:
![]() (2.4)
(2.4)
Vývoj reťazovej reakcie v čase je určený pomerom rýchlostných konštánt reakcií rozvetvenia a ukončenia reťazca a keď je exponent v rovnici (2.4) pozitívny a
akcia je neobmedzene zrýchlená. V počiatočnom období vývoja reakcie platí nasledovný vzťah:
Vzhľadom k tomu, že rýchlosť počiatočnej iniciácie je malá, v počiatočnom období nie je viditeľná žiadna chemická transformácia. Po určitom čase sa hodnota stáva podstatne väčšou ako jedna. Potom sa rýchlosť reakcie v súlade s rovnicou (2.4) začína rýchlo zvyšovať a dosahuje veľmi veľké hodnoty, hoci to bolo predtým prakticky nepostrehnuteľné.
Prítomnosť oneskorovacej periódy (indukčná perióda) počas vývoja reťazovej reakcie je spôsobená potrebou akumulácie určitého počtu aktívnych centier v reaktívnom systéme. Až po tejto chemickej transformácii sa prejaví.
Veľkosť indukčnej periódy v reťazových reakciách určuje pomery rýchlostí rozvetvenia a procesov ukončenia reťazca, nie rýchlosť počiatočnej iniciácie. Na druhej strane sú rýchlosti rozvetvenia a rozpadových reakcií spôsobené chemickými vlastnosťami každého reakčného systému, sú určené závislosťou od teploty a koncentrácií východiskových zložiek. Zvláštnosť reťazových reakcií pre
je to, že rozvetvovacie procesy vyžadujú významnú aktivačnú energiu, zatiaľ čo teplotný koeficient rýchlostnej konštanty procesu rozbitia sa blíži nule. V reakciách ukončenia reťazcov všetkých troch typov: v prípade hromadných a heterogénnych rekombinácií, pri interakcii radikálov s aktívnymi nečistotami, sú aktivačné energie nulové.
So zvýšením teploty, celkového tlaku zmesi alebo zmenou koncentrácie reagujúcich zložiek je možná zmena rýchlostných konštánt rozvetvenia a rozbitia, pri ktorých sa reakcia mení zo stacionárneho na nestacionárny. Zvláštnosť tohto procesu spočíva v náhlom prechode z jedného režimu do druhého, pri zmene reakčnej rýchlosti zo zanedbateľnej hodnoty na neobmedzene rastúcu.
Tok niektorých reťazových reakcií je sprevádzaný tvorbou medziproduktov, ktoré sú pomerne stabilné, ale so schopnosťou vytvárať aktívne centrá. Medzi takéto reakcie patria napríklad uhľovodíkové spalovacie reakcie ako medziprodukty, v ktorých sa tvoria peroxidy a aldehydy. To vedie k rozvetveniu reťazca. V dôsledku relatívnej stability medziproduktov sa však zrýchlenie reakcie časom roztiahne. Takéto pomalé vetviace reťazce sa nazývajú degenerované.
Reťazové reakcie s obvyklým mechanizmom rozvetvenia radikálov, spravidla v dôsledku vysokej aktivity radikálov, prebiehajú pomerne rýchlo. Výsledné radikály buď iniciujú rýchlo urýchľujúcu reakciu, alebo rekombinujú a opúšťajú proces.
Otvorený okruh Aktívna častica, podobne ako každá molekula plynu, robí náhodné pohyby v reaktívnom systéme a koliduje s inými molekulami. Zároveň existuje určitá pravdepodobnosť pri určitej kolízii interakcie s inou aktívnou časticou alebo molekulou a tvorbou novej aktívnej častice, ktorá pokračuje cestou predchádzajúcej. Vývoj reakčného reťazca je podobný Brownovmu pohybu inertných molekúl, hoci prenos aktívnych centier je sprevádzaný chemickou reakciou. Na ceste vývoja reťazca striedajú aktívne centrá dvoch alebo viacerých typov.
Korolchenko A.Ya. Spaľovacie a explózne procesy
Reťazec reakcií pokračuje až do okamihu, keď aktívna častica nereaguje bez regenerácie. V tomto prípade dôjde k tzv. Otvorenému okruhu. Procesy rozbitia hrajú veľkú úlohu v kinetike reťazových reakcií. Existujú dva typy reakcií, ktoré vedú k smrti aktívnych centier:
Homogénny zlom (smrť v objeme reakčnej zmesi);
Heterogénne prerušenie (smrť na pevnom povrchu) Homogénne prerušenie reťazcov je možné jedným z dvoch procesov:
keď sa radikály rekombinujú alebo keď rôzne chemicky aktívne zložky interagujú s aktívnymi centrami bez ich regenerácie.
Heterogénne zlomenie reťazca sa vyskytuje na časticiach sadzí vytvorených počas spaľovania alebo na povrchu pevných horiacich materiálov. Otvorený okruh na pevnom povrchu možno považovať za difúziu aktívnych centier zo zmesi plynov k tomuto povrchu, na ktorom zmiznú. Mechanizmus rekombinácie na pevnom povrchu spočíva v tom, že aktívna častica, ktorá má zvýšenú reaktivitu, je sorbovaná na povrchu. Zvyšky, ktoré sú sorbované na priľahlých miestach, sa navzájom rekombinujú, pretože pre tento proces neexistujú žiadne energetické a priestorové prekážky. Molekuly stabilných zlúčenín vytvorené ako výsledok rekombinácie už nie sú zapojené do vývoja reťazovej reakcie.
Avšak nie každá kolízia aktívnej častice s pevným povrchom vedie k jej adsorpcii. Možno jeho odraz od povrchu. Pravdepodobnosť adsorpcie aktívneho stredu pevným povrchom sa nazýva koeficient umiestnenia. Tento koeficient je charakteristický pre chemickú afinitu aktívnej častice a povrchu. V prakticky dôležitých prípadoch sa aktívna častica po odraze od steny neodtiahne ďaleko od nej. Existuje pravdepodobnosť nových kolízií so stenou, až kým sa nevyskytne jej umiestnenie. V dôsledku tohto procesu je za určitých podmienok reakčná rýchlosť prakticky nezávislá od koeficientu umiestnenia. Proces prebieha tak, ako EÚ
* Sorpcia - absorpcia látky ha životného prostredia pevnou látkou (alebo kvapalinou). Absorpčné teleso sa nazýva sorbent- sorbát. Rozlišujte absorpciu celej hmoty sorbentu (absorpcia) a povrchovej vrstvy (adsorpcia). Sorpcia v dôsledku interakcie chemického typu medzi povrchom pevného sorbentu a sorbátom sa nazýva chemisorpcia.
__________________________ Kapitola 2. Chemické procesy počas spaľovania
ak pri každej kolízii nastal otvorený okruh. Koncentráciu aktívnych centier na povrchu možno považovať za nulovú.
V neprítomnosti aktívnych nečistôt v reakčnej zmesi môže dôjsť k rozbitiu reťazcov buď na tuhých povrchoch alebo homogénne rekombináciou radikálov vo veľkom. Pri reálnych požiaroch sa realizuje druhý spôsob.
Určitý vplyv na kinetiku reťazových reakcií má aditíva v reakčnom systéme inertných plynov. Inertné prísady zvyšujú počet kolízií s aktívnymi časticami, zvyšujú pravdepodobnosť zlomenia reťazca a tým inhibujú celkovú reakciu.
Účinnejšia inhibícia reťazových reakcií sa dosahuje zavedením reaktívnych aditív - inhibítorov do reakčnej zmesi. Inhibítory interagujú s aktívnymi centrami, čo vedie k reakcii a rozbíja reťazec. Kinetika reakcie v inhibovanej zmesi je určená podmienkami konkurencie medzi inhibítorom a hlavnými zložkami reakcie pri interakcii s aktívnymi centrami. S vysokou účinnosťou inhibítora a miernou rýchlosťou tvorby nových aktívnych centier môžu už malé prísady inhibítora úplne potláčať priebeh reťazovej reakcie.
Procesy inhibície majú veľký význam v praxi v oblasti bezpečnosti požiaru a výbuchu. Použitie inhibítorov umožňuje efektívne ovplyvňovať procesy spaľovania.
2.2. Chemické procesy pri spaľovaní vodíka
Interakcia vodíkovej molekuly s molekulou kyslíka prebieha komplexným spôsobom v sérii postupných fáz. Teraz je pevne stanovené, že spaľovanie vodíka prebieha reťazovým mechanizmom, pričom častice hrajú úlohu aktívnych centier. Postupnosť a význam elementárnych reakcií počas spaľovania vodíka sú podrobne opísané pre rôzne podmienky vzniku a vývoja vodíkových plameňov.
Najpodrobnejšiu analýzu procesu spaľovania vodíka v režime samovznietenia pomocou experimentálnych a výpočtových metód vykonal profesor A. N. Baratov. Navrhol nasledujúcu schému procesu, vrátane štrnástich základných elementárnych reakcií:
Korolchenko A.Ya. Spaľovacie a explózne procesy
K vzniku aktívnych centier dochádza reakciou
![]()
Pokračovanie reťazca reakcií
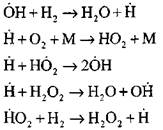
Rozvetvovacie reťaze
 |
otvorený okruh
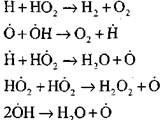 |
Koncentrácia atómov vodíka v počiatočnom štádiu procesu samovznietenia je nevýznamnou časťou počiatočného obsahu vodíka. S vývojom reťazovej reakcie sa rýchlosť konverzie molekulárneho vodíka stáva takou vysokou, že sa spotrebuje v stotinách sekundy.
2.3. Chemické reakcie pri horení oxidu uhoľnatého
Interakcia oxidu uhoľnatého s kyslíkom je hlavnou reakciou pre procesy spaľovania. Priebeh tejto reakcie počas
__________________________ Kapitola 2. Chemický process pri horení
mnoho prípadov určuje zákony spaľovania látok obsahujúcich uhlík. Reakcia je charakterizovaná mechanizmom s rozvetveným reťazcom. Má množstvo funkcií.
Dlhé obdobie existovalo presvedčenie, že úplne suchá zmes CO a 0 2 sa nemôže vznietiť a horieť. Avšak starostlivo nastavené experimenty, pri ktorých sa monitorovala neprítomnosť vody pomocou hmotnostného spektrografu, ukázali, že zapálenie je možné aj pre suchú zmes. Treba poznamenať, že prítomnosť vodnej pary CO + 0 2 alebo vodíka v systéme aktivuje proces vznietenia a spaľovania zvýšením počtu možných aktívnych centier. Akceleračný účinok vody je obzvlášť badateľný pri nízkych koncentráciách.
Spaľovanie oxidu uhoľnatého v prítomnosti vodnej pary alebo malých prídavkov vodíka sa uskutočňuje za účasti nasledujúcich základných procesov: \\ t

Zvyšky H20, ktoré sú tvorené reakciou (VI), môžu pokračovať v reťazci (reakcia VIII) alebo viesť k jeho rozpadu reakciou (IX-XII).
Na posúdenie podmienok prechodu pomalej oxidácie CO na explóziu reťazca odhadneme pravdepodobnosť prerušenia reťazca radikálom H02; berieme do úvahy, že úloha reakcií (X) a (XI) pri ukončení reťazca bude zanedbateľná z hľadiska
v porovnaní s reakciou (IX), pretože rýchlostné konštanty procesov (IX-XI) pri teplotách rádovo 1000 K sú blízko pri sebe, ale koncentrácia radikálov je omnoho nižšia ako koncentrácia atómov vodíka, pretože radikály majú vyššiu chemickú aktivitu. Pravdepodobnosť otvoreného okruhu cez radikál H02 môže byť zapísaná vo forme:
Pri teplote 1000 K
Preto za predpokladu, že
![]()
![]()
účinok
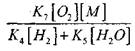
na riešenie rovnice (2.7) bude slabá.
Kapitola 2. Chemické procesy počas spaľovania
V prípade ![]() alebo
alebo ![]() (čo je pozorované v. \\ t
(čo je pozorované v. \\ t
reálne plamene S), rovnica (2.7) sa prevedie na formulár:
![]() (2.8)
(2.8)
Stav horenia oxidu uhoľnatého vo vzduchu je teda do značnej miery determinovaný prítomnosťou a modelmi horenia vodíka. Oxidácia CO reakciou (I) závisí od koncentrácie OH radikálov vytvorených v reakciách zahŕňajúcich vodík.
Zvláštnosťou spaľovacej reakcie oxidu uhoľnatého je jeho rýchla inhibícia, keď sa do reaktívneho systému látok s vysokou afinitou k atómom vodíka zavádzajú malé prísady. Takéto látky inhibujúce spaľovanie CO sú halogenidy a halogénové deriváty uhľovodíkov. Ich inhibičný účinok v dôsledku ukončenia reakčných reťazcov pri interakcii s atómami vodíka reakciou
2.4. Spaľovanie uhľovodíkov
Skúmanie procesov spaľovania vodíka a oxidu uhoľnatého ukazuje zložitosť mechanizmu spaľovacej reakcie. V prípade H2 a CO reakcia prebieha ako reťazec s účasťou mnohých základných fáz a medziproduktov. Preto je prirodzené očakávať, že mechanizmus spaľovacích reakcií komplexnejších látok - uhľovodíkov - je ešte zložitejší a účinky sprevádzajúce procesy zapálenia a spaľovania týchto zlúčenín sú rôznorodejšie.
V súčasnosti dostupné informácie o povahe chemického zvýšenia uhľovodíkov v procese ich spaľovania nám umožňujú vysvetliť pozorované účinky s určitou aproximáciou.
Bolo zistené, že v uhľovodíkových plameňoch, spolu s už známymi aktívnymi časticami, existuje veľký počet medziproduktov zložitejšej štruktúry. V niektorých prípadoch sa stávajú zdrojom vzniku nových reťazcov. Hlavnú úlohu v procesoch vznietenia a spaľovania uhľovodíkov zohrávajú nasledujúce typy medziproduktov:
Korolchenko A.Ya. Spaľovacie a explózne procesy
1. Uhľovodíkové radikály, čo je molekula
levodoroda, ktorá odstránila jeden alebo viac atómov vodíka. títo
zvyšky sa nazývajú alkyl (CH3-metyl; C2H5-etyl; C3H7-propyl a
atď.). Vďaka svojej vysokej reaktivite sú voľné alkyly
neexistujú dlho. Prítomný v plameňoch ako medziprodukt
VLÁDNE produkty. Pri interakcii s inými molekulami sa správajú
ako nezávislá štrukturálna skupina. Uhľovodíkové radikály
zvyčajne predstavuje písmeno R.
2. Peroxidy - zlúčeniny všeobecného vzorca R-00-R ".
3. Aldehydy - zlúčeniny typu
![]()
Najjednoduchšími aldehydmi sú mravčia (formaldehyd) a octová (acetaldehyd). ![]() , Tieto látky sú všetky
, Tieto látky sú všetky
sú prítomné v produktoch neúplného spaľovania uhľovodíkov.
Tvorba reťazcov počas spaľovania uhľovodíkov môže byť akákoľvek reakcia, pri ktorej sa tvoria uhľovodíkové zvyšky. To môže byť rozkladná reakcia molekuly etánu s tvorbou dvoch voľných metylových skupín:
![]()
alebo reakcia uhľovodíka s kyslíkom:
![]()
Pokračovanie reťazcov nastáva v dôsledku reakcií tvorby peroxid alebo hydroperoxid:
![]()
Reťazenie vetvenia sa vykonáva počas rozkladu hydroperoxidu:
Kapitola 2. Chemické procesy počas spaľovania
Uvedená sekvencia reakcií vedie k postupnému zvyšovaniu koncentrácie peroxidových zlúčenín v reakčnom systéme.
Súčasne s hromadením peroxidov, radikálov a štartovaním
existujú paralelné reakcie:

Tieto reakcie sú exotermické; keď prúdia veľké množstvo tepla.
Pri zvýšení teploty reakčnej zmesi prechádza úloha aktívnych centier z jedného medziproduktu na druhý v nasledujúcom poradí: alkylhydroperoxidy, acylhydroperoxidy, formaldehydy.
Experimentálne štúdie zmien v zložení reakčnej zmesi v priebehu času vo vysokoteplotnej oblasti (600-800 ° C) ukazujú, že proces transformácie počiatočných uhľovodíkov na konečné produkty spaľovania je rozdelený do dvoch stupňov: prvý, vyskytujúci sa veľmi vysokou rýchlosťou, oxiduje uhľovodíky na CO. V druhom pomalom štádiu sa oxiduje CO na. Nasleduje veľmi dôležitý záver: mnohé zo zákonov spaľovania uhľovodíkov možno vysvetliť vlastnosťami spaľovania oxidu uhoľnatého.
2.5. Spaľovanie uhlíka
Spaľovanie uhlíka prebieha podľa mechanizmu heterogénneho procesu, ktorého špecifickosť spočíva v tom, že chemický stupeň nemožno považovať za izolovaný od procesu prenosu plynného okysličovadla (kyslíka zo vzduchu) z okolitého priestoru na povrch horiacej tuhej látky. Rýchlosť horenia závisí od chemických vlastností uhlíka a od vlastností, ktoré určujú proces dodávania kyslíka na povrch paliva. Prívod kyslíka do spaľovacej zóny sa uskutočňuje difúziou a preto
Korolchenko A.Ya. Spaľovacie a explózne procesy
závisí od mnohých faktorov: tvaru a veľkosti spaľovacieho telesa, pohybu plynného média, difúznych koeficientov kyslíka a reakčných produktov ako v priestore nad povrchom paliva, tak v trhlinách a póroch obsiahnutých v uhoľnom a koksárenskom priemysle vo významných množstvách.
Na ilustráciu vlastností heterogénneho spaľovania uhlíka uvažujeme správanie samostatného kusa uhlia umiestneného v peci ohriatej na teplotu 900 ° C. V počiatočnom momente dôjde k spaľovaniu uhlia na úkor kyslíka nachádzajúceho sa v blízkosti jeho povrchu. Po jeho použití sa okolo ohrievaného povrchu tvorí vrstva produktov horenia. Rýchlosť horenia sa zníži a proces by mohol prestať, ak by nevznikal žiadny kyslík zo vzdialenejších oblastí plynového priestoru.
Tento prietok prebieha difúziou a rýchlosť horenia sa určí difúznym tokom. Intenzita difúzie do značnej miery závisí od intenzity a povahy pohybu plynového média v blízkosti horiaceho povrchu. Rýchlosť chemickej reakcie je určená hlavne teplotou. Heterogénne reakcie, rovnako ako homogénne reakcie, sa riadia zákonom Arre-nius.
Pri vysokých teplotách prebieha oxidačná reakcia uhlíka veľmi rýchlo a celková rýchlosť procesu bude obmedzená difúziou kyslíka na povrch.
Proces spaľovania uhlíka sa teda skladá z dvoch procesov rôzneho charakteru: procesu transportu kyslíka zo vzduchu do priestoru jeho spotreby a procesu jeho chemickej interakcie s povrchom tuhého uhlíka. Oba tieto procesy sú vzájomne prepojené, ale každý má svoje vlastné zákony. Najdôležitejším z týchto procesov je proces spotreby kyslíka, ktorý sa vyznačuje rôznymi chemickými reakciami.
Mechanizmus komplexnej reakcie spájania kyslíka s uhlíkom spočíva v súčasnej tvorbe dvoch oxidov CO a C02 cez intermediárny fyzikálno-chemický komplex typu CXoY, ktorý sa potom rozdelí na CO a C02. Pomer medzi týmito oxidmi závisí od podmienok horenia. Rovnica pre reakciu horiaceho uhlíka môže byť zapísaná nasledovne:
Kapitola 2. Chemické procesy počas spaľovania
Potom pokračuje homogénna reakcia horenia oxidu uhoľnatého:
mechanizmus, o ktorom sa hovorí v oddiele 2.3.
Táto reakcia sa môže uskutočniť v blízkosti povrchu uhlíka, taka vo vnútri uhoľnej hmoty, v póroch a trhlinách.
Ďalšou reakciou je heterogénna reakcia medzi horúcim uhlíkom a oxidom uhličitým:
![]()
Teká pri viditeľnej rýchlosti v miestach, kde je nedostatok kyslíka, ale kde je teplota uhlíka dostatočne vysoká.
Kombinácia opísaných reakcií určuje zloženie produktov spaľovania uhlíka.
EMERGENCIA PROCESOV SPUSTENIA
| D |
v dôsledku samovznietenia, vznietenia vonkajším zdrojom alebo samovznietenia sa môže vyskytnúť zavlažovanie v horľavých zmesiach. Ak sú procesy samovznietenia a vznietenia charakteristické pre látky, ktoré sú v plynnom, kvapalnom alebo tuhom skupenstve, potom je samovznietenie charakteristické pre tuhé materiály (najmä tie v jemne rozdelenom stave) alebo vysoko vriace kvapaliny rozložené na materiáloch s vyvinutým povrchom.
3.1. Samovznietenia. Stacionárna teória
Jednoducho povedané, spaľovanie sa chápe ako rýchly exotermický proces oxidácie látok atmosférickým kyslíkom s uvoľňovaním významného množstva tepla a emisií svetla.
Spaľovanie je komplexný fyzikálno-chemický proces interakcie horľavej látky s oxidačným činidlom, ako aj rozklad určitých látok, charakterizovaný samovoľnou transformáciou s uvoľňovaním veľkého množstva tepla a emisií svetla. Obvykle sa ako oxidačné činidlo používa kyslíkový vzduch s koncentráciou 21. vol. %, Na vznik a vývoj procesu spaľovania sú potrebné horľavé látky, oxidačné činidlo a zdroj vznietenia, ktoré iniciujú určitú rýchlosť chemickej reakcie medzi palivom a oxidačným činidlom.
Spaľovanie sa spravidla uskutočňuje v plynnej fáze, preto musia byť horľavé látky, ktoré sú v kondenzovanom stave (kvapaliny a pevné látky), podrobené splyňovaniu (odparovaniu, rozkladu) za účelom vytvorenia a udržania spaľovania. Spaľovanie sa vyznačuje rôznymi typmi a charakteristikami spôsobenými procesmi prenosu tepla a hmoty, plyn-dynamickými faktormi, kinetikou chemických reakcií a ďalšími faktormi, ako aj spätnou väzbou medzi vonkajšími podmienkami a charakterom procesu vývoja.
2.4.2.1. Klasifikácia procesov spaľovania.
Horenie môže byť homogénna a heterogénne v závislosti od stavu agregácie horľavých látok a oxidačného činidla.
K homogénnemu spaľovaniu dochádza, keď reagujúce zložky horľavej zmesi majú rovnaký agregátny stav. Homogénne horenie môže byť kinetický a rozptyl v závislosti na podmienkach tvorby zmesi horľavých zložiek a na pomere rýchlostí chemických reakcií a tvorby zmesi. Jeden alebo iný spôsob spaľovania sa realizuje napríklad v prípade požiaru, v závislosti od toho, ktorý z fáz procesu spaľovania je limitujúci: rýchlosť tvorby zmesi alebo rýchlosť chemických reakcií.
Kinetické je spaľovanie zmesí zmiešaného plynu alebo pár so vzduchom (limitujúcim stupňom procesu je rýchlosť chemických reakcií), ktorá má často výbušný charakter (ak sa zmes vytvára v uzavretom priestore), pretože energia uvoľnená súčasne nemá čas na to, aby sa vybila mimo tohto priestoru. Kinetické spaľovanie môže byť tiež pokojné, ak je horľavá zmes vytvorená v malom otvorenom priestore s nepretržitým prívodom paliva do spaľovacej zóny.
Spôsob difúzie spaľovania sa realizuje pri vytváraní horľavej zmesi priamo v zóne spaľovania, keď do nej oxidačné činidlo vstupuje v dôsledku difúznych procesov, napríklad pri heterogénne pálenie.
Heterogénne spaľovanie sa uskutočňuje v rôznych agregačných stavoch horľavej látky a oxidačného činidla. Pri heterogénnom spaľovaní zohráva dôležitú úlohu intenzita prúdenia pár vytvorených z kondenzovaných horľavých látok (kvapalín, pevných látok) do reakčnej zóny.
Z plynových dynamických polôh môže byť spaľovanie laminárnea turbulentné.
Laminárny režim procesu spaľovania sa vykonáva v prípade, keď zložky horľavej zmesi vstupujú do reakčnej zóny s malými hodnotami Reynoldsovho kritéria (0).< Re < 200), т.е. в основном за счёт молекулярной диффузии. Процесс характеризуется малыми скоростями газовыхtoky paliva a okysličovadla a vrstvené rozloženie reakčnej zóny (predná časť plameňa) v priestore. Rýchlosť horenia v tomto prípade závisí od rýchlosti tvorby horľavej zmesi.
Turbulentný režim procesu sa realizuje vtedy, keď zložky horľavej zmesi vstupujú do reakčnej zóny s veľkými hodnotami Reynoldsovho kritéria (230).< R e< 10000). horiace v tomto režime nastáva so zvyšujúcou sa rýchlosťou plynu prietokkeď je narušená laminarita ich pohybu. V turbulentnom spôsobe spaľovania turbulencia prúdov plynu zlepšuje miešanie reagujúcich zložiek, čím sa zvyšuje povrchová plocha, cez ktorú dochádza k molekulovej difúzii, čo vedie k zvýšeniu rýchlosti šírenia plameňa v priestore.
Rýchlosť šírenia plameňa v priestore je rozdelená na:
– náhleho vznietenia(rýchlosť šírenia plameňa je niekoľko m / s);
– výbušný (Rýchlosť plameňa je desiatky a stovky m / sale nie viac ako rýchlosť šírenia zvuku vo vzduchu (344). \\ t m / s));
– klepanie (rýchlosť šírenia plameňa je väčšia ako rýchlosť zvuku vo vzduchu).
V závislosti od hĺbky chemických reakcií môže byť horenie plne a neúplný.
Pri plnom spaľovaní sa reakcia uskutočňuje až do konca, t.j. pred tvorbou látok, ktoré nie sú schopné ďalej vzájomne spolupracovať s palivom a oxidantom (počiatočný pomer horľavej látky a oxidačného činidla sa nazýva stechiometrický). Napríklad, zvážte úplné spaľovanie metánu, pokračujte reakciou
CH 4 + 2O 2 = CO 2 + 2H 2 O+ Q
kde Q - teplo uvoľnené exotermickou reakciou, \\ t J..
Pri úplnom spaľovaní uhľovodíkov sú reakčnými produktmi oxid uhličitý a voda, teda netoxické a nehorľavé látky. Plné spaľovanie môže byť realizované tak so stechiometrickým pomerom paliva a oxidačného činidla, ako aj s nadbytkom oxidačného činidla vzhľadom na jeho stechiometrický obsah v horľavej zmesi.
Neúplné spaľovanie je charakterizované neúplnosťou chemickej reakcie, t.j. reakčné produkty v prítomnosti oxidačného činidla s ním môžu ďalej interagovať. K neúplnému spaľovaniu dochádza s nedostatočným (v porovnaní so stechiometrickým) obsahom oxidačného činidla v horľavej zmesi. V dôsledku neúplného spaľovania, napríklad uhľovodíkov, sa vytvárajú toxické a horľavé zložky, ako sú napr CO, H 2, benzpyrén, C (sadze), organické živice, atď., spolu asi 300 chemických zlúčenín a prvkov.
Iné veci, ktoré sú rovnaké, s plným spaľovaním, sa vyvíjajú vyššie teploty ako v neúplných podmienkach.
2.4.2.2. Hlavné mechanizmy spaľovania.
Spaľovanie je sprevádzané uvoľňovaním tepla a vyžarovaním svetla a vyskytuje sa v podmienkach postupného samovoľného zrýchlenia procesu spojeného s akumuláciou tepla v systéme ( tepelné horenie) alebo katalyzáciou aktívnych medziproduktov reakcie ( spaľovanie reťazcov).
Tepelné spaľovanie je možné počas exotermickej reakcie, ktorej rýchlosť sa rýchlo zvyšuje vplyvom tepla nahromadeného v systéme, čo vedie k zvýšeniu teploty. Keď teplota, pri ktorej tepelný príkon z reakcie prevyšuje tepelné straty v životnom prostredí, systém sa bude samovoľne zahrievať, končiť samovznietením horľavej zmesi. Za týchto podmienok sa pozoruje spontánny vývoj reakcie, po čom nasleduje výsledné produkty na teplotu, pri ktorej začínajú emitovať svetlo (viac ako 900 ° С). Tepelné spaľovanie zahŕňa procesy zahŕňajúce vzdušný kyslík a bez neho (rozklad výbušnín, ozónu, acetylénu a peroxidov (napr. H 2 ach 2), interakcie niektorých kovov s halogénmi, sírou atď.).
Spaľovanie reťazí je možné len pri reakciách, pri ktorých je reťazový proces základom zapálenia alebo výbuchu. Ten je sprevádzaný tvorbou nestabilných medziproduktov reakcie produktov, ktoré regenerujú aktívne centrá (atómy a molekuly s voľnými chemickými väzbami), ktoré urýchľujú proces. Akumulácia dostatočného počtu aktívnych centier prispieva k prechodu reťazového procesu na teplo a k zvýšeniu teploty zmesi do bodu jej samovznietenia. Takéto aktívne centrá vznikajú v dôsledku zvýšenia rýchlosti tepelného vibračného pohybu molekúl a sú násobené v dôsledku rozvetvenia reťazcov. V počiatočných fázach reakcií prebiehajúcich reťazovým mechanizmom prechádza chemická energia reagujúcich látok hlavne do tvorby nových aktívnych centier. Proces zmeny koncentrácie aktívnych centier je opísaný v rovnici:
![]() (1)
(1)
kde n - počet aktívnych centier v reakčnej zóne;
τ - čas;
w 0 - rýchlosť nukleace aktívnych centier;
φ - konštantná charakteristika rozdielu v rýchlosti vetvenia a ukončenia reťazca.
Z hľadiska molekulárnej kinetickej teórie (MKT) štruktúry hmoty dochádza k chemickým reakciám spaľovania v dôsledku interakcie molekúl paliva a oxidačných molekúl. Sily molekulárnej interakcie medzi dvomi zložkami horľavej zmesi sa objavujú vo veľmi malej vzdialenosti a s nárastom týchto zložiek prudko klesá. Preto je interakcia medzi palivom a oxidačnými molekulami možná len s ich úplnou konvergenciou, ktorú možno považovať za kolíziu. V dôsledku toho musí chemickej reakcii medzi palivom a oxidačným činidlom predchádzať zmiešanie zložiek a fyzikálne pôsobenie elastickej kolízie molekúl.
Počet zrážok molekúl plynu na jednotku objemu sa dá ľahko vypočítať. Napríklad pre stechiometrickú zmes vodíka a kyslíka (2) H 2 + ach 2) pri teplote 288 ° C K a atmosférický tlak (~ 101325 ° C) pas) počet kolízií pre 1. \\ t s v 1 cm3 dosiahne 8,3 · 10 28. Ak by všetky tieto kolízie viedli k chemickej reakcii, celá zmes by reagovala veľmi rýchlo. Prax ukazuje, že za týchto podmienok nie je reakcia spaľovania vôbec, pretože Všetky tieto kolízie nevedú k chemickej interakcii.
Aby nastala chemická reakcia, musia byť reaktívne molekuly v excitovanom stave. Takáto excitácia môže byť chemická, keď atómy molekúl majú jednu alebo dve voľné valencie (takéto molekuly sa nazývajú radikály a označujú sa napr. CH 3 , OH , CH 2, atď.) A fyzikálne, keď v dôsledku pomalého zahrievania molekuly získavajú kinetickú energiu nad kritickou hodnotou.
Molekuly s potrebnou energiou na rozbitie alebo zoslabenie existujúcich väzieb sa nazývajú aktívne centrá chemickej reakcie.
Rozdiel medzi priemernými úrovňami energetickej zásoby molekúl v aktívnom stave a normálnom stave, t. neaktívny, neosobný stav, sa nazýva aktivačná energia ( E a). Čím vyššia je číselná hodnota aktivačnej energie, tým ťažšie je, aby sa tento pár činidiel dostal do chemickej reakcie a naopak. Aktivačná energia je teda nepriamym ukazovateľom stupňa nebezpečenstva požiaru horľavých látok.
Aktivačnú energiu môžete odhadnúť podľa vzorca:
kde E a- aktivačná energia J.;
k - Boltzmannova konštanta, rovná 1,38 · 10 –23 J / c;
T- absolútna teplota K.
Charakter toku hlavného procesu chemického spaľovania závisí od množstva fyzikálnych procesov:
- pohyb reaktantov a reakčných produktov (difúzne procesy);
- uvoľňovanie a distribúcia tepla (procesy prenosu tepla);
- aerodynamické a hydrodynamické podmienky zabezpečujúce prenos tepla a hmoty (konvekčné procesy).
Potreba zohľadniť tieto faktory značne komplikuje štúdium a teoretický opis procesov spaľovania.
Spaľovanie tuhých látok, ktoré pri zahrievaní nevytvárajú plynnú (parnú) fázu, je heterogénne a prebieha na rozhraní, preto spolu s faktormi, ktoré sa posudzujú vyššie, ktoré ovplyvňujú charakter procesu, hrá veľkosť a povaha povrchu pevnej fázy mimoriadne dôležitú úlohu (to je obzvlášť dôležité pre aerosóly).
2.4.2.3. Pulzy zapálenia.
Popri horľavej látke a oxidačnom činidle je potrebný počiatočný energetický impulz na výskyt spaľovania (najčastejšie celkové uvoľňovanie tepla), ktoré spôsobuje vznietenie malého objemu horľavej zmesi, po ktorom sa spaľovanie šíri po celom priestore, v ktorom je distribuovaný.
K impulzu zapálenia môže dôjsť, keď sa vyskytnú fyzikálne, chemické a mikrobiologické procesy, ktoré podporujú tvorbu tepla. V závislosti od povahy týchto procesov sa impulzy, resp fyzický, chemickýa mikrobiologické.
Pretože keď sa na systém aplikuje fyzikálny impulz, vytvára sa teplo, ktoré nie je výsledkom chemického procesu, tento impulz sa považuje za teplo. Vplyv tepelného impulzu, ktorý spôsobuje, že systém sa zahrieva, môže byť:
– kontakt - prenos tepla sa vykonáva v dôsledku kontaktu horľavej zmesi s jej zdrojom;
– žiarenie- prenos tepla horľavej zmesi nastáva elektromagnetickým žiarením zo zdroja tepla;
– prúdenie - prenos tepla do horľavého systému sa uskutočňuje látkou (vzduch alebo iný plyn v pohybe);
– hydraulicky (dynamická) - tvorba tepla v dôsledku rýchleho poklesu objemu zmesi plynov, sprevádzaná zvýšením tlaku týchto plynov.
Hlavnými zdrojmi tepelného impulzu sú:
- otvorený plameň (teplota ~ 1500 ° C) ° С);
- vyhrievané povrchy (teplota\u003e 900 ° C) ° С);
- mechanické iskry (teplota ~ 1200 ° C) ° С)
- elektrické iskry (teplota do 6000 ° C). \\ t ° С).
Počas chemických a mikrobiologických pulzov dochádza k akumulácii tepla v systéme v dôsledku chemickej reakcie, fyzikálno-chemického procesu (napríklad adsorpcie) a životne dôležitej aktivity mikroorganizmov, pre ktoré je horľavá látka potravou.
2.4.2.4. Rýchlosť spaľovacích reakcií.
Rýchlosť procesu spaľovania vo všeobecnosti je určená rovnicou:
 (3)
(3)
kde a , b - koncentrácia reaktívnych zložiek;
τ - čas
alebo 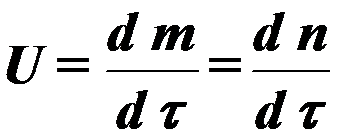 (4)
(4)
kde m, n - koncentrácia produktov spaľovania.
Zvýšenie rýchlosti horenia je sprevádzané zvýšením množstva tepla vstupujúceho do systému za jednotku času a v dôsledku toho zvýšením teploty horenia.
2.4.2.5. Teplota horenia
Počas spaľovania nie je celé množstvo uvoľneného tepla vynaložené na zvýšenie teploty reakčnej zmesi, pretože jej časť je spotrebovaná vo forme strát pre:
- chemické a fyzikálne spaľovanie, započítané koeficientom podpaľovania (\\ t β );
- elektromagnetické žiarenie plameňa v závislosti od teploty vyžarujúceho telesa, jeho stavu agregácie a chemickej povahy. Táto závislosť je určená koeficientom čiernej sálavého telesa ( ε ) a vlnovej dĺžky elektromagnetického žiarenia;
- straty vodivosti a konvekcie.
Na tomto základe v procesoch spaľovania existujú 3 hlavné typy teplôt:
- kalorimetrické;
- teoretické (vypočítané);
- skutočné.
Kalometrická teplota sa dosiahne, keď sa všetko teplo uvoľnené počas procesu spaľovania použije na zohrievanie produktov spaľovania, napríklad počas spaľovania benzénu. K, benzín - 2315 Kvodík - 2503 Kzemný plyn - 2293 K.
Teoretická (vypočítaná) teplota sa stanoví s prihliadnutím na tepelné straty disociácie produktov spaľovania. Významná disociácia produktov spaľovania uhľovodíkových horľavých látok začína pri teplote\u003e 2000 ° C K, Takéto vysoké teploty sa pri požiari za výrobných podmienok prakticky nestretávajú, preto sa v týchto prípadoch spravidla neberú do úvahy tepelné straty spôsobené disociáciou.
Skutočná teplota spaľovania je určená s ohľadom na tepelné straty pre životné prostredie a pre takmer všetky horľavé látky je ~ 1300 - 1700 K.


 Metódy spaľovania zemného plynu
Metódy spaľovania zemného plynu Ako preniesť údaje z meračov v Perm?
Ako preniesť údaje z meračov v Perm? Ako umývať kuchynské utierky
Ako umývať kuchynské utierky