දහන ක්රියාවලියේ ප්රධාන රසායනික ප්රතික්රියාව. දහන ක්රියාවලි
දහනය යනු භෞතික රසායනික ක්රියාවලියක් වන අතර එය සං signs ා තුනකින් සංලක්ෂිත වේ: රසායනික පරිවර්තනය, තාප උත්පාදනය, ආලෝක විමෝචනය. මෙම සං signs ා මගින් පිළිස්සීම වෙනත් සංසිද්ධීන්ගෙන් වෙන්කර හඳුනාගත හැකිය. උදාහරණයක් ලෙස තාපදීප්ත විදුලි බුබුලක “දැවීම” තාපය හා ආලෝකය නිපදවුවද එය දැවීම ලෙස හැඳින්විය නොහැක. මෙම සංසිද්ධිය දහනය කිරීමේ සං signs ා වලින් එකක් නොවේ - රසායනික ක්රියාවලියක්. විදුලි බුබුලක සූත්රිකාවක දීප්තිය යනු තාප ශක්තියෙන් කොටසක් ආලෝකයට සංක්රමණය වීමත් සමඟ නිශ්චිත උෂ්ණත්වයකට විද්යුත් ධාරාවක් ගමන් කිරීමෙන් එහි දීප්තියයි.
බොහෝ අවස්ථාවලදී දහනය කිරීම සංකීර්ණ රසායනික ක්රියාවලියකි. එය රෙඩොක්ස් වර්ගයේ මූලික රසායනික ප්රතික්රියා වලින් සමන්විත වන අතර එය අන්තර්ක්රියාකාරී අණු වල පරමාණු අතර සංයුජතා ඉලෙක්ට්රෝන නැවත බෙදා හැරීමට මග පාදයි. ඔක්සිකාරක විවිධ ද්රව්ය විය හැකිය: ක්ලෝරීන්, බ්රෝමීන්, සල්ෆර්, ඔක්සිජන්, ඔක්සිජන් අඩංගු ද්රව්ය ආදිය. කෙසේ වෙතත්, බොහෝ විට ඔබට වාතයේ වායුගෝලයේ දැවීම සමඟ කටයුතු කිරීමට සිදුවන අතර ඔක්සිකාරක කාරකය ඔක්සිජන් වේ. වාතය වායූන්ගේ මිශ්රණයක් බව දන්නා අතර එහි ප්රධාන කොටස් වන්නේ නයිට්රජන් (78%), ඔක්සිජන් (21%) සහ ආගන් (0.9%) ය. වාතයේ අඩංගු ආගන් නිෂ්ක්රීය වායුවක් වන අතර දහන ක්රියාවලියට සහභාගී නොවේ.
බොහෝ ගණනය කිරීම් සඳහා (ද්රව්යයක තනි ස්කන්ධයක් හෝ පරිමාව ඒකකයක් දහනය කිරීම සඳහා අවශ්ය වාතය පරිමාව තීරණය කිරීම, දහන නිෂ්පාදනවල පරිමාව සොයා ගැනීම, දහන උෂ්ණත්වය යනාදිය), වාතයේ ඇති ද්රව්ය දහනය කිරීමේ ප්රතික්රියා සඳහා සමීකරණ සෑදීම අවශ්ය වේ. මෙම සමීකරණ සම්පාදනය කිරීමේදී පහත පරිදි ඉදිරියට යන්න: දහනය කළ හැකි පදාර්ථය සහ දහනයට සහභාගී වන වාතය වම් පසින් ලියා ඇති අතර සමාන ලකුණෙන් පසුව දහනයේ නිෂ්පාදන ලියා ඇත. උදාහරණයක් ලෙස, වාතයේ මීතේන් දහනය කිරීමේ ප්රතික්රියාව සඳහා සමීකරණය කිරීම අවශ්ය වේ. පළමුව, ප්රතික්රියා සමීකරණයේ වම් පැත්ත ලියන්න: මීතේන්හි රසායනික සූත්රය සහ වාතය සෑදෙන ද්රව්යවල රසායනික සූත්ර. ගණනය කිරීමේ පහසුව සඳහා, වාතය 21% ඔක්සිජන් සහ 79% නයිට්රජන් වලින් සමන්විත යැයි උපකල්පනය කෙරේ, එනම්. 79/21 = වාතයේ ඇති ඔක්සිජන් පරිමාවකට නයිට්රජන් පරිමාව 3.76 ක් හෝ එක් එක් ඔක්සිජන් අණුවකට නයිට්රජන් අණු 3.76 ක්. මේ අනුව, වාතයේ සංයුතිය පහත පරිදි නිරූපණය කළ හැකිය: O 2 + 3.76N 2. එවිට සමීකරණයේ වම් පැත්ත පෙනෙනු ඇත:
CH 4 + O 2 + 3.76N 2 =.
කුමන නිෂ්පාදන සිදුවනු ඇත්ද? දහනය කළ හැකි ද්රව්යවල සංයුතිය කෙරෙහි අවධානය යොමු කිරීම අවශ්ය වේ. සම්පූර්ණයෙන්ම දහනය වන විට ඉන්ධන කාබන් සෑම විටම වල් බවට පත්වේ
කාබන් කාබන් (CO 2), හයිඩ්රජන් - ජලයේ (H 2 O). මෙම ඉන්ධනවල වෙනත් මූලද්රව්යයන් නොමැති බැවින්, දහන නිෂ්පාදනවල කාබන් ඩයොක්සයිඩ් සහ ජලය පවතිනු ඇත. වාතයේ නයිට්රජන් (3.76N 2) දහන ක්රියාවලියට සහභාගී නොවන අතර එය සම්පූර්ණයෙන්ම දහනය කිරීමේ නිෂ්පාදන බවට පරිවර්තනය වේ. මේ අනුව, මීතේන් දැවෙන ප්රතික්රියා සමීකරණයේ දකුණු පස පහත දැක්වෙන ස්වරූපය ඇත:
CO 2 + H 2 O + 3.76N 2.
වම් සහ දකුණු කොටස් ලියා ඇති පසු, සූත්රවලට පෙර සංගුණක සොයා ගැනීම අවශ්ය වේ. ප්රතික්රියාවට ඇතුළු වූ ද්රව්යවල මුළු ස්කන්ධය ප්රතික්රියාවේ ප්රති ing ලයක් ලෙස ඇති සියලුම ද්රව්යවල ස්කන්ධයට සමාන විය යුතු බව දන්නා කරුණකි.
ප්රතික්රියා සමීකරණය වනු ඇත
CH 4 + 2O 2 + 2 ´ 3.76N 2 = CO 2 + 2H 2 O + 2 ´ 3.76N 2.
ගණනය කිරීම සාමාන්යයෙන් දහනය කළ හැකි ද්රව්යයක 1 mol හෝ 1 m 3 මත සිදු කරන බැවින්, දහනය කළ හැකි ද්රව්යයක සංගුණකය ප්රතික්රියා සමීකරණයට ඇතුළත් නොවේ. එබැවින්, දහන ප්රතික්රියා වල සමහර සමීකරණ වලදී, භාගික සංගුණක ඔක්සිජන් හෝ වෙනත් ද්රව්යයක් ඉදිරිපිට දිස්විය හැකිය, නිදසුනක් ලෙස, වාතයේ ඇසිටිලීන් දහනය කිරීමේ ප්රතික්රියාව සඳහා සමීකරණයට ස්වරූපයක් ඇත
C 2 H 2 + 2.5O 2 + 2.5´3.76N 2 = 2CO 2 + H 2 O + 2.5´3.76N 2.
කාබන් සහ හයිඩ්රජන් වලට අමතරව දහනය කළ හැකි ද්රව්යයක සංයුතියට නයිට්රජන් ඇතුළත් වේ නම්, එය දහනය කිරීමේදී නිදහස් ආකාරයෙන් N 2 නිදහස් වේ, නිදසුනක් ලෙස, පිරිඩින් දහනය කිරීමේදී (C 2 H 5 N) .. දහනය කළ හැකි ද්රව්යයේ කොටසක් වන ක්ලෝරීන් ක්ලෝරයිඩ් ලෙස විමෝචනය වේ. හයිඩ්රජන් (HCl). දහනය කළ හැකි ද්රව්යයක කොටසක් වන සල්ෆර් SO 2 ආකාරයෙන් විමෝචනය වේ.
නීතියක් ලෙස ඔක්සිජන් බහුල ද්රව්ය දහනය කිරීමේදී අඩු වාතය අවශ්ය වේ. ඔක්සිජන් නිසා ද්රව්ය දහනය කිරීම ද සිදුවිය හැකි අතර එය පහසුවෙන් ලබා දිය හැකි වෙනත් ද්රව්යවල සංයුතිය තුළ පවතී. එවැනි ද්රව්ය වන්නේ නයිට්රික් අම්ලය HNO 3, බර්ටොලට් ලුණු KClO 3, නයිට්රේට් KNO 3, NaNO 3, NH 4 NO 3, පොටෑසියම් පර්මැන්ගනේට් KMnO 4, බේරියම් පෙරොක්සයිඩ් BaO 2 සහ වෙනත් ය. පිපිරීමක් සමඟ. එවැනි මිශණ සඳහා උදාහරණ වන්නේ කළු කුඩු, සං signal ා ආලෝකකරණ සංයුතිය සහ ඒ හා සමාන ය.
දහනය සිදුවීම සඳහා, යම් යම් කොන්දේසි අවශ්ය වේ: දහනය කළ හැකි ද්රව්යයක්, ඔක්සිකාරක කාරකයක් (ඔක්සිජන්) සහ ජ්වලන ප්රභවයක් තිබීම. දහනය කළ හැකි ද්රව්යය සහ ඔක්සිකාරකය තාප ප්රභවයෙන් (ජ්වලන ප්රභවය) යම් උෂ්ණත්වයකට රත් කළ යුතුය: ගිනි, ගිනි පුපුර, උණුසුම් ශරීරය හෝ ඕනෑම රසායනික ප්රතික්රියාවක් හෝ යාන්ත්රික කාර්යයක් මගින් ජනනය වන තාපය. ස්ථාවර තත්වයේ දහනය කිරීමේ ක්රියාවලියේදී, නිරන්තර ජ්වලන ප්රභවයක් වන්නේ දහන කලාපයයි, එනම්. ප්රතික්රියාව සිදුවන කලාපය, තාපය හා ආලෝකය මුදා හරිනු ලැබේ. දහන ක්රියාවලිය සිදුවීමට නම්, ද්රව්යය සහ ඔක්සිකාරක කාරකය යම් ප්රමාණාත්මක අනුපාතයකින් තිබිය යුතුය.
ද්රව්ය දහනය සම්පූර්ණ හා අසම්පූර්ණ විය හැකිය. සම්පූර්ණ දහනයකදී, තවදුරටත් දහනය කළ නොහැකි නිෂ්පාදන (CO 2, H 2 O, HCl) සෑදී ඇත; සම්පූර්ණයෙන් නොමැති නම්, එහි ප්රති products ලයක් ලෙස ඇති වන නිෂ්පාදන තවදුරටත් දැවිය හැකි ය (CO, H 2 S, HCN, NH 3, ඇල්ඩිහයිඩ් ආදිය) .
ගින්නක කාබනික ද්රව්ය වාතයේ දහනය කිරීමේදී බොහෝ විට සම්පූර්ණ දහනය සිදු නොවේ. අසම්පූර්ණ දහනයේ සං sign ාවක් නම්, නොකැඩූ කාබන් අංශු අඩංගු දුමාරය තිබීමයි. කෙසේ වෙතත්, දැවෙන ක්රියාවලිය කෙසේ වෙතත්, එය පදනම් වී ඇත්තේ දහනය කළ හැකි ද්රව්යයක් සහ ඔක්සිකාරක කාරකයක් අතර රසායනික අන්තර්ක්රියා මත ය.
ඔක්සිකරණය පිළිබඳ නූතන න්යාය - අඩු කිරීම පහත සඳහන් විධිවිධාන මත පදනම් වේ. ඔක්සිකරණයේ සාරය සමන්විත වන්නේ ඔක්සිකාරක ද්රව්යයෙන් (අඩු කිරීමේ කාරකය) ඔක්සිකාරකයට සංයුජතා ඉලෙක්ට්රෝන මුදා හැරීමෙනි, එය ඉලෙක්ට්රෝන පිළිගැනීමෙන් අඩු වේ. අඩු කිරීමේ සාරය සමන්විත වන්නේ අඩු කරන ද්රව්ය (ඔක්සිකාරක) මගින් අඩු කරන කාරක ඉලෙක්ට්රෝන ඇමිණීමෙනි, එය ඉලෙක්ට්රෝන අත්හැර ඔක්සිකරණය වේ. ඉලෙක්ට්රෝන හුවමාරුවේ ප්රති the ලයක් ලෙස පරමාණුවේ බාහිර (සංයුජතා) ඉලෙක්ට්රෝන මට්ටමේ ව්යුහය වෙනස් වේ. මෙම අවස්ථාවේ දී, එක් එක් පරමාණුව ලබා දී ඇති කොන්දේසි යටතේ වඩාත්ම ස්ථායී තත්වය බවට පත්වේ.
රසායනික ක්රියාවලීන්හිදී, එක් වර්ගයක පරමාණුවල ඉලෙක්ට්රෝන කවචයේ සිට තවත් වර්ගයක පරමාණු කවචයට ඉලෙක්ට්රෝන සම්පූර්ණයෙන්ම ගමන් කළ හැකිය. ඉතින්, ක්ලෝරීන් වල ලෝහමය සෝඩියම් දහනය කිරීමේදී සෝඩියම් පරමාණු එක් ඉලෙක්ට්රෝනයක් ක්ලෝරීන් පරමාණුවලට ලබා දෙයි. ඒ සමගම, ඉලෙක්ට්රෝන අටක් (ස්ථායී ව්යුහයක්) සෝඩියම් පරමාණුවක බාහිර ඉලෙක්ට්රෝන මට්ටමට හැරෙන අතර එක් ඉලෙක්ට්රෝනයක් අහිමි වූ පරමාණුවක් ධන ආරෝපිත අයන බවට හැරේ. එක් ඉලෙක්ට්රෝනයක් ලබාගත් ක්ලෝරීන් පරමාණුවේදී බාහිර මට්ටම ඉලෙක්ට්රෝන අටකින් පිරී ඇති නමුත් පරමාණුව charged ණ ආරෝපිත අයනයක් බවට හැරේ. කූලෝම් විද්යුත් ස්ථිතික බලවේගවල ප්රතිවිරුද්ධ ආරෝපිත අයන එකිනෙකට ළඟා වන අතර සෝඩියම් ක්ලෝරයිඩ් අණුවක් (අයනික බන්ධනය) සෑදී ඇත.
Na + Cl - Na + Cl -.
වෙනත් ක්රියාවලීන්හිදී, විවිධ පරමාණු දෙකක පිටත කවචවල ඉලෙක්ට්රෝන සාමාන්ය භාවිතයේ පවතින බව පෙනේ, එමඟින් පරමාණු සහ අණු (සහසංයුජ බන්ධනය) තද කරයි:
H + CL : එච් : .L :
අවසාන වශයෙන්, එක් පරමාණුවකට එහි ඉලෙක්ට්රෝන යුගලය පොදු භාවිතයට ලබා දිය හැකිය:
: O + : සා : ඔහ් : සා
නමුත් සෑම අවස්ථාවකදීම පරමාණු ස්ථාවර බාහිර ඉලෙක්ට්රොනික ව්යුහයන් ලබා ගැනීමට නැඹුරු වේ.
දහන ක්රියාවලිය ඉතා ක්රියාකාරී ක්රියාවලියක් වන අතර එය සැලකිය යුතු ශක්තියක් (තාපය හා ආලෝකය ස්වරූපයෙන්) මුදා හැරේ. මෙහි ප්රති sequently ලයක් වශයෙන්, අඩු ස්ථායී ද්රව්ය වලින් වඩා ස්ථායී ද්රව්ය ලබා ගන්නා ද්රව්යවල පරිවර්තනයක් සිදු වේ.
දහනය යනු වායුව, තාපය හා ආලෝකය මුදා හැරීමත් සමඟ දහනය කළ හැකි ද්රව්යයක් හා ඔක්සිජන් ඔක්සිකරණය හෝ සංයෝජනය කිරීමේ වේගවත් රසායනික ක්රියාවලියකි.
තාපය හා ආලෝකය ඇතිවීමත් සමඟ වාතයෙන් ඔක්සිජන් නොමැතිව දැවෙන හා දන්නා. මේ අනුව, දහනය යනු සංයෝගයේ රසායනික ප්රතික්රියාවක් පමණක් නොව දිරාපත් වීමකි.
ඇත්ත වශයෙන්ම දැවීම, පිපිරීම සහ පුපුරා යාම ඇත. සැබවින්ම දැවීමත් සමඟ, ගිනි පැතිරීමේ වේගය තත්පරයට මීටර දස දහස් නොඉක්මවන අතර පිපිරීමක් - තත්පරයට මීටර් සිය ගණනක් සහ පුපුරා යාමෙන් - තත්පරයට මීටර් දහස් ගණනක්.
දහනය වීමේ ඉහළම අනුපාතය පිරිසිදු ඔක්සිජන් සමඟ සිදු වේ. ඔක්සිජන් සාන්ද්රණය අඩු වන විට, දහන ක්රියාවලිය මන්දගාමී වේ, වාතයේ ඇති ඔක්සිජන් ප්රමාණය 14–15% වන විට දහනය වීමේ වේගය අඩු වේ.
දහනය සඳහා දහනය කළ හැකි ද්රව්ය, ඔක්සිකාරක කාරකයක් සහ ජ්වලන ප්රභවයක් අවශ්ය වේ.
ප්රායෝගිකව, සම්පූර්ණ හා අසම්පූර්ණ දහනය අතර වෙනස හඳුනා ගන්න. සම්පූර්ණ දහනය ප්රමාණවත් ඔක්සිජන් සමඟ ලබා ගත හැකි අතර අසම්පූර්ණයි - ඔක්සිජන් නොමැතිකම සමඟ. අසම්පූර්ණ දහනය, රීතියක් ලෙස, කෝස්ටික්, විෂ සහ පුපුරන සුළු මිශ්රණ සෑදී ඇත.
ප්රායෝගිකව දහනය කිරීමේ ක්රියාවලිය දහනය කළ හැකි ද්රව්යයක් ජ්වලනය කිරීමේ කොන්දේසි යටතේ සලකා බලනු ලැබේ. රසායනික ක්රියාවලීන්ගේ ප්රති result ලයක් ලෙස දහනය කළ හැකි ද්රව්යයක අභ්යන්තර උණුසුම සිදු වන විට ස්වයං ජ්වලනය (තාප පිපිරීම) සිදු වේ. ගිනි අවුලුවන ද්රව්යවල ගිනි උවදුර ප්රේරක කාල පරිච්ඡේදයක් හෝ ස්වයංක්රීයව ජ්වලන ප්රමාද කාලයකින් සංලක්ෂිත වේ. දහනය හා ජ්වලනය සඳහා වාතයේ වායූන් හා වාෂ්ප සාන්ද්රණය වැදගත් වේ. දහනය හා ජ්වලන පරාසය පහළ සහ ඉහළ පිපිරුම් සීමාවන් මගින් සංලක්ෂිත වේ. ගිනි අවුලුවන ද්රව්යවල පුපුරණ ද්රව්යයේ වැදගත්ම ලක්ෂණය ඒවාය.
ඇතැම් වායූන්, වාෂ්ප හා මිශ්රණ පුපුරා යාමේදී දහනය විශේෂ ස්වරූපයක් බවට පරිවර්තනය වේ - පුපුරා යාම.
ගිනි වැළැක්වීම සම්බන්ධයෙන් වැදගත් වන්නේ විදුලි ජාල සහ උපකරණ නිසි ලෙස ක්රියාත්මක කිරීමයි.
ගිනි හා පුපුරණ ද්රව්ය (POA) යනු පුපුරණ ද්රව්ය නිෂ්පාදනය කරන, ගබඩා කරන, ප්රවාහනය කරන සහ යම් යම් තත්වයන් යටතේ ජ්වලනය හෝ පිපිරීමට හැකියාව ඇති ව්යවසායන් ය.
ඒවායේ සියලුම ගොඩනැගිලි ද්රව්ය හා ව්යුහයන් කාණ්ඩ තුනකට බෙදා ඇත.
1) ගිනි ආරක්ෂණ - මේවා ගින්නෙන් හෝ තාපයේ බලපෑම යටතේ, දැල්වීම, දුම් නොබොන සහ වර්ග නොකරන ද්රව්ය වේ;
2) පිළිස්සීමට අපහසුය - මේවා ගින්නෙන් හෝ තාපයේ බලපෑම යටතේ, කිසිසේත් ජ්වලනය කිරීම, දුම් පානය කිරීම හෝ වර්ග කිරීම සහ ගින්නක් ඇති වුවහොත් දිගටම පිළිස්සීම;
3) දහනය කළ හැකි - මේවා ගින්නෙන් හෝ තාපයෙන්, ජ්වලනය හෝ දුම් පානය කිරීම සහ ගිනි ප්රභවය ඉවත් කිරීමෙන් පසුව දිගටම දැවී යාම හා දුම් පානය කරන ද්රව්ය වේ.
ව්යවසායයේ ගිනි ආරක්ෂාව සංවිධානය කිරීම සහ කළමනාකරණය කිරීමගිනි ආරක්ෂාව - වස්තුවෙහි තත්වය, ගින්න ඇතිවීමේ හැකියාව බැහැර කර ඇති අතර, එය සිදුවුවහොත්, ගින්නෙහි භයානක සාධක කෙරෙහි මිනිසුන්ට ඇති බලපෑම වළක්වා ඇති අතර ද්රව්යමය අගයන් ආරක්ෂා වේ. ගිනි ආරක්ෂණ සපයනු ලබන්නේ ගිනි වැළැක්වීමේ පද්ධතියක් සහ ගිනි ආරක්ෂණ පද්ධතියක් මගිනි. සෑම කාර්යාලයකම ගින්නක් ඇති වුවහොත් මිනිසුන් ඉවත් කිරීමේ සැලසුමක් තිබිය යුතුය.
ගිනි ආරක්ෂණ - එය ජනතාවගේ ආරක්ෂාව සහතික කිරීම, ගින්න වැළැක්වීම, පැතිරීම සීමා කිරීම සහ ගින්නක් සාර්ථකව නිවා දැමීම සඳහා කොන්දේසි නිර්මානය කිරීම අරමුණු කරගත් ආයතනික හා තාක්ෂණික පියවරයන්ගේ සංකීර්ණයකි.
කුඩා ගින්නක් ඇති කිරීම සඳහා නිර්මාණය කර ඇති ගිනි නිවන නියෝජිතයන් අතර ගිනි ද ds ු, අභ්යන්තර ගිනි ජල නල, ගිනි නිවන උපකරණ, වියළි වැලි, ඇස්බැස්ටෝස් බ්ලැන්කට් ආදිය ඇතුළත් වේ.
ගිනි ආරක්ෂණයේ වැදගත්ම කර්තව්ය වන්නේ ගින්නකදී අධික උෂ්ණත්වයකට නිරාවරණය වීමේ කොන්දේසි යටතේ පරිශ්රයන් හානිවලින් ආරක්ෂා කිරීම සහ ඒවායේ ප්රමාණවත් ශක්තිය සහතික කිරීමයි.
ගොඩනැගිලිවල, කොරිඩෝවල, පඩි පෙළවල් සහ පිවිසුම් ස්ථානවල ගිනි හයිඩ්රන්ට් සවි කර ඇත. පුස්තකාල, සහායක සහ සේවා පරිශ්රයන්හි ගින්න නිවා දැමීමට ජලය යොදා ගනී.
ආරම්භක අවධියේදී ගින්න නිවා දැමීමට ගිනි නිවන උපකරණ බහුලව භාවිතා වේ. භාවිතා කරන ගිනි නිවන කාරක වර්ගය අනුව, ගිනි නිවන උපකරණ පහත සඳහන් ප්රධාන කණ්ඩායම් වලට බෙදා ඇත.
වෝල්ටීයතාවයට යටත්ව ඇති විදුලි උපකරණ හැර දැවෙන ද්රව, විවිධ ද්රව්ය, ව්යුහාත්මක මූලද්රව්ය සහ උපකරණ නිවා දැමීමට ෆෝම් ගිනි නිවන උපකරණ භාවිතා කරයි. ගෑස් ගිනි නිවන උපකරණ ද්රව සහ substances න ද්රව්ය නිවා දැමීමට මෙන්ම සජීවී විදුලි ස්ථාපනයන් සඳහා යොදා ගනී.
කාබන් ඩයොක්සයිඩ් ගිනි නිවන උපකරණ ද භාවිතා කරන අතර, එහි වාසිය වන්නේ ගිනි නිවීමේ ඉහළ කාර්යක්ෂමතාව, ඉලෙක්ට්රොනික උපකරණවල ආරක්ෂාවයි.
හැඳින්වීම
සියලුම හදිසි අවස්ථා වලින් 90% කට වඩා වැඩි ප්රමාණයක් ගින්නකි. ගිනි යනු වඩාත් පොදු හදිසි අවස්ථා වේ. ගින්නෙන් හා ඒ සමඟ සිදුවන සංසිද්ධිවල හානිකර බලපෑම් පිළිබඳ ක්රියාවලිය (පිපිරීම්, ව්යුහයන් කඩා වැටීම, තාක්ෂණික ස්ථාපනයන් අසමත් වීම, නල මාර්ග කැඩීම, ටැංකි විනාශ කිරීම යනාදිය) බහුපාර්ශ්වික වේ. වායුගෝලයේ විකිරණ හා රසායනික දූෂණය, පස, ශාක හා සත්වයන්ගේ මරණය, වාතයේ ඔක්සිජන් පරිභෝජනය, දහන නිෂ්පාදන සෑදීම ඇතුළු විය හැකිය. සහ විෂ සහිත වන අතර ඒවා වායුගෝලයට ඇතුළු වීම, ගිනි මැඩපැවැත්වීම සඳහා ජලය භාවිතා කිරීම, ජල වාෂ්ප පැතිරීම සහ අපජලය මගින් විෂ සහිත නිෂ්පාදන පුළුල් ප්රදේශයක් පුරා විසුරුවා හරින ලදි. එවැනි දූෂණයක පරිමාව සමහර විට රටින් පිටතට යයි (නිදසුනක් ලෙස, චර්නොබිල් න්යෂ්ටික බලාගාරයේ අනතුර).
ලී කිලෝග්රෑම් 1 ක් දහනය කරන විට, සාමාන්යයෙන් වාතය 4.2 m3 පමණ පරිභෝජනය කරයි, දහන නිෂ්පාදන පරිමාව 4.9 m3 පමණ වන අතර තෙල් සඳහා මෙම සංඛ්යා පිළිවෙලින් 11.8 සහ 11.9 m3 වේ.
ගින්නක් ඇතිවීමේ ප්රධාන හා ප්රධාන ක්රියාවලිය දහනය වන අතර, භෞතික දෘෂ්ටි කෝණයකින් ගින්න නිවා දැමීම සෑම විටම එහි සියලු ආකාර හා ආකාරවල දැවීම නැවැත්වීමට පැමිණේ.
දහනය යනු පුද්ගලයෙකුගේ වර්ධනයේ ආරම්භයේ දී හමු වූ පළමු සංකීර්ණ භෞතික රසායනික ක්රියාවලියකි. එම ක්රියාවලිය අත්පත් කර ගනිමින් ඔහු අවට ජීවීන් හා සොබාදහමේ බලවේග කෙරෙහි ඉමහත් ආධිපත්යයක් ලබා ගත්තේය.
දහනය යනු නිෂ්පාදනයේ බොහෝ තාක්ෂණික ක්රියාවලීන්ගේ පදනම වන ශක්තිය ලබා ගැනීමේ හා පරිවර්තනය කිරීමේ එක් ආකාරයකි (ප්රධාන). එමනිසා, පුද්ගලයෙකු දහනය කිරීමේ ක්රියාවලීන් නිරන්තරයෙන් අධ්යයනය කරමින් ඉගෙන ගනී.
දහන විද්යාවේ ඉතිහාසය ආරම්භ වන්නේ එම්.වී. ලොමොනොසොව්: "පිළිස්සීම යනු වාතය සමඟ ඇති ද්රව්යයන්ගේ එකතුවකි." මෙම සොයා ගැනීම භෞතික හා රසායනික පරිවර්තනයන් අතරතුර ද්රව්ය ස්කන්ධය සංරක්ෂණය කිරීමේ නීතිය සොයා ගැනීමට පදනම විය. ලැවොසියර් දහන ක්රියාවලියේ අර්ථ දැක්වීම පැහැදිලි කළේය: "දහනය යනු වාතය සමඟ නොව වායු ඔක්සිජන් සමඟ සංයෝග වේ."
අනාගතයේදී සෝවියට් හා රුසියානු විද්යා scientists යින් වන A.V. දහන විද්යාව අධ්යයනය කිරීම හා සංවර්ධනය කිරීම සඳහා සැලකිය යුතු දායකත්වයක් ලබා දුන්නේය. මයිකල්සන්, එන්.එන්. සෙමෙනොව්, අයි.වී. සෙල්ඩොවිච්, යූ.බී. කරිටන්, අයි.වී. බ්ලිනොව් සහ තවත් අය.
දහනය කිරීමේ ක්රියාවලීන් පදනම් වී ඇත්තේ රසායනික චාලක විද්යාව, රසායනික තාප ගති විද්යාව සහ සොබාදහමේ අනෙකුත් මූලික නීති (ස්කන්ධය, ශක්තිය ආදිය සංරක්ෂණය කිරීමේ නියමය) යන නීතිවලට අවනත වන බාහිර තාප රෙඩොක්ස් ප්රතික්රියා මත ය.
රසායන විද්යා පා course මාලාවෙන් ඔක්සිකරණ-අඩුකිරීමේ ප්රතික්රියා දහන ක්රියාවලියට යටත් වන අතර, ඉලෙක්ට්රෝන කාරක අඩු කිරීමේ සිට ඔක්සිකාරක කාරක වෙත මාරු කරනු ලබන අතර ඊට අනුරූප පරමාණුවල ඔක්සිකරණයේ අංශක වෙනස් වීමක් සිදු වේ.
ඉලෙක්ට්රෝන හුවමාරුවේ ප්රති the ලයක් ලෙස පරමාණුවල බාහිර (සංයුජතා) ඉලෙක්ට්රෝන මට්ටමේ ව්යුහය වෙනස් වේ. මෙම අවස්ථාවේ දී, එක් එක් පරමාණුව ලබා දී ඇති කොන්දේසි යටතේ වඩාත්ම ස්ථායී තත්වය බවට පත්වේ.
රසායනික ක්රියාවලීන්හිදී, එක් වර්ගයක පරමාණුවල ඉලෙක්ට්රෝන කවචයේ සිට තවත් වර්ගයක පරමාණු කවචයට ඉලෙක්ට්රෝන සම්පූර්ණයෙන්ම ගමන් කළ හැකිය.
දහනය යනු රසායනික ඔක්සිකරණ ප්රතික්රියාවක් වන අතර විශාල තාප ප්රමාණයක් මුදා හැරීම හා සාමාන්යයෙන් දීප්තිය වැඩි වේ.
දහන ක්රියාවලියට එහි සාරය පිළිබිඹු කරමින් වඩාත් නිවැරදි අර්ථ දැක්වීමක් ලබා දිය හැකිය: “දහනය යනු සංකීර්ණ භෞතික-රසායනික ක්රියාවලියක් වන අතර, අධික උෂ්ණත්වවල බලපෑම යටතේ දහනය කළ හැකි ද්රව්ය හා ද්රව්ය ඔක්සිකාරක කාරකයක් (වාතයේ ඔක්සිජන්) සමඟ රසායනික අන්තර්ක්රියා වලට ඇතුළු වන අතර දහනය කිරීමේ නිෂ්පාදන බවට හැරේ. දැඩි තාපය හා ආලෝක විකිරණ සමඟ.
දහන ක්රියාවලිය සිදුවීමට අවශ්ය කොන්දේසි (රූපය): දහනය කළ හැකි ද්රව්යයක් (ජීවී) තිබීම; ඔක්සිකාරක කාරකයක් (O.) තිබීම - වායු ඔක්සිජන්; ජ්වලන ප්රභවයක් තිබීම (I.Z.).
රූපය. සිහිවටන: සම්භාව්ය ගිනි ත්රිකෝණය
මෙම කොන්දේසි තුන මූලික වේ, ඒවා අන්තර් සම්බන්ධිත හා එකිනෙකට පරායත්ත වේ.
නමුත් ඒවා පිළිස්සීමේ ක්රියාවලිය සඳහා ප්රමාණවත් නොවේ. ඊට අමතරව, පහත සඳහන් කොන්දේසි සපුරාලිය යුතුය:
අ) දහනය කළ හැකි ද්රව්යය ඔක්සිකරණ ක්රියාවලිය ආරම්භ වන නිශ්චිත උෂ්ණත්වයකට රත් කළ යුතුය;
ආ) දහනය කළ හැකි ද්රව්යයක් යම් උෂ්ණත්වයකට රත් කිරීමට, ජ්වලන ප්රභවයේ යම් බලයක් අවශ්ය වේ;
ඇ) දහන ක්රියාවලිය පවත්වා ගැනීම සඳහා ඇතැම් ඉන්ධන හා ඔක්සිකාරක සාන්ද්රණයන් අවශ්ය වේ.
දහනය යනු අන්තර් සම්බන්ධිත රසායනික හා භෞතික ක්රියාවලීන්ගේ සංකීර්ණයකි. වැදගත්ම දහන ක්රියාවලීන් වන්නේ තාපය හා ස්කන්ධ හුවමාරුවයි. දහනය කිරීමේ වඩාත් පොදු ගුණාංගය වන්නේ ගින්නක් ඇතිවීම සහ දහනය කළ හැකි මිශ්රණය පුරා තාපය මාරු කිරීමෙන් හෝ ක්රියාකාරී අංශු දහන කලාපයේ සිට නැවුම් දහනය කළ හැකි මිශ්රණයකට විසුරුවා හැරීමයි.
ගිනිදැල් යනු දැවෙන දෘශ්යමාන ප්රකාශනයකි. එය දැවෙන කලාපය ලෙසද හැඳින්වේ. දහනය කළ හැකි මිශ්රණය සම්පූර්ණ හා අසම්පූර්ණ දහනය කිරීමේ නිෂ්පාදන බවට පරිවර්තනය වන අවකාශයේ කොටස මෙයයි.
ගිනි තත්වයන් යටතේ, දහනය කිරීමේ ක්රියාවලියේ ප්රධාන පරාමිතීන් වන්නේ මරණයට හේතු වන අතර ද්රව්යමය හානියක් වේ. දහන කලාපයේ ජනනය වන තාපය විශාල ප්රමාණයක්, දැඩි තාප උත්පාදනය හේතුවෙන් ඇති වන අධික උෂ්ණත්වය සහ දහන නිෂ්පාදනවල විෂ සංයුතිය බොහෝ දුරට වර්ගය මත රඳා පවතී ( ස්වභාවය) දහනය වන ද්රව්යයේ සහ දහන ක්රියාවලියට සම්බන්ධ වාතය ප්රමාණය. ගින්නක් ඇති විට, දහනය සෑම විටම සිදුවන්නේ දහන කලාපයේ වාතය නොමැති විටය, එය අසම්පූර්ණ දහන නිෂ්පාදන (විෂ සහිත කාබන් මොනොක්සයිඩ් CO, carbon න කාබන් සී අංශු (සබන් ස්වරූපයෙන්) සෑදීමට දායක වේ, ගින්න මත දුමාරය කළු සහ පාරාන්ධව ඇති කරයි, සහ දහනය කළ හැකි ද්රව්යවල පිරොලයිසිස් වල වෙනත් නිෂ්පාදන)
GOST ට අනුව ගින්නඑය විශේෂ උදුනකින් පිටත පාලනයකින් තොරව දහනය කිරීමෙන් ද්රව්යමය හානි සිදු වේ. දහනය යනු දැඩි තාපය හා ආලෝක විකිරණ සමඟ දහනය කළ හැකි ද්රව්ය හා ද්රව්ය දහනය කිරීමේ නිෂ්පාදන බවට පරිවර්තනය කිරීමේ සංකීර්ණ භෞතික රසායනික ක්රියාවලියකි.
බොහෝ අවස්ථාවන්හීදී වායුගෝලීය ඔක්සිජන්, මූලික වශයෙන් කාබන්, CO2 (කාබන් ඩයොක්සයිඩ්) සහ හයිඩ්රජන් H2O (ජල වාෂ්ප) සෑදීමට දහනය කළ හැකි ද්රව්ය ඔක්සිකරණය කිරීමේ වේගවත් රසායනික ප්රතික්රියා මත පදනම් වේ. නිදහස් වාතය ගින්නක් ඇති වුවහොත්, එහි සංයුතිය සාම්ප්රදායිකව නියත ලෙස සැලකිය හැකිය: 21% ඔක්සිජන් සහ 79% නයිට්රජන් (පරිමාව අනුව) හෝ 23% සහ 77% (බර අනුව).
සියලුම ගින්නෙන් සංලක්ෂිත වන්නේ:
තාපය හා දහන නිෂ්පාදන මුදා හැරීම සමඟ දහනය කිරීම;
සංවහන වායු ප්රවාහ යාන්ත්රණය මඟින් සිදු කරනු ලබන ගෑස් හුවමාරුව, දහන කලාපයට ඔක්සිජන් ගලා ඒම සහ දහන නිෂ්පාදන ඉවත් කිරීම;
දහන කලාපයේ සිට දහනය කළ හැකි ද්රව්ය ද ඇතුළුව අවට ප්රදේශයට තාප හුවමාරුවකින් තොරව අඛණ්ඩ දහන ක්රියාවලියක් කළ නොහැකිය.
ගින්නෙන් දැවෙන වර්ග.
ජ්වලන වායූන්ගේ තාප ප්රභවයේ බලපෑම යටතේ ද්රව, ids න සහ දූවිලි වෙනස් ලෙස හැසිරේ. ගිනිගැනීම් වලදී, දහනය කිරීමේ ප්රධාන වර්ග දෙකක් තිබේ: සමජාතීය හා විෂමජාතීය.
සමජාතීය දහනය සමඟ ඔක්සිකාරකය සහ ඉන්ධන වායු අවධියේ පවතී. දහනය කළ හැකි වායුව දහනය කිරීමේදී සමජාතීය දහනය සිදු වනවාට අමතරව, දහනය කළ හැකි සියලුම ද්රව ජ්වලනයට පෙර වාෂ්ප වී වායුමය මාධ්යයක් සාදයි. ගින්නක් තුළ රත් වීමේ ක්රියාවලියේ බොහෝ ids න ද්රව්ය දිය වී, දිරාපත් වී වාෂ්ප වී වායුමය භාග නිකුත් කරයි. මෙම ඕනෑම පරිවර්තනයකින් ලබාගත් වායුමය මාධ්යය වාතය හා පිළිස්සුම් සමඟ මිශ්ර වේ.
විෂමජාතීය දහනය කිරීමේදී ඉන්ධන solid න තත්වයේ පවතින අතර ඔක්සිකාරකය වායුමය තත්වයේ පවතින අතර ඉන්ධනවල ඔක්සිකරණ ප්රතික්රියාව phase න අවධියේදී සිදු වේ. Solid න ද්රව්ය දූවිලි බවට පත් වේ (ගල් අඟුරු, ලෝහ, රෙදිපිළි), වාතය සමඟ මිශ්ර වූ විට ගිනි හා පිපිරුම්-අන්තරායකර දූවිලි-වායු මිශ්රණ සාදයි.
ගින්න මත දහනය කිරීමේදී, ඔක්සිකාරක කාරකයේ කාර්යභාරය බොහෝ විට සිදු කරනු ලබන්නේ රසායනික ප්රතික්රියා කලාපය අවට වාතයේ ඇති ඔක්සිජන් මගිනි, දහනයේ තීව්රතාවය තීරණය වන්නේ මෙම ප්රතික්රියා වල වේගය අනුව නොව පරිසරයේ සිට දහන කලාපයට ඔක්සිජන් අනුපාතය අනුව ය.
ගිනි කලාප.
ගින්නක් හටගන්නා අවකාශයේ කලාප තුනක් සාම්ප්රදායිකව සලකනු ලැබේ: දහනය, තාප නිරාවරණය සහ දුම.
දැවෙන කලාපය යනු දහනය සඳහා දහනය කළ හැකි ද්රව්ය සැකසීම (උණුසුම, වාෂ්පීකරණය, වියෝජනය) සහ ඒවා දහනය කිරීම සඳහා වන අවකාශයේ කොටසකි.
තාප නිරාවරණ කලාපය යනු දහන කලාපයට යාබදව ඇති අවකාශයේ කොටසකි. මෙහිදී තාප නිරාවරණය මගින් ද්රව්ය හා ව්යුහයන්ගේ සැලකිය යුතු වෙනසක් සිදු වන අතර විශේෂ ආරක්ෂාවක් නොමැතිව මිනිසුන්ට එහි රැඳී සිටීමට නොහැකි වේ. මෙම කලාපයේ පිටත මායිම 60-70 of C උෂ්ණත්වයකට අනුරූප වේ.
දුම් කලාපය යනු දුම මිනිසුන්ගේ ජීවිතයට හා සෞඛ්යයට තර්ජනයක් වන අවකාශයේ කොටසකි (සංඛ්යාලේඛන පෙන්වා දෙන්නේ ගින්නකින් මියගිය බොහෝ දෙනා හුස්ම හිරවීමෙන් මිය යන බවයි).
ඒවායේ පරාමිතීන් දහනය කිරීම හා සංලක්ෂිත කිරීම සඳහා සහභාගී වන ද්රව්ය.
සමුච්චය කිරීමේ තත්වයට අනුව, දහනයට සම්බන්ධ ද්රව්ය වායුමය, ද්රව සහ .න ලෙස බෙදී යයි.
වායූන් අතර 50 ° C උෂ්ණත්වයක නිරපේක්ෂ වාෂ්ප පීඩනය 300 kPa ට සමාන හෝ වැඩි හෝ විවේචනාත්මක උෂ්ණත්වය 50 than C ට අඩු ද්රව්ය අඩංගු වේ.
ද්රව සඳහා - ද්රවාංකය (පහත වැටීම) 50 than C ට අඩු ද්රව්ය.
Sol න ද්රව්ය සඳහා - 50 ° C සහ ඊට වැඩි ද්රවාංකයක් (පහත වැටීම) සහිත ද්රව්ය. Ids න ද්රව්ය වලදී දූවිලි යනු විශේෂ කණ්ඩායමකි, එනම්. මයික්රෝන 850 ට අඩු අංශු ප්රමාණයක් සහිත විසිරුණු ද්රව්ය.
හැකි සෑම විටම ද්රව්යයක් ජ්වලනය දහනය කළ නොහැකි, මන්දගාමී දහනය සහ දහනය කළ හැකි ලෙස බෙදා ඇත. දහනය කළ නොහැකි (ගිනි ආරක්ෂණ) යනු වාතයේ දැවිය නොහැකි ද්රව්ය හා ද්රව්ය වේ. මන්දගාමීව දැවීම (මන්දගාමීව දැවීම) යනු ජ්වලන ප්රභවයෙන් වාතයේ දැල්විය හැකි ද්රව්ය හා ද්රව්ය වන නමුත් එය ඉවත් කිරීමෙන් පසු ඒවා තනිවම දහනය කිරීමට හැකියාවක් නැත. දහනය කළ හැකි (දහනය කළ හැකි) යනු ස්වයංසිද්ධව ජ්වලනය කළ හැකි ද්රව්ය හා ද්රව්ය වන අතර ජ්වලන ප්රභවයෙන් ඇවිළී එය ඉවත් කිරීමෙන් පසු ගිනිබත් වේ.
ගිනි අවුලුවන ද්රව්ය හා ද්රව්ය දහනය කළ හැකි ද්රව්ය කාණ්ඩයෙන් වෙන් කරනු ලැබේ, එනම්. කෙටි කාලීන (තත්පර 30 දක්වා) අඩු ශක්ති ජ්වලන ප්රභවයකට නිරාවරණය වීමෙන් (ගිනි දැල්ල, ගිනි පුපුර, සිගරට් ආදිය). දැවෙන ද්රව යනු සංවෘත කබොලක අංශක 61 ට නොඉක්මවන හෝ විවෘත කබොලක අංශක 66 ට නොඉක්මවන ෆ්ලෑෂ්පොයින්ට් ඇති අයයි.
පිටාර ගැලීම යනු සම්පීඩිත වායූන් සෑදීම සමඟ නොගැලපෙන සහ ස්ථිතික දහනය නොවන දහනය කළ හැකි මිශ්රණයක වේගවත් දහනයකි.
ෆ්ලෑෂ් පොයින්ට් යනු දහනය කළ හැකි ද්රව්යයක අවම උෂ්ණත්වය වන අතර, විශේෂ පරීක්ෂණ තත්වයන් යටතේ, එහි මතුපිටට ඉහළින් වාෂ්ප හෝ වායූන් සෑදී ඇති අතර, ජ්වලන ප්රභවයෙන් දැල්වීමට හැකියාව ඇත, නමුත් ඒවායේ දහනය කිරීමේ අනුපාතය තවමත් ස්ථායී දහනය ජනනය කිරීමට ප්රමාණවත් නොවේ.
ජ්වලන උෂ්ණත්වය විශේෂ පරීක්ෂණ තත්වයන් යටතේ වාෂ්ප හා වායූන් මුදා හරිනු ලබන ද්රව්යයක අවම උෂ්ණත්වය ලෙස හැඳින්වේ. ඒවායේ ජ්වලනයෙන් පසු ස්ථිර ගිනි දහනයක් සිදු වේ.
ස්වයංක්රීය ජ්වලන උෂ්ණත්වය යනු ද්රව්යයක අවම උෂ්ණත්වය වන අතර විශේෂ පරීක්ෂණ තත්වයන් යටතේ බාහිර තාප ප්රතික්රියා වල තියුණු වැඩිවීමක් සිදුවන අතර එහි ප්රති fire ලයක් ලෙස දැවෙන දැවීමක් සිදුවේ. මෙම උෂ්ණත්වය භෞතික රසායනික නියතයක් නොවීම සැලකිය යුතු ලෙස රඳා පවතින්නේ ද්රව්යයේ හැඩය සහ පරිමාව මෙන්ම තවත් සාධක ගණනාවක් මත ය. එබැවින් ස්වයං ජ්වලන උෂ්ණත්වය තීරණය කිරීම සඳහා විශේෂ ස්ථාපනයක් භාවිතා කරයි.
ගිනි පරාමිතීන්.
ගින්නක ප්රධාන පරාමිතීන් අතර: ගිනි බර, විශාල පිළිස්සුම් අනුපාතය, ගිනි පැතිරීමේ වේගය, ගිනි උෂ්ණත්වය, තාප මුදා හැරීමේ වේගය යනාදිය
ගිනි භාරය අනුරූපී ප්රදේශයක ඒකකයකට දහනය කළ හැකි ද්රව්යවල ශක්ති විභවය (බිම් හෝ බිම් කැබැල්ල) මගින් සංලක්ෂිත වේ. ගිනි බර මනිනු ලබන්නේ ඒකක ඒකකයකට බලශක්ති ඒකක හෝ දහනය කළ හැකි ද්රව්ය ප්රමාණයෙන් (දැව අනුව), උදාහරණයක් ලෙස, J / m.sq (දහනය කිරීමේදී මුදා හරින ශක්තිය අනුව) හෝ kg / m.sq (දැව සම්බන්ධයෙන් - පදනම් කරගෙන) දැව කිලෝග්රෑම් දහයක් දහනය කිරීමෙන් ශක්තිය 18.8 MJ නිපදවයි).
කාමරයේ ගිනි භාරය නියත (ව්යුහයේ සියලුම දහනය කළ හැකි ව්යුහයන්) සහ තාවකාලික (කාමරයේ ඇති ද්රව්ය) වලින් සමන්විත වේ. ගොඩනැගිලිවල, එක් එක් මහලේ ගිනි භාරය වෙන වෙනම තීරණය කරනු ලබන අතර එය අදාළ ප්රමිතීන්ට සීමා වේ.
විශාල පිළිස්සුම් අනුපාතය - කාල ඒකකයකට දැවෙන ද්රව්ය ස්කන්ධය නැතිවීම. එය ද්රව්ය පරිමාවට දහනය කිරීමේ පෘෂ් area වර්ග area ලය, ඇසුරුම් dens නත්වය, වායු හුවමාරු තත්වයන් සහ වෙනත් හේතු මත රඳා පවතී. (නිදසුනක් ලෙස, ගෘහ භාණ්ඩ පිළිස්සීමේ අනුපාතය 50 kg / m.kv.ch, ල logs ු-සටහන් සහ විශාල ලී මූලද්රව්ය 25 kg / m.kv.ch; තොගවල ලී 400 kg / m.kv.ch). පිළිස්සීමේ වේගය වැඩි වන තරමට ගින්නක් තුළ උෂ්ණත්වය වැඩිවේ.
ගින්නක් පැතිරීමේ වේගය තීරණය වන්නේ දහනය කළ හැකි ද්රව්ය මතුපිටට ඉහළින් දැල්ල ප්රචාරණය කිරීමේ වේගයෙනි. එය බොහෝ සාධක මත රඳා පවතී (ද්රව්ය වර්ගය, ජ්වලනය කිරීමේ හැකියාව, ආරම්භක උෂ්ණත්වය, වායු ප්රවාහයේ දිශාව, ඇඹරුම් ද්රව්යයේ උපාධිය ආදිය). ඊට අමතරව, එය කාලයාගේ ඇවෑමෙන් අනිත්ය වේ. ප්රායෝගිකව, ගණනය කිරීම් සිදු කරන විට, මෙම පරාමිතියේ සාමාන්ය අගයන් භාවිතා වේ:
දැවෙන දැවෙන ද්රව දහනය කරන විට 30 m / min,
ලී කුට්ටි මත 4 m / min
ලී ආවරණ මත 1 m / min,
ලී ව්යුහයන් සඳහා 2 m / min දක්වා අවලංගු වේ.
මෙම පෘෂ් of ය තිරස් අතට නැඹුරු වීමේ කෝණය මත පදනම්ව, ද්රව්ය මතුපිට පුරා ගිනි පැතිරීමේ වේගය පුළුල් ලෙස වෙනස් වේ. නැඹුරුවීමේ කෝණය අංශක 90 ක් වූ විට, ගිනිදැල් ප්රචාරණය කිරීමේ වේගය දක්වා ඇති අගයන්ට වඩා 2 ගුණයකින් අඩු වන අතර ඉහළට - 8-10 ගුණයක් වැඩිය.
උෂ්ණත්වය වැඩි වන විට, වේගය වැඩි වන අතර, ද්රව්යවල ස්වයංක්රීයව ජ්වලන උෂ්ණත්වය ළඟා වූ විට, ඒවායේ මතුපිට ක්ෂණිකව පාහේ ගින්නෙන් ආවරණය වේ.
වායුගෝලීය පීඩනය සහ කාමර උෂ්ණත්වයේ විවිධ වායූන්හි ගිනි පැතිරීමේ ප්රවේගයේ අගයන් පහත දැක්වේ.
හයිඩ්රොකාබන්-වායු මිශ්රණ 0.3-0.5 m / s, 18-30 m / min
හයිඩ්රජන්-වායු මිශ්රණය 2.8 m / s, 168 m / min
හයිඩ්රජන්-ඔක්සිජන් මිශ්රණය 13.8 m / s, 828 m / min
ඇට්සිටෙලෙනෝ-ඔක්සිජන් මිශ්රණය 15.4 m / s, 924 m / min
දහනය යනු භෞතික රසායනික ක්රියාවලියක් වන අතර එය පහත ලක්ෂණ වලින් සංලක්ෂිත වේ: රසායනික පරිණාමනය, තාපය හා ආලෝකය මුදා හැරීම. තිරසාර දහනය සිදුවීම සඳහා සාධක තුනක් අවශ්ය වේ: දහනය කළ හැකි ද්රව්යයක් (ද්රව්ය, මිශ්රණය), ඔක්සිකාරකයක් සහ ජ්වලන ප්රභවයක්.
දහනයෙහි රසායනික ප්රතික්රියාව සැලකිය යුතු තාප ප්රමාණයක් මුදා හැරීමත් සමඟ සෑම විටම පාහේ විවිධ ආකාරයේ භෞතික සංසිද්ධි සමඟ සම්බන්ධ වේ. මේ අනුව, පිළිස්සීමේ ක්රියාවලියේදී, ප්රතික්රියා කරන ද්රව්ය හා දහන නිෂ්පාදන එක් ස්ථානයක සිට තවත් ස්ථානයකට තාප හුවමාරුව සිදු වේ. දහන ප්රතික්රියා කලාපයේ සිදුවන සියලුම ක්රියාදාමයන් එකිනෙකට සම්බන්ධ වේ - රසායනික ප්රතික්රියා වල වේගය තීරණය වන්නේ තාප හුවමාරුවේ මට්ටම සහ ද්රව්යයේ විසරණය වීමේ අනුපාතය අනුව වන අතර අනෙක් අතට භෞතික පරාමිතීන් (උෂ්ණත්වය, පීඩනය, ද්රව්යයේ හුවමාරු අනුපාතය) රසායනික ප්රතික්රියා වේගය මත රඳා පවතී.
දහනය කළ හැකි ද්රව්යය. නිෂ්පාදනයේ සංසරණය වන සියලුම ද්රව්ය හා ද්රව්ය අමුද්රව්ය, අර්ධ නිමි භාණ්ඩ, ව්යුහාත්මක මූලද්රව්ය ගොඩනැගීම යන කාණ්ඩ තුනකට බෙදා ඇත: දහනය කළ නොහැකි, මන්දගාමී දහනය සහ දහනය කළ හැකි.
දහනය කළ නොහැකි ඒවා සාමාන්ය සංයුතියේ වාතයේ දැවිය නොහැකි ද්රව්ය හා ද්රව්ය ලෙස හැඳින්වේ. දහනය කළ නොහැකි ද්රව්ය හා ද්රව්ය සැලකිය යුතු කණ්ඩායමක් වේ. මේවාට ස්වාභාවික හා කෘතිම අකාබනික ද්රව්ය හා ඉදිකිරීම් ලෝහවල භාවිතා වන ද්රව්ය මෙන්ම 8% දක්වා කාබනික ද්රව්ය අන්තර්ගත ජිප්සම් හෝ ජිප්සම්-ෆයිබර් පුවරු, කෘතිම, පිෂ් ch ය හෝ බිටුමන් බන්ධනයක ඛනිජමය ලොම් තහඩු එහි අන්තර්ගතය බරින් 6%.
ජ්වලන ප්රභවයක ක්රියාකාරිත්වය යටතේ ජ්වලනය කළ හැකි නමුත් එය ඉවත් කිරීමෙන් පසු ස්වයං-දහනය කිරීමට හැකියාවක් නොමැති ද්රව්ය (ද්රව්ය) මන්දගාමී දහනය ලෙස හැඳින්වේ. මේවාට දහනය කළ නොහැකි හා දහනය කළ හැකි සංරචක වලින් සමන්විත ද්රව්ය හා ද්රව්ය ඇතුළත් වේ, උදාහරණයක් ලෙස: කාබනික සමස්ථ බරින් 8% ට වඩා අඩංගු ඇස්ෆල්ට් කොන්ක්රීට්, ජිප්සම් සහ කොන්ක්රීට් ද්රව්ය; 7 සිට 15% දක්වා එහි අන්තර්ගතය සහිත බිටුමන් මිටියක් මත ඛනිජ-ලොම් ස්ලැබ්; අවම වශයෙන් 900 kg / m 3 ක බරකින් යුත් මැටි-ලුණු ද්රව්ය; මැටි ද්රාවණයකින් කාවැදී ඇති බවක් දැනුණි; දැව, දැවෙන රිටර්ඩන්ට් වලින් ගැඹුරින් කාවද්දන ලද; සිමෙන්ති තන්තු මැට්; සමහර වර්ගයේ ඉංජිනේරු ප්ලාස්ටික් ආදිය.
දහනය කළ හැකි දේ සාමාන්ය සංයුතියේ වාතය තුළ ස්වයංව දහනය කළ හැකි ද්රව්ය (ද්රව්ය, මිශ්රණ) ලෙස හැඳින්වේ. දහනය කළ නොහැකි හා මන්දගාමී දහනය වන ද්රව්ය හා ද්රව්ය සඳහා වන අවශ්යතා සපුරාලන්නේ නැති සියලුම ද්රව්ය හා ද්රව්ය මේවාට ඇතුළත් වේ, උදාහරණයක් ලෙස: ගුවන් ඉන්ධන, ඇල්කොහොල්, කාබනික හා අකාබනික තෙල්, ප්ලාස්ටික්, රෙදිපිළි, මැග්නීසියම්, සෝඩියම්, සල්ෆර් සහ වෙනත් ද්රව්ය හා රසායනික ද්රව්ය.
අනෙක් අතට, සියළුම දහනය කළ හැකි ද්රව්ය හා ද්රව්ය උප කාණ්ඩ තුනකට බෙදා ඇත: දැවිය හැකි, මධ්යම ගිනි තැබිය හැකි, ගිනි-ප්රතිරෝධී.
ගිනි අවුලුවන ද්රව්ය කෙටි කාලීනව නිරාවරණය වීමෙන් තරඟයක දැල්ලක්, ගිනි පුපුරක්, රත් වූ විදුලි කම්බියක් සහ අඩු ශක්තියක් සහිත ජ්වලන ප්රභවයන් දැල්විය හැකි ද්රව්ය (ද්රව්ය, මිශ්රණ) ලෙස හැඳින්වේ.
අඩු ශක්ති ජ්වලන ප්රභවයකට දීර් exp කාලයක් නිරාවරණය වීමෙන් දැවිය හැකි ද්රව්ය (ද්රව්ය, මිශ්රණ) සාමාන්ය ජ්වලන හැකියාව ඇත.
ගිනි අවුලුවන ද්රව්ය හැඳින්වෙන්නේ ද්රව්ය (ද්රව්ය, මිශ්රණ) ලෙසිනි. එය ජ්වලන ප්රබල ප්රභවයක බලපෑම යටතේ පමණක් ජ්වලනය කළ හැකි අතර එමඟින් ද්රව්යයේ සැලකිය යුතු කොටසක් ජ්වලන උෂ්ණත්වයට රත් කරයි.
ගිනි අවුලුවන ද්රව්ය හා ද්රව්යවල උප සමූහයට මූලික වශයෙන් වායූන් සහ දැවෙන ද්රව ඇතුළත් වේ.
නිෂ්පාදනයේ සංසරණය වන සියලුම ද්රව වලින් ගිනි අවුලුවන ද්රව (HLI) සංවෘත කබොල්ලක + 61 ° C නොඉක්මවන ෆ්ලෑෂ්පොයින්ට් සහිත දැවෙන ද්රව ඇතුළත් වේ. ඒවා කොටස් තුනකට බෙදා ඇත:
මම - -18 ° C ෆ්ලෑෂ් පොයින්ට් එකක් සහිත විශේෂයෙන් භයානක ගිනි අවුලුවන දියර;
II - 18 සිට 23 ° C දක්වා ෆ්ලෑෂ්පොයින්ට් එකක් සහිත නිරන්තරයෙන් භයානක ගිනි අවුලුවන ද්රව;
III - පීඑල්එච්අයිවී, 23 from සිට 61 ° C දක්වා ෆ්ලෑෂ් ලක්ෂ්යයක් සහිත වාතයේ හෝ තරලයේ ඉහළ උෂ්ණත්වවලදී භයානක ය.
ෆ්ලෑෂ් පොයින්ට් දහනය කළ හැකි ද්රව්යයක අවම (විශේෂ පරීක්ෂණ තත්වයන් යටතේ) උෂ්ණත්වය ලෙස හැඳින්වෙන අතර, එහි මතුපිටට ඉහළින් වාෂ්ප හෝ වායූන් සෑදී ඇති අතර එය ජ්වලන ප්රභවයකින් වාතයේ දැල්වීමට හැකියාව ඇත, නමුත් ඒවා සෑදීමේ වේගය තවමත් ස්ථායී දහනය සඳහා ප්රමාණවත් නොවේ. දැවෙන ද්රව සඳහා, ෆ්ලෑෂ් ලක්ෂ්යය 1-5 ° C ෆ්ලෑෂ් පොයින්ට් වලට වඩා අඩුය.
ජ්වලන උෂ්ණත්වය දහනය කළ හැකි ද්රව්යයක උෂ්ණත්වය ලෙස හැඳින්වෙන අතර එමඟින් දහනය කළ හැකි වාෂ්ප හා වායූන් විමෝචනය වන අතර එමඟින් ජ්වලන ප්රභවයෙන් ජ්වලනය කිරීමෙන් පසු ස්ථිර පිළිස්සීමක් සිදු වේ.
ටයිටේනියම්, ඇලුමිනියම්, ඇන්ත්රසයිට් සහ තවත් බොහෝ දේ හැරුණු විට ප්රායෝගිකව සියළුම දහනය කළ හැකි හා සෙමින් දහනය වන ද්රව්ය හා ද්රව්ය වාෂ්ප හෝ වායු අවධියේදී දහනය වේ. දහනය කළ හැකි ද්රව්ය හා ද්රව්ය රසායනික සංයුතිය, සමුච්චය කිරීමේ තත්වය සහ වෙනත් ගුණාංග අනුව වෙනස් විය හැකිය. ඒවායේ පදනම මත දහනය සඳහා ඒවා සකස් කිරීමේ ක්රියාවලිය විවිධ ආකාරවලින් ඉදිරියට යයි. වායූන් දහන ප්රතික්රියාවට ඇතුල් වන්නේ ප්රායෝගිකව කිසිදු වෙනසක් සිදු නොවන්නේ නම්, ඔක්සිකාරක කාරකය (වායු ඔක්සිජන්) සමඟ මිශ්ර වීම ඕනෑම පරිසර උෂ්ණත්වයකදී සිදුවන අතර සැලකිය යුතු අමතර බලශක්ති පිරිවැයක් අවශ්ය නොවේ. ද්රවයන් මුලින්ම වාෂ්ප වී වාෂ්ප තත්වයට යා යුතු අතර එය යම් තාප ශක්තියක් පරිභෝජනය කරන අතර වාෂ්ප අවධියේදී පමණක් ඒවා ඔක්සිකාරකය සමඟ මිශ්ර වී දහනය වේ. දහනය සඳහා සූදානම් කිරීමේදී ids න ද්රව්ය හා ද්රව්යවලට වඩා විශාල ශක්තියක් අවශ්ය වේ. මන්දයත් මුලදී ඒවා දිය වී හෝ දිරාපත් විය යුතුය. උණු කළ හෝ දිරාපත් වූ ද්රව්ය හා ද්රව්ය වාෂ්ප වී ඔක්සිකාරක කාරකය සමඟ මිශ්ර විය යුතු අතර, පසුව දහන ක්රියාවලිය ජ්වලන ප්රභවයේ බලපෑම යටතේ සිදු වේ. රබර්, රබර් සහ අනෙකුත් ප්ලාස්ටික් ද්රව්ය මෙන්ම මැග්නීසියම් සහ එහි මිශ්ර ලෝහ ජ්වලනයට පෙර දිය වී වාෂ්ප වී යයි (ඒ සමඟම ප්ලාස්ටික් දිරාපත් වේ). කඩදාසි, දැව, කපු රෙදි සහ ඇතැම් ඉංජිනේරු ප්ලාස්ටික් වැනි ද්රව්ය වායුමය නිෂ්පාදන හා solid න අපද්රව්ය (සාමාන්යයෙන් ගල් අඟුරු) සෑදීමට රත් වූ විට දිරාපත් වේ.
ඔක්සිකාරක කාරකය.ඔක්සිකාරකය සාමාන්යයෙන් වායු ඔක්සිජන් වේ. එහි සංයුතියේ වාතය බොහෝ වායූන්ගේ මිශ්රණයකි, ඒවායින් ප්රධාන වන්නේ: නයිට්රජන් (N 2) - පරිමාවෙන් 78.2% සහ බර අනුව 75.5%; ඔක්සිජන් (O 2) - පරිමාවෙන් 20.9% සහ බර අනුව 23.2%; නිෂ්ක්රීය වායූන් (He, Ne, Ar, Kg) - පරිමාවෙන් 0.9% සහ බර අනුව 1.3%. මෙම වායූන් වලට අමතරව, කාබන් ඩයොක්සයිඩ්, ජල වාෂ්ප හා දූවිලි වල සුළු ප්රමාණයක් වායු පරිමාවේ සෑම විටම පවතී. කාබනික ද්රව්ය හා ද්රව්ය දහනය කිරීමේදී ඔක්සිජන් හැර වාතයේ මෙම සියලුම සංරචක දහන ප්රතික්රියාවකට ප්රායෝගිකව ඇතුල් නොවේ. ඔක්සිජන්, නයිට්රජන් සහ නිෂ්ක්රීය වායූන් වාතයේ ස්ථිර සංරචක ලෙස සැලකේ. කාබන් ඩයොක්සයිඩ්, ජල වාෂ්ප හා දූවිලි වල අන්තර්ගතය නියත නොවන අතර මෙම හෝ එම දහන ක්රියාවලිය සිදුවන තත්වයන් අනුව වෙනස් විය හැකිය.
ජ්වලන ප්රභවය.එය දැවෙන හෝ උණුසුම් සිරුරක් මෙන්ම විද්යුත් විසර්ජනයකි, වෙනත් ද්රව්ය දහනය කිරීමට ප්රමාණවත් තරම් ශක්තියක් හා උෂ්ණත්වයක් ඇත.
ප්රායෝගිකව, නිෂ්පාදනයේ හෝ ගබඩාවේ ඇති ද්රව්ය හා ද්රව්යවල උෂ්ණත්වය වැඩි කරන විවිධ සංසිද්ධීන් තිබේ, ඒවා බොහෝ විට දේශීය වශයෙන් සහ දහනය කළ හැකි ද්රව්යයක හෝ ද්රව්යයක සමස්ත පරිමාව තුළ දහන ක්රියාවලිය මතුවීමට හේතු වේ. ජ්වලනයේ ප්රභවයන් අතර: ලෝහ මගින් ජනනය වන ස්පාර්ක් ලෝහ හෝ වෙනත් materials න ද්රව්ය වලට පහර දෙයි; විදුලි උපකරණවල කෙටි පරිපථ සහ වෙල්ඩින් සහ වෙනත් ගිනි නිවීමේ කටයුතු වලදී උණු කළ ලෝහවල ස්පාර්ක් සහ බිංදු; විදුලි ජාල අධි බර පැටවීමේදී විදුලි රැහැන් රත් කිරීම; යන්තවල අතුල්ලන කොටස් යාන්ත්රිකව උණුසුම් කිරීම, එළවළු තෙල් ඔක්සිකරණය කිරීමේදී ජීව විද්යාත්මක උණුසුම සහ මෙම තෙල් සමඟ තෙතමනය කර ඇති කපුටා; දැවෙන කථා, සිගරට් බට් ආදිය. මෙම ජ්වලන ප්රභවයන්ගේ බලපෑමේ ස්වභාවය වෙනස් වේ. එබැවින්, ජ්වලන ප්රභවයක් ලෙස ලෝහ වස්තූන්ගේ බලපෑමෙන් ජනනය වන ගිනි පුපුර ඉතා අඩු බලයක් ඇති අතර වායු-වායු මිශ්රණ පමණක් දැල්වීමට සමත් වේ: මීතේන්-වාතය, ඇසිටිලීන්-වාතය, කාබන්-කාබන්-වාතය සහ වෙනත් ය. ගිනි අවුලුවන හැකියාව සහ ඒවායේ සමස්ත තත්වය නොසලකා දහනය කළ හැකි සියලුම ද්රව්ය හා ද්රව්ය දහනය කිරීමට හේතු විය හැක.
දහනය කළ හැකි පරිසරය. දහන ක්රියාවලියේ සිදුවීම හා පා course මාලාවේදී, දහනය කළ හැකි ද්රව්යය සහ ඔක්සිකාරකය ප්රතික්රියා කරන ද්රව්ය වන අතර ඒවා දහනය කළ හැකි මාධ්ය වන අතර ජ්වලන ප්රභවය දහන ක්රියාවලියේ ආරම්භකය වේ. ස්ථිර දහනය සමඟ, තවමත් දහනය නොවන ද්රව්ය හා ද්රව්ය ජ්වලනය කිරීමේ ප්රභවය වන්නේ දහන ප්රතික්රියා කලාපයෙන් නිකුත් වන තාපයයි.
දහනය කළ හැකි මාධ්ය භෞතිකව සමජාතීය (සමජාතීය) සහ විෂමජාතීය (විෂමජාතීය) විය හැකිය. පළමුවැන්න නම් දහනය කළ හැකි ද්රව්යය සහ ඔක්සිකාරකය (වාතය) ඒකාකාරව මිශ්ර වන පරිසරයන් ය: දහනය කළ හැකි වායූන්, වාෂ්ප හා වාතය සමඟ දූවිලි මිශ්ර වීම. සමජාතීය පරිසර දහනයකට නිදසුන් අතර: ද්රවයක නිදහස් පෘෂ් from යෙන් නැගී එන වාෂ්ප දහනය කිරීම (හදිසි අනතුරකදී TC-1 ජෙට් ඉන්ධන විසුරුවා හැරීම); හානියට පත් සිලින්ඩරයකින් හෝ නල මාර්ගයකින් ගලා යන වායුව; ගෑස්, වාෂ්ප හා දූවිලි සහිත වායු මිශ්රණ පිපිරීම. විෂමජාතීය මාධ්ය අතරට දහනය කළ හැකි ද්රව්යය (ද්රව්ය) හා ඔක්සිකාරක එකිනෙකට සම්බන්ධ නොවන අතර අතුරු මුහුණතක් ඇත: solid න දහනය කළ හැකි ද්රව්ය හා ද්රව්ය, දහනය කළ හැකි වායූන් ජෙට් සහ අධික පීඩනය යටතේ වාතයට ඇතුළු වන ද්රව ආදිය. දැවෙන සමජාතීය මාධ්යයකට උදාහරණයක්. ටයිටේනියම්, ඇලුමිනියම්, ඇන්ත්රසයිට් හෝ තෙල් හා ගෑස් උල්පත් දහනය කිරීම, තෙල් හා ගෑස් පැමිණෙන විට, අධික පීඩනය යටතේ දහන කලාපයේ සහ ඉතා සැලකිය යුතු ප්රවාහ අනුපාතයක් ඇත.
ගිනිදැල්. වාෂ්ප, වායූන් සහ අත්හිටුවීම් දැවෙන අවකාශය ගිනිදැල් ලෙස හැඳින්වේ. කලින් සකස් කරන ලද වාෂ්ප, වායූන් හෝ දූවිලි වාතය සමඟ පිලිස්සී තිබේද යන්න මත පදනම්ව ගිනි දැල්ල චාලක හෝ විසරණය විය හැකිය, හෝ එවැනි මිශ්රණයක් දහනය කිරීමේදී ගිනි කලාපයේ කෙලින්ම සෑදී තිබේද යන්න මත පදනම්ව. චාලක දැල්ලේ සිදුවන ක්රියාදාමයන් දහන ප්රතික්රියාවේ අධික වේගයකින් සංලක්ෂිත වේ (දැල්ලේ රේඛීය ප්රවේගය 1000 m / s ඉක්මවිය හැක) සහ, නීතියක් ලෙස, දහනය කළ හැකි මාධ්යයේ පිපිරීමක් නිරූපණය කරන අතර ඉහළ තාප උත්පාදනයක් සහ දහන කලාපයේ පීඩනයෙහි තියුණු වැඩිවීමක් ද ඇත.
ගින්නක දී, වායූන්, වාෂ්ප, ද්රව සහ ids න ද්රව්ය හා ද්රව්ය සියල්ලම පාහේ විසරණය වන දැල්ලකින් දැවී යයි. මෙම දැල්ලේ ව්යුහය සැලකිය යුතු ලෙස රඳා පවතින්නේ දැවෙන වාෂ්ප හෝ වායූන්ගේ ප්රවාහයේ හරස්කඩ සහ එහි වේගය මත ය. මෙම ප්රවාහයේ ස්වභාවය අනුව, ලැමිනර් සහ කැළඹිලි විසරණය වන දැල්ලක් වෙන්කර හඳුනාගත හැකිය. පළමුවැන්න සිදුවන්නේ දහනය කළ හැකි වාෂ්ප හෝ වායූන් ගලා යන කුඩා හරස්කඩවල ය අඩු වේගය (ඉටිපන්දම් දැල්ලක්, ගැලපීම්, උදුන දාහකයක වායුව ආදිය). විවිධ ද්රව්ය හා ද්රව්ය දහනය කිරීමේදී ඇති වන ගින්නකදී, කැළඹිලි විසරණය වන දැල්ලක් සෑදී ඇත; මිනාර් සහ කැළඹිලි දැල්ල යනු වාෂ්ප හෝ වායු කලාපය වටා ඇති දහන ප්රතික්රියා කලාපයකි. දෙවැන්න දහන කලාපයේ මුළු පරිමාවම වාගේය. විසරණය වන දැල්ලකින් දහනය කිරීමේ ප්රතික්රියා කලාපය තාපය ජනනය කරන ඉතා තුනී (මයික්රොමීටර කිහිපයක්) තට්ටුවක් වන අතර ලැමිනාර් මෙන් නොව සැහැල්ලු කැළඹිලි දැල්ලක් I මගින් සංලක්ෂිත වේ, එය පැහැදිලි දළ සටහන්, නියත කොටස් සහ ගිනි ඉදිරිපස පිහිටීම් නොමැත.
වාෂ්ප කලාපයේ උෂ්ණත්වය ප්රතික්රියා කලාපයට වඩා සැලකිය යුතු ලෙස අඩුය.
ගුවන් ඉන්ධනවල දැල්ල තුළ, දියර මතුපිට අසල ඇති වාෂ්ප ප්රවාහයේ උෂ්ණත්වය එහි තාපාංකය කරා ළඟා වේ (TC-1 ජෙට් ඉන්ධන සඳහා, මෙම උෂ්ණත්වය 150 - 280 of C පරාසයේ පවතී). වාෂ්ප ප්රවාහය ප්රතික්රියා කලාපයට ගමන් කරන විට, ඒවායේ උෂ්ණත්වය පළමුව ඉහළ යන්නේ දැල්ලේ තාප විකිරණය නිසා වන අතර පසුව උනුසුම් දහන නිෂ්පාදනවල ප්රතික්රියා කලාපයෙන් විසරණය වේ. උනුසුම් වීමේ ප්රති result ලයක් ලෙස වාෂ්ප ද්රව්යවල තාප දිරාපත්වීම (වි ociation ටනය) සිදු වන අතර එහි ප්රති free ලයක් ලෙස නිදහස් පරමාණු සහ රැඩිකලුන් දහන නිෂ්පාදන සමඟ සෘජුවම ප්රතික්රියා කලාපයට යයි, එනම් ගිනිදැල් බවට පත්වේ. කාබන් පරමාණු, දහන ප්රතික්රියා කලාපයට ඇතුළු වී, රත් වී දිලිසෙන්නට පටන් ගෙන ඊනියා දීප්තිමත් දැල්ලක් සාදයි. දහන ප්රතික්රියා කලාපයේ උෂ්ණත්වය ගින්නෙහි උස අනුව වෙනස් වේ. දහන කලාපයට ඇතුළු වන සීතල වාතය ස්කන්ධය රත් කිරීම සඳහා සැලකිය යුතු තාප ප්රමාණයක් පරිභෝජනය කිරීම නිසා ගින්නෙහි පහළ කොටසෙහි උෂ්ණත්වය අඩු වන අතර එක් එක් වර්ගයේ දහනය සඳහා අවම වේ. ඉහළම උෂ්ණත්වය ගිනිදැල් මැද කොටසෙහි වර්ධනය වේ, මන්ද ප්රතික්රියාකාරක සං components ටකවල සාන්ද්රණය අඩුවීම (පිළිස්සීම) හේතුවෙන් ප්රතික්රියා අනුපාතය අඩු වන අතර එම නිසා තාප මුදා හැරීමේ මට්ටම අඩු වන අතර උෂ්ණත්වය අඩු වේ.
සාමාන්ය තත්වයන් යටතේ වාතයේ අර්ධ ඔක්සිජන් පීඩනය 228.72 kPa වන අතර දහන ප්රතික්රියා කලාපයේ 0 වේ. එබැවින් අර්ධ පීඩන වෙනසක ප්රති the ලයක් ලෙස සංසරණ වාතයෙන් ඔක්සිජන් දහනය වන නිෂ්පාදනවල ඇඳ හරහා ප්රතික්රියා කලාපයට විහිදේ (පෙරීම, කාන්දු වීම). දහනය කළ හැකි සංරචක දහනය කිරීමේ ප්රතික්රියා කලාපයට ඇතුළත් වීම ප්රායෝගිකව අසීමිතය. මේ අනුව, සංවර්ධිත ක්රියාවලියේදී දහනයේ ප්රතික්රියා අනුපාතය ප්රධාන වශයෙන් රඳා පවතින්නේ ප්රතික්රියා කලාපයට ඇතුළු වන ඔක්සිජන් ප්රමාණය මත පමණි, එනම් එහි විසරණය වීමේ වේගය මත ය. ඒකාකාරී නොවන මාධ්යයක දහනය කිරීමේදී, ප්රතික්රියා කලාපයට ඔක්සිජන් විනිවිද යාම ද ප්රතික්රියා කලාපයට යාබද අවකාශයට මුදා හරින දහන නිෂ්පාදන වලට බාධා කරයි.
දහන ප්රතික්රියා කලාපයේ ප්රමාණවත් ඔක්සිජන් නොමැතිකම එහි ප්රවාහයේ වේගය වළක්වයි. මෙම නිෂේධනය සිදු නොවූයේ නම්, වායුගෝලයේ සිදුවන සියලුම දහන ප්රතික්රියා දිනෙන් දින ඉහළ යන වේගයකින් ඉදිරියට යන අතර ප්රතික්රියා කරන ද්රව්ය පුපුරා යාමෙන් අවසන් වේ. දහනය කිරීමේ ක්රියාවලීන් මෙන්ම සියලුම රසායනික ක්රියාවලීන් විවිධ අනුපාතයන්ට අනුව සිදු වේ. ඒවා සිදුවන තත්වයන් අනුව, ප්රතික්රියා කරන ද්රව්යවල ස්වභාවය අනුව, ඒවායේ එකතුවෙහි තත්වය අනුව. උදාහරණයක් ලෙස පුපුරණ ද්රව්ය තත්පරයෙන් දහසකින් දිරාපත් වන අතර පෘෂ් ust යේ රසායනික ක්රියාවලීන් වසර සිය දහස් ගණනක් පවතී. වායුවේ හා වාෂ්ප අවධිවල ද්රව්යවල අන්තර්ක්රියා සිදුවන්නේ ද්රවයට වඩා වේගයෙන් වන අතර වඩාත් state න තත්වයේ ය. මේ අනුව, ටීඑස් -1 විසිරී ඇති ගුවන් ඉන්ධන සාපේක්ෂව සෙමින් දහනය වන අතර එය දුම් දැල්ලක් (අසම්පූර්ණ දහනය) සාදයි, සහ පිපිරීමක් සමඟ වාතය පිලිස්සීමත් සමඟ මෙම ඉන්ධන සකස් කළ වාෂ්ප-වායු මිශ්රණය. ඔක්සිකාරකයක් සමඟ ids න ද්රව්ය හා ද්රව්ය අන්තර්ක්රියා කිරීමේ වේගය ඒවායේ භූමියේ මට්ටම අනුව නාටකාකාර ලෙස වෙනස් වේ. නිදසුනක් ලෙස, ඇලුමිනියම් සහ ටයිටේනියම්, විශේෂ තත්වයන් යටතේ, සෙමෙන් දැවෙන, පුපුරා ගිය තත්වයක පුපුරන සුලු දූවිලි-වායු මිශ්රණ සෑදිය හැකි අතර, පිළිවෙලින් 0.62 සහ 0.49 MPa පිපිරුම් පීඩනයක් වර්ධනය වේ.
සෑම අවස්ථාවකම රසායනික ක්රියාවලියක් ලෙස දහනය කිරීම සමාන වේ. කෙසේ වෙතත්, භෞතික ක්රියාවලියක් ලෙස, එය දහන ප්රතික්රියාවේ ස්වභාවය අනුව වෙනස් වේ, එබැවින් ආරම්භක දහන ක්රියාවලීන් පහත දැක්වෙන වර්ග වලට බෙදා ඇත: ස්වයංසිද්ධ දහනය, ජ්වලනය සහ ස්වයං ජ්වලනය.
ස්වයංසිද්ධ දහනයගබඩා කිරීමේදී සහ ක්රියාවලි උපකරණ ක්රියාත්මක කිරීමේදී වෙන් කරන ද්රව්ය (ද්රව්ය, මිශ්රණ) ස්වයංසිද්ධව දැල්විය හැකිය. ස්වයංසිද්ධ දහනය යනු බාහිර තාප ප්රතික්රියා වල තියුණු වැඩිවීමක ප්රපංචයකි, එය ජ්වලන ප්රභවයක් නොමැති විට ද්රව්යයක් දහනය වීමට හේතු වේ. ස්වයංසිද්ධව දැල්විය හැකි ද්රව්ය අතර එළවළු සහ මේද තෙල්, එළවළු තෙල්, යකඩ සල්ෆයිඩ් සහ වෙනත් තනි රසායනික ද්රව්යවලින් තෙතමනය කර ඇති කපුටන් සහ කපුටන් ඇතුළත් වේ. එළවළු සහ මේද තෙල් (සූරියකාන්ත, හණ බීජ, කංසා, ඉරිඟු, සත්ව මේද ආදිය) මේද පන්තියට අයත් වන අතර ඉහළ අණුක බර මේද අම්ල වල ග්ලිසරයිඩ මිශ්රණයකි. මෙම අම්ල වල අණු වල අසංතෘප්ත (ද්විත්ව) බන්ධන ඇති අතර, මෙම ද්රව්යවල ස්වයංසිද්ධ දහනය සඳහා යම් කොන්දේසි යටතේ දායක වේ. A. එන්. බැච්ගේ පෙරොක්සයිඩ් න්යායට අනුව, ද්විත්ව බන්ධනයට සාපේක්ෂව ස්ථානයේ ඇති මෙතිලීන් කාණ්ඩයට ඔක්සිජන් එකතු කිරීම හා හයිඩ්රොපෙරොක්සයිඩ් සෑදීම නිසා ඔක්සිකරණය සිදුවිය හැකිය. දන්නා පරිදි, සියලුම පෙරොක්සයිඩ් සහ හයිඩ්රොපෙරොක්සයිඩ් අස්ථායී රසායනික සංයෝග වේ. ඒවායේ දිරාපත්වීමේදී නිදහස් රැඩිකලුන් සෑදී විශාල කාබනික අණු බවට බහුඅවයවීකරණය කරයි. බහුඅවයවීකරණයේදී, යම් තාප ප්රමාණයක් සෑම විටම මුදා හරිනු ලබන අතර, අවසාන ප්රති result ලය ලෙස කාබනික ද්රව්ය ඔක්සිකරණය කිරීම ස්වයංසිද්ධව දහනය වීමට හේතු වේ. කාබනික ද්රව්ය ස්වයංසිද්ධව දහනය කිරීම යම් යම් තත්වයන් යටතේ සිදු වේ. මේවාට ඇතුළත් වන්නේ: පාර්ශ්වීය අම්ලවල තෙල් හෝ ග්රීස් වල ඇති අධික අණුක බර ග්ලිසරයිඩවල අන්තර්ගතය යම් අවම ප්රමාණයකට වඩා අඩු නොවේ; ඔක්සිකාරක කාරකය හා අඩු තාප හුවමාරුව සමඟ විශාල පෘෂ් contact සම්බන්ධතාවයක් තිබීම; මේද හා තෙල්වල නිශ්චිත අනුපාතයක් සහ ඒවා සමඟ කාවැදී ඇති සිදුරු සහිත හෝ තන්තුමය ද්රව්යයකි.
ගුවන් යානා ව්යාපාරවල ඉන්ධන ගබඩාවල ක්රියාවලි උපකරණවල යකඩ සල්ෆයිඩ් FeS, Fe 2 S 3 සෑදිය හැකිය. විශේෂයෙන් දහනය කළ හැකි වාෂ්ප හා වායූන් තිබීම නිසා වාතයේ ස්වයංසිද්ධව දැල්වීමට ඒවාට හැකියාව ඇත. ස්වාභාවික පයිරයිට් සංයෝගයේ FeS2 ඔක්සිකරණය කිරීමේ උදාහරණයේ දී යකඩ සල්ෆයිඩ ඔක්සිජන් සමඟ සම්බන්ධ කිරීමේ යාන්ත්රණය සලකා බලන්න:
FeS 2 + 2O 2 = FeS + 2SO 2 + 222.3 kJ.
යකඩ සල්ෆයිඩ වලට අමතරව, එවැනි ද්රව්ය ස්වයංසිද්ධව දැල්විය හැකිය. s,දුඹුරු ගල් අඟුරු, පීට්, ශාක සම්භවයක් ඇති නිෂ්පාදන ලෙස: පිදුරු, පිදුරු, ගිලීම ආදිය.
වඩාත්ම භයානක වන්නේ නුසුදුසු ලෙස ගබඩා කිරීමේදී පුද්ගලික, රසායනික ද්රව්ය ස්වයංසිද්ධව දහනය කිරීමයි, මන්ද මෙම ක්රියාවලිය මඟින් මෙම ද්රව්ය ගබඩා කර ඇති ස්ථානයේ ගින්නක් ඇතිවිය හැකිය. ඒවායේ රසායනික ගුණාංග අනුව, මෙම ද්රව්ය කාණ්ඩ තුනකට බෙදා ඇත: වාතය, ජලය සහ එකිනෙකා සමඟ ස්පර්ශ වීමෙන් ස්වයං-ජ්වලනය. මිතුරෙක්.
පළමු කාණ්ඩයට අයත් ද්රව්ය ගුවන් සේවා ව්යවසායයන්ගේ තාක්ෂණයෙන් ප්රායෝගිකව සිදු නොවන බැවින් අපි ඒවා නොසලකමු.
දෙවන කණ්ඩායමට ද්රව්ය ගණනාවක් ඇතුළත් වන අතර ඒවායින් වඩාත් සිත්ගන්නා සුළු වන්නේ කැල්සියම් කාබයිඩ් CaC2 සහ කැල්සියම් ඔක්සයිඩ් CaO ය. කැල්සියම් කාබයිඩ් සමඟ අන්තර්ක්රියා කරන විට, දහනය කළ හැකි වායුවක් වන ඇසිටිලීන් සහ සැලකිය යුතු තාප ප්රමාණයක් මුදා හරිනු ලැබේ. සාපේක්ෂව කුඩා ජල ප්රමාණයක් සමඟ, කැල්සියම් කාබයිඩ් පද්ධතිය - ජලය 920 K දක්වා දැල්විය හැකි අතර එමඟින් ඇසිටිලීන් වායු මිශ්රණයක් පුපුරා යා හැක:
CaC 2 + 2H 2 O = C 2 H 2 + Ca (OH) 2 + 127 kJ.
කැල්සියම් කාබයිඩයට අමතරව, කැල්සියම් ඔක්සයිඩ් CaO සතුව කුඩා ජල ප්රමාණයක් එයට ඇතුළු වන විට දීප්තියේ උෂ්ණත්වය දක්වා රත් කිරීමේ හැකියාව ඇති අතර එමඟින් ගබඩාවේ බහාලුම් සහ දහනය කළ හැකි ව්යුහාත්මක මූලද්රව්ය ජ්වලනය කිරීමට ද හේතු විය හැකිය:
CaO + H 2 O = Ca (OH) 2 + 64.5 kJ.
තෙවන කණ්ඩායමට ශක්තිමත් ඔක්සිකාරක කාරක, තනි රසායනික ද්රව්ය සහ කාබනික ද්රව්ය හා ද්රව්ය ඇතුළත් වේ. උදාහරණයක් ලෙස, පොටෑසියම් පර්මැන්ගනේට් සහ ග්ලිසරින් වැනි ද්රව්ය එකට ගබඩා කළ නොහැක; ටර්පන්ටයින්, එතිල් ඇල්කොහොල් සහ හයිඩ්රජන් සල්ෆයිඩ් සමඟ සාන්ද්රිත නයිට්රික් අම්ලය; ගිනි අවුලුවන වායූන් සහ දැවෙන ද්රව සහිත හැලජන්; නයිට්රේට්, ක්ලෝරේට්, පර්ක්ලෝරෙට් සහිත සල්ෆියුරික් අම්ලය, මේ අවස්ථාවේ දී රසායනික ප්රතික්රියාවක් ඇති විය හැකි බැවින් විශාල තාපයක් නිකුත් වේ.
ගිනි අවුලුවන.ස්වයං-ජ්වලනයට අමතරව, ජ්වලන ප්රභවයක බලපෑම යටතේ දහනය වීම සරලව දැල්විය හැකිය. ගින්නක් සම්බන්ධ ගින්නක් ජ්වලනය ලෙස හැඳින්වේ. මෙය සිදු වූ විට, තාප නිරාවරණ ලක්ෂ්යයට යාබද පරිමාවේ උණුසුම. නිශ්චිත පරිමාවේ උෂ්ණත්වය ඉහළ යාමේ ප්රති the ලයක් ලෙස එයට යාබදව දහනය කළ හැකි මාධ්යයේ ප්රදේශවලට (පරිමාව) තාපය බෙදා හරිනු ලැබේ. දහන ක්රියාවලියට සම්බන්ධ දහනය කළ හැකි ද්රව්ය (ද්රව්ය, මිශ්රණය) වැඩි වන තරමට තාපය අවට අවකාශයට මුදා හරිනු ලැබේ. මේ අනුව, දහනය කිරීමේ ක්රියාවලිය ස්වයංසිද්ධව වර්ධනය වේ. මෙම අවස්ථාවේ දී ජ්වලනයේ ප්රභවය දහනය කළ හැකි මිශ්රණයේ කුඩා පරිමාවක් පමණක් රත් කරන අතර දහනය කළ හැකි මාධ්යයේ සමස්ත පරිමාවේ උෂ්ණත්වය නොවෙනස්ව පැවතිය හැකිය.
දහනය කළ හැකි මිශ්රණ වර්ගය අනුව ජ්වලන ක්රියාවලිය ස්වභාවයෙන්ම වෙනස් වේ. වඩාත්ම භයානක වන්නේ වායු-වායු මිශණ ය. කෙසේ වෙතත්, ජ්වලන ප්රභවයේ අවම ශක්තිය බොහෝ පරාමිතීන් මත රඳා පවතී, ප්රධාන ඒවා වන්නේ මිශ්රණයේ ප්රතිශත සංයුතිය, දහනය කළ හැකි ද්රව්ය වර්ගය, මිශ්රණයේ පීඩනය, ජ්වලන උෂ්ණත්වය, සාමාන්ය ගිනි ප්රචාරණ අනුපාතය සහ දහන උෂ්ණත්වය මෙම අගයන් මත රඳා පවතින බැවිනි. ඊට අමතරව, ජ්වලන ප්රභවයේ අවම උෂ්ණත්වය දහනය කළ හැකි මාධ්යයක් සමඟ එහි සම්බන්ධතාවයේ කාලයට බලපායි.
ද්රව ප්රදාහය සිදුවිය හැක්කේ ස්ථායී දහනය සිදුවීමට අවශ්ය තරම් වාෂ්ප වාෂ්ප වීමට පරිසරයේ හෝ ද්රවයේ ප්රමාණවත් නම් පමණි. විවිධ දැවෙන ද්රව සඳහා මෙම උෂ්ණත්වය සමාන නොවේ. ජ්වලන උෂ්ණත්වයට වඩා අඩු උෂ්ණත්වවලදී, දහනය කිරීම කළ නොහැක්කකි, මන්ද මෙම අවස්ථාවේ දී ද්රවයක වාෂ්පීකරණ වේගය ඉතා අඩුය. පිටත වාතයේ උෂ්ණත්වය හෝ දැවෙන ද්රවයේ වැඩි වීමත් සමඟ වෙනත් දේ සමාන වීම, ද්රව වාෂ්පීකරණය වැඩි වන අතර ස්ථායී දහනය සිදුවීමට වාෂ්ප ප්රමාණය ප්රමාණවත් වේ.
ස්වයං ජ්වලනය. එය ස්වයංසිද්ධ දහනය ලෙස හැඳින්වේ. ප්රායෝගිකව ස්වයංසිද්ධ දහනය හා ජ්වලනය කිරීමේ ක්රියාවලියට අමතරව, විවිධ දහනය කළ හැකි මාධ්ය ස්වයං-ජ්වලනය කිරීමේ ක්රියාවලියක් ද ඇත. ඒවායේ රසායනික ස්වභාවය අනුව, මෙම ක්රියාවලීන් තුනම එකිනෙකට වඩා වෙනස් නොවේ. ඒවා අතර වෙනස පවතින්නේ දහන ක්රියාවලියේ භෞතික සාරය තුළ වන අතර, ස්වයංසිද්ධ දහනය හා ජ්වලන ක්රියාවලියට වෙනස්ව, ස්වයං-ජ්වලන ක්රියාවලිය ප්රතික්රියා කරන දහනය කළ හැකි මාධ්යයේ මුළු පරිමාව පුරාම ක්ෂණිකව ඉදිරියට යයි. භෞතික විද්යාවේ දෘෂ්ටි කෝණයෙන් බලන කල, දැනටමත් මිශ්ර හා සකස් කළ මිශ්රණයක් පුළුස්සා දැමීමේ චාලක ක්රියාවලිය මෙයයි. වාෂ්ප-, දූවිලි හා වායු වායු මිශ්රණ දහනය කරන විට මේවා නීතියක් ලෙස පිපිරුම් වේගය වේ. ස්වයං-ජ්වලන ක්රියාවලිය සිදුවීමට නම්, දහනය කළ හැකි මිශ්රණයේ මුළු පරිමාවේම ස්වයං-ජ්වලන උෂ්ණත්වයක් තිබීම අවශ්ය වේ. ස්වයං-ජ්වලන උෂ්ණත්වය යනු ද්රව්යයක අවම උෂ්ණත්වය (ද්රව්ය, මිශ්රණය) යන්නෙහි අර්ථය වන අතර එහිදී බාහිර තාප ප්රතික්රියා වල තියුණු වැඩිවීමක් ඇති වන අතර එහි ප්රති fla ලයක් ලෙස ගිනි දැල්වීම සිදුවේ. ගිනි අවුලුවන ද්රව්යයක ස්වයංක්රීයව ජ්වලන උෂ්ණත්වය නියත නොවේ. එය තාප උත්පාදනයේ වේගය සහ තාප සින්ක් මත රඳා පවතින අතර එය මිශ්රණයේ පරිමාව, සාන්ද්රණය, පීඩනය සහ වෙනත් සාධක මත රඳා පවතී. ගිනි අවුලුවන වාෂ්ප හා වායුව සමඟ වායූන් මිශ්ර කිරීමේ ස්වයංක්රීය ජ්වලන උෂ්ණත්වය ඒවායේ ප්රතිශත සංයුතිය අනුව වෙනස් වේ. අවම ස්වයංක්රීය ජ්වලන උෂ්ණත්වය වන්නේ ප්රතික්රියාකාරක සාන්ද්රණයක ඇති ස්ටොයිකොමිතික මිශ්රණයක් හෝ ඊට ආසන්න මිශ්රණයක් සඳහා ය. Ids න ද්රව්ය හෝ ද්රව්යවල ස්වයං-ජ්වලන උෂ්ණත්වය ඒවායේ ඇඹරුම් මට්ටමට ප්රතිලෝමව සම්බන්ධ වේ: ද්රව්යයක් ඇඹරීමේ මට්ටම වැඩි වන තරමට එහි ස්වයං ජ්වලන උෂ්ණත්වය අඩු වේ. මෙයට හේතුව ද්රව්ය හා ද්රව්ය ඇඹරීමත් සමඟ මෙම දහනය කළ හැකි සං components ටක හා ඔක්සිකාරකයේ ස්පර්ශක පෘෂ් of යේ ප්රදේශය තියුණු ලෙස වැඩි වීමයි.
| / ak උදුන හා භූමිතෙල් පුළුස්සා දැමීම. වාතයේ ඔක්සිජන් සහභාගී වීමත් සමඟ සිදුවන රසායනික ප්රතික්රියා සඳහා වඩාත් කැපී පෙනෙන උදාහරණය වන්නේ දහනයයි. එමඟින් අපට තාපය හා ආලෝකය ලැබේ. මොනවා වුනත්
අපි ඉන්ධන දහනය නොකළෙමු - ගල් අඟුරු හෝ දර, භූමිතෙල් හෝ බෙන්සියම්, මධ්යසාර හෝ දීප්තිමත් වායුව - දහනය කිරීමේදී ප්රධාන රසායනික ප්රතික්රියාව සමාන වේ: ඉන්ධන අණු වල කොටසක් වන කාබන් සහ හයිඩ්රජන් වාතයේ ඔක්සිජන් සමඟ සංයෝජනය වී කාබන් ඩයොක්සයිඩ් හා ජලය සාදයි. භූමිතෙල් ලාම්පුවක් කහ, දීප්තිමත් දැල්ලක් ලබා දෙන බව ප්රීමස් උදුන නිල් හෝ වයලට්, පාහේ දීප්තිමත් නොවන දැල්ලක් ලබා දෙන බව කවුරුත් දන්නා කරුණකි. අවස්ථා දෙකේදීම, ඉන්ධන සමාන වේ - භූමිතෙල්. මෙය සිදුවන්නේ ඇයි?
භූමිතෙල් යනු විවිධ හයිඩ්රොකාබන, හයිඩ්රජන් සමඟ කාබන් සංයෝගයකි. උදාහරණයක් ලෙස, සන්ගෝ සංයුතිය ඇති භූමිතෙල් හයිඩ්රොකාබන වලින් එකක් - නොනේන්. දැවෙන විට, නොනේන් ඔක්සිජන් හා කාබන් ඩයොක්සයිඩ් සමඟ සංයෝජනය වන අතර ජලය සෑදී ඇත. මෙම ක්රියාවලියේ ආරම්භක හා අවසාන තත්වයන් රසායනික සමීකරණයකින් නිරූපණය කළ හැකිය:
C9H20 + 1402 - 9 C02 + 10 H20 (වාෂ්ප) + තාපය,
එවැනි සමීකරණයක් ලිවීමෙන් පසුව අපි උපකල්පනය කළේ හයිඩ්රොකාබන් සම්පූර්ණයෙන්ම දැවෙන බවයි. හොඳ ප්රාථමිකයක සිදුවන්නේ මෙයයි. උදුන තුළ භූමිතෙල් පීඩනය යටතේ දාහකයට ඇතුල් වේ. උනුසුම් දාහකයක වාෂ්ප වන විට, තුණ්ඩයක් හරහා ශක්තිමත් ජෙට් යානයක් පුපුරා යන විට භූමිතෙල් වාතය සමඟ හොඳින් මිශ්ර වේ. මෙම මිශ්රණය ඔක්සිජන් වලින් පොහොසත් වන අතර භූමිතෙල් සම්පූර්ණයෙන්ම දහනය වේ. මීට අමතරව, භූමිතෙල් වාෂ්ප, දාහකයේ උණුසුම් කොටස හරහා ගමන් කිරීම, රත් වීම පමණක් නොව, රසායනිකව ද වෙනස් වේ: අංශක 400-500 ක උෂ්ණත්වයක ඇති සංකීර්ණ හයිඩ්රොකාබන් අණු සරල ඒවාට කැඩී යයි, ඒවා වඩාත් පහසුවෙන් දහනය වේ. මෙම වියෝජනය සාමාන්යයෙන් solid න කාබන් - කෝක් කුඩා ප්රමාණයක් මුදා හැරීම සමඟ සිදු වේ. කෝක් ක්රමයෙන් දාහකය වසා දමයි, එබැවින් වරින් වර එය “පිළිස්සීම” අවශ්ය වේ.
භූමිතෙල් සෑම විටම සබන් හෝ සබන් ලබා දෙන බව අපි දනිමු, එනම් ගල් අඟුරු ඉතා කුඩා අංශු. මෙයින් අදහස් කරන්නේ භූමිතෙල් සම්පූර්ණයෙන් දහනය නොකෙරෙන බවයි. භූමිතෙල් පෘෂ් from යෙන් වාෂ්ප වී වාතය සමඟ මිශ්ර වේ. ගින්න තුළ වාතය ප්රමාණය ප්රමාණවත් නොවේ. එබැවින් ගල් අඟුරු වල කුඩාම රතු-උණුසුම් අංශු සෑදී ඇති අතර එයින් දැල්ල දීප්තිමත් ලෙස බබළයි.
දර සහ ගල් අඟුරු දැවෙන විට දැවෙන අතර අඟුරු දැල්ලක් නොමැතිව දැවෙන්නේ ඇයි? විවිධ solid න ඉන්ධන වෙනස් ලෙස දහනය වේ: දර සහ ගල්
ගල් අඟුරු සෑදී ඇත්තේ ගිනි දැල්වීමෙන් වන අතර අඟුරු ගිනිදැල් ඇති නොකරයි. ඔවුන් අතර ඇති වෙනස කුමක්ද?
දැව පල්ප් සහ ගල් අඟුරු යනු කාබන් වලින් පොහොසත් සංකීර්ණ ද්රව්යවල මිශ්රණයකි. ඒවායේ ඔක්සිජන් සහ හයිඩ්රජන් ද අඩංගු වේ. දැව හා ගල් අඟුරු රත් කළ විට, සංකීර්ණ ද්රව්ය සරල හා ඒ සමඟම වැඩි වාෂ්පශීලී ද්රව්යවලට බෙදා ඇත. මෙම ද්රව්ය, දැවෙන සහ ගිනිදැල් ඇති කරයි. දර දර ගල් අඟුරු වලට වඩා ගින්නක් ලබා දෙයි: ඒවා වැඩි වාෂ්පශීලී ද්රව්ය නිපදවයි.
අඟුරු ලබා ගන්නේ අසම්පූර්ණ දැව දහනය කිරීමෙනි. හොඳ අඟුරු පාහේ පිරිසිදු කාබන්; ඛනිජ ද්රව්ය පමණක් එයට මිශ්ර කර ඇති අතර එය පිළිස්සීමෙන් පසු අළු ලබා දෙයි. එමනිසා අඟුරු මගින් වාෂ්පශීලී නිෂ්පාදන සාදන්නේ නැත.
වාෂ්පශීලී නිෂ්පාදන මුදා හැරීමත් සමඟ අධික උෂ්ණත්වයේ දී දිරාපත් වන සියලුම ද්රව ද්රව්ය හා දහනය කළ හැකි වායූන් දැවෙන විට දැල්ලක් සාදයි. වාෂ්පශීලී දිරාපත්වීමේ නිෂ්පාදන නිපදවීමට හැකියාවක් නොමැති ids න ද්රව්ය දැල්ලකින් තොරව දැවී යයි. අසම්පූර්ණ දහනයකදී, දුම සෑම විටම සෑදී ඇති අතර, නොකැඩූ ගල් අඟුරු වල solid න අංශු සහ දහන වායුමය නිෂ්පාදන වන කාබන් මොනොක්සයිඩ්, කාබන් ඩයොක්සයිඩ් සහ ජල වාෂ්ප වලින් සමන්විත වේ.
භූමිතෙල් ලාම්පුවක් දුම් පානය කරන්නේ ඇයි සහ කලින් වසා ඇති උදුනක් දැවී යන්නේ ඇයි? අපට රසායනික ප්රතික්රියා පාලනය කළ හැකිය, ඒවා අපට අවශ්ය ආකාරයට ගලා යා හැකිය. මේ සඳහා උදාහරණ අපගේ එදිනෙදා ජීවිතයේදී සොයා ගැනීම පහසුය.
භූමිතෙල් ලාම්පුව දුම් පානය කිරීමට පටන් ගත්තේය. සබන් මුදා හැරියහොත් පිළිස්සීම සම්පූර්ණ නොවන බව පැහැදිලිය. අපි විකිය ප්රතික්ෂේප කළෙමු - සබන් සෑදීම නතර වී ඇත. ඇයි අපි පිළිස්සීමේ කොන්දේසි වෙනස් කළ නිසා. විකිය නිවා දැමීමෙන් අපි භූමිතෙල් වාෂ්පීකරණ වේගය අඩු කළෙමු. ලාම්පුවට ඇතුළු වන වාතය ප්රමාණය එලෙසම පැවතුනි. එමනිසා, පිළිස්සීම වඩාත් සම්පූර්ණ වී ඇත.
ඉක්මනින් වසා දැමූ උදුන නාස්තියක් වන්නේ ඇයි? - දැවෙන මාදිලිය උල්ලං is නය වී ඇති අතර එක් ප්රතික්රියාවක් වෙනුවට තවත් එකක් ගමන් කරයි. උදුනට ඇතුළු වන වාතය නොමැතිකම සමඟ, දහනය අවසානයට යන්නේ නැත: කාබන් ඩයොක්සයිඩ්, CO2 වෙනුවට, කාබන් මොනොක්සයිඩ් සෑදී ඇත, නැතහොත් වෙනත් ආකාරයකින් හැඳින්වෙන පරිදි, කාබන් මොනොක්සයිඩ් CO. කාබන් මොනොක්සයිඩ් අදෘශ්යමාන ය, මන්ද දුම මෙන් නොව එහි solid න අංශු අඩංගු නොවන බැවිනි. ඔහු ඉතා විෂ සහිත ය.
නළය විවෘත වන විට කාබන් මොනොක්සයිඩ් ද සෑදී ඇත, නමුත් උදුනට ඔක්සිජන් සැපයුම ප්රමාණවත් බැවින් එය දහනය වී නලයට ඇතුළු වන කාබන් ඩයොක්සයිඩ් සාදයි
(රූපය 7, ඒ). නළය වසා ඇති විට, දහනය කිරීමේ නිෂ්පාදන උදුන දොර හරහා කාමරයට පිටවෙයි. උදුනෙහි ඕනෑවට වඩා රතු-උණුසුම් ගල් අඟුරු ඉතිරිව තිබේ නම්, වායු ප්රවාහය ප්රමාණවත් වන්නේ කාබන් මොනොක්සයිඩ් සෑදීම සඳහා පමණක් වන අතර කාමරයේ අපද්රව්ය සිදු වේ (රූපය 7, £).
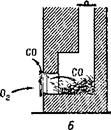
මෙම සරල උදාහරණවලින් පෙන්නුම් කරන්නේ ප්රතික්රියාකාරක ප්රමාණය අතර අනුපාත වෙනස් කිරීමෙන් ඔබට රසායනික ප්රතික්රියාව පාලනය කළ හැකි බවයි.
උදුනක පුළුස්සා දැමීම සහ ජීවියෙකු තුළ පුළුස්සා දැමීම අතර ඇති වෙනස කුමක්ද? උදුන තුළ ඉන්ධන දහනය වේ. මක්නිසාද ශරීරය ඉන්ධන ආහාර වේ. ශරීරයේ මෙන්ම උදුනෙහිද කාබනීක ද්රව්ය දහනය කර කාබන් ඩයොක්සයිඩ් හා ජලය බවට පරිවර්තනය වේ.
මෙය සමානතාවයකි.
වෙනස වන්නේ උදුනක දැවීම අධික උෂ්ණත්වයකදී සහ ජීවියෙකු තුළ - අඩු හා වඩා මන්දගාමී වේ.
Aces ෂ්මකවල, විශේෂයෙන් කාර්මික වර්ගය - පිපිරීම, වීදුරු ආදිය උෂ්ණත්වය අංශක 1000 ඉක්මවයි. මිනිස් සිරුරේ සාමාන්ය උෂ්ණත්වය අංශක 36.6 කි. අංශක 10 ක උෂ්ණත්වය ඉහළ යාම ප්රතික්රියා වේගය මෙන් දෙගුණයක් බව රසායන ists යින් සොයාගෙන ඇත. එයින් අදහස් වන්නේ උදුන තුළ පිළිස්සීම ශරීරයට වඩා බොහෝ ගුණයකින් වේගයෙන් සිදුවන බවයි.
කෙසේ වෙතත්, එය පමණක් නොවේ. ඉහළ උෂ්ණත්වවලදී, ප්රතික්රියාව සම්පූර්ණයෙන්ම වෙනස් ආකාරයකින් ඉදිරියට යා හැකිය. අංශක 1000 දී සමහර ඔක්සිජන් අණු (සියයට 1.5 ක් පමණ) පරමාණු වලට කැඩී යයි: 02 ^ 20. මෙයින් අදහස් කරන්නේ නිදහස් ඔක්සිජන් පරමාණු ඉන්ධන සමඟ ප්රතික්රියා කරන නිසා ඉහළ උෂ්ණත්වවලදී දහනය කිරීම පැහැදිලි කළ හැකි අතර, ඒවා පරිභෝජනය කරන විට දිරාපත් වීම, වි ociation ටනය වීම සහ නව ඔක්සිජන් අණු මගින් නැවත පිරවීමයි. නමුත් ජීවීන් තුළ ඔක්සිජන් අණු පරමාණු බවට විසුරුවා හැරිය නොහැක. ජීවීන් තුළ දැවීම සිදු වන්නේ කෙසේද?
එවැනි ක්රියාදාමයන්ගේ පොදු න්යාය පසුගිය ශතවර්ෂයේ අවසානයේ දී රුසියානු ශාස්ත්ර ician ඒ.එන්. සරල කාබන් සංයෝග හා සත්ව හා ශාක ජීවීන් සමඟ අඩංගු අත්හදා බැලීම් මාලාවකින් A.N. බැච් ඔප්පු කළේ සාමාන්ය උෂ්ණත්වවලදී සමස්ත ඔක්සිජන් අණු මෙම ද්රව්යවල අණු සමඟ බැඳී ඇති බවයි. ඒ අතරම, පරමාණුක ඔක්සිජන් තරම් පහසුවෙන් වෙනත් ද්රව්ය ඔක්සිකරණය කළ හැකි එවැනි සංයෝග සෑදී ඇත. පෙරොක්සයිඩ් ලෙස හඳුන්වන මෙම සංයෝග අතරමැදි ඔක්සිකරණ නිෂ්පාදන වේ.
පෙරොක්සයිඩ් අණු සෑදී ඇත්තේ කෙසේද සහ ඒවායේ ඇති ගුණාංග මොනවාද?
සරලම පෙරොක්සයිඩ් - හයිඩ්රජන් පෙරොක්සයිඩ් Н202 සමඟ මුලින්ම දැන හඳුනා ගනිමු. එහි ව්යුහය HOOOH සූත්රයෙන් නිරූපණය කෙරේ. හයිඩ්රජන් පෙරොක්සයිඩ් අස්ථායි, ගබඩා කිරීමේදී එය සෙමෙන් ජලය හා ඔක්සිජන් බවට දිරාපත් වේ: H202 = H20 + 0. පෙරොක්සයිඩ්වල ඇති ඔක්සිජන් පරමාණු වලින් එකක් “ජංගම”, “ක්රියාකාරී” බව එයින් අදහස් වේ. එබැවින් හයිඩ්රජන් පෙරොක්සයිඩ් හොඳ ඔක්සිකාරක කාරකයකි.
සතුන් හා ශාක වල හයිඩ්රජන් පෙරොක්සයිඩ් නොමැත, නමුත් කාබනික සංයෝගවල කාබන් පරමාණු පෙරොක්සයිඩ්වල ලක්ෂණයක් වන –O - O– පරමාණු සමූහය සමඟ සම්බන්ධ කළ හැකිය. එවැනි පෙරොක්සයිඩ් කාබනික සංයෝගවල පෙරොක්සයිඩ් ලෙස හැඳින්වෙන අතර ඒවා ජීවීන් තුළ දක්නට ලැබේ. ශරීරයේ මන්දගාමී ඔක්සිකරණ ක්රියාවලීන්හි සුවිශේෂී කාර්යභාරයක් ඉටු කරන්නේ මේවා බව ඒ. එන්. බැච් පෙන්වා දුන්නේය.
සතුන් තුළ ආහාර ද්රව්ය ඔක්සිකරණය රුධිරයේ සිදු වේ. රතු රුධිර සෛල තුළ හීමොග්ලොබින් නම් සංකීර්ණ ප්රෝටීන් ද්රව්යයකි. හිමොග්ලොබින් සංයුතියට යකඩ අඩංගු වන අතර එමඟින් ඔක්සිජන් සමඟ සංයෝජනය කිරීමේ හැකියාව ලබා දෙයි. හුස්ම ගැනීමේදී හිමොග්ලොබින් ඔක්සිකරණය වී (පෙණහලුවල) ඔක්සිහෙමොග්ලොබින් බවට පත්වේ. ඔක්සිහෙමොග්ලොබින් සැබෑ පෙරොක්සයිඩ් නොවේ, මන්දයත් එය පෙරොක්සයිඩ් මෙන් අඩක් නොව අමුණා ඇති ඔක්සිජන් සියල්ලම අතහැර දමයි. නමුත් එය පහසුවෙන් සමහර ආහාර ද්රව්ය රුධිරයට පෙරොක්සයිඩ් බවට පරිවර්තනය කර එයට ඔක්සිජන් ලබා දී නැවත හිමොග්ලොබින් බවට පත්වේ. ආහාර ද්රව්ය ඔක්සිකරණය කිරීම සඳහා, ජීවිතය පවත්වා ගැනීමට අවශ්ය ශක්තිය නිපදවීම සඳහා ඔක්සිජන් පරිභෝජනය කරයි.
දහනය හා ඔක්සිකරණය අතර වෙනසක් තිබේද? විසින්
ඉන්ධන දහනය කිරීමට සමානව, තාපය හා ආලෝකය විමෝචනය වීමත් සමඟ සිදුවන සියලුම රසායනික ක්රියාවලීන් දහනය කිරීම ස්වාභාවිකය. "දැවීම" යන වචනය බාහිර සං signs ා විස්තර කරන අතර රසායනික ප්රතික්රියාවක එක් පැත්තක් පමණි - රසායනික ශක්තිය තාපය හා ආලෝකය බවට පරිවර්තනය කිරීම.
නමුත් රසායන mist යෙකුට විස්තර කිරීමට මෙම ප්රතික්රියාව පමණක් ප්රමාණවත් නොවේ. ඔහුට අවශ්ය වන්නේ ද්රව්යය සෑදෙන එක් එක් පරමාණුවලට සිදුවන්නේ කුමක්ද, ප්රතික්රියා අතරතුර මෙම පරමාණු වෙනස් වන්නේ කෙසේද යන්නයි. මෙම පැත්තෙන් දහනය කිරීමේදී සිදුවන ප්රතික්රියා දෙස බැලුවහොත්, සෑම විටම දැවෙන අණුවේ එක් පරමාණුවක් එහි ධනාත්මක සංයුජතාව වැඩි කරන බව පෙනේ. උදාහරණයක් ලෙස, C02 හි CO දහනය කිරීමේදී, කාබන් පරමාණුව තවදුරටත් එකක් සමඟ නොව ඔක්සිජන් පරමාණු දෙකක් සමඟ සම්බන්ධ වන බැවින් කාබන් වල ධනාත්මක සංයුජතාව 2 සිට 4 දක්වා වැඩි වේ. දහනය කිරීමේදී කාබන් ඔක්සිකරණය වේ. එබැවින්, අපි ඔක්සිකරණය ලෙස හඳුන්වන්නේ මූලද්රව්යයක් සඳහා මූලද්රව්යයක් ඇති ප්රතික්රියාවක් එහි ධනාත්මක සංයුජතාව වැඩි කරයි.
ඔබ ඔක්සිකාරක කාරකය සමඟ ඔක්සිකරණය කළ විට කුමක් සිදුවේද? අපගේ උදාහරණයේ දී, ඔක්සිකාරක ද්රව්යය වාතයෙන් ලැබෙන ඔක්සිජන් වේ, ප්රතික්රියාවට ශුන්ය සංයුජතාව පැවරීමට අපි එකඟ වූ සරල ද්රව්යයකි (පි. 22). CO2 අණුවේ සංයුතියට ඇතුළු වන විට ඔක්සිජන් පරමාණුව ද්විමය negative ණ බවට පත්වේ. මූලද්රව්යය සඳහා පරමාණුක කකොග්-එල් ප්රතික්රියාව එහි negative ණ සංයුජතාව වැඩි කරයි. එහි ප්රති CO ලයක් ලෙස CO සමඟ කාබන් ඔක්සිකරණය කිරීමෙන් වාතයේ ඔක්සිජන් අඩු වේ. අපගේ උදාහරණයෙන්, ඔක්සිකරණය සහ අඩු කිරීම ද්විත්ව ක්රියාවලීන් දෙකක් බව අපට පෙනේ: ඒවා සෑම විටම එකිනෙකා සමඟ යන අතර අනෙකක් නොමැතිව එකක් කළ නොහැකි ය.
සියලුම ඔක්සිකරණය දහනය මෙන් ඉදිරියට යනවාද? යකඩ, මලකඩ, මලකඩ. නමුත් ඇත්ත වශයෙන්ම අපට කිව හැකිද මේ අවස්ථාවේ දී යකඩ දැවෙන බව. ඇත්ත වශයෙන්ම නැත. ඔක්සිකරණය ජීවියෙකුගේ ආලෝකය විමෝචනය සමඟ තිබේද? - නැත, තාපය පමණක් ජනනය වේ. එබැවින් ඔක්සිකරණය සෑම විටම පිළිස්සීම සමඟ සිදු නොවේ. නමුත්, නීතියක් ලෙස, සියලු දහන ක්රියාවලීන් ඔක්සිකරණය වේ.
ඔක්සිජන් නොමැතිව දැවීම හා ඔක්සිකරණය සිදුවිය හැකිද? ඔක්සිකරණය වන පරමාණුවට ඔක්සිජන් පරමාණුවට එහි සංයුජතා ඉලෙක්ට්රෝන ලබා දිය යුතු නොවේ. ඉතා පහසුවෙන් මෙය වෙනත් මූලද්රව්ය සමඟ සිදු වේ. 12 වන පිටුවේ විස්තර කර ඇති අත්දැකීම් වෙත නැවත යමු. තඹ සල්ෆේට් ද්රාවණයක අප ගිලී යන යකඩ යනු ශුන්ය සංයුජතාවයකින් යුත් සරල ද්රව්යයකි. යකඩ තඹට වඩා ක්රියාකාරී වන අතර ද්රාවණයෙන් තඹ විස්ථාපනය කරයි. මෙම විස්ථාපන ප්රතික්රියා වලදී, යකඩ පරමාණුව තඹ පරමාණු 2 ඉලෙක්ට්රෝන අතහැර දමා සංයුජතාව + 2 ලබා ගනී. එබැවින් මෙහි ද යකඩ ඔක්සිකරණය වේ! තඹ පරමාණුව යකඩ පරමාණුවෙන් ඉලෙක්ට්රෝන 2 ක් ගෙන සංයුජතාව + 2 සිට ශුන්යයට වෙනස් කර ප්රතිෂ් .ාපනය වේ.
ඒ හා සමානව, සල්ෆර් සහ යකඩ අතර ප්රතික්රියාව සලකා බැලිය හැකිය (පිටුව 9). දෙකම ශුන්ය සංයුජතාව සහිත සරල ද්රව්ය වේ. ප්රතික්රියාවෙන් පසු යකඩ + 2 සහ සල්ෆර් - 2 වල සංයුජතාව යකඩ ඔක්සිකරණය වී සල්ෆර් යථා තත්ත්වයට පත් විය. සල්ෆර් සහ යකඩ අතර ප්රතික්රියාව තාපය හා ආලෝකය මුදා හැරීමත්, එනම් දහනයත් සමඟ ඔක්සිජන් එයට සහභාගී නොවුනත් මතක තබා ගන්න. මෙයින් අදහස් කරන්නේ ඔක්සිකරණය පමණක් නොව දහනය ද ඔක්සිජන් නොමැතිව සිදුවිය හැකි බවයි.
යකඩ මලකඩ සහ රන් හා රිදී නොකියන්නේ ඇයි? සියලුම ලෝහ වලින් යකඩ තාක්ෂණය හා එදිනෙදා ජීවිතයේදී බහුලව භාවිතා වේ. යකඩවල විශාල lack නතාවක් නම් එය පහසුවෙන් වාතයේ හා ජලයේ ඇති ඔක්සිජන් සමඟ සංයෝජනය වීමයි. මලකඩ ලෝහයේ මතුපිටට ලිහිල්ව බන්ධනය වී ඇති බැවින් එය පහසුවෙන් මකා දමා ඉසීමෙන් විශාල ලෝහ පාඩු සිදු වේ. ලෝහ විනාශ කිරීමේ මලකඩ හා ඒ හා සමාන ක්රියාවලීන් කොරෝසා සහ ඊ ලෙස හැඳින්වේ.
ලොව පුරා විඛාදනය හේතුවෙන් වසරකට ලෝහ ටොන් මිලියන 30 කට වඩා අහිමි වන බව ගණන් බලා තිබේ. මෙය සැබෑ ව්යසනයකි. එබැවින් රසායන ists යින් සහ භෞතික විද්යා ists යින් විඛාදනයට එරෙහිව සටන් කිරීමට වෙහෙස මහන්සි වී වැඩ කරති.
මලකඩ යනු ජලීය ෆෙරස් ඔක්සයිඩ් Fe (OH) g, යකඩ ඔක්සයිඩ් Fe203, පරිමාණ Pe304 සහ තවත් ද්රව්ය කිහිපයක මිශ්රණයකි. අඩු උෂ්ණත්වයකදී යකඩ ඔක්සිකරණය වී ඇති බව එහි සැලකිය යුතු රසායනික ක්රියාකාරිත්වය මගින් පැහැදිලි කෙරේ.
රිදී, රත්රන්, ප්ලැටිනම් සහ වෙනත් වටිනා ලෝහ තවත් දෙයක්. ඔවුන්ගේ ක්රියාකාරිත්වය ඉතා කුඩා ය. ඒවායේ පරමාණුවල න්යෂ්ටීන් සංයුජතා ඉලෙක්ට්රෝන රඳවා තබා ගන්නා අතර එම නිසා ඔක්සිකරණය වීම දුෂ්කර ය. මෙම ලෝහවල සංයෝග බිඳෙනසුලු වන අතර නිදහස් ලෝහ මුදා හැරීමත් සමඟ ඒවා පහසුවෙන් දිරාපත් වේ. උදාහරණයක් ලෙස ක්ලෝරයිඩ් සහ මෙතිල් රිදී ආලෝකයේ දිරාපත් වේ. සමස්ත ඡායාරූප-සිනමා කර්මාන්තය මෙම ප්රතික්රියාව මත පදනම් වේ.
රිදී ලවණවල අස්ථාවරත්වය රසවත් අත්දැකීමකින් සනාථ කළ හැකිය. වීදුරුවක අපි ඇමෝනියා (මෙය ඇමෝනියා වල ජලීය ද්රාවණයකි) අංශක 50-60 දක්වා රත් කර මිශ්ර කරන අතරතුර ලයිපිස් (රිදී නයිට්රේට්) ද්රාවණයක බින්දු කිහිපයක් වත් කරන්නෙමු. ඉන්පසු ෆෝමලීන් බින්දු කිහිපයක් හෝ මිදි සීනි ද්රාවණයක් එක් කරන්න - ග්ලූකෝස්. මිනිත්තු කිහිපයකට පසු, කුසලානෙහි බිත්ති මත රිදී කැඩපතක් සාදනු ලබන අතර, විසඳුමේ අඳුරු අඳුරු බවක් දිස් වේ. ෆෝමලින් හෝ ග්ලූකෝස් එහි ලුණු වලින් රිදී නැවත ලබා ගනී. මෙම ප්රතික්රියාව දර්පණ සෑදීම සඳහා යොදා ගනී.
ඉතින්, අපි වාතයේ සංයුතිය ගැන දැන හඳුනා ගත් අතර සොබාදහමේ ඔක්සිජන් වල විශේෂ කාර්යභාරය සටහන් කළෙමු. නමුත් ඔක්සිජන් සම්බන්ධ බොහෝ ප්රතික්රියා බොහෝ වෙනස් ආකාරයකින් සිදුවනු ඇති අතර, වෙනත් ද්රව්යවලට නිරාවරණය වන විට ජලය ඔක්සිජන් ආධාරයට නොපැමිණියේ නම් සමහර ඒවා සිදු නොවනු ඇත. ජලය, ඔක්සිජන් මෙන් සොබාදහමේ දැවැන්ත කාර්යභාරයක් ඉටු කරන අතර ඉතා වැදගත් ගුණාංග රාශියක් ඇත. අපි ඊළඟ කොටසින් ඒවා දෙස බලමු.


 ලිට්මස් පරීක්ෂණය - pH අගය මැනීම
ලිට්මස් පරීක්ෂණය - pH අගය මැනීම මීටර කියවීම යවන්න
මීටර කියවීම යවන්න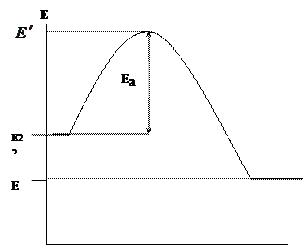 දහන ක්රියාවලීන්ගේ භෞතික රසායනික පදනම්
දහන ක්රියාවලීන්ගේ භෞතික රසායනික පදනම්