ස්වාභාවික වායුව දහනය කිරීමේ ක්රම. ස්වාභාවික වායුව. දැවෙන ක්රියාවලිය
8.1. දැවෙන ප්රතික්රියා
සාමාන්යයෙන්, දහනය කළ හැකි සං components ටක ඔක්සිජන් සමඟ සංයෝජනය කිරීමේ වේගවත් රසායනික ප්රතික්රියාවක් සමඟ දැඩි තාප මුදා හැරීමක් සහ දහන නිෂ්පාදනවල උෂ්ණත්වයෙහි තියුණු වැඩිවීමක් සිදු වේ. දහනය කිරීමේ ප්රතික්රියා ඊනියා විසින් විස්තර කෙරේ. ගුණාත්මකව හා ප්රමාණාත්මකව ප්රතික්රියා කරන සහ එහි ද්රව්යයේ ප්රති ing ලයක් ලෙස නිරූපණය කරන ස්ටොයිකොමිතික සමීකරණ (දහනය කළ හැකි මිශ්රණයේ ස්ටොයිකියෝමිතික සංයුතිය (ග්රීක භාෂාවෙන්. ස්ටොයිචියන් - පදනම, මූලද්රව්යය සහ ග්රීක. මෙට්රියෝ - මනින ලද) - මිශ්රණයේ සංයුතිය, ඔක්සිකාරකය ඉන්ධන සම්පූර්ණ ඔක්සිකරණය සඳහා අවශ්ය තරම්ම අවශ්ය වේ). ඕනෑම හයිඩ්රොකාබනයක දහනයේ ප්රතික්රියාවේ සාමාන්ය සමීකරණය
C m H n + (m + n / 4) O 2 = mCO 2 + (n / 2) H 2 O + Q (8.1)
m, n යනු අණුවේ ඇති කාබන් සහ හයිඩ්රජන් පරමාණු ගණන; Q යනු ප්රතික්රියාවේ තාප බලපෑම හෝ දහනයේ තාපයයි.
සමහර වායූන්ගේ දහන ප්රතික්රියාව වගුවේ දක්වා ඇත. 8.1. මෙම සමීකරණ සමතුලිත වන අතර ඒවායින් ප්රතික්රියා අනුපාතය හෝ රසායනික පරිණාමනයේ යාන්ත්රණය විනිශ්චය කළ නොහැකිය.
වගුව 8.1. දහන ප්රතික්රියාව සහ වියළි වායූන් දහනය කිරීමේ තාපය (0 ° C සහ 101.3 kPa දී)
| ගෑස් | දැවෙන ප්රතික්රියාව | දහනයේ උණුසුම | |||||
|---|---|---|---|---|---|---|---|
| මෝලර්, kJ / kmol | ස්කන්ධය, kJ / kg | පරිමාව, kJ / m 3 | |||||
| ඉහළ | පහළ | ඉහළ | පහළ | ඉහළ | පහළ | ||
| හයිඩ්රජන් | H 2 + 0.5O 2 = H 2 0 | 286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| කාබන් මොනොක්සයිඩ් | CO + 0.5O 2 = CO 2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| මීතේන් | CH 4 + 2O 2 = CO 2 + 2H 2 O. | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| ඊතන් | C 2 H 6 + 0.5O 2 = 2CO 2 + 3H 2 O. | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| ප්රොපේන් | C 3 H 8 + 5H 2 O = 3CO 2 + 4H 2 O. | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| n- බියුටේන් | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 | |
| අයිසොබුටේන් | C 4 H 10 + 6.5O 2 = 4CO 2 + 5H 2 O. | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| n- පෙන්ටේන් | C 5 H 12 + 8O 2 = 5CO 2 + 6H 2 O. | 3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| එතිලීන් | C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O. | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| ප්රොපිලීන් | C 3 H 6 + 4,5O 2 = 3CO 2 + 3H 2 O. | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| බියුටිලීන් | C 4 H 8 + 6O 2 = 4CO 2 + 4H 2 O. | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
T epl ov o e f f e k t (දහනයේ තාපය) Q යනු සාමාන්ය භෞතික තත්වයන් යටතේ කිලෝමීටර 1 ක්, කිලෝග්රෑම් 1 ක් හෝ 1 m 3 වායුවක් සම්පූර්ණ දහනය කිරීමේදී නිකුත් වන තාප ප්රමාණයයි. ඉහළ Q හා අඩු Q n කැලරි අගය වෙන්කර හඳුනා ගන්න: දහනය කිරීමේ ක්රියාවලියේදී ජල වාෂ්ප cond නීභවනය වීමේ තාපය ඉහළ කැලරි අගයට ඇතුළත් වේ (යථාර්ථයේ දී, වායුව දහනය කරන විට ජල වාෂ්ප ense නීභවනය නොවන නමුත් දහනය කිරීමේ වෙනත් නිෂ්පාදන සමඟ ඉවත් කරනු ලැබේ). සාමාන්යයෙන් තාක්ෂණික ගණනය කිරීම් සිදු කරනු ලබන්නේ ජල වාෂ්ප (≈ 2400 kJ / kg) cond නීභවනයේ තාපය සැලකිල්ලට නොගෙන දහනයේ අවම තාපය මත ය.
අඩු කැලරි වටිනාකම මත ගණනය කරන ලද කාර්යක්ෂමතාව විධිමත් ලෙස ඉහළ ය, නමුත් ජල වාෂ්ප cond නීභවනයේ තාපය ප්රමාණවත් තරම් විශාල වන අතර එහි භාවිතය සාධාරණත්වයට වඩා වැඩි ය. තාපන තාක්ෂණය සඳහා ස්පර්ශ තාපන හුවමාරුකාරක සක්රීයව භාවිතා කිරීමෙන් මෙය සනාථ වේ.
දහනය කළ හැකි වායූන් මිශ්රණයක් සඳහා, වායූන් දහනය කිරීමේ ඉහළම (හා අඩුම) තාපය අනුපාතය අනුව තීරණය වේ
Q = r 1 Q 1 + r 2 Q 2 + ... + r n Q n (8.2)
මෙහි r 1, r 2, ..., r n යනු මිශ්රණයේ ඇති සංරචකවල පරිමාව (මවුලය, ස්කන්ධය) වේ; Q 1, Q 2, ..., Q n - සංරචක දහනය කිරීමේ තාපය.
මේසය භාවිතා කිරීම. 8.1, සංකීර්ණ වායුවක ඉහළම හා අඩු කැලරි අගය වන kJ / m 3 පහත සඳහන් සූත්ර මගින් තීරණය කළ හැකිය:
Q в = 127.5 Н 2 + 126.4 СО + 398 СН 4 + 703 С 2 Н 6 + 1012 С 8 Н 8 + 1338 C 4 H 10 + 1329 C 4 H 10 +
+ 1693 සී 5 එච් 12 + 630 සී 2 එච් 4 + 919 සී 3 එච් 6 + 1214 සී 4 එච් 8 (8.3)
Q n = 107.9 H 2 + 126.4 CO + 358.8 CH 4 + 643 C 2 H 6 + 931.8 C 8 H 8 + 1235 C 4 H 10 + 1227 C 4 H 10 +
+ 1566 සී 5 එච් 12 + 595 සී 2 එච් 4 + 884 සී 8 එච් 6 + 1138 සී 4 එච් 8 (8.4)
එහිදී H 2, CO, CH 4, ආදිය. - ගෑස් ඉන්ධන වල තනි සංරචකවල අන්තර්ගතය, ගැන. %
සූත්රයට (8.1) අනුව දහන ක්රියාවලිය වඩා සංකීර්ණ ය, අතු දම්වැල් සමඟ, ඉහළ උෂ්ණත්වයේ දී තවදුරටත් පරිවර්තනයට භාජනය වන අතරමැදි ස්ථායී සංයෝග සෑදීම නිසා ඒවා කැඩී යයි. ප්රමාණවත් ඔක්සිජන් සාන්ද්රණයක දී අවසාන නිෂ්පාදන සාදනු ලැබේ: ජල වාෂ්ප H 2 O සහ කාබන් ඩයොක්සයිඩ් CO 2. ඔක්සිකාරක කාරකයක් නොමැතිකම මෙන්ම ප්රතික්රියා කලාපය සිසිල් කිරීමත් සමඟ අතරමැදි සංයෝගවලට ස්ථාවර වී පරිසරයට ඇතුළු විය හැකිය.
තාප උත්පාදනයේ තීව්රතාවය සහ උෂ්ණත්වය ඉහළ යාම ප්රතික්රියා පද්ධතියේ ක්රියාකාරී අංශු වැඩි වීමට හේතු වේ. දාම ප්රතික්රියා සහ උෂ්ණත්වයේ මෙම අන්තර් සම්බන්ධතාවය, දහන තාප පිපිරීමේ සංකල්පය හඳුන්වාදීමට තුඩු දුන්නේය - රසායනික දහන ප්රතික්රියා වල දාම ලක්ෂණයක් ඇති අතර ඒවායේ ත්වරණය සිදුවන්නේ තාප මුදා හැරීම සහ ප්රතික්රියා පද්ධතියේ උෂ්ණත්වය ඉහළ යාම හේතුවෙනි.
සමජාතීය මිශ්රණයක රසායනික ප්රතික්රියාවක වේගය ප්රතික්රියා කරන ද්රව්යවල සාන්ද්රණයේ නිෂ්පාදනයට සමානුපාතික වේ:
w = kС 1 С 2 (8.5)
С 1 සහ С 2 - ප්රතික්රියා කරන සංරචකවල සාන්ද්රණය, kmol / m 3; k යනු ප්රතික්රියාකාරකවල ස්වභාවය සහ උෂ්ණත්වය අනුව ප්රතික්රියා අනුපාත නියතයයි.
වායුවක් දහනය කරන විට, ප්රතික්රියාකාරකවල සාන්ද්රණය නොවෙනස්ව සැලකිය හැකිය, මන්දයත් දහන කලාපයේ නොපැහැදිලි සංයුතියේ නැවුම් සංරචක අඛණ්ඩව ගලා ඒමයි.
ප්රතික්රියා අනුපාත නියතය (අර්හීනියස් සමීකරණයට අනුව):
K = K 0 e -E / RT (8.6)
K 0 යනු ජෛවමිතික සමජාතීය මිශ්රණ සඳහා පිළිගත් පූර්ව-සාධකය සාධකය වන .01.0; - සක්රිය ශක්තිය, kJ / kmol; R යනු විශ්වීය වායු නියතය, J / (kg K); T යනු නිරපේක්ෂ උෂ්ණත්වය, K (° C); e - ස්වාභාවික ල ar ු ගණකයේ පදනම.
පූර්ව on ාතීය සාධකය K 0 අණු වල ision ට්ටනයේ සම්පූර්ණත්වය පිළිබිඹු කරන නියතයක් ලෙස අර්ථ දැක්විය හැකි අතර, අණු වල බන්ධන බිඳීමේ අවම ශක්තිය ලෙස E හා isions ට්ටනයේ effectiveness ලදායී බව සහතික කරන ක්රියාකාරී අංශු සෑදීම. පොදු දහනය කළ හැකි මිශ්රණ සඳහා එය (80 ÷ 150) 10 3 kJ / kmol තුළ වේ.
සමීකරණය (8.6) පෙන්නුම් කරන්නේ උෂ්ණත්වය ඉහළ යාමත් සමඟ රසායනික ප්රතික්රියා අනුපාතය නාටකාකාර ලෙස ඉහළ යන බවයි: නිදසුනක් ලෙස, උෂ්ණත්වය 500 සිට 1000 K දක්වා වැඩි කිරීමෙන් දැවෙන ප්රතික්රියාව 2 10 4 ÷ 5 10 8 ගුණයකින් වැඩි වේ (සක්රිය ශක්තිය මත පදනම්ව).
දහන ප්රතික්රියා වල වේගය ඒවායේ දාම ස්වභාවය අනුව බලපායි. ප්රතික්රියාවෙන් මුලින් ජනනය වූ පරමාණු සහ රැඩිකලුන් ආරම්භක ද්රව්ය හා ඒවා අතර සංයෝගවලට ඇතුළු වී අවසාන නිෂ්පාදන හා නව අංශු සාදමින් එකම ප්රතික්රියා දාමයක් පුනරාවර්තනය කරයි. එවැනි අංශුවල වැඩිවන පරම්පරාව රසායනික ප්රතික්රියා “ත්වරණය” කරා යොමු කරයි - ඇත්ත වශයෙන්ම සමස්ත මිශ්රණයේ පිපිරීමක්.
හයිඩ්රොකාබනවල අධික උෂ්ණත්ව දහනය සංකීර්ණ වන අතර එය පරමාණු හා රැඩිකලුන්ගේ ස්වරූපයෙන් ක්රියාකාරී අංශු සෑදීම හා අතරමැදි අණුක සංයෝග සමඟ සම්බන්ධ වේ. උදාහරණයක් ලෙස, සරලම හයිඩ්රොකාබනයේ දහන ප්රතික්රියාව - මීතේන්:
- H + O 2 - ›OH + O.
4 + ОН - 3 + Н 2
4 + О - ›СН 2 + Н 2 - 3 + О 2 - ›+
2 + О 2 - ›+ - + - ›+ Н 2
NSNO + O - ›CO + H 2 O.
NSO + O 2 - ›CO + O + OH - CO + O - ›CO 2
CO + HE - ›CO 2 + H.
තනි චක්රයක ප්රති ult ලය:
2СН 4 + 4О 2 - ›2СО 2 + 4Н 2
8.2. ගණනය කිරීම් දහනය කිරීම
දහනය සඳහා ඔක්සිජන් එහි කොටසක් ලෙස වාතයෙන් පැමිණේ. ගණනය කිරීම් සඳහා, වියළි වායු පරිමාවේ සංයුතිය පහත පරිදි වේ යැයි උපකල්පනය කෙරේ:
ඔක්සිජන් - 21.0%, නයිට්රජන් - 79.0%.
ලබා දී ඇති තොරතුරු වලට අනුව, ඔක්සිජන් 1 m 3 වාතයේ 100/21 = 4.76 m 3 හෝ ඔක්සිජන් 1 m 3 ට නයිට්රජන් 79/21 = 3.76 m 3 අඩංගු වේ. සාමාන්ය තත්වයන් යටතේ කිලෝමීටර 1 ක වායුවක් ලීටර් 22.4 ක පරිමාවක් ගන්නා බව සලකන විට, වාතයේ ඇති ඕනෑම හයිඩ්රොකාබනයක දහන ප්රතික්රියාව (8.1 සමීකරණය බලන්න) සාමාන්ය ස්වරූපයෙන් ලිවිය හැකිය:
C m H n + (t + n / 4) (O 2 + 3.76N 2) = tCO 2 + (n / 2) H 2 O + (t + n / 4) 3.76N 2
ඉහත දහන ප්රතික්රියා වලින් ගණනය කරන ලද විවිධ වායූන් දහනය කිරීමේදී ඔක්සිජන් හා වාතය සඳහා වන අවශ්යතා වගුවේ දක්වා ඇත. 8.2.
වගුව 8.2. වියළි ඔක්සිජන් හා වාතය සඳහා න්යායාත්මක අවශ්යතාවය, m 3, සහ 1 m 3 වායුව දහනය කිරීමේදී වායු දහන නිෂ්පාදන පරිමාව
| ගෑස් | න්යායාත්මක අවශ්යතාවය | දහන නිෂ්පාදන | ||||
|---|---|---|---|---|---|---|
| ඔක්සිජන් | වාතයේ | කාබන් ඩයොක්සයිඩ් | ජල වාෂ්ප | නයිට්රජන් | එකතුව | |
| හයිඩ්රජන් එච් 2 | 0,5 | 2,38 | – | 1,0 | 1,88 | 2,88 |
| කාබන් මොනොක්සයිඩ් CO | 0,5 | 2,38 | 1,0 | – | 1,88 | 2,88 |
| මීතේන් සීඑච් 4 | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| ඊතන් සී 2 එච් 6 | 3,5 | 16,66 | 2,0 | 3,0 | 13,16 | 18,16 |
| ප්රොපේන් සී 3 එච් 8 | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| බියුටේන් සී 4 එච් 10 | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| පෙන්ටේන් සී 5 එච් 12 | 8,0 | 38,08 | 5,0 | 6,0 | 30,08 | 41,08 |
| එතිලීන් සී 2 එච් 4 | 3,0 | 14,28 | 2,0 | 2,0 | 11,28 | 15,28 |
| ප්රොපිලීන් සී 3 එච් 6 | 4,5 | 21,42 | 3,0 | 3,0 | 16,92 | 22,92 |
| බියුටිලීන් සී 4 එච් 8 | 6,0 | 28,56 | 4,0 | 4,0 | 22,56 | 30,56 |
| පෙන්ටයිල් සී 5 එච් 10 | 7,5 | 35,70 | 5,0 | 5,0 | 28,20 | 38,20 |
| ඇසිටිලීන් සී 2 එච් 2 | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
සංකීර්ණ වායුව සඳහා, වියළි වාතයේ ප්රවාහ අනුපාතය V c, m 3 / m 3 ගණනය කරනු ලබන්නේ මිශ්රණයේ තනි කොටස්වල ඔක්සිජන් ඉල්ලුම සැලකිල්ලට ගන්නා සූත්රයෙනි:
V c = 4.76 / 100 (0.5H 2 + 0.5SO + 2CH 4 + 3.5С 2 H 6 + 5С 3 H 8 + 6.5 С 4 Н 10 + 3С 2 H 4 + 4.5 С 3 N. 6 + 6C 4 H 8 -O 2) (8.7)
තෙතමනය සහිත වාතයේ න්යායාත්මක ප්රවාහ අනුපාතය Vl, m 3 / m 3, අඩංගු ජල වාෂ්ප පරිමාව සඳහා (8.7) සූත්රය මගින් තීරණය කරනු ලැබේ:
Vl = V සමඟ + 0,001244d සමඟ V සමඟ (8.8)
එහිදී d - ආර්ද්රතාවය, g / m 3.
වායූන්ගේ නොදන්නා රසායනික සංයුතියකින්, නමුත් දන්නා අඩු උනුසුම් අගය Q n, kJ / m 3, න්යායාත්මක වායු ප්රවාහ V t, m 3 / m 3,
V t Q n / 3770(8.9)
සැබෑ වායු ප්රවාහ අනුපාතය V f, m 3 / m 3, සෑම විටම තරමක් විශාල ලෙස ගනු ලැබේ:
V Fe = V t α (8.10)
එහිදී α - GOST හි අවශ්යතා සපුරාලන අතිරික්ත වාතයේ සංගුණකය. ඉන්ධන සම්පූර්ණයෙන් දහනය කිරීම සඳහා α හි අගය 1 ට වඩා වැඩි විය යුතුය. වියළි වාතයේ ඇති සමහර වායූන්ගේ දහන ප්රතික්රියා වලින් ගණනය කරන ලද දහන නිෂ්පාදනවල සංයුතිය හා පරිමාව වගුවේ දක්වා ඇත. 8.2.
8.3. දැවෙන උෂ්ණත්වය
තාප ඉංජිනේරු විද්යාවේදී, පහත දැක්වෙන ගෑස් දැවෙන උෂ්ණත්වය වෙනස් වේ: තාප නිෂ්පාදනය, කැලරිමිතික, න්යායාත්මක සහ තාත්වික (ගණනය කළ). තාප produc ලදායිතාව t W - අතිරික්ත වායු සංගුණකය α = 1.0 සහ 0 ° C ට සමාන වායු හා වායු උෂ්ණත්වයකදී ඇඩියබැටික් තත්වයන් තුළ සම්පූර්ණ වායුව දහනය කිරීමේ නිෂ්පාදනවල උපරිම උෂ්ණත්වය:
t ж = Q n / (∑Vc p) (8.11)
එහිදී Q n - වායුවේ ශුද්ධ කැලරි වටිනාකම, kJ / m 3; CVc p යනු 1 m 3 වායුව (m 3 / m 3) දහනය කිරීමේදී සාදන ලද කාබන් ඩයොක්සයිඩ්, ජල වාෂ්ප හා නයිට්රජන් පරිමාවන්ගේ නිෂ්පාදනවල එකතුව හා ඒවායේ සාමාන්ය පරිමාමිතික තාප ධාරිතාව 0 ° from සිට t the (kJ / (m 3 o ° C).
වායූන්ගේ තාප ධාරිතාවේ නොගැලපීම හේතුවෙන්, තාප ප්රතිදානය තීරණය කරනු ලබන්නේ අනුක්රමික ඇස්තමේන්තු කිරීමේ ක්රමයෙනි. ආරම්භක පරාමිතියක් ලෙස, ස්වාභාවික වායුව සඳහා එහි වටිනාකම (≈2000 ° С) ගනු ලැබේ, α = 1.0 සමඟ, දහන නිෂ්පාදනවල සංරචක පරිමාව තීරණය කරනු ලැබේ, වගුව අනුව. 8.3, ඒවායේ සාමාන්ය තාප ධාරිතාව සොයා ගන්නා අතර, පසුව (8.11) සූත්රයට අනුව වායුවේ තාප ප්රතිදානය සැලකේ. ගණනය කිරීමේ ප්රති result ලයක් ලෙස, එය දරුකමට හදාගත් ඒවාට වඩා අඩු හෝ වැඩි නම්, තවත් උෂ්ණත්වයක් සකසා ගණනය කිරීම නැවත සිදු වේ.
වගුව 8.3. වායූන්ගේ සාමාන්ය පරිමාමිතික තාප ධාරිතාව, kJ / (m 3 С)
උෂ්ණත්වය, ° |
CO 2 | එන් 2 | ඕ 2 | CO | සීඑච් 4 | එච් 2 | එච් 2 ඕ (ජල වාෂ්ප) | වාතය | |
|---|---|---|---|---|---|---|---|---|---|
| වියළි | 1 m 3 දී තෙත් වේ වියළි වායුව |
||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
පොදු සරල හා සංකීර්ණ වායූන් වියළි වාතය තුළ දහනය කරන විට ඒවායේ තාප produc ලදායිතාව වගුවේ දක්වා ඇත. 8.4. වායුගෝලීය වාතයේ වායුව දහනය කරන විට, වොට් 1 ක් පමණ අඩංගු වේ. % තෙතමනය, තාප ප්රතිදානය 25-30 by C කින් අඩු වේ.
වගුව 8.4. වියළි වාතය තුළ වායූන් උණුසුම් කිරීම
| සරල වායුව | තාප produc ලදායිතාව ,. | දුෂ්කර වායුව සාමාන්ය සංයුතිය |
ආසන්න තාප ප්රතිදානය ,. C. |
|---|---|---|---|
| හයිඩ්රජන් | 2235 | ස්වාභාවික වායු ක්ෂේත්ර |
2040 |
| කාබන් මොනොක්සයිඩ් | 2370 | ස්වාභාවික තෙල් බිම් |
2080 |
| මීතේන් | 2043 | කෝක් |
2120 |
| ඊතන් | 2097 | ෂේල් හි අධික උෂ්ණත්ව ආසවනය |
1980 |
| ප්රොපේන් | 2110 | පීඩනය යටතේ වාෂ්ප-ඔක්සිජන් පිපිරීම |
2050 |
| භූතානය | 2118 | මේද ගල් අඟුරු වලින් ජනකය |
1750 |
| පෙන්ටේන් | 2119 | සිහින් ඉන්ධන වලින් උත්පාදක වායු වාෂ්ප පහර |
1670 |
| එතිලීන් | 2284 | ද්රව (50% С 3 Н 4 + 50% С 4 Н 10) |
2115 |
| ඇසිටිලීන් | 2620 | 2210 |
කැලරිමිතික දැවෙන උෂ්ණත්වය t සිට - උෂ්ණත්වය, ජල වාෂ්ප හා කාබන් ඩයොක්සයිඩ් වි diss ටනය සැලකිල්ලට නොගෙන තීරණය කරනු ලැබේ, නමුත් වායුවේ සහ වාතයේ සත්ය ආරම්භක උෂ්ණත්වය සැලකිල්ලට ගනී. එය තාප ප්රතිදානය t ට වඩා වෙනස් වන අතර වායුවේ හා වාතයේ උෂ්ණත්වය මෙන්ම අතිරික්ත වාතයේ සංගුණකය their ඒවායේ සත්ය අගයන් අනුව ගනු ලැබේ. සූත්රය විය හැකි බව තීරණය කරන්න:
t k = (Q n + q nat) / (ΣVc p) (8.12)
q nat යනු 0 ° from, kJ / m 3 සිට මනිනු ලබන වායුවේ සහ වාතයේ තාප අන්තර්ගතය (භෞතික තාපය) වේ.
ස්වාභාවික වායුව සහ ද්රව හයිඩ්රොකාබන් වායූන් දහනය කිරීමට පෙර සාමාන්යයෙන් රත් නොවන අතර දහනය වන වාතයේ පරිමාවට සාපේක්ෂව ඒවායේ පරිමාව කුඩා වේ. එබැවින් කැලරිමිතික උෂ්ණත්වය තීරණය කිරීමේදී වායූන්ගේ තාප අන්තර්ගතය නොසලකා හැරිය හැකිය. අඩු කැලරි වටිනාකමක් ඇති වායූන් දහනය කරන විට (උත්පාදක යන්ත්රය, පිපිරුම් aces ෂ්මක ආදිය), ඒවායේ තාප අන්තර්ගතය (විශේෂයෙන් දහනයට පෙර රත් කරනු ලැබේ) කැලරිමිතික උෂ්ණත්වයට ඉතා වැදගත් බලපෑමක් ඇති කරයි.
0 ° C උෂ්ණත්වයක් සහ අතිරික්ත වාතයේ සංගුණකයෙන් 1% ක ආර්ද්රතාවයක් සහිත වාතයේ සාමාන්ය සංයුතියක ස්වාභාවික වායුවේ කැලරිමිතික උෂ්ණත්වය රඳා පැවතීම වගුවේ දක්වා ඇත. 8.5, වියළි වාතය තුළ දහනය කරන විට ද්රව හයිඩ්රොකාබන් වායුව සඳහා - වගුවේ. 8.7. දත්ත වගුව. 8.5–8.7 අනෙකුත් ස්වාභාවික වායූන් දහනය කිරීමේ කැලරිමිතික උෂ්ණත්වය, සංයුතියට සාපේක්ෂව සමීපව සහ ප්රායෝගිකව ඕනෑම සංයුතියක හයිඩ්රොකාබන් වායූන් තීරණය කිරීමේදී ප්රමාණවත් නිරවද්යතාවයකින් යුතුව අනුගමනය කළ හැකිය. අතිරික්ත වාතයේ කුඩා සංගුණක සමඟ වායූන් දහනය කිරීමේදී ඉහළ උෂ්ණත්වයක් ලබා ගැනීමට අවශ්ය නම් මෙන්ම aces ෂ්මකවල කාර්යක්ෂමතාව වැඩි කිරීමට අවශ්ය නම්, ප්රායෝගිකව ඒවා වාතය උණුසුම් කරන අතර එය කැලරිමිතික උෂ්ණත්වය ඉහළ යාමට හේතු වේ (වගුව 8.6 බලන්න).
වගුව 8.5. අතිරික්ත වාතයේ සංගුණකය මත පදනම්ව t = 0 ° C හා ආර්ද්රතාවය 1% සමඟ වාතයේ ස්වාභාවික වායුව දහනය කිරීමේ කැලරිමිතික හා න්යායාත්මක උෂ්ණත්වය α
| න්යායාත්මක දැවෙන උෂ්ණත්වය t t, ° | අතිරික්ත වායු සංගුණකය α | කැලරිමිතික දැවෙන උෂ්ණත්වය t к, ° | ||
|---|---|---|---|---|
| 1,0 | 2010 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
වගුව 8.6. අතිරික්ත වියළි වාතයේ සංගුණකය සහ එහි උෂ්ණත්වය (වටකුරු අගයන්) මත පදනම්ව ස්වාභාවික වායුවේ කැලරිමිතික දැවෙන උෂ්ණත්වය t к, °
| අතිරික්ත වායු සංගුණකය α | වියළි වායු උෂ්ණත්වය, ° | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2015 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2010 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
වගුව 8.7. අතිරික්ත වාතයේ සංගුණකය මත පදනම්ව t = 0 ° C සහිත වියළි වාතයෙහි තාක්ෂණික ප්රොපේන් සිට කැලරිමිතික දැවෙන උෂ්ණත්වය t
| අතිරික්ත වායු සංගුණකය α | කැලරිමිතික දැවෙන උෂ්ණත්වය t к, ° | අතිරික්ත වායු සංගුණකය α | කැලරිමිතික දැවෙන උෂ්ණත්වය t к, ° |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2010 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
න්යායාත්මක දැවෙන උෂ්ණත්වය t T යනු කැලරිමිතික t K ට සමානව තීරණය වන උපරිම උෂ්ණත්වය වන නමුත් කාබන් ඩයොක්සයිඩ් හා ජල වාෂ්ප වි diss ටනය වීමේ එන්ඩොතෙරමික් (තාපය අවශ්ය) ප්රතික්රියා සඳහා සකස් කර ඇති අතර එය පරිමාව වැඩි වීමක් කරා ළඟා වේ:
CO 2 ‹-› CO + 0.5O 2 - 283 mJ / mol (8.13)
H 2 O ‹-› H 2 + 0.5O 2 - 242 mJ / mol (8.14)
ඉහළ උෂ්ණත්වවලදී, වි ociation ටනය පරමාණුක හයිඩ්රජන්, ඔක්සිජන් සහ OH හයිඩ්රොක්සයිල් කාණ්ඩ ඇතිවීමට හේතු වේ. ඊට අමතරව, වායුව දහනය කිරීමේදී, නයිට්රික් ඔක්සයිඩ් යම් ප්රමාණයක් සෑම විටම සෑදී ඇත. මෙම සියලු ප්රතික්රියා එන්ඩොතෙරමික් වන අතර දහන උෂ්ණත්වය අඩු වීමට හේතු වේ.
න්යායාත්මක දැවෙන උෂ්ණත්වය පහත සූත්රයෙන් තීරණය කළ හැකිය:
t T = (Q n + q fiz - q dis) / (ΣVc p) (8.15)
q dis - දහන නිෂ්පාදනවල CO 2 සහ H 2 O හි තාප වි ociation ටනයේ මුළු පිරිවැය, kJ / m 3; CVc p - වායුවේ 1 m 3 ට වි ociation ටනය සම්බන්ධයෙන් පරිමාවේ නිෂ්පාදනයේ එකතුව සහ දහන නිෂ්පාදනවල සාමාන්ය තාප ධාරිතාව.
වගුව 8.8. අර්ධ පීඩනය මත පදනම්ව ජල වාෂ්ප H 2 O සහ කාබන් ඩයොක්සයිඩ් CO 2 වි diss ටනය වීමේ උපාධිය
| උෂ්ණත්වය, ° | අර්ධ පීඩනය, MPa | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| ජල වාෂ්ප H 2 O. | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| කාබන් ඩයොක්සයිඩ් CO 2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 | |
මේසයෙන් දැකිය හැකි පරිදි. 8.8, 1600 to C දක්වා උෂ්ණත්වවලදී, වි ociation ටනයේ මට්ටම නොසලකා හැරිය හැකි අතර න්යායාත්මක දහන උෂ්ණත්වය කැලරිමිතිකයට සමාන යැයි ගත හැකිය. ඉහළ උෂ්ණත්වවලදී, වි ociation ටනය වීමේ උපාධිය වැඩ කරන අවකාශයේ උෂ්ණත්වය සැලකිය යුතු ලෙස අඩු කළ හැකිය. ප්රායෝගිකව, මේ සඳහා විශේෂ අවශ්යතාවයක් නොමැත, න්යායාත්මක දැවෙන උෂ්ණත්වය තීරණය කළ යුත්තේ පූර්ව රත් වූ වාතය මත ක්රියා කරන ඉහළ උෂ්ණත්ව aces ෂ්මක සඳහා පමණි (නිදසුනක් ලෙස, විවෘත-උදුන aces ෂ්මක). බොයිලේරු පැල සඳහා මෙය අවශ්ය නොවේ.
වගුව 8.9. උපරිම
උෂ්ණත්වය පැන නගී
නිදහස් ගින්නෙන්, °
දහන නිෂ්පාදනවල තථ්ය (ගණනය කළ) උෂ්ණත්වය t d - විදුලි පන්දමේ උණුසුම්ම ස්ථානයේ සැබෑ තත්වයන් යටතේ ලබා ගන්නා උෂ්ණත්වය. එය න්යායාත්මකව වඩා අඩු වන අතර පරිසරයට සිදුවන තාප අලාභය, විකිරණ මගින් දහන කලාපයෙන් තාපය මුදා හැරීමේ ප්රමාණය, කාලයත් සමඟ දහන ක්රියාවලියේ දිග ආදිය මත රඳා පවතී. පර්යේෂණාත්මකව ස්ථාපිත නිවැරදි කිරීමේ සාධක හඳුන්වාදීමත් සමඟ aces ෂ්මකවල උෂ්ණත්වය මත:
t d = t t η (8.16)
මෙහි යනු ඊනියා ය පයිෙරොමෙට්රික් සංගුණකය, සීමාවන් තුළ:
- තාප පරිවරණය සහිත උසස් තත්ත්වයේ තාප හා උනුසුම් aces ෂ්මක සඳහා - 0.75-0.85;
- තාප පරිවරණයකින් තොරව මුද්රා තැබූ aces ෂ්මක සඳහා - 0.70-0.75;
- ආවරණ සහිත බොයිලේරු aces ෂ්මක සඳහා - 0.60–0.75.
ප්රායෝගිකව, යමෙකු ඉහත ඇඩියබැටික් දහන උෂ්ණත්වය පමණක් නොව, ගින්නෙන් සිදුවන උපරිම උෂ්ණත්වය ද දැන සිටිය යුතුය. ඒවායේ ආසන්න අගයන් සාමාන්යයෙන් වර්ණාවලීක්ෂන ක්රම මගින් පර්යේෂණාත්මකව ස්ථාපිත කර ඇත. කේතුකාකාර දහන ඉදිරිපස මුදුනේ සිට මි.මී. 5-10 ක් දුරින් නිදහස් දැල්ලක සිදුවන උපරිම උෂ්ණත්වය වගුවේ දක්වා ඇත. 8.9. දත්ත විශ්ලේෂණයෙන් පෙන්නුම් කරන්නේ දැල්ලේ උපරිම උෂ්ණත්වය තාප ප්රතිදානයට වඩා අඩු බවයි (H 2 O සහ CO 2 වි ociation ටනය සඳහා තාප පිරිවැය සහ ගිනි කලාපයෙන් තාපය ඉවත් කිරීම හේතුවෙන්).
8.4. ස්වයං තොරතුරු ලබා ගැනීමේ උෂ්ණත්වය
දහන ප්රතික්රියා ආරම්භ කිරීම සඳහා ඉන්ධන / ඔක්සිකාරක මිශ්රණයේ ජ්වලන කොන්දේසි අවශ්ය වේ. ජ්වලනය ස්වයංසිද්ධව හා බලහත්කාරයෙන් (ජ්වලනය) විය හැකිය.
ස්වයංක්රීය උෂ්ණත්වය - වායුවේ අංශු දහනය කිරීමෙන් තාපය මුදා හැරීම හේතුවෙන් රත් වූ වායු-වායු මිශ්රණයකින් ස්වයංසිද්ධ (එනම් බාහිර තාප සැපයුමකින් තොරව) දහනය කිරීමේ ක්රියාවලිය ආරම්භ වන අවම උෂ්ණත්වය.
ස්වයංක්රීය ජ්වලන උෂ්ණත්වය දී ඇති වායුවක් සඳහා සවි කර නොමැති අතර බොහෝ පරාමිතීන් මත රඳා පවතී: වායු-වායු මිශ්රණයේ එහි අන්තර්ගතය, මිශ්රණයේ සමජාතීයතාවයේ ප්රමාණය, මිශ්රණය රත් වන යාත්රාවේ හැඩය සහ ප්රමාණය, එහි වේගය හා උනුසුම් ක්රමය, යාත්රා බිත්තිවල උත්ප්රේරක බලපෑම, පීඩනය යටතේ ඇති පීඩනය මිශ්රණය. මෙම සාධක නිවැරදිව සලකා බැලීම ඉතා අපහසුය, එබැවින් ප්රායෝගිකව, පිපිරුම් අවදානම තක්සේරු කිරීමේදී, පර්යේෂණාත්මක දත්ත භාවිතා කරන්න (වගුව 8.10 බලන්න).
වගුව 8.10. වායුගෝලීය පීඩනයේදී වාතය සමඟ මිශ්ර වූ ඇතැම් වායූන් හා වාෂ්ප වල අවම මනිනු ලබන ස්වයංක්රීය ජ්වලන උෂ්ණත්වය.
ඔක්සිජන් තුළ දැවෙන වායූන්ගේ ස්වයං ජ්වලන උෂ්ණත්වය වාතයට වඩා තරමක් අඩුය. බැලස්ට් අපද්රව්ය (නයිට්රජන් සහ කාබන් ඩයොක්සයිඩ්) වල වායූන්ගේ සංයුතිය හඳුන්වාදීම ස්වයංක්රීයව ජ්වලන උෂ්ණත්වය ඉහළ යාමට හේතු වේ. සංකීර්ණ වායූන් තුළ අඩු ස්වයං-ජ්වලන උෂ්ණත්වයක් සහිත සංරචක පැවතීම මිශ්රණයේ ස්වයංක්රීය ජ්වලන උෂ්ණත්වය අඩු වීමට හේතු වේ.
බලහත්කාරයෙන් ජ්වලනය (ජ්වලනය) සිදු කරනුයේ ඉහළ උෂ්ණත්ව ප්රභවයක් මගින් මිශ්රණය එකකින් හෝ කිහිපයකින් ජ්වලනය කිරීමෙනි - විවෘත දැල්ලක් හෝ විදුලි ගිනි පුපුරක් දහනය කරන්නන්ගේ ගිනි නාලිකා වලින් උදුන පරිමාවට පිටවන ස්ථානයේ. ජ්වලනය ස්වයං ජ්වලනයට වඩා වෙනස් වන්නේ දහනය කළ හැකි මිශ්රණය මුළු පරිමාවේම දැල්ලේ පෙනුමට ගෙන එනු නොලබන නමුත් එහි කුඩා කොටසකින් පමණි. උනුසුම් කලාපයේ තාප සින්ක් සඳහා ජ්වලන ප්රභවයේ තාප තීව්රතාවය මෙම තාප ඉවත් කිරීම ඉක්මවා යා යුතුය. ජ්වලනය කිරීමෙන් පසු, ජ්වලන ප්රභවය ඉවත් කරනු ලබන අතර, ගිනි දැල්ල ඉදිරිපස ප්රචාරණය හේතුවෙන් දහනය සිදු වේ.
8.5. ගිනිගැනීමේ හා නිරාවරණයේ සීමාවන්
ගෑස්-වායු මිශ්රණයට ජ්වලනය (පුපුරා යා හැක්කේ) මිශ්රණයේ ඇති වායු අන්තර්ගතය නිශ්චිත (එක් එක් වායුව සඳහා) සීමාවන් තුළ ඇති විට පමණි. මේ සම්බන්ධයෙන්, ගිනි අවුලුවීමේ අඩු හා ඉහළ සාන්ද්රණ සීමාවන් ඇත. පහළ සීමාව අවමයට අනුරූප වන අතර මිශ්රණයේ ඇති උපරිම වායු ප්රමාණයට ඉහළ සීමාව (ජ්වලනය අතරතුර) සහ ස්වයංසිද්ධව (පිටතින් තාප ප්රවාහයකින් තොරව) ගිනි පැතිරීම (ස්වයං ජ්වලනය). එකම සීමාවන් පුපුරන සුලු වායු-වායු මිශ්රණවල තත්වයන්ට අනුරූප වේ.
ගෑස්-වායු මිශ්රණයේ ඇති වායු අන්තර්ගතය අඩු ගිනි අවුලුවන සීමාවට වඩා අඩු නම්, එවැනි මිශ්රණයකට දැවී පුපුරා යා නොහැක, මන්ද ජ්වලන ප්රභවය අසල මුදා හරින තාපය මිශ්රණය ජ්වලන උෂ්ණත්වයට රත් කිරීමට ප්රමාණවත් නොවේ. මිශ්රණයේ ඇති වායු අන්තර්ගතය පහළ සහ ඉහළ ගිනි අවුලුවන සීමාවන් අතර තිබේ නම්, ජ්වලිත මිශ්රණය ජ්වලන ප්රභවයට ආසන්නයේ සහ එය ඉවත් කරන විට දැල්වෙයි. එවැනි මිශ්රණයක් පුපුරන සුලු ය. පුළුල් පරාසයක ගිනිගැනීමේ සීමාවන් (පිපිරුම් සීමාවන් ලෙසද හැඳින්වේ) සහ පහළ සීමාව, වඩා පුපුරන සුලු වායුව. අවසාන වශයෙන්, මිශ්රණයේ ඇති වායු අන්තර්ගතය ඉහළ ගිනි අවුලුවීමේ සීමාව ඉක්මවා ගියහොත්, මිශ්රණයේ ඇති වාතය ප්රමාණය සම්පූර්ණයෙන්ම වායුව දහනය කිරීමට ප්රමාණවත් නොවේ.
ගිනිගැනීමේ සීමාවන් පැවතීම දහනය කිරීමේදී සිදුවන තාප අලාභය නිසා ඇතිවේ. දහනය කළ හැකි මිශ්රණයක් වාතය, ඔක්සිජන් හෝ වායුව සමඟ තනුක කළ විට, තාප අලාභය වැඩි වන අතර, ගිනි දැල්වීමේ වේගය අඩු වන අතර, ජ්වලන ප්රභවය ඉවත් කිරීමෙන් පසු දැවීම නතර වේ.
වගුව 8.11. වාතය සමඟ මිශ්ර වූ වායූන්ගේ දැවෙන හැකියාව (t = 20 ° C සහ p = 101.3 kPa දී)
| ගෑස් | ගෑස් මිශ්රණයේ ගෑස් අන්තර්ගතය, ගැන. % | උපරිම |
ජ්වලන සීමාවන්හි අතිරික්ත වායු සංගුණකය | ||||
|---|---|---|---|---|---|---|---|
| ගිනි අවුලුවන සීමාවන් සමඟ | මිශ්රණයේ ස්ටොයිකියෝමිතික සංයුතිය විට | මිශ්රණයේ සංයුතිය, උපරිම පිපිරුම් පීඩනය ලබා දෙන විට | |||||
| පහළ | ඉහළට | පහළ | ඉහළට | ||||
| හයිඩ්රජන් | 4,0 | 75,0 | 29,5 | 32,3 | 0,739 | 9,8 | 0,15 |
| කාබන් මොනොක්සයිඩ් | 12,5 | 74,0 | 29,5 | – | – | 2,9 | 0,15 |
| මීතේන් | 5,0 | 15,0 | 9,5 | 9,8 | 0,717 | 1,8 | 0,65 |
| ඊතන් | 3,2 | 12,5 | 5,68 | 6,28 | 0,725 | 1,9 | 0,42 |
| ප්රොපේන් | 2,3 | 9,5 | 4,04 | 4,60 | 0,858 | 1,7 | 0,40 |
| n- බියුටේන් | 1,7 | 8,5 | 3,14 | 3,6 | 0,858 | 1,7 | 0,35 |
| අයිසොබුටේන් | 1,8 | 8,4 | 3,14 | – | – | ~1,8 | 0,35 |
| n- පෙන්ටේන් | 1,4 | 7,8 | 2,56 | 3,0 | 0,865 | 1,8 | 0,31 |
| එතිලීන් | 3,0 | 16,0 | 6,5 | 8,0 | 0,886 | 2,2 | 0,17 |
| ප්රොපිලීන් | 2,4 | 10,0 | 4,5 | ~5,1 | ~0,89 | 1,9 | 0,37 |
| බියුටිලීන් | 1,7 | 9,0 | 3,4 | ~4,0 | ~0,88 | 1,7 | 0,35 |
| ඇසිටිලීන් | 2,5 | 80,0 | 7,75 | 14,5 | 1,03 | 3,3 | 0,019 |
වගුව 8.12. ඔක්සිජන් සමඟ මිශ්ර වූ වායූන්ගේ ගිනි අවුලුවීමේ සීමාවන් (t = 20 ° C සහ p = 101.3 kPa දී)
වාතය සහ ඔක්සිජන් සමඟ මිශ්රණයේ ඇති පොදු වායූන් සඳහා දැවෙන සීමාවන් වගුවේ දක්වා ඇත. 8.11–8.12. මිශ්රණයේ උෂ්ණත්වය ඉහළ යාමත් සමඟ, ගිනි අවුලුවීමේ සීමාවන් පුළුල් වන අතර ස්වයංක්රීය උෂ්ණත්වය ඉක්මවා යන උෂ්ණත්වයකදී වාතය හෝ ඔක්සිජන් සමඟ වායුවේ මිශ්රණය ඕනෑම පරිමාව අනුපාතයකින් දහනය වේ.
ගිනි අවුලුවන සීමාවන් රඳා පවතින්නේ දහනය කළ හැකි වායූන් වර්ග මත පමණක් නොව, අත්හදා බැලීම්වල කොන්දේසි මත ය (යාත්රා ධාරිතාව, ජ්වලන ප්රභවයේ තාප බලය, මිශ්රණයේ උෂ්ණත්වය, ගිනි පැතිරීම ඉහළට, පහළට, තිරස් අතට යනාදිය). විවිධ සාහිත්ය මූලාශ්රවල මෙම සීමාවන්හි තරමක් වෙනස් අගයන් මෙය පැහැදිලි කරයි. පටිත්තෙහි. 8.11–8.12 කාමර උෂ්ණත්වයේ හා වායුගෝලීය පීඩනයේදී ලබාගත් සාපේක්ෂව විශ්වසනීය දත්ත පෙන්වන්නේ ගිනිදැල් මිලිමීටර 50 සහ ඊට වැඩි විෂ්කම්භයක් සහිත නළයක පහළ සිට ඉහළට පැතිරීමෙනි. ගින්න ඉහළ සිට පහළට හෝ තිරස් අතට පැතිරෙන විට පහළ සීමාවන් තරමක් වැඩි වන අතර ඉහළ ඒවා අඩු වේ. බැලස්ට් අපද්රව්ය අඩංගු නොවන සංකීර්ණ දහනය කළ හැකි වායූන්ගේ ගිනි අවුලුවීමේ සීමාවන් ආකලන රීතිය අනුව තීරණය වේ:
L g = (r 1 + r 2 +… + r n) / (r 1 / l 1 + r 2 / l 2 +… + r n / l n) (8.17)
එහිදී L g - වායු-වායුව හෝ ගෑස්-ඔක්සිජන් මිශ්රණයේ ඇති සංකීර්ණ වායුවේ දහනය වීමේ පහළ හෝ ඉහළ සීමාව, පමණ. %; r 1, r 2, ..., r n - සංකීර්ණ වායුවක තනි සංරචකවල අන්තර්ගතය, වෙළුම. %; r 1 + r 2 + ... + r n = 100%; l 1, l 2, ..., l n - වගුව අනුව ගෑස්-වාතය හෝ ගෑස්-ඔක්සිජන් මිශ්රණයේ ඇති තනි සංරචකවල දැවෙන හැකියාවෙහි පහළ හෝ ඉහළ සීමාවන්. 8.11 හෝ 8.12, පමණ. %
වායුවේ බැලස්ට් අපද්රව්ය තිබේ නම්, ගිනිගැනීමේ සීමාවන් සූත්රය මගින් තීරණය කළ හැකිය:
L b = L g / (8.18)
එහිදී L b - බැලස්ට් අපද්රව්ය සහිත මිශ්රණයේ දැවෙන හැකියාව ඉහළ සහ පහළ සීමාවන් ගැන. %; L g - දහනය කළ හැකි මිශ්රණයේ ඉහළ සහ පහළ ගිනිගැනීමේ සීමාවන්, පමණ. %; B - බැලස්ට් අපද්රව්ය ප්රමාණය, ඒකකයක භාග.
ගණනය කිරීම් වලදී, බොහෝ විට අතිරික්ත වාතයේ සංගුණකය දැන ගැනීම අවශ්ය වේ, different, විවිධ ගිනි අවුලුවන සීමාවන් සඳහා (වගුව 8.11 බලන්න), මෙන්ම වායු-වායු මිශ්රණයක් පුපුරා යාමෙන් ඇතිවන පීඩනය. ගිනිගැනීමේ ඉහළ හෝ පහළ සීමාවන්ට අනුරූප වන අතිරික්ත වාතයේ සංගුණකය සූත්රය මගින් තීරණය කළ හැකිය
α = (100 / L - 1) (1 / V T) (8.19)
ගෑස්-වායු මිශ්රණ පුපුරා යාමෙන් ඇතිවන පීඩනය පහත දැක්වෙන සූත්ර මගින් ප්රමාණවත් දළ වශයෙන් තීරණය කළ හැකිය:
සරල වායුවේ වාතයේ ස්ටොයිකියෝමිතික අනුපාතය සඳහා:
R s = P n (1 + kt k) (m / n) (8.20)
සංකීර්ණ වායුවේ වාතය හා අනුපාතය සඳහා:
R s = P n (1 + ct c) V vlaps / (1 + αV m) (8.21)
එහිදී P VC - පිපිරීමෙන් ඇතිවන පීඩනය, MPa; p n - ආරම්භක පීඩනය (පිපිරීමට පෙර), MPa; β යනු වායූන්ගේ පරිමාව පුළුල් කිරීමේ සංගුණකය, සංඛ්යාත්මකව පීඩනයේ සංගුණකය (1/273); t K - කැලරිමිතික දැවෙන උෂ්ණත්වය, ° C; m යනු පිපිරීමෙන් පසු මවුල ගණන, වාතයේ වායුවක් දහනය කිරීමේ ප්රතික්රියාව මගින් තීරණය වේ; n යනු දහන ප්රතික්රියාවට සම්බන්ධ පිපිරීමට පෙර මවුල ගණන; V Vlaps - වායුවේ 1 m 3 ට තෙත් දහන නිෂ්පාදන පරිමාව, m 3; V t - න්යායාත්මක වායු ප්රවාහය, m 3 / m 3.
වගුව 8.13. ප්රොපේන්-වායු මිශ්රණයේ පිපිරීමෙන් ඇතිවන පීඩනය, විසර්ජන සංගුණකය k සැට් සහ ආරක්ෂිත උපාංගයේ වර්ගය මත පදනම්ව
| ආරක්ෂිත උපාංගයේ වර්ගය | යළි පිහිටුවීමේ සාධකය k sat, m 2 / m 3 | ||
|---|---|---|---|
| 0,063 | 0,033 | 0,019 | |
| 3 mm thickness ණකම සහිත වීදුරු බාහිර සවි කිරීම් සමඟ තනි කුහරයක් ඔප දැමීම | 0,005 | 0,009 | 0,019 |
| 3 mm thickness ණකම සහිත වීදුරු බාහිර සවි කිරීම් සමඟ ද්විත්ව කුහර ඔප දැමීම | 0,007 | 0,015 | 0,029 |
| 5 MPa / m 2 බරක් සඳහා විශාල ඉඟියක් සහ වසන්ත අගුලක් සහිත තනි කවුළු ආවරණයක් මාරු කරන්න | 0,002 | – | – |
| 5 MPa / m 2 බරක් සඳහා ඉහළ උකුල සහ වසන්ත අගුල සහිත තනි කවුළු ආවරණයක් හැරීම | 0,003 | – | – |
| ස්ලැබ් ස්ලැබ් බර මත නිදහසේ වැතිරීම, kg / m 2: | |||
| 0,023 | |||
| 0,005 | |||
| 0,018 | |||
පිපිරුම් පීඩනය වගුවේ දක්වා ඇත. 8.13 හෝ සූත්ර මගින් නිර්වචනය කළ හැක්කේ ටැංකිය තුළ වායුව සම්පූර්ණයෙන් දහනය වී එහි බිත්ති මෙම පීඩන සඳහා නිර්මාණය කර ඇත්නම් පමණි. එසේ නොමැති නම්, ඒවා බිත්තිවල ශක්තියෙන් හෝ ඒවායේ පහසුවෙන් කඩා වැටෙන කොටස් වලින් සීමා වේ - පීඩන ස්පන්දන ශබ්දයේ වේගයෙන් මිශ්රණයේ දැවෙන නොවන පරිමාව හරහා ව්යාප්ත වන අතර ගිනිදැල් ඉදිරිපසට වඩා වේගයෙන් වැටට ළඟා වේ.
මෙම ලක්ෂණය - ගිනි පැතිරීමේ වේගය සහ පීඩන ස්පන්දන (කම්පන තරංග) අතර වෙනස - පිපිරුමකදී ගෑස් උපාංග සහ පරිශ්රයන් විනාශයෙන් ආරක්ෂා කිරීම සඳහා ප්රායෝගිකව බහුලව භාවිතා වේ. මෙය සිදු කිරීම සඳහා, බිත්ති සහ බිම් විවෘත කිරීමේදී පහසුවෙන් විවෘත කිරීම හෝ බිඳ වැටීම, රාමු, පැනල්, කපාට ආදිය සවි කර ඇත. පිපිරුමකින් ඇතිවන පීඩනය ආරක්ෂණ උපාංගවල සැලසුම් ලක්ෂණ සහ විසර්ජන සංගුණකය k sat මත රඳා පවතී, එය ආරක්ෂිත උපාංගවල වර්ග ප්රමාණය කාමරයේ පරිමාවට අනුපාතය වේ.
8.6. ස්ථිර මාධ්යයක සංයුතිය
ගිනි කලාපය චලනය කිරීම - ගිනි ඉදිරිපස - දහන නිෂ්පාදන වලින් ප්රතික්රියා නොකළ දහනය කළ හැකි මිශ්රණය වෙන් කරන ප්රදේශය, එයට ඉදිරියෙන් ඇති සීතල දහනය කළ හැකි මිශ්රණය ජ්වලන උෂ්ණත්වය දක්වා උනුසුම් වීම නිසා තාප සංවහනය සහ උණුසුම් දහන නිෂ්පාදන සීතල මිශ්රණයට විහිදේ. සමජාතීය දහනය කළ හැකි මිශ්රණයක් ඔස්සේ දැල්ල ඉදිරිපස චලනය වන රේඛීය ප්රවේගය හැඳින්වේ ඒකාකාර ගිනි වේගයවායුවේ වර්ගය සහ වායු-වායු මිශ්රණයේ අන්තර්ගතය මත පදනම්ව. සියලු වර්ගවල දහනය කළ හැකි වායූන් සඳහා අවම වේගය ජ්වලනයේ පහළ සහ ඉහළ සීමාවන්ට අනුරූප වන අතර උපරිම - වායූන් හා වාතයේ අනුපාතය.
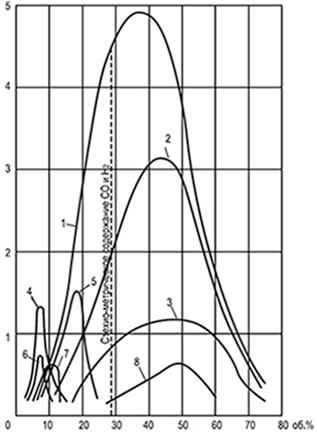
රූපය. 8.1. ඒකාකාර ප්රවේග වක්ර
ගිනි පැතිරීම u n අර්ථ දක්වා ඇත
විෂ්කම්භය 25.4 මි.මී.
1-හයිඩ්රජන්; 2-ජල වායුව; කාබන් මොනොක්සයිඩ්;
4-එතිලීන්; 5-කෝක් අවන් වායුව; 6-එතේන්; 7-මීතේන්;
8-ජනක වාෂ්ප වායු වායුව

රූපය. 8.2. විෂ්කම්භයේ බලපෑම Tr Tr සහ සාන්ද්රණය
වෙනස මත වාතය සමඟ මීතේන් මිශ්ර වේ
ඒකාකාර ගිනි වේගය u n
අත්හදා බැලීම් මගින් ගිනි පැතිරීමේ වේගය රඳා පවතින්නේ එය පැතිරෙන සිලින්ඩරාකාර නලයේ විෂ්කම්භය මත ය: විෂ්කම්භය විශාල වන තරමට, ව්යාප්තියේ වේගය වැඩි වේ. නලයේ විෂ්කම්භය වැඩි කිරීමෙන් දහන ක්රියාවලියට හා චලනය වන ගිනි දැල්ලට ඉදිරිපස බිත්තිවල බලපෑම අඩු වන අතර සංවහනය වැඩි කිරීමට දායක වේ (රූපය 8.2). ප්රස්ථාර දත්ත විශ්ලේෂණය කිරීමෙන් පෙන්නුම් කරන්නේ ඉතා කුඩා නල ප්රමාණවලින් ගිනි දැල්වීම සාමාන්යයෙන් කළ නොහැකි බවයි (ශක්තිමත් සාපේක්ෂ තාප බේසම හේතුවෙන්). දැල්ල පැතිරෙන්නේ නැති නල, නාලිකා සහ තව් වල මානයන් විවේචනාත්මක ලෙස හැඳින්වේ.
විවිධ වායූන් සඳහා ඒවා වෙනස් වේ:
- වාතය සමඟ මීතේන් සීතල මිශ්රණය - 3 මි.මී.;
- හයිඩ්රජන්-වායු මිශ්රණය - මි.මී. 0.9;
- වාතය සමඟ මීතේන් රත් කළ මිශ්රණය - 1.2 මි.මී.
ගිනිදැල් අත් අඩංගුවට ගන්නන් නිර්මාණය කිරීම සඳහා කුඩා කොටසේ නාලිකා වල මැකී යාම ප්රායෝගිකව භාවිතා වේ: ගිනිදැල් අත් අඩංගුවට ගැනීමේ දැල්, සෙරමික් සිදුරු තැටි, සම්පීඩිත ලෝහ බෝලවලින් සාදන ලද තැටි, සිහින්ව කැපූ ද්රව්යවලින් පිරුණු යාත්රා ආදිය); ගෑස්-වායු මිශණ මත වැඩ කරන දාහක සැලසුම් කිරීමේදී ගිනි නාලිකා.
වායූන්ගේ දහනය කළ හැකි ගුණාංගවල සංසන්දනාත්මක ලක්ෂණ සඳහා (නලවල ප්රමාණය නොසලකා), සංකල්පය "සාමාන්ය ගිනි පැතිරීමේ වේගය" - මෙය සීතල (තවමත් දැවිය නොහැකි) මිශ්රණයට යොමු වන වේගය වන අතර, ගිනිදැල් සාමාන්යයෙන් එහි මතුපිටට ගමන් කරයි. ගිනි දැල්ල ඉදිරිපස පැතලි හා නලයේ විෂ්කම්භයට සමාන යැයි උපකල්පනය කෙරේ:
u n = w p πr 2 /S(8.22)
එහිදී u n - ගිනි පැතිරීමේ සාමාන්ය වේගය, m / s; w p - මනින ලද ඒකාකාර ගිනි ප්රවේගය, m / s; r යනු නලයේ අරය, m; S යනු ගිනිදැල් ඉදිරිපස පෘෂ් area වර්ග area ලය, m 2.
වගුව 8.14. විවිධ වායු වායු මිශ්රණවල දැවෙන ප්රචාරණ අනුපාතය (t = 20 ° C සහ p = 103.3kPa දී), m / s
| ගෑස් | උපරිම සාමාන්යය සමඟ මිශ්රණය ගිනි වේගය |
ස්ටොයිකොමිතික මිශ්රණය | ||||
|---|---|---|---|---|---|---|
| මිශ්රණයේ අන්තර්ගතය, ගැන. % | උපරිම සාමාන්යයි වේගය පැතිරීම |
මිශ්රණයේ අන්තර්ගතය, ගැන. % | සාමාන්යයි වේගය පැතිරීම ගිනිදැල් |
|||
| ගෑස් | වාතයේ | ගෑස් | වාතයේ | |||
| හයිඩ්රජන් | 42,0 | 58,0 | 2,67 | 29,5 | 70,5 | 1,6 |
| කාබන් මොනොක්සයිඩ් | 43,0 | 57,0 | 0,42 | 29,5 | 70,5 | 0,30 |
| මීතේන් | 10,5 | 89,0 | 0,37 | 9,5 | 90,5 | 0,28 |
| ඊතන් | 6,3 | 93,7 | 0,40 | 5,7 | 94,3 | 0,32 |
| ප්රොපේන් | 4,3 | 95,7 | 0,38 | 4,04 | 95,96 | 0,31 |
| n- බියුටේන් | 3,3 | 96,7 | 0,37 | 3,14 | 96,86 | 0,30 |
| එතිලීන් | 7,0 | 93,0 | 0,63 | 6,5 | 93,5 | 0,5 |
| ප්රොපිලීන් | 4,8 | 95,2 | 0,44 | 4,5 | 95,5 | 0,37 |
| බියුටිලීන් | 3,7 | 96,3 | 0,43 | 3,4 | 96,6 | 0,38 |
| ඇසිටිලීන් | 10,0 | 90,0 | 1,35 | 7,75 | 92,25 | 1,0 |
දත්ත වගුවෙන් දැකිය හැකි පරිදි. 8.14, ගිනිදැල් ප්රචාරණය කිරීමේ උපරිම අනුපාතය ඔක්සිකාරක lack නතාවයකින් යුත් වායුව හා වාතය මිශ්රණයට අනුරූප වේ (ස්ටොයිකොමිතික නොවේ). ඉන්ධන අතිරික්තයක් සමඟ ප්රතික්රියා අංශුවල ision ට්ටනයේ කාර්යක්ෂමතාව වැඩි වන අතර රසායනික ප්රතික්රියා වේගය වැඩිවේ.
ගෑස්-ඔක්සිජන් මිශ්රණ සඳහා ගිනි පැතිරීමේ වේගය ගෑස්-වායු මිශ්රණයට වඩා බෙහෙවින් වැඩි ය. මේ අනුව, මීතේන්-ඔක්සිජන් මිශ්රණයක උපරිම සාමාන්ය ගිනි පැතිරීමේ වේගය 3.3 m / s වන අතර ඔක්සිජන් සමඟ ප්රොපේන් හා බියුටේන් මිශ්රණයක් සඳහා 3.5–3.6 m / s වේ.
M / s වාතය සමඟ සංකීර්ණ වායුවක මිශ්රණයක දැවෙන ප්රචාරණයේ උපරිම සාමාන්ය ප්රවේගය සූත්රය මගින් තීරණය වේ:
u n max = (r 1 u 1 + r 2 u 2 +… + r n u n) / (r 1 + r 2 + ... + r n) (8.23)
එහිදී r 1, r 2, ... r n - සංකීර්ණ වායුවක තනි සංරචකවල අන්තර්ගතය, වෙළුම. %; u 1, u 2, ... u n - වාතය සමඟ මිශ්ර වූ සංකීර්ණ වායුවක සං components ටකවල දැවෙන ප්රචාරණයේ උපරිම සාමාන්ය වේගය, m / s.
ඉහත අනුපාත ආසන්න සාමාන්ය ගිනි ප්රචාරණ අනුපාත සහිත වායූන් සඳහා සුදුසු වේ, නිදසුනක් ලෙස ස්වාභාවික හා ද්රව හයිඩ්රොකාබන් වායූන් සඳහා. තියුණු ලෙස වෙනස් වන ගිනි ප්රචාරණ අනුපාත ඇති වායූන්ගේ මිශ්රණයන් සඳහා (නිදසුනක් ලෙස, ස්වාභාවික හා කෘතිම වායූන් මිශ්රණය සඳහා, හයිඩ්රජන් ඉහළ අන්තර්ගතයක් සහිත මිශ්රණ සඳහා), ඒවා ලබා දෙන්නේ දළ අගයන් පමණි.
මිශ්රණයේ බැලස්ට් අපද්රව්ය (නයිට්රජන් සහ කාබන් ඩයොක්සයිඩ්) තිබේ නම්, ගිනි පැතිරීමේ වේගය ආසන්න වශයෙන් ගණනය කිරීම සඳහා සූත්රය භාවිතා කරන්න:
u b = u n උපරිම (1 - 0,01N 2 - 0,012СО 2) (8.24)
ගෑස්-වායු මිශ්රණය රත් කිරීමෙන් ගිනි පැතිරීමේ වේගය සැලකිය යුතු ලෙස වැඩි කරයි:
සහ ‘n = සහ n (ටී‘ / ටී) (8.25)
කොහේද සහ නිරපේක්ෂ උෂ්ණත්වය T ‘, K සහිත රත් කළ මිශ්රණයක‘ n - ගිනි ප්රචාරණ වේගය; සහ n - එකම, සීතල මිශ්රණයක ටී, කේ.
මිශ්රණය පූර්ව රත් කිරීමෙන් එහි ity නත්වය නිරපේක්ෂ උෂ්ණත්වයට ප්රතිලෝමව සමානුපාතිකව වෙනස් වේ, එබැවින් මෙම උෂ්ණත්වයට සමානුපාතිකව ගිනි පැතිරීමේ වේගය වැඩිවේ. ගණනය කිරීම් වලදී මෙම කරුණ සැලකිල්ලට ගත යුතුය, විශේෂයෙන් එවැනි අවස්ථාවලදී දාහකයන්ගේ වෙඩි තැබීමේ නාලිකා රත් වූ පෙදරේරු වල පිහිටා ඇති විට හෝ ගිනි පෙට්ටියේ විකිරණ, උණුසුම් වායු ආදිය මගින් බලපෑමට ලක් වූ විට.
පහත දැක්වෙන කොන්දේසි සපුරා ඇති විට ගින්න ඒකාකාරව පැතිර යා හැකිය:
- ගිනි නළයට කුඩා දිගක් ඇත;
- දහනය වායුගෝලයට ආසන්න නියත පීඩනයකදී ව්යාප්ත වේ.
නල දිග සැලකිය යුතු නම්, සමහර මිශ්රණ සඳහා ගිනි පැතිරීම පවා කම්පනය බවට පත් විය හැකි අතර, පසුව සුපර්සොනික් දැවෙන ප්රවේගය (2000 m / s සහ ඊට වැඩි) සමඟ පුපුරා යා හැක. කම්පන තරංගය හේතුවෙන් මිශ්රණය දැල්වෙන විට මිශ්රණය උෂ්ණත්වයට රත් වේ. ස්වයංක්රීයකරණ උෂ්ණත්වය ඉක්මවා යාම. අධික ලෙස ගිනි පැතිරීම සහිත මිශ්රණවල පුපුරා යාම සිදුවේ. පුපුරා යාමේ සාන්ද්රණයේ සීමාවන් දැනටමත් වායු-වාතය සහ ගෑස්-ඔක්සිජන් මිශ්රණවල දැවෙන හැකියාව තුළ ඇත, වෙළුම. %: ප්රොපේන් - 3.2–37, අයිසොබුටේන් - 2.8–31, හයිඩ්රජන් - 15-90. පුපුරා යාමේ දහනය අතරතුර ඇතිවන පීඩනය ආරම්භක දස ගුණය ඉක්මවා යා හැකි අතර ඉහළ පීඩන සඳහා නිර්මාණය කර ඇති පයිප්ප සහ අනෙකුත් යාත්රා විනාශ වීමට හේතු වේ.
8.7. ලැමිනර් සහ කැළඹිලි ධාරාවන්හි සංයුතිය

රූපය. 8.3. ඉදිරිපස දැවීම
තුළ වායු වායු මිශ්රණය
ලැමිනාර් රියදුරු මාදිලිය
ඔබ දහනය කළ හැකි මිශ්රණයේ ප්රති-චලනයක් ගිනිදැල් ප්රචාරණය කිරීමේ සාමාන්ය වේගයට සමාන වේගයකින් නිර්මාණය කළහොත් ගිනිදැල් ඉදිරිපස නතර කළ හැකිය. හොඳ උදාහරණයක් වන්නේ බන්සන් දාහකයේ අභ්යන්තර කේතුවක මතුපිටයි. ලැමිනර් චලන මාදිලියේ දාහකයෙන් පිටතට ගලා යන වායු-වායු මිශ්රණයේ සංයුතිය නියාමනය කිරීමෙන් ස්ථාවර හා තියුණු ලෙස අර්ථ දක්වා ඇති දැවෙන කේතුවක පෙනුම ලබා ගත හැකිය (රූපය 8.3). දාහක නාලිකාවේ වෙඩි තැබීමේ දාරයට සාපේක්ෂව සවි කර ඇති කේතුවක පැති පෘෂ් (ය (ගිනි දැල්ල ඉදිරිපස), පිටතට යන වායු-වායු මිශ්රණය දෙසට ගමන් කරන අතර, මේ අවස්ථාවේ දී දැල්ල සාමාන්යයෙන් එක් එක් අවස්ථාවේදී ජ්වලන මතුපිටට ව්යාප්ත වේ. කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස පෘෂ් on ය මත ප්රවේගවල සමානාත්මතාවය ආරක්ෂා වේ - ගෑස්-වායු මිශ්රණයේ ප්රවාහ අනුපාතය සාමාන්ය wн සිට කේතුවේ උත්පාදනය දක්වා සහ සාමාන්ය ගිනි ප්රචාරණ වේගය u n මයිකල්සන් නීතියට අවනත වේ:
w n = w pot cosφ = u n (8.26)
මෙහි flow යනු කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස පෘෂ් to යට ගලා යන දිශාව සහ සාමාන්යය අතර කෝණය; w දහඩිය යනු කාල ඒකකයකට දාහකය හරහා ගමන් කරන වායු-වායු මිශ්රණයේ සාමාන්ය ප්රවාහ අනුපාතය, m / s.
සාමාන්ය ගිනිදැල් ප්රචාරණ ප්රවේගයේ නියත වලංගු වන්නේ කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස පාර්ශ්වීය පෘෂ් of යේ ප්රධාන කොටස සඳහා පමණි. කේතුවක මුදුනේ, ගිනිදැල් ඉදිරිපස කේතුකාකාර පෘෂ් of යේ සමීප පරතරයකින් ගෑස්-වායු මිශ්රණය උණුසුම් වීම නිසා වේගය වැඩි වන අතර, දාහක වෙඩි තැබීමේ නාලිකාවේ අවසාන කොටසෙහි සිසිලන ආචරණය හේතුවෙන් කේතුවක පාමුල එය අඩු වේ.
ප්රායෝගික ගණනය කිරීම් සඳහා, මෙම වෙනස සාමාන්යයෙන් නොසලකා හරිනු ලබන අතර, ගිනිදැල් ඉදිරිපස හරහා ගමන් කරන මිශ්රණය කේතුවක මුළු පෘෂ් over යටම නියත යැයි උපකල්පනය කර u n ට සමාන වේ.
සාමාන්ය ගිනි දැල්වීමේ ප්රචාරණ වේගය වේ
u n = V cm / S (8.27)
V cm යනු දාහකය හරහා ගමන් කරන වායු-වායු මිශ්රණයේ පරිමාව වන අතර S යනු කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස පෘෂ් area වර්ග area ලය වේ.
ප්රායෝගිකව, කේතුකාකාර ගිනි දැල්ලට ඉදිරිපස ජ්යාමිතික හැඩයක් නොමැත, එබැවින්, එස් නිවැරදිව තීරණය කිරීම සඳහා, දැල්ල ඡායාරූප ගත කරනු ලැබේ, ගිනි දැල්ල ඉදිරිපස කපා දැමූ කේතු මාලාවකට බෙදා ඇත. පැති පෘෂ් aces වල එකතුව යනු කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස මුළු පෘෂ් surface යයි. බන්සන් දාහක ක්රමය සහ වෙනත් ක්රම මගින් තීරණය කරනු ලබන සාමාන්ය ගිනි ප්රචාරණ අනුපාතවල අගයන් වගුවේ දක්වා ඇති සාමාන්ය වේගයට සමාන හා සමාන වේ. 8.14.
කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස උස ප්රධාන වශයෙන් රඳා පවතින්නේ දාහකයේ වෙඩි තැබීමේ නාලිකාවේ ප්රමාණය මත ය. විශාල ගිනි නාලිකා කුඩා ඒවාට තලා දැමීමෙන් ගින්නෙහි උස අඩු කර ගත හැකිය. එකම සංයුතියේ වායු-වායු මිශ්රණ සඳහා, කුඩා නාලිකා h හි කේතුකාකාර ගිනි දැල්වල උස ආසන්න වශයෙන් තීරණය කළ හැක්කේ තනි නාලිකාවක ගිනි දැල්ලේ ඉදිරිපස උසින් ය:
h = H / (n (8.28)
මෙහි n යනු කුඩා නාලිකා ගණන වේ.
අධික තාප ප්රතිදානයක් සහිත කාර්මික දාහකයන් සඳහා (කාර්මික බොයිලේරු, aces ෂ්මක ආදිය) දහන සාමාන්යයෙන් කැළඹිලි ප්රවාහයක සිදු වේ - සුළි චලිතය හා ස්පන්දනය හේතුවෙන් සුමට කේතුකාකාර ගිනි දැල්ලක් ඉදිරිපස ඛාදනය වී පැහැදිලි කේතුකාකාර දළ සටහන් නැති වේ. මෙම අවස්ථාවේ දී, කුඩා පරිමාණයේ මහා පරිමාණ කැළඹීම් වලට අනුරූප වන දහනය කිරීමේ ලක්ෂණ දෙකක් නිරීක්ෂණය කෙරේ.
කැළඹිලි කොරපොතු ලැමිනර් දැවෙන කලාපයේ thickness ණකම නොඉක්මවන හෙයින්, කේතුකාකාර ගිනි දැල්ල ඉදිරිපස එහි හැඩය රඳවාගෙන සුමටව පවතී, දැවෙන කලාපය වැඩි වුවද. කැළඹිලි පරිමාණය සාමාන්ය දහන කලාපයේ thickness ණකම ඉක්මවා ගියහොත් කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස පෘෂ් .ය අසමාන වේ. මෙය දහන ඉදිරිපස මුළු පෘෂ් in යේ වැඩි වීමකට සහ ප්රවාහයේ ඒකක හරස්කඩකට දහනය කළ හැකි මිශ්රණයෙන් විශාල ප්රමාණයක් දහනය කිරීමට හේතු වේ.
ලැමිනර් දහන කලාපයේ thickness ණකම සැලකිය යුතු ලෙස ඉක්මවා යන මහා පරිමාණ කැළඹීම් වලදී, ගිනිදැල් ඉදිරිපස පෘෂ් of යේ උද්දීපනය උණුසුම් මිශ්රණයේ තනි අංශු වෙන් කිරීමට හේතු වන අතර පසුව ස්පන්දන මගින් තලා දමනු ලැබේ. ගිනිදැල් ඉදිරිපස එහි අඛණ්ඩතාව නැති වී දහනය කළ හැකි මිශ්රණයක අංශු ප්රවාහයේ සමාන, ඛණ්ඩනය හා දැවෙන ස්වරූපයෙන් තනි දහන මධ්යස්ථාන පද්ධතියක් බවට හැරේ.

රූපය. 8.4. සාපේක්ෂ වේගය වෙනස් කිරීම
කෝක් ගෑස් දැල්ල පැතිරීම
අංකය අනුව වාතය සමඟ මිශ්ර වේ
රෙනෝල්ඩ්ස් සහ මික්ස් චලන ප්රකාරය
මහා පරිමාණ කැළඹිලි සහිතව, දැවෙන ඉදිරිපස පෘෂ්, ය, සියලු දැවෙන අංශුවල පෘෂ් from යන්ගෙන් සංයුක්ත වීම වැඩි වන අතර එය ගිනි දැල්වීමේ ප්රචාරණ වේගයෙහි තියුණු වැඩිවීමක් ඇති කරයි (රූපය 8.4). මෙම අවස්ථාවේ දී, සාමාන්ය ප්රවේගය vn සමඟ ප්රචාරණය වන ඉදිරිපස දහනය පමණක් නොව, පරිමාව ද ඇතිවිය හැකි අතර එය රත් වූ දහන නිෂ්පාදන නැවුම් මිශ්රණයට ස්පන්දනය වීම නිසා සිදු වේ. එහි ප්රති, ලයක් වශයෙන්, මහා පරිමාණ කැළඹිලි කාලය තුළ ගිනි පැතිරීමේ සම්පූර්ණ වේගය තීරණය වන්නේ ඉදිරිපස හෝ පරිමාව දැවෙන මූලද්රව්යයන්ගේ එක් හෝ තවත් සංයෝජනයක් මගිනි.
ස්පන්දන නොමැති විට, කැළඹිලි සහිත දැවෙන අනුපාතය සාමාන්ය ගිනි ප්රචාරණ ප්රවේගයට සමාන වේ. ඊට පටහැනිව, ස්පන්දන වේගය සාමාන්ය අගය ඉක්මවා ගියහොත්, කැළඹිලි සහිත දැවෙන වේගය දහනය කළ හැකි මිශ්රණයේ භෞතික රසායනික ගුණාංග මත රඳා නොපවතී. ගිනි උදුනෙහි සාමාන්ය අනුපාතය මත කාර්මික aces ෂ්මකවල α\u003e 1 සමඟ විවිධ සමජාතීය වායු-වායු මිශ්රණ දහනය කිරීමේ අනුපාතය අඩු පරායත්තතාවයක් පරීක්ෂණ මගින් පෙන්නුම් කර ඇත.
8.8. පිළිස්සීමේ ස්ථායිතාව

රූපය. 8.5. සෘජු වන්දි යෝජනා ක්රමය
u n = w ලැමිනර් චලනය සමඟ දහඩිය
වායු වායු මිශ්රණය
1 - දාහක බිත්තිය;
2 - ගිනි ඉදිරිපස
දහනයේ ස්ථායිතාවයට බලපාන ප්රධාන සාධක - ගෑස්-වායු මිශ්රණයේ ප්රවාහ අනුපාතය සහ දැල්ල පැතිරීම. ලැමිනර් ප්රවාහයක වායු-වායු මිශ්රණ දහනය කරන විට, කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස කොටස එහි පහළ කොටස වේ. මෙම අවස්ථාවෙහිදී, වායුගෝලයට ගලා යන වායු-වායු මිශ්රණය ප්රසාරණය වීම සහ නාලිකා බිත්තියේ පිරිහෙන ක්රියාකාරිත්වය හේතුවෙන් තිරස් අතට හැරී නාලිකා අද්දරට ඉහළින් ගිනිදැල් ඉදිරිපස thickness ණකම මගින් ඉහළට ඔසවා ඇත (රූපය 8.5).
ඉදිරිපස මෙම කොටසෙහි ගිනි දැල්වීමේ ප්රචාරණ වේගය අනුව වායු-වායු ප්රවාහයේ ප්රවේගයට සම්පූර්ණ වන්දි ගෙවීමක් සිදු වේ u n = w pers. ගිනිදැල් ඉදිරිපස කේතුකාකාර කොටසේ ඉතිරි කොටසෙහි වන්දි අර්ධ ස්වභාවයක් ගන්නා අතර එය සිදු කරනු ලබන්නේ දහන ඉදිරිපස සාමාන්ය දිශාවට පමණි: u n = w යනු කොස් co දහඩියයි. W pot sinφ සං component ටකය අසමතුලිතව පවතින අතර ෆ්ලෑෂ් ලක්ෂ්යය කේතුවක පාදයේ සිට ඉහළට ඇද දමයි. කේතුකාකාර ගිනි දැල්ලේ ඉදිරිපස ස්ථායිතාව පැහැදිලි කරනුයේ පාදයේ වළලුකර පටිය ජ්වලන ප්රභවයක් ලෙස සේවය කරන අතර, එසේ නොමැතිව ඉදිරිපස කොටස ගෑස්-වායු මිශ්රණයකින් කඩා දමනු ඇත.
මිශ්රණයේ ප්රවාහ අනුපාතය ගිනි පැතිරීමේ වේගය ඉක්මවා ගියහොත්, එය නොසැලකිලිමත් වන තෙක් ජ්වලන පටියේ පළල අඩු වේ. මෙම අවස්ථාවේ දී, ගිනිදැල් ඉදිරිපස ස්ථායිතාව බිඳී ඇති අතර, දාහකයෙන් වෙන්වීම සිදු වේ. වළලුකර බිත්ති කලාපයේ (බිත්තියේ නොව) ගින්න පැතිරීමේ වේගය ගෑස්-වායු මිශ්රණයේ ප්රවාහ අනුපාතය ඉක්මවා ගියහොත්, දැල්ල දාහක මික්සර් තුළ (උඩිස් ෂූට්) ඇද ගනු ලැබේ.
කැඩී බිඳී යාම නිරීක්ෂණය කළ විට:
- දාහකයෙන් දැල්ල කඩාකප්පල් වීම සහ එය වඳ වී යාම;
- ගිනි උදුන දාහකයට ඉහළින් ඇති ප්රවාහයේ නව, තරමක් ස්ථාවර ස්ථානයකට ළඟා වූ විට වෙඩි තැබීමේ නාලිකාවේ මායිමෙන් වෙන් කිරීම;
- මතු වූ දැල්ල කඩාකප්පල් කිරීම සහ එහි වඳවීම;
- දාහක වෙඩි තැබීමේ නාලිකාවේ අද්දරට කුණු කන්දක් ඔසවා;
- ජෙට් යානය දාහකයෙන් යම් දුරකින් දැල්වෙන විට අත්හිටවූ දැල්ලක් නිර්මාණය කිරීම.
මෙම සියලු සංසිද්ධීන් පිළිගත නොහැකි වන්නේ ඒවා අවට වායුගෝලයේ හෝ ගිනි නොගත් වායුවේ ගිනි පෙට්ටියේ සමුච්චය වීමට තුඩු දෙන බැවිනි.

රූපය. 8.6. තනි වේගයේ යැපීම
ස්වාභාවික මිශ්රණවල විවෘත වායුගෝලයේ දැල්ල
ගිනි නාලිකාවේ ප්රමාණයට වාතය සහිත වායුව සහ
ප්රාථමික වායු අන්තර්ගතය.

රූපය. 8.7. වෙන්වීමේ වේගය රඳා පැවතීම
විවෘත වායුගෝලයේ බහු ගිනි දැල්ල
ස්වාභාවික වායුවේ වායු ප්රමාණය සමඟ මිශ්ර කිරීම
ගිනි නාලිකාව සහ ප්රාථමික වායු අන්තර්ගතය.
a - දාහක රූප සටහන; b - ගිනි බිඳීමේ වක්ර
අත්තික්කා වලින්. 8.6 වාතය සමඟ සීතල වායුවක මිශ්රණයක් මත වැඩ කරන එන්නත් කරන තනි පන්දම් දාහකවල වෙඩි තැබීමේ නාලිකා වල දාරවලින් වෙන්වන ගිනිදැල්වල පර්යේෂණාත්මක වක්ර පෙන්වා ඇත. මායිමේ සහ වක්රයට ඉහළින්, දැල්ල කැඩී යයි, සහ වක්රයට පහළින් - ස්ථාවර දැවීම.
ප්රායෝගිකව, මිලිමීටර 2-6 ක විෂ්කම්භයක් සහිත ගිනි නාලිකා සහිත බහු-ගිනි අවුලුවන දාහක පුළුල් ලෙස බෙදා හරිනු ලැබේ (රූපය 8.7). එවැනි දාහකයන් සඳහා දැවෙන වේගය තීරණය කිරීම පහත සූත්රයට අනුව කළ හැකිය:
w ref = 3,510 -3 dk T 2 (1 + V t) / (1 + α 1 V t) (8.29)
එහිදී d k - ගිනි නාලිකා වල විෂ්කම්භය, m; α 1 - අතිරික්ත ප්රාථමික වාතයේ සංගුණකය; T යනු වායු-වායු මිශ්රණයේ නිරපේක්ෂ උෂ්ණත්වය වන කේ.
සූත්රයට අනුව, ගිනි නාල වල හා උෂ්ණත්වයේ විෂ්කම්භය වැඩිවීමත් සමඟ දහනයේ ස්ථායිතාව වැඩි වන අතර අතිරික්ත ප්රාථමික වාතයේ සංගුණකය වැඩි වීමත් සමඟ අඩු වේ. දැවෙන ස්ථායිතාව ද ගිනිදැල්වල අන්යෝන්ය බලපෑමෙන් වැඩි කරයි.
ගිනි නාලිකා වලින් ගිනි වෙන්වීම වෙනත් හේතු නිසා සිදුවිය හැකිය. දාහකය සහ දහන වායු පිටාර නල වැරදි තැනක තිබේ නම්, ඒවා දාහක ඉන්ජෙක්ටරයට ඇතුළු වී ගින්න නිවා දැමීමට හේතු විය හැක (නිෂ්ක්රීය වායූන් සමඟ තනුක කර ඇති වායු-වායු මිශ්රණයේ දැවෙන ප්රචාරණ වේගය අඩු කිරීමෙන්). එසේම, වෙන්වීමට හේතුව ද්විතියික වාතයේ ඉහළ ප්රවේගයක් විය හැකි අතර එය වෙඩි තැබීමේ නාලිකා වලින් ගිනි දැල්වෙයි.
වගුව 8.15. ස්වාභාවික සමජාතීය මිශ්රණයක වේගය
පෙරළියක් සිදුවන වාතය සහිත වායුව
දැල්ල, m / s (මිශ්රණ උෂ්ණත්වය 20 С С)
| විෂ්කම්භය ගින්න නාලිකා |
ප්රාථමික වායු අතිරික්ත සාධකය | |||||
|---|---|---|---|---|---|---|
| 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | |
| 3,5 | 0,05 | 0,10 | 0,18 | 0,22 | 0,23 | 0,21 |
| 4,0 | 0,08 | 0,12 | 0,22 | 0,25 | 0,26 | 0,20 |
| 5,0 | 0,09 | 0,16 | 0,27 | 0,31 | 0,31 | 2,23 |
| 6,0 | 0,11 | 0,18 | 0,32 | 0,38 | 0,39 | 0,26 |
| 7,0 | 0,13 | 0,22 | 0,38 | 0,44 | 0,45 | 0,30 |
| 8,0 | 0,15 | 0,25 | 0,43 | 0,50 | 0,52 | 0,35 |
| 9,0 | 0,17 | 0,28 | 0,48 | 0,57 | 0,58 | 0,39 |
| 10,0 | 0,20 | 0,30 | 0,54 | 0,64 | 0,65 | 0,43 |
සාමාන්යයෙන් කපු සමග දාහක මික්සර් තුළට ගිනි පුපුරා යාම ද පිළිගත නොහැකිය. කඩාවැටීම මඟින් ගින්න වඳ වී යාම සහ නොකැඩූ මිශ්රණය කාමරයට හෝ උදුනට මුදා හැරීම හෝ දාහකය තුළ මිශ්රණය දහනය කිරීම සිදු වේ. ගින්න පෙරළීමේ ප්රවණතාව රඳා පවතින්නේ වායුවේ වර්ගය, ගිනි පැතිරීමේ සාමාන්ය වේගය, වායු-වායු මිශ්රණයේ ප්රාථමික වාතයේ අන්තර්ගතය, වෙඩි තැබීමේ නාලිකා වල ප්රමාණය, මිශ්රණයේ උෂ්ණත්වය හෝ නාලිකා වල බිත්ති මත ය. වෙඩි තැබීමේ නාලිකා නිපදවන ද්රව්යවල තාප සන්නායකතාවයේ සංගුණකය, ඒවායේ හැඩය, ගැඹුර සහ නිෂ්පාදනයේ ගුණාත්මකභාවය, බර්ර්ස් පැවතීම, දාර කැඩීම යනාදිය ද ගිනිදැල් බිඳවැටීමට බලපායි.
වගුවේ දක්වා ඇත. 8.15. සංශෝධන සැලකිල්ලට ගනිමින් ස්වාභාවික වායූන් වාතය සමඟ සමජාතීය මිශ්රණයක වේගය, කඩාවැටීමක් සිදුවන විට වෙනත් වායූන් සඳහා ද භාවිතා කළ හැකිය:
w "pr = w pr u" n / u n (8.30)
මෙහි w ‘pr යනු වෙනත් වායුවක් සඳහා ගිනි දැල්වීමේ වේගය, m / s; w ol - ස්වාභාවික වායුව සඳහා කඩිනම් වේගය (වගුව 8.15), m / s; u ‘n - වෙනත් වායුවක් සඳහා සාමාන්ය ගිනි පැතිරීමේ වේගය, m / s; u n - මීතේන් හි ගිනි පැතිරීමේ වේගය, m / s.
ඉදිරි ගමනේ උපරිම වේගය දළ සූත්රයෙන් ගණනය කළ හැකිය:
w ol = 0,73 10 -3 d k T 2 (8.31)
පුහුණුවීම් සඳහා ප්රමාණවත් දළ විශ්ලේෂණයක් සහිත එකම සූත්රය වෙනත් වායූන් සඳහා භාවිතා කළ හැකි අතර සාමාන්ය ගිනි දැල්වීමේ අනුපාතයේ වෙනසට සංශෝධනයක් හඳුන්වා දෙනු ලැබේ. බොහෝ අත්හදා බැලීම්වල පදනම මත, පහත දැක්වෙන නිගමනය කළ හැකිය: දාහකයන්ගේ ස්ථාවර ක්රියාකාරිත්වයේ සීමාවන් වෙන්වීමේ වේගය සහ ගිනි දැල්වීම මගින් සීමා වේ.

රූපය. 8.8. අතිරික්ත ප්රාථමික වාතයේ සංගුණකය මත ගින්නෙන් වෙන්වීමක් හා කාන්දුවක් ඇති වායු-වායු මිශ්රණයේ ප්රවේගයේ යැපීම
I - ගිනි වෙන් කිරීම; II - ගිනි දැල්වීම; III - දැල්ලේ කහ දාර;
1-3 විෂ්කම්භය ගිනි දාහක ගිනි නාලිකා, mm: 1 - 25, 2 - 25, 3 - 32
අත්තික්කා වලින්. 8.8 මඟින් වායුව සමඟ ස්වාභාවික වායු මිශ්රණයක ප්රවාහ අනුපාතය සංලක්ෂිත වන වක්රය පෙන්නුම් කරයි. වක්රයේ ස්වභාවය පෙන්නුම් කරන්නේ ප්රාථමික වාතයේ මිශ්රණයේ අන්තර්ගතය වැඩි වීමත් සමඟ ගිනි ස්ථායිතාවයේ තියුණු අඩුවීමක් පෙන්නුම් කරයි. ගිනිදැල්වල ස්ථායිතාවයේ වැඩි වීමක් සිදුවන්නේ ප්රාථමික වාතයේ අන්තර්ගතය අඩුවීමත් සමඟ එය ශුන්යයට අඩු වන විට උපරිමයට ළඟා වීමෙනි (විසරණය දහනය). කෙසේ වෙතත්, බොහෝ අවස්ථාවන්හීදී එවැනි හයිඩ්රොකාබන් වායූන් දහනය කිරීම පිළිගත නොහැකිය. මන්දයත් එය කහ ෆ්ලැප් වල පෙනුමට හේතු වන අතර එමඟින් එහි ඇති දුමාර අංශු වල ස්වරූපයයි.

රූපය. 8.9. පොදු දහන ස්ථායීකාරක
a - හරස්කඩ හදිසියේ ප්රසාරණය වන සිලින්ඩරාකාර උමගක්;
b - එකම, වේගයෙන් ගලා යන ප්රවාහයක් සහිත;
(ඇ) වේගයෙන් ගලා යන කේතුකාකාර උමග;
g - කේතුකාකාර සිරුරක ස්වරූපයෙන් ස්ථායීකාරකය;
d - එකම, වටකුරු දණ්ඩක ස්වරූපයෙන්;
e - එකම, ස්ථාවර මුදු දැල්ලක ස්වරූපයෙන්
1 - දාහක තුණ්ඩ; 2 - උමග; 3 - පැති විවරය;
4 - වළලු නාලිකාව; 5 - මුදු දැල්ල;
6 - ගෑස්-වායු මිශ්රණයේ ප්රධාන ප්රවාහයේ දැල්ල
ප්රායෝගිකව, ඕනෑම දහනය කළ හැකි වායු-වායු මිශ්රණයක දහනයේ ස්ථායීතාවයේ පරාසය පුළුල් කිරීම සඳහා, ප්රවාහ අනුපාතය වෙන් කිරීමේ අනුපාතයට වඩා කිහිප ගුණයකින් වැඩි වේ. දැල්ල වෙන් කිරීම වැළැක්වීම දහනය ස්ථායීකාරක භාවිතා කිරීමෙන් සිදු වේ (රූපය 8.9).
අක්ෂීය සමමිතික වායු-වායු ජෙට් නිපදවන එන්නත් සහ අනෙකුත් දාහකවල දැල්ල ස්ථාවර කිරීම සඳහා, ඒවායේ හරස්කඩ හදිසියේ ප්රසාරණය වීමත් සමඟ පරාවර්තක සිලින්ඩරාකාර උමං මාර්ග භාවිතා කරනු ලැබේ. එවැනි උමගක ක්රියාකාරිත්වය පදනම් වන්නේ ජෙට් යානය විසින් නිර්මාණය කරන ලද දුර්ලභ ක්රියාකාරිත්වය හේතුවෙන් පැන නගින උණුසුම් දහන නිෂ්පාදනවල කොටසක පර්යන්ත සංසරණය මත ය.
දාහකයන්ගේ දැල්ල ස්ථාවර කිරීම සඳහා, වේගයෙන් ගෑස්-වායු මිශ්රණයක් නිකුත් කිරීම සඳහා 30-60 of ක ආරම්භක කෝණයක් සහිත සිලින්ඩරාකාර හා කේතුකාකාර උමං මාර්ග භාවිතා කරනු ලැබේ. වේගයෙන් ගලා යන ප්රවාහයක් සමඟ උමගෙහි මධ්ය කොටසට වඩා විශාල පීඩනයක් පැන නගී. මෙය උණුසුම් දහන නිෂ්පාදනවල කොටසක් අක්ෂීයව ප්රතිචක්රීකරණය කිරීමට සහ ඇතුළත සිට උමඟට ගලා යන සීතල වායු වායු මිශ්රණය ජ්වලනය කිරීමට හේතු වේ.
උමං සවි කිරීම කළ නොහැකි වූ විට, ගින්න ස්ථාවර කිරීම සඳහා දුර්වල ලෙස හැඩගස්වන ලද සිරුරු භාවිතා කරනු ලැබේ.එය දාහකයේ ගිනි නාලිකාවෙන් ගිනි දැල්ලෙන් පිටවන විට වායු-වායු මිශ්රණයේ ගලායාමේ තැන්පත් කර ඇත. එකවරම මිශ්රණයේ ජ්වලනය සිදුවන්නේ ස්ථායීකාරකයේ පරිධිය මත වන අතර ඉන් පසුව ඇතුළත සිට දහනය කළ හැකි මිශ්රණය අවුලුවන උණුසුම් වායූන් අර්ධ වශයෙන් ප්රතිචක්රීකරණය කරයි. එවැනි උපකරණවල ස්ථායීකරණ බලපෑම උමං මාර්ගවලට වඩා අඩුය.
විශේෂ ගිනි තුණ්ඩයක ස්වරූපයෙන් දහන ස්ථායීකාරක එන්නත් කරන තනි පන්දම් දාහක සඳහා බහුලව භාවිතා වේ. මෙම උපාංගයේ ස්ථායීකරණ බලපෑම පදනම් වී ඇත්තේ විදුලි පන්දමේ මූලයේ ඇති අතිරික්ත වාතය සමඟ ප්රධාන ධාරාව තනුක වීම වැළැක්වීම මත වන අතර එහි ස්ථායිතාව සීමා කරයි. එසේම ප්රධාන ධාරාව උනුසුම් කිරීම සහ ජ්වලනය මගින් වළලුකර දැල්ල එහි සමස්ත පරිධිය දිගේ. ගිනි වළල්ලේ හරස්කඩවල අනුපාතය සහ පැති කුහරවල අනුපාතය හේතුවෙන් වෙන්වීමේදී වළලුකර දැල්ලේ ස්ථායිතාව ළඟා කර ගත හැකි අතර, එමඟින් වළලු කුහරයෙහි වායු-වායු මිශ්රණයේ ප්රවේගය සාමාන්ය ගිනි දැල්වීමේ ප්රචාරණ වේගය ඉක්මවා නොයයි. දැල්ල දාහක මික්සර් තුළට විනිවිද යාම වැළැක්වීම සඳහා, වළලුකර දැල්ල සෑදෙන පැති විවරයන්ගේ මානයන් අඩු විවේචනාත්මක යැයි උපකල්පනය කෙරේ.
8.9. ගිනි නිවීමේ චක්ර
වායුව හෝ ඔක්සිජන්, වරක් ගෑස් නල මාර්ගයේ පුපුරන සුලු මිශ්රණයක් සෑදිය හැකි අතර එමඟින් නල මාර්ග වාතය හෝ ඔක්සිජන් ඇතුළු වීමෙන් ආරක්ෂා කිරීම අත්යවශ්ය වේ. සියළුම පුපුරන සුලු නිෂ්පාදන පහසුකම් වලදී, ආවේගයන් අවුලුවාලීමේ හැකියාව බැහැර කිරීම සඳහා කොන්දේසි නිර්මානය කළ යුතුය. ජ්වලනයේ ප්රභවයන්, ගෑස්-වායු මිශ්රණය පිපිරීමට හේතු වේ:
- විවෘත දැල්ල;
- පවත්නා විදුලි උපකරණවල විදුලි විසර්ජන;
- විදුලි රැහැන්වල කෙටි පරිපථය;
- විදුලි උපකරණවල දිලිසීම;
- පුපුරා ගිය විවෘත ෆියුස්;
- ස්ථිතික විසර්ජන.
පුපුරා යාමේ ආරක්ෂාව සපයනු ලබන්නේ විවිධ ගිනි නිවන අය විසිනි. පුපුරා යාමේ අවදානමක් ඇති නල මාර්ග, ටැංකි, පිරිසිදු කිරීමේ නල මාර්ග, ඉටිපන්දම් සහ වෙනත් පද්ධතිවල ස්ථාපනය කර ඇත.
දහනය කළ හැකි මිශ්රණයකින් පිරුණු නාලිකාවක දැවෙන වඳවීම සිදුවන්නේ මිශ්රණයේ රසායනික සංයුතිය හා පීඩනය මත පදනම්ව අවම නාලිකා විෂ්කම්භයකින් පමණක් වන අතර ප්රතික්රියා කලාපයේ සිට නාලිකා බිත්තිවලට සිදුවන තාප අලාභය මගින් පැහැදිලි කෙරේ. නාලිකා විෂ්කම්භය අඩු වන විට, ප්රතික්රියාකාරක මිශ්රණයේ ඒකක ස්කන්ධයකට එහි මතුපිට වැඩි වේ, එනම්. තාප පාඩු වැඩිවේ. ඒවා තීරණාත්මක අගයකට ළඟා වූ විට, දහන ප්රතික්රියා වේගය කොතරම් අඩු වී ද යත්, තවදුරටත් දැල්ල පැතිරීම කළ නොහැකි ය.
ගිනිදැල් අත්හිටුවීමේ හැකියාව ප්රධාන වශයෙන් රඳා පවතින්නේ නිවාදැමීමේ නාලිකා වල විෂ්කම්භය සහ ඒවායේ දිගට වඩා බෙහෙවින් අඩු වන අතර, නිවාදැමීමේ නාලිකා හරහා ගිනිදැල් විනිවිද යාමේ හැකියාව ප්රධාන වශයෙන් රඳා පවතින්නේ දහනය කළ හැකි මිශ්රණයේ ගුණාංග හා සංයුතිය මත ය. සාමාන්ය ගිනි දැල්වීමේ ප්රචාරණ වේගය යනු නිවා දමන නාලිකා වල ප්රමාණය සහ ගිනි නිවීමේ යන්ත්රයේ තේරීම තීරණය කරන මූලික ප්රමාණයයි: එය විශාල වන තරමට, දැල්ල නිවා දැමීමට නාලිකා ප්රමාණය කුඩා වේ. එසේම, නිවාදැමීමේ නාලිකා වල මානයන් දහනය කළ හැකි මිශ්රණයේ ආරම්භක පීඩනය මත රඳා පවතී. ඊනියා භාවිතා කරන ගිනිදැල් අත් අඩංගුවට ගන්නන්ගේ ගිනි නිවීමේ හැකියාව තක්සේරු කිරීම. Peckle Re නිර්ණායකය:
Fe = w cm dc p p / (RT 0 λ 0) (8.32)
ගිනිදැල් වඳවීමේ සීමාවේදී, පෙක්ලට් නිර්ණායක සූත්රය පහත පරිදි වේ:
Pe cr = w cm d cr c p p cr / (RT 0 λ 0) (8.33)
එහිදී w cm යනු ගිනි පැතිරීමේ සාමාන්ය වේගයයි; d යනු නිවාදැමීමේ නාලිකාවේ විෂ්කම්භය; d кr - නිවාදැමීමේ නාලිකාවේ විවේචනාත්මක විෂ්කම්භය; с р - 0 ° at දී වායුවේ නිශ්චිත තාප ධාරිතාව සහ නියත පීඩනය; p යනු වායු පීඩනයයි; p kr - විවේචනාත්මක වායු පීඩනය; R යනු විශ්වීය වායු නියතය; ටී 0 - වායුවේ නිරපේක්ෂ උෂ්ණත්වය; λ 0 - මුල් මිශ්රණයේ තාප සන්නායකතාවය.
මේ අනුව, ගිනිදැල් අත් අඩංගුවට ගන්නන්ගේ ගිනි නිවීමේ හැකියාව ගණනය කිරීම සඳහා පහත සඳහන් මූලික දත්ත අවශ්ය වේ.
- දහනය කළ හැකි වායු මිශ්රණවල සාමාන්ය ගිනි දැල්වීමේ අනුපාතය;
- දී ඇති ගිනිදැල් අත් අඩංගුවට ගන්නෙකුගේ උපරිම නිවාදැමීමේ නාලිකා වල සත්ය ප්රමාණය.
ලබාගත් අගය Pecr = 65 ට වඩා වැඩි නම්, ගිනි නිවන තැනැත්තා මෙම දහනය කළ හැකි මිශ්රණයේ දැල්ල පැතිරීම ප්රමාද නොකරනු ඇති අතර අනෙක් අතට Pe< 65, огнепреградитель задержит распространение пламени. Запас надежности огнепреградителя, который находят из отношения Ре кр к вычисленному значению Ре, должен составлять не менее 2:
P = Pe cr / Re = 65 / Fe\u003e 2.0 (8.34)
ගිනිදැල් වඳවීමේ සීමාවේ නියත ඩීසීආර් යන කාරණය භාවිතා කරමින්, ඕනෑම දහනය කළ හැකි මිශ්රණයක් සඳහා නාලිකා වල ආසන්න වශයෙන් විවේචනාත්මක විෂ්කම්භය ගණනය කළ හැකිය, ගිනි දැල්වීමේ ප්රචාරණ වේගය ද, වායු පද්ධතියේ තාප ධාරිතාව සහ තාප සන්නායකතාව ද දන්නේ නම්. නිවාදැමීමේ නාලිකාවේ පහත දැක්වෙන විවේචනාත්මක විෂ්කම්භය, මි.මී.
- වායු වායු මිශ්රණය දහනය කිරීමෙන් - මීතේන් සඳහා 2.9 ක් සහ ප්රොපේන් සහ එතේන් සඳහා 2.2 ක්;
- පයිප්පවල ඔක්සිජන් මිශ්රණ දහනය කරන විට (දහනය කිරීමේ නිෂ්පාදන නිදහස්ව ව්යාප්ත කිරීමේ කොන්දේසි යටතේ 0.1 MPa ක නිරපේක්ෂ පීඩනයකදී) - මීතේන් සඳහා 1.66 ක් සහ ප්රොපේන් සහ එතේන් සඳහා 0.39 ක්.

රූපය. 8.10. ගිනි නිවන අයගේ වර්ග:
a - තුණ්ඩ; b - කැසට්; in - ලැමෙලර්; g - දැලක්; d - ලෝහ-පිඟන් මැටි
ව්යුහාත්මකව, අත්අඩංගුවට ගන්නන් වර්ග හතරකට බෙදා ඇත (රූපය 8.10):
- කැටිති ද්රව්ය තුණ්ඩයක් සමඟ;
- සෘජු නාලිකා සමඟ;
- ලෝහ පිඟන් මැටි හෝ ලෝහ තන්තු වලින්;
- දැලක්.
ස්ථාපනය කිරීමේ ක්රමයට අනුව - වර්ග තුනකට: වායුගෝලයට හෝ දැල්ලට වායූන් විමෝචනය කිරීම සඳහා පයිප්ප මත; සන්නිවේදනය පිළිබඳ; ගෑස් දහනය කරන උපාංග වලට පෙර.
ජාලක අතර අසුරන ලද ගිනි දැල්වීමක දී පිරවුමක් සහිත තුණ්ඩයක් ඇත (වීදුරු හෝ පෝසිලේන් බෝල, බොරළු, කොරුන්ඩම් සහ කල් පවත්නා ද්රව්යවල වෙනත් කැටිති). කැසට් ගිනි දැල්වීම යනු විඛාදනයට ලක්වූ සහ පැතලි ලෝහ පටිවලින් ගිනි නිවන කැසට් පටයක් සවි කර රෝල් එකකට තදින් ඇඹරීමයි. තහඩු ආකාරයේ ගිනි දැල්වීමක දී තල-සමාන්තර ලෝහ තහඩු පැකේජයක් ඇත. නඩුවේ දැල ගිනි දැල්වීමේදී තදින් සම්පීඩිත ලෝහ ජාලක පැකේජයක් තබා ඇත. සහතික දැල්ල අත් අඩංගුවට ගැනීම යනු පැතලි තැටියක් හෝ නලයක් ආකාරයෙන් සිදුරු සහිත සහතික තහඩුවක් සවි කර ඇති නිවාසයකි.
වඩාත් බහුලව භාවිතා වන්නේ දැල් ගිනි නිවන භටයින්ය (ඔවුන් 19 වන සියවස ආරම්භයේදී පතල් ගෑස් පිපිරීම් වැළැක්වීම සඳහා පතල් කම්කරුවන්ගේ ලාම්පු (දේවිගේ ලාම්පු) තුළ ස්ථාපනය කිරීමට පටන් ගත්හ). ගෑස් ඉන්ධන දහනය කරන ස්ථාපනයන් ආරක්ෂා කිරීම සඳහා මෙම ගිනි නිවන භටයින් නිර්දේශ කරනු ලැබේ. ගිනි අවහිර කිරීමේ මූලද්රව්යය පිත්තල කම්බි දැල ස්ථර කිහිපයකින් සමන්විත වන අතර එහි දැල විශාලත්වය 0.25 මි.මී. ඉවත් කළ හැකි රඳවනයක ඇසුරුම් දැල් ශක්තිමත් කර ඇත.
ගිනිදැල් අත් අඩංගුවට ගත් තැනැත්තාගේ සිරුර වාත්තු-යකඩ හෝ ඇලුමිනියම් මිශ්ර ලෝහයකින් සාදා ඇති අතර ඒවා අතර බෝල්ට් මගින් සම්බන්ධ කර ඇති සමාන කොටස් දෙකකින් සමන්විත වේ. සලකා බලන ලද වියළි ගිනිදැල් අත් අඩංගුවට ගන්නන්ට අමතරව, ලෝහවලට ගෑස් ගිනි දැල්වීමේදී පිපිරුම් තරංගයක් හා දැල්ලක් ඇතුළු වීමෙන් ගෑස් නල මාර්ග ආරක්ෂා කිරීම සඳහා ද්රව ඔක්සිජන් හා වාතය විනිවිද යාමෙන් වායුව පුරවා ඇති නල මාර්ග සහ උපකරණ ද බහුලව භාවිතා වේ.
දියර කපාට විය යුත්තේ:
- ප්රතිලෝම කම්පන සහ වායූන් ජ්වලනය අතරතුර පිපිරුම් තරංගයක් පැතිරීම වැළැක්වීමට;
- නල මාර්ගය ඔක්සිජන් හා වාතයෙන් ආරක්ෂා කරන්න;
- වායුවේ ප්රවාහයට අවම හයිඩ්රොලික් ප්රතිරෝධයක් සපයයි. ඊට අමතරව, ගේට්ටුවෙන් ලැබෙන දියර සැලකිය යුතු ප්රමාණයකින් ජල බිඳිති ස්වරූපයෙන් රැගෙන නොයා යුතුය.
8.10. පිළිස්සීමේ මූලධර්ම
වායු දහනය කිරීමේ ක්රියාවලීන් සාම්ප්රදායිකව චාලක හා විසරණය ලෙස හැඳින්වෙන මූලධර්ම මත පදනම් වේ. මූලධර්මය දෙස බලන විට, දහනය ආරම්භ වීමට පෙර නිශ්චිත අතිරික්ත වාතය සහිත ඒකාකාර මිශ්රණයක් නිර්මාණය වේ. එවැනි මිශ්රණයක දහනය සිදුවන්නේ ගින්නෙහි ඇති දුමාර අංශු සෑදීමකින් තොරව කෙටි පාරදෘශ්ය පන්දමක ය. චාලක මූලධර්මයට අනුව වායු දහනය සඳහා, ප්රාථමික වායු අතිරික්ත සංගුණකය α 1 = 1.02: 1.05 සමඟ සමජාතීය වායු-වායු මිශ්රණයක් සකස් කිරීම සඳහා විශේෂ මික්සර් හෝ ඉන්ජෙක්ෂන් දාහක භාවිතා කරනු ලැබේ.
ප්රාථමික වාතයේ අඩු අන්තර්ගතයක් සහිතව, චාලක මූලධර්මයට අනුව, වායුව සමඟ මිශ්රණයේ ඔක්සිජන් භාවිතා කරන තෙක් දහනයේ ආරම්භක අදියර පමණක් ඉදිරියට යයි. අසම්පූර්ණ දහනයේ ඉතිරි වායූන් හා නිෂ්පාදන බාහිර ඔක්සිජන් (ද්විතියික වාතය) හේතුවෙන් දහනය වේ, එනම්. z හි d සහ f f සහ මූලධර්මය මත m ගැන n ගැන. At 1 දී< 1 у факела есть два видимых фронта горения: внутренний, возникающий за счет первичного воздуха, и наружный, образующийся за счет диффузии кислорода из окружающей среды. Общая высота пламени при таком горении возрастает, а температура - несколько снижается. Устойчивость пламени и его прозрачность зависят от содержания первичного воздуха в смеси: чем оно выше, тем ниже устойчивость пламени, больше его прозрачность, и наоборот.
Gas 1 සමඟ වායුව දහනය කිරීමේ මූලධර්මය< 1,0 является п р о м е ж у т о ч н ы м (между кинетическим и диффузионным). С учетом этого принципа конструируются все газовые аппараты с инжекционными горелками. В таких горелках содержание первичного воздуха в смеси принимается в зависимости от вида газа таким, чтобы:
- ගින්නෙහි දුමාර අංශු නොතිබුණි;
- ප්රායෝගිකව අවශ්ය ඕනෑම සීමාවක තාප බලයේ වෙනස්වීම් සමඟ දහනයේ ස්ථායිතාව සහතික කිරීම.
විසරණය කිරීමේ මූලධර්මය සමඟ (α 1 = 0), දහනය හා මිශ්ර කිරීමේ ක්රියාවලීන් සමාන්තරව වර්ධනය වේ. මිශ්ර කිරීමේ ක්රියාවලීන් දහනය කිරීමේ ක්රියාවලියට වඩා මන්දගාමී වන හෙයින්, දහනයේ වේගය හා සම්පූර්ණත්වය තීරණය වන්නේ වායුව හා වාතය මිශ්ර වීමේ වේගය හා සම්පූර්ණත්වය අනුව ය. මෙම අවස්ථාවේ දී, වායුව විසරණය මගින් වාතය සමඟ මිශ්ර කළ හැකිය (මන්දගාමී අණුක හෝ කැළඹිලි සහිත, අණුක ද ඇතුළුව අවසාන අදියර). ඒ අනුව, දැවෙන වේගය සහ විසරණය වන දැල්ලේ ව්යුහය වෙනස් වේ.
මෙම පිළිස්සීමේ ලක්ෂණ:
- වෙන්වීමේ කොන්දේසි අනුව ශුන්යයේ සිට උපරිමයට තාප බලය වෙනස් වීමත් සමඟ ගිනි ස්ථායිතාව;
- ගින්නෙහි උස පුරා උෂ්ණත්වයේ නියතතාව;
- විශාල අත්තනෝමතික පෘෂ් on යන් මත එය බෙදා හැරීමේ හැකියාව;
- සංයුක්ත දාහක සහ නිෂ්පාදන පහසුව;
- ගිනිදැල් වල සැලකිය යුතු උස සහ පයිරොලිටික් ක්රියාවලීන්ගේ නොවැළැක්විය හැකි බව නිසා දීප්තිමත් දීප්තිමත් දැල්ලක් ඇති වේ.

රූපය. 8.11. නිදහස් ගිනිදැල් වල ව්යුහය:
a - ලැමිනාර් දැල්ල; b - කැළඹිලි දැල්ල
දහන ක්රියාවලියට වඩා මිශ්රණය ඉදිරියෙන් සිටී නම් විසරණය දහනය චාලක හෝ අතරමැදි වෙත මාරු කළ හැකිය. ප්රායෝගිකව බලහත්කාරයෙන් වායු සැපයුමෙන් මෙය සාක්ෂාත් කරගත හැකි අතර එය විනිවිද පෙනෙන පන්දමක දැවෙන α 1\u003e 1.0 සමඟ අර්ධ-සමජාතීය වායු-වායු මිශ්රණයක් සෑදීමට හේතු වේ.
අත්තික්කා පුළුස්සා දැමීමේ මූලධර්ම නිදර්ශනය කිරීම. 8.11. නොමිලේ පන්දම් යෝජනා ක්රම ලබා දී ඇත: ලැමිනාර් සහ කැළඹිලි. ලැමිනාර් පන්දම සිදුවන්නේ වායුවේ හා වාතයේ අන්යෝන්ය අණුක විසරණය නිසාය. කේතු හරය 1 ඇතුළත ලැමිනර් ප්රවාහ තන්ත්රයක් තුළ නළයෙන් පිටවන පිරිසිදු වායුවකි. කලාප 2 දී - වායුව හා දහන නිෂ්පාදන 3 වන කලාපයේ - දහන හා වාතයේ නිෂ්පාදන මිශ්රණයකි. බෝඩර් 4 යනු සුමට කේතුකාකාර ගිනි දැල්ලක් වන අතර එය වායු අණු පිටතින් විහිදෙන අතර ඇතුළත සිට වායු අණු වේ. දහනයේ නිෂ්පාදන අර්ධ වශයෙන් වායුව දෙසට විහිදෙන අතර එය පෙර ගිනි කලාපයේ දැඩි ලෙස රත් කරයි. මෙය හයිඩ්රොකාබන වල පිරොලයිසිස් හා සුමට අංශු සෑදීමට තුඩු දෙන අතර දැල්ලට දීප්තිමත් දීප්තියක් ලබා දෙයි.
මිශ්ර ප්රවාහවල කැළඹිලි ස්වභාවය නිසා දහනය තීව්ර කළ හැකිය. කැළඹිලි සහිත විදුලි පන්දමෙහි පැහැදිලි කේතුකාකාර දහන ඉදිරිපස නොමැත, එය “නොපැහැදිලි” වන අතර ස්පන්දන මගින් වෙනම අංශු වලට බෙදී යයි.
ගිනි ව්යුහය සමන්විත වන්නේ පිරිසිදු ගෑස් හරය 1, සාපේක්ෂව මන්දගාමී දැවෙන කලාප 2, දහන නිෂ්පාදනවල ඉහළ අන්තර්ගතයක් සහිත වඩාත් තීව්ර දැවෙන 3 හි විසරණය වන කලාපය සහ එහි වාතය ප්රමුඛ වන දැවෙන කලාප 4 ය. කලාප අතර පැහැදිලිව අර්ථ දක්වා ඇති සීමාවන් නොමැත; ඒවා ප්රවාහ කැළඹිලි මට්ටම අනුව අඛණ්ඩව මාරු කරනු ලැබේ. කැළඹිලි සහිත විදුලි පන්දමේ ලක්ෂණ:
- පරිමාව පුරාම පාහේ දැවෙන ක්රියාවලිය;
- දහනයේ තීව්රතාවය වැඩි කිරීම;
- ගින්නෙහි වැඩි විනිවිදභාවය;
- වෙන්වීමට සාපේක්ෂව එහි අඩු ස්ථායිතාව.
කැළඹිලි සහිත ගෑස් දැල්වීම විවිධ බොයිලේරු සහ aces ෂ්මකවල aces ෂ්මකවල බහුලව භාවිතා වේ. දහන ක්රියාවලිය තීව්ර කිරීම සඳහා ස්වාභාවික (වැඩි වේගය හේතුවෙන්) සහ ප්රවාහයන් කෘතිමව කැළඹීම සඳහා යොදා ගනී, නිදසුනක් ලෙස, වායු ප්රවාහය විකෘති කිරීමෙන් සහ තුනී ගෑස් ජෙට් විවිධ කෝණවලින් පෝෂණය කිරීමෙන්.
8.11. අසම්පූර්ණ සංයුතිය හා අඩුකිරීමේ නිෂ්පාදන සැකසීම සඳහා වන කොන්දේසි හානිකර උපසිරැසි සම්මුතිය
දහනය කළ හැකි වායූන් දහනය කරන විට, දහන නිෂ්පාදනවල සම්පූර්ණ (කාබන් ඩයොක්සයිඩ් සහ ජල වාෂ්ප) සහ අසම්පූර්ණ දහනය (කාබන් මොනොක්සයිඩ්, හයිඩ්රජන්, අසංතෘප්ත, සංතෘප්ත, ඇරෝමැටික හයිඩ්රොකාබන් සහ සබන්) යන සං components ටක අඩංගු විය හැකිය. මීට අමතරව, දහන නිෂ්පාදනවල නයිට්රජන් ඔක්සයිඩ් සෑම විටම දක්නට ලැබේ. සැලකිය යුතු සාන්ද්රණයන්හි අසම්පූර්ණ දහනය කිරීමේ නිෂ්පාදන තිබීම පිළිගත නොහැකිය, මන්ද එය විෂ සහිත ද්රව්ය සමඟ වායුගෝලය දූෂණය වීමට සහ ගෑස් බලයෙන් ක්රියාත්මක වන ස්ථාපනයන්හි කාර්යක්ෂමතාව අඩුවීමට හේතු වේ.
ඒවායේ ඉහළ අන්තර්ගතයට ප්රධාන හේතු:
- ප්රමාණවත් වාතය සහිත දැවෙන වායූන්;
- දහනය කිරීමේ ක්රියාවලියට පෙර සහ අතරතුර දහනය කළ හැකි වායූන් හා වාතය දුර්වල ලෙස මිශ්ර කිරීම;
- දහන ප්රතික්රියා සම්පූර්ණ කිරීම සඳහා දැල්ල අධික ලෙස සිසිල් කිරීම.
මීතේන් සඳහා, දහන ප්රතික්රියා (ප්රතික්රියා මිශ්රණයේ ඇති ඔක්සිජන් සාන්ද්රණය මත පදනම්ව) පහත සමීකරණ මගින් විස්තර කළ හැකිය:
CH 4 + 2O 2 = CO 2 + 2H 2 O + 800.9 MJ / mol
ස්ටොයිකියෝමිතික අනුපාතය හෝ ඔක්සිකාරක අතිරික්තයක් ඇති විට;
CH 4 + O 2 = CO + H 2 + H 2 O + Q සහ CH 4 + 0.5O 2 = CO + 2H 2 O + Q
ඔක්සිකාරක කාරකයක් නොමැතිකම සමඟ.

රූපය. 8.12. අතරමැදි දහන නිෂ්පාදන

රූපය. 8.13. ප්රාථමික වාතයේ අන්තර්ගතය
එය සෑදීම වළක්වයි
කහ දිව දිවෙන්
ගෑස්: 1 - කෝක්;
2 - ස්වාභාවික වායු ක්ෂේත්ර;
3 - තෙල් බිම්;
4 - ප්රොපේන්; 5 - බියුටේන්
අත්තික්කා වලින්. 8.12 සමහර අතරමැදියන්ගේ ආසන්න සාමාන්ය සංයුතිය පෙන්නුම් කරයි - හයිඩ්රජන්, කාබන් මොනොක්සයිඩ්, එතිලීන්, ඇසිටිලීන් සහ සාපේක්ෂව කුඩා සංතෘප්ත හා සරල ඇරෝමැටික සංයෝග - සහ ස්වාභාවික වායුව විසුරුවා හැරීමේදී (97%) ගිනිදැල් තුළ නිපදවන කාබන් ඩයොක්සයිඩ්. ලැමිනර් පිහාටුවක වායුව පුළුස්සා දැමූ අතර, විෂ්කම්භය 12 මි.මී. ගින්නෙහි මුළු උස 130-140 මි.මී.
හයිඩ්රජන් හා ඇසිටිලීන් වල උපරිම සාන්ද්රණය ගින්නෙහි එකම උසකට ළඟා වන අතර, ඒවා එකවරම පාහේ දැල්ලෙහි දීප්තිමත් කලාපයේ මුදුනෙහි අතුරුදහන් වේ. ගිනිදැල් තුළ ඇති සියලුම අතරමැදි සංයෝගවලින් (සබන් අංශු හැර) කාබන් මොනොක්සයිඩ් අවසන් වරට අතුරුදහන් වේ. මෙය වායු දහනයෙහි සම්පූර්ණත්වය පිළිබඳ දර්ශකය අනුව විනිශ්චය කිරීමට හේතු සපයයි. දහන නිෂ්පාදනවල නයිට්රජන් ඔක්සයිඩ් සෑම විටම පවතී, එහි උපරිම සාන්ද්රණය කාබන් මොනොක්සයිඩ් හා හයිඩ්රජන් වලින් දැවෙන කලාපවල හට ගනී.
ඔක්සිකාරක කාරකයක් නොමැති හයිඩ්රොකාබන් වායූන් දහනය කිරීමෙන් සිනිඳු අංශු සෑදීමට තුඩු දෙන අතර දැල්ලට කහ පැහැයක් ලබා දේ. දුමාරය දහනය කිරීමේ ක්රියාවලිය අදියර හා සාපේක්ෂව සෙමින් සිදු වේ. සමහර විට, සෑදී ඇති පස් අංශු දහනය කිරීම ප්රමාද වන අතර විදුලි පන්දමේ අඩු උෂ්ණත්ව කලාපයට ඇතුළු වන විට හෝ තාප හුවමාරු පෘෂ් aces යන් ගින්නෙන් සෝදා හරින විට සම්පූර්ණයෙන්ම නතර විය හැකිය. මේ අනුව, දිලිසෙන දැල්ලක් සෑම විටම පෙන්නුම් කරන්නේ පයිරොලයිටික් ක්රියාවලීන් සිදුවීම සහ රසායනික අසම්පූර්ණ දහනය කිරීමේ හැකියාව, විශේෂයෙන් කුඩා ආවරණ සහිත බොයිලේරු aces ෂ්මකවල ය.
හයිඩ්රොකාබන් වායූන් ප්රමාණවත් ලෙස ඔක්සිකාරක කාරකයක් සමඟ මිශ්ර කිරීමෙන් පොඟවා අංශු සෑදීම වැළැක්විය හැකිය. විනිවිද පෙනෙන දැල්ලක් සිදුවන මිශ්රණයේ ඇති ප්රාථමික වාතයේ අන්තර්ගතය හයිඩ්රොකාබන වර්ගය මත පමණක් නොව ද්විතියික වාතය (දාහකයන්ගේ වෙඩි තැබීමේ නාලිකා වල විෂ්කම්භය) සමඟ මිශ්ර වීමේ කොන්දේසි මත රඳා පවතී (රූපය 8.13). මායිමේ සහ වක්රයට ඉහළින්, දැල්ල විනිවිද පෙනෙන අතර, වක්රයට පහළින් කහ දිව ඇත. වක්රය පෙන්නුම් කරන්නේ අණුවේ ඇති කාබන් පරමාණු ගණන වැඩි වීමත්, දාහකයන්ගේ වෙඩි තැබීමේ නාලිකා වල විෂ්කම්භයත් සමඟ මිශ්රණයේ ඇති ප්රාථමික වාතයේ අන්තර්ගතය වැඩි වන බවයි. මිශ්රණයේ ඇති අතිරික්ත ප්රාථමික වාතය α 1 හි සංගුණකය, කහ ගිනිදැල් අතුරුදහන් වන අතර, නිශ්චිත සාධක මත පදනම්ව දාහකයන්ගේ කුඩා ගිනි නාලිකා සඳහා තීරණය කළ හැකිය:
α 1 = 0.12 (m + n / 4) 0.5 (d k / d 0) 0.25 (8.35)
m සහ n යනු අණුවක ඇති කාබන් සහ හයිඩ්රජන් පරමාණු ගණන හෝ සංකීර්ණ වායුවක් සඳහා ඒවායේ සාමාන්ය සංඛ්යාව ය; d k - දාහකයේ ගිනි නාලිකා වල විෂ්කම්භය, mm; d 0 යනු දාහක නාලිකාවේ (1 මි.මී.) යොමු විෂ්කම්භයයි.
ප්රායෝගික තත්වයන් යටතේ දහනයේ සම්පූර්ණත්වය සහතික කිරීම තරමක් සංකීර්ණ කාර්යයක් වන අතර එය වායු දහනය කිරීමේ මූලධර්මය මත පමණක් නොව, උදුන පරිමාවේ ගිනි සංවර්ධනයේ කොන්දේසි මත ද රඳා පවතී. දහනය සම්පූර්ණ කිරීම සඳහා ඉහළම අවශ්යතා වන්නේ දහන නිෂ්පාදන වායුගෝලයට දමනු ලබන ගෘහ උපකරණ සහ වෙනත් ස්ථාපනයන් මත ය. එවැනි ස්ථාපනයන්හි වායුව දහනය කිරීම වඩාත් අපහසු වන්නේ එය සීතල තාප හුවමාරු පෘෂ් aces යන් දැල්ලකින් සේදීම සමඟ සම්බන්ධ වී ඇති බැවිනි. ගෘහස්ථ උදුනෙහි වායුව දහනය කිරීම සඳහා, එන්නත් බහුකාර්ය දාහක භාවිතා කරනු ලබන අතර එය ප්රාථමික වායු අතිරික්ත සංගුණකය α 1 සමඟ සමජාතීය මිශ්රණයක් සාදයි.< 1. Недостающий для сгорания газа воздух поступает за счет диффузии из окружающей атмосферы.

රූපය. 8.14. කාබන් මොනොක්සයිඩ් සාන්ද්රණය
ගෑස් උදුනෙහි දහන නිෂ්පාදන වල
සහ - ද්විතියික වාතය පර්යන්ත සැපයුම සහිත පන්දමක්;
b - මධ්යම හා පර්යන්ත ද්විතියික වායු සැපයුම සමඟ
1 - ස්වාභාවික වායුව, පර්යන්ත දාහකය
ද්විතියික වාතය, බඳුනේ පතුලේ ඇති දුර 25 මි.මී.
2-4 - ස්වාභාවික වායුව, පර්යන්ත සහිත දාහකය සහ
ද්විතියික වාතය, දුර
පිඟානේ පහළට, mm: 2 - 25, 3 - 18, 4 - 10;
5 - ද්රව වායුව, මධ්යම හා පර්යන්ත සහිත දාහකය
ද්විතියික වාතය සැපයීම, බඳුනේ පතුලේ ඇති දුර 25 mm;
6 - ද්රව වායුව, පර්යන්ත දාහකය
අත්තික්කා වලින්. 8.14 මඟින් දේශීය වායු උදුන සඳහා 2-දාහක දාහක යෝජනා ක්රම සහ ස්වාභාවික මීතේන් (95 වෝල්.%) සහ ප්රොපේන් (93 වෝල්.%) දහන නිෂ්පාදනවල කාබන් මොනොක්සයිඩ් CO සාමාන්ය සාන්ද්රණය පෙන්නුම් කරයි. දාහක නාමික තාප ප්රතිදානයක් සමඟ ක්රියාත්මක වන විට. දාහකයන් අතර ඇති වෙනස නම් ද්විතීයික වාතය ඔවුන්ගෙන් එක් අයෙකුට සපයනු ලබන්නේ පරිධියේ සිට පමණක් වන අතර අනෙකට - පරිධියේ සිට සහ මධ්යම නාලිකාවෙන්.
වායු දහනයෙහි සම්පූර්ණත්වය රඳා පවතින්නේ මිශ්රණයේ ඇති ප්රාථමික වායු අතිරික්තයේ අනුපාතය, දාහකයේ ගිනි නාලිකා සිට කුක්වෙයාර් පතුලේ ඇති දුර, දහනය කළ හැකි වායුවේ වර්ගය සහ ද්විතියික වාතය සැපයීමේ ක්රමය මත ය. මිශ්රණයේ ඇති ප්රාථමික වාතයේ අන්තර්ගතය වැඩි වීම මෙන්ම දාහකයේ සිට පහළට කුක්වෙයාර් දක්වා ඇති දුර වැඩි වීම දහන නිෂ්පාදනවල කාබන් මොනොක්සයිඩ් සාන්ද්රණය අඩු වීමට හේතු වේ. කාබන් මොනොක්සයිඩ්වල අවම සාන්ද්රණය ප්රාථමික වායු අතිරික්තයේ සංගුණකය α 1 = 0.6 සහ ඊට ඉහළින් අනුරූප වන අතර දාහකයේ සිට කුක්වෙයාර් පතුලේ ඇති දුර 25 මි.මී. වන අතර උපරිම - α 1 = 0.3 සහ ඊට පහළින් සහ දාහකයේ සිට කුක්වෙයාර් පතුලේ ඇති දුර 10 මි.මී. ඊට අමතරව, වායු පීඩනය වැඩිවීම හේතුවෙන් දාහකවල තාප ප්රතිදානය 15-20% කින් වැඩිවීම දහන නිෂ්පාදනවල කාබන් මොනොක්සයිඩ් සාන්ද්රණය 1.2–1.3 ගුණයකින් වැඩි කිරීමට හේතු වන අතර වායුවේ දහනයෙහි තාපය හේතුවෙන් - 1.5–2 වාරයක්.
දහන ක්රියාවලියේදී ඇරෝමැටික සංයෝගවල පෙනුම කෙරෙහි විශේෂ අවධානයක් යොමු කළ යුතුය - බෙන්සීන්, පොලිසයික්ලික් බෙන්ස්පිරීන්, බෙසැන්ට්රසීන් යනාදිය ඒවායින් සමහරක් පිළිකා කාරක බැවින්. ඒවා සෑදීමේ ක්රියාවලිය ඉතා සංකීර්ණ වන අතර එය අදියර වශයෙන් ඉදිරියට යයි. පළමු අදියරේදී ඇසිටිලීන් සහ එහි ව්යුත්පන්නයන් පෙනේ. ගිනි කලාපයේ, මෙම ද්රව්ය ත්රිත්ව කාබන් බන්ධන ද්විත්ව බන්ධන ලෙස නැවත සකස් කිරීමත් සමඟ දාම විස්තාරණ ක්රියාවලියට භාජනය වේ. චක්රීයකරණය සහ විජලනය වීමේ ප්රති poly ලයක් ලෙස, බහු අවයවික ඇතුළු විවිධ ඇරෝමැටික සංයෝග පෙනේ.
වගුව 8.16. කාබන් මොනොක්සයිඩ් සහ බෙන්සෝ (අ) පයිරීන් වල දහන නිෂ්පාදනවල සාමාන්ය සාන්ද්රණය රඳා පවතින්නේ වායුවේ වර්ගය, දාහක වර්ගය සහ ප්රාථමික වායු අතිරික්තයේ සංගුණකය මත ය (දාහක තාප බර 1600 kcal / h, දාහකයේ සිට කුක්වෙයාර් පතුලේ ඇති දුර 24-26 මි.මී.)
| දාහකයේ වර්ගය | සාමාන්ය සාන්ද්රණය | |
|---|---|---|
| කාබන් මොනොක්සයිඩ්, mg / l (α = 1.0 අනුව) |
බෙන්සෝ (අ) පයිරීන්, mcg / 100 m 3 |
|
| ස්වාභාවික වායුව | ||
α i = 0,60 ÷ 0,70 විට |
0,10 | අනාවරණය වී නැත |
α i = 0,30 ÷ 0,35 විට |
1,20 | පාද සටහන් |
α i = 0,60 ÷ 0,70 විට |
0,50 | අනාවරණය වී නැත |
α i = 0,30 ÷ 0,35 විට |
0,12 | අනාවරණය වී නැත |
| ද්රව පෙට්රෝලියම් වායුව | ||
| ද්විතියික වාතය පර්යන්ත සැපයුම සහිත දාහකය: | ||
α i = 0,60 ÷ 0,70 විට |
0,30 | 0,03 |
α i = 0,30 ÷ 0,35 විට |
1,20 | 1,10 |
| මධ්යම හා පර්යන්ත ද්විතියික වායු සැපයුම සහිත දාහකය: | ||
α i = 0,60 ÷ 0,70 විට |
0,07 | 0,02 |
α i = 0,30 ÷ 0,35 විට |
1,00 | 0,045 |
දත්ත වගුව. 8.16 පෙන්නුම් කරන්නේ ප්රාථමික වායු අතිරික්ත සංගුණකය α 1 = 0.6 සහ ඊට වැඩි දාහක දෙකටම ස්වාභාවික වායූන් දහනය කරන විට, දහනය කිරීමේ කාබන් මොනොක්සයිඩ් නිෂ්පාදන සාන්ද්රණය GOST 5542-87 හි අවශ්යතා සපුරාලන බවයි.
වගුව 8.17. තනි පේළි ඉන්ජෙක්ෂන් දාහකවල වෙඩි තැබීමේ නාලිකා වල දාර අතර දුර, ඒවායේ ප්රමාණය සහ ප්රාථමික වායු අතිරික්තයේ සංගුණකය මත පදනම්ව
| ගිනි නාලිකා වල විෂ්කම්භය, මි.මී. | නාලිකා වල දාර අතර දුර, ප්රාථමික වායු අතිරික්ත සංගුණකයේ විවිධ අගයන් සඳහා mm 1 | ||||
|---|---|---|---|---|---|
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | |
| 2,0 | 11 | 8 | 6 | 5 | 4 |
| 3,0 | 15 | 12 | 9 | 7 | 5 |
| 4,0 | 16 | 14 | 11 | 9 | 7 |
| 5,0 | 18 | 15 | 14 | 12 | 10 |
| 6,0 | 20 | 18 | 16 | 14 | 12 |
ගිනිදැල් වේගයෙන් පැතිරීම සහතික කිරීම, ඒවා ඒකාබද්ධ වීම වැළැක්වීම, ඒවායේ ප්රමාණය හා මිශ්රණයේ ඇති ප්රාථමික වාතයේ අන්තර්ගතය මත රඳා පවතින අතර වෙඩි තැබීමේ නාලිකා වල දාර අතර ඇති දුර ප්රමාණය එහි වැඩිවීමත් සමඟ අඩු වන බව අධ්යයනවලින් හෙළි වී තිබේ. නාලිකා වල දාර අතර ප්රශස්ත දුර, වායු දහනය සහ වේගවත් ගිනි පැතිරීම ප්රමාණවත් බව සහතික කිරීම වගුවේ දක්වා ඇත. 8.17. පේළි දෙකකින් ගිනි නාලිකා එකතැන පල්වෙන ආකාරයට සකස් කිරීමත් සමඟ දාර අතර දුර එකම වගුවෙන් ගත හැකිය. මෙම අවස්ථාවේ දී, පේළි අතර දුර නාලිකා අතර දුරට වඩා 2-3 ගුණයක් දිගු විය යුතුය.

රූපය. 8.15. කාබන් මොනොක්සයිඩ් සාන්ද්රණය, ඇසිටිලීන්,
දහන නිෂ්පාදනවල එතේන්, එතිලීන් සහ බෙන්සෝ (අ) පයිරීන්
එන්නත් දාහකයක මධ්යම පීඩන වායුව
පරීක්ෂණාත්මක දත්ත රාශියක් සාමාන්යකරණය කිරීම මඟින් දහන ක්රියාවලිය ගුණාත්මකව හා ප්රමාණාත්මකව සංලක්ෂිත විවිධ සංරචකවල දහන නිෂ්පාදනවල සාමාන්ය සාන්ද්රණ වක්ර ලබා ගැනීමට අපට ඉඩ ලබා දී ඇත (රූපය 8.15). සමජාතීය වායු-වායු මිශ්රණයක පූර්ණ දහනය ලබා ගත හැක්කේ අතිරික්ත ප්රාථමික වාතයේ සංගුණකය α = 1.05 සහ ඊට වැඩි වූ විට පමණි. මිශ්රණයේ වාතය අඩු කරන විට, විශේෂයෙන් α විට< 1,0, возрастает концентрация оксида углерода СО, ацетилена С 2 Н 2 , этилена С 2 Н 4 , пропилена С 3 Н 6 и пропана С 3 Н 8 , а также бенз(а)-пирена С 20 Н 9 . Также возрастает концентрация и других компонентов - водорода, бензола и др.
අසම්පූර්ණ දහනයේ සැලකිය යුතු නිෂ්පාදන වලට අමතරව, ගෑස් දහනය කිරීමේදී සෑම විටම නිශ්චිත නයිට්රජන් ඔක්සයිඩ ප්රමාණයක් පැන නගී. ඒවා සෑදීම ප්රධාන දහන ප්රතික්රියා සම්පූර්ණ කිරීමෙන් පසුව සහ දහනය කිරීමේ ක්රියාවලියේදී ඉහළ උෂ්ණත්ව කලාපවල සිදු වේ. NO x හි උපරිම සාන්ද්රණය සිදුවන්නේ හයිඩ්රජන් සහ කාබන් මොනොක්සයිඩ් ස්වරූපයෙන් ගෑස් වියැකීම සහ අතරමැදි නිෂ්පාදන දැඩි ලෙස දහනය කිරීම ය.
වායු-වායු මිශ්රණ දහනය කිරීමේ මූලික සංයෝගය වන්නේ නයිට්රජන් ඔක්සයිඩ් ය. දාම ප්රතික්රියාවක ආරම්භය අණුක ඔක්සිජන් වි diss ටනය වීම හේතුවෙන් ඉහළ උෂ්ණත්ව කලාපවල සිදුවන පරමාණුක ඔක්සිජන් සමඟ සම්බන්ධ වේ:
O 2 - O 2O - 490 kJ / mol (8.36)
O + N 2 - ›NO + N - 300 kJ / mol (8.37)
N + O 2 - N 2NO + 145 kJ / mol (8.38)
ශේෂ ප්රතික්රියාව
N 2 + O 2 - N 2NO - 177 kJ / mol (8.39)
පරමාණුක ඔක්සිජන් සෑදීම ද දහන නිෂ්පාදනවල අර්ධ වශයෙන් වි ociation ටනය වන විට සිදු වේ: උෂ්ණත්වය අඩු වී ඔක්සිජන් පවතින බැවින්, පිහිටුවන ලද නයිට්රික් ඔක්සයිඩ් (1-3 වෝල්.%) නයිට්රජන් ඩයොක්සයිඩ් NO 2 වෙත ඔක්සිකරණය වේ. නයිට්රික් ඔක්සයිඩ් වායුගෝලයට මුදා හැරීමෙන් පසුව ප්රතික්රියාව වඩාත් තීව්ර වේ. බලපාන ප්රධාන සාධක:
- ප්රතික්රියා කලාපවල උෂ්ණත්වය;
- අතිරික්ත වායු අනුපාතය සහ ප්රතික්රියා කරන සංරචකවල සම්බන්ධතා කාලය.
ගින්නෙහි උෂ්ණත්වය රඳා පවතින්නේ වායුවේ රසායනික සංයුතිය, වායු-වායු මිශ්රණයේ ඇති වාතය, එහි සමජාතීයතාවයේ ප්රමාණය සහ ප්රතික්රියා කලාපයෙන් තාපය ඉවත් කිරීම මත ය. මෙම උෂ්ණත්වයේ දී හැකි උපරිම, නයිට්රික් ඔක්සයිඩ් සාන්ද්රණය, පමණ. % සූත්රයෙන් ගණනය කළ හැකිය
NO p = 4,6e -2150 / (RT) / √ O 2 N 2 (8.40)
NO p යනු නයිට්රික් ඔක්සයිඩ්වල සමතුලිත සාන්ද්රණය, වෙළුම. %; R යනු විශ්වීය වායු නියතය; T යනු නිරපේක්ෂ උෂ්ණත්වය, K; O 2 සහ N 2 - සාන්ද්රණය, පමණ. %, පිළිවෙලින් ඔක්සිජන් සහ නයිට්රජන්.
බලගතු වාෂ්ප උත්පාදක යන්ත්රවල සහ ඉහළ උෂ්ණත්වයේ විවෘත උදුන, කෝක් සහ ඒ හා සමාන aces ෂ්මකවල වායුව දහනය කරන විට සමතුලිතතාවයට අනුකූල නයිට්රික් ඔක්සයිඩ් ඉහළ සාන්ද්රණයක් ඇතිවේ. කුඩා හා මධ්යම ප්රමාණයේ බොයිලේරු වල, සැලකිය යුතු තාප සින්ක් සහිත කුඩා උනුසුම් හා තාප aces ෂ්මකවල සහ ඉහළ උෂ්ණත්ව කලාපවල කෙටි සංරචක පදිංචිය සඳහා, නයිට්රික් ඔක්සයිඩ්වල අස්වැන්න විශාලත්වයේ අඩු අනුපිළිවෙලකි. ඊට අමතරව, ඉහළ උෂ්ණත්ව කලාපයේ ප්රතික්රියා කරන සංරචකවල පදිංචිය කෙටි වීම, දහන නිෂ්පාදනවල අඩු නයිට්රික් ඔක්සයිඩ්.
විකිරණ දාහක සහ ද්රවකරණය කළ ඇඳෙහි වායුව දහනය කිරීම ද effective ලදායී වේ: මෙම අවස්ථා වලදී සමජාතීය වායු-වායු මිශ්රණයේ ක්ෂුද්ර ෆ්ලෑෂ් දහනය සිදුවන්නේ අතිරික්ත වායු සංගුණකය α = 1.05 සමඟ ප්රතික්රියා කලාපයෙන් ඉතා දැඩි තාප ඉවත් කිරීමෙනි. විකිරණ දාහකවල වායු දහනය කිරීමේදී නයිට්රජන් ඔක්සයිඩ සාන්ද්රණය 40 ක් පමණ වන අතර තරල කළ ඇඳෙහි එය 80–100 mg / m 3 වේ. විකිරණශීලී දාහක සහ ද්රව සහිත ඇඳෙහි වර්තන ධාන්ය වල වෙඩි තැබීමේ නාලිකා වල ප්රමාණය අඩු කිරීම නයිට්රජන් ඔක්සයිඩ්වල අස්වැන්න අඩු කිරීමට උපකාරී වේ.
සමුච්චිත දත්ත මගින් බොයිලේරු සහ උනුසුම් උපකරණ සැලසුම් කිරීමේදී වෙනස්කම් රාශියක් සිදු කිරීමට ඉඩ ලබා දී ඇති අතර එමඟින් අසම්පූර්ණ දහනයේ නිෂ්පාදනවල ඉහළ කාර්යක්ෂමතාව සහ අඩු සාන්ද්රණය පමණක් නොව නයිට්රජන් ඔක්සයිඩ වායුගෝලයට මුදා හැරීම ද අඩු වේ. මෙම වෙනස්කම් වලට ඇතුළත් වන්නේ:
- ඉහළ උෂ්ණත්ව උමං වල දිග අඩු කිරීම සහ ඒවා ගිනි උදුන තුළට ගෙනයාම;
- දුර්වල ලෙස විධිමත් හැඩයක් හෝ මුදු දැල්ලක් සහිත සිරුරු ස්වරූපයෙන් දහන ස්ථායීකාරක සෙරමික් උමං වෙනුවට භාවිතා කරන්න;
- වැඩි තාප හුවමාරු පෘෂ් with යක් සහිත පැතලි දැල්ලක් සංවිධානය කිරීම;
- දාහකයන්ගේ සංඛ්යාව වැඩිවීම හෝ බ්ලොක් දාහක භාවිතය හේතුවෙන් ගිනි විසිරීම;
- ප්රතික්රියා කලාපයට වායු සැපයුම;
- උදුනෙහි තාප ප්රවාහ ඒකාකාරව බෙදා හැරීම, aces ෂ්මක ආරක්ෂා කිරීම සහ ඒවා තිර මගින් මැදිරිවලට බෙදීම;
- වායු දහනය කිරීමේ විසරණය කිරීමේ මූලධර්මය භාවිතා කිරීම (විසරණය දහනය කිරීම අවසර දෙනුයේ තාප හුවමාරු පෘෂ් aces යන් සේදීමකින් තොරව දැල්ලේ නිදහස් සංවර්ධනය සහතික කළ හැකි අවස්ථාවන්හිදී පමණි).
නයිට්රජන් ඔක්සයිඩ්වල අස්වැන්න වඩාත් effective ලදායී ලෙස අඩු කිරීම ක්රම කිහිපයක් එකවර භාවිතා කිරීමෙන් සිදු වේ.
සාමාන්ය තොරතුරු. මිනිසුන් සඳහා ප්රබල සංවේදී සාධකයක් වන අභ්යන්තර දූෂණයට තවත් වැදගත් ප්රභවයක් වන්නේ ස්වාභාවික වායුව සහ එහි දහන නිෂ්පාදන ය. වායුව යනු විශේෂයෙන් එකතු කරන ලද ඒවා ඇතුළුව විවිධ සංයෝග දුසිම් ගණනකින් සමන්විත බහුකාර්ය පද්ධතියකි (වගුව
ස්වාභාවික ගෑස් (ගෑස් උදුන සහ බොයිලේරු) දහනය කරන උපකරණ භාවිතය මිනිස් සෞඛ්යයට අහිතකර ලෙස බලපාන බවට සෘජු සාක්ෂි තිබේ. මීට අමතරව, පාරිසරික සාධක කෙරෙහි වැඩි සංවේදීතාවයක් ඇති පුද්ගලයින් ස්වභාවික වායුවේ සං and ටක සහ එහි දහන නිෂ්පාදන වලට ප්රමාණවත් ලෙස ප්රතික්රියා නොකරයි.
නිවසේ ස්වාභාවික වායුව විවිධ දූෂකවල ප්රභවයකි. මේවාට වායුවේ සෘජුවම පවතින සංයෝග (ගන්ධ, වායුමය හයිඩ්රොකාබන්, විෂ සහිත කාබනික සංකීර්ණ හා විකිරණශීලී වායු රේඩෝන්), අසම්පූර්ණ දහනයේ නිෂ්පාදන (කාබන් මොනොක්සයිඩ්, නයිට්රජන් ඩයොක්සයිඩ්, එයරොසෝල් කාබනික අංශු, බහු අවයවික ඇරෝමැටික හයිඩ්රොකාබන සහ වාෂ්පශීලී කාබනික සංයෝග කුඩා ප්රමාණයක්) ඇතුළත් වේ. මෙම සියලු සංරචක මිනිස් සිරුරට තනිවම හා එකිනෙකා සමඟ සංයෝජනය විය හැකිය (සමමුහුර්ත ආචරණය).
වගුව 12.3
වායුමය ඉන්ධන වල සංයුතිය
ගන්ධයන්. ගන්ධයන් යනු සල්ෆර් අඩංගු කාබනික ඇරෝමැටික සංයෝග (මර්කැප්ටන්, තයියෝතර් සහ තියෝ-ඇරෝමැටික සංයෝග) ය. ඒවා ස්වාභාවික වායුවලට එකතු වන්නේ කාන්දුවීම් වලදී එය හඳුනා ගැනීම සඳහා ය. මෙම සංයෝග බොහෝ පුද්ගලයින්ට විෂ සහිත යැයි නොසැලකෙන ඉතා කුඩා, උපස්ථර සාන්ද්රණයන්හි පැවතුනද, ඒවායේ සුවඳ නිරෝගී පුද්ගලයින් තුළ ඔක්කාරය හා හිසරදය ඇති කරයි.
සායනික අත්දැකීම් සහ වසංගත දත්ත මගින් පෙන්නුම් කරන්නේ රසායනිකව සංවේදී පුද්ගලයින් සියුම් සාන්ද්රණයන්හි දී පවා පවතින රසායනික සංයෝගවලට ප්රමාණවත් ලෙස ප්රතික්රියා නොකරන බවයි. ඇදුම රෝගයෙන් පෙළෙන පුද්ගලයින් බොහෝ විට සුවඳ ඇදුම රෝගයේ ප්රවර්ධකයෙකු (ප්රේරකයක්) ලෙස හඳුනා ගනී.
ගන්ධයන්ට මෙතේනෙතියෝල් ඇතුළත් වේ. මීතේන්-ඕල්, මෙතිල් මර්කැප්ටන් (මර්කාප්ටෝමෙතේන්, තයොමෙටයිල් ඇල්කොහොල්) ලෙසද හැඳින්වේ. එය වායුමය සංයෝගයකි. එය ස්වාභාවික වායුවට ඇරෝමැටික ආකලන ලෙස බහුලව භාවිතා වේ. 140 ppm ට 1 කොටසක සාන්ද්රණයකින් බොහෝ දෙනෙකුට අප්රසන්න සුවඳ දැනේ; කෙසේ වෙතත්, මෙම සංයෝගය ඉතා අඩු සංවේදීතාවයකින් අඩු සාන්ද්රණයකින් හඳුනාගත හැකිය. සත්ව විෂ විද්යා අධ්යයනවලින් හෙළි වී ඇත්තේ 0.16% මෙතේනෙතියෝල්, 3.3% එතනෙතියෝල් හෝ 9.6% ඩිමෙටයිල් සල්ෆයිඩ් විනාඩි 15 ක් මෙම සංයෝගවලට නිරාවරණය වන මීයන්ගෙන් 50% ක් තුළ කෝමාටෝස් තත්වයක් උත්තේජනය කළ හැකි බවයි.
ස්වාභාවික වායුව සඳහා ඇරෝමැටික ආකලන ලෙස භාවිතා කරන තවත් මර්කැප්ටන් එකක් - මර්කාප්ටොතෙනෝල් සී 2 එච් 6 ඕඑස්) 2-තයොතෙනෝල්, එතිල් මර්කැප්ටන් ලෙසද හැඳින්වේ. ඇස් සහ සමට දැඩි ලෙස කෝප වන අතර සම හරහා විෂ සහිත බලපෑමක් ඇති කළ හැකිය. අධික ලෙස විෂ සහිත SOx වාෂ්ප සෑදීමට එය රත් වූ විට දිරාපත් වේ.
ගෘහස්ථ වායු දූෂක වන මර්කැප්ටන්වල සල්ෆර් අඩංගු වන අතර මූලද්රව්ය රසදිය අල්ලා ගැනීමේ හැකියාව ඇත. ඉහළ සාන්ද්රණයක දී, මර්කැප්ටාන් මගින් පර්යන්ත සංසරණය දුර්වල වීම සහ හෘද ස්පන්දන වේගය වැඩි වීම, සවි ness ් of ාණ අහිමි වීම, සයනොසිස් වර්ධනය හෝ මරණය පවා උත්තේජනය කළ හැකිය.
Aerosols. ස්වාභාවික වායුව දහනය කිරීමෙන් පිළිකා කාරක ඇරෝමැටික හයිඩ්රොකාබන මෙන්ම සමහර වාෂ්පශීලී කාබනික සංයෝග ද ඇතුළුව කුඩා කාබනික අංශු (එයරොසෝල්) සෑදීමට හේතු වේ. ඩොස් - “රෝගී ගොඩනැගිල්ලක” සින්ඩ්රෝමය මෙන්ම බහු රසායනික සංවේදීතාව (එම්එච්සී), අනෙකුත් සංරචක සමඟ ප්රේරණය කළ හැකි සංවේදී කාරක.
ගෑස් දහනය කිරීමේදී කුඩා ප්රමාණවලින් සෑදී ඇති ෆෝමල්ඩිහයිඩ් ද ඩොස්ට ඇතුළත් වේ. සංවේදී පුද්ගලයින් ජීවත්වන නිවසක ගෑස් උපකරණ භාවිතය මෙම උත්තේජකවලට නිරාවරණය වීම වැඩි කරයි, පසුව රෝගයේ රෝග ලක්ෂණ වැඩි කරන අතර තවදුරටත් සංවේදීතාවයට දායක වේ.
ස්වාභාවික වායුව දහනය කිරීමේදී ඇති වන වායුසෝලයන් වාතයේ පවතින විවිධ රසායනික සංයෝග සඳහා අවශෝෂණ මධ්යස්ථාන බවට පත්විය හැකිය. මේ අනුව, වායු දූෂකවලට ක්ෂුද්ර වෝල්ටීයතාවන්හි සංකේන්ද්රණය වී එකිනෙකා සමඟ ප්රතික්රියා කළ හැකිය, විශේෂයෙන් ලෝහ ප්රතික්රියා සඳහා උත්ප්රේරක ලෙස ක්රියා කරන විට. අංශුව කුඩා වන විට, එවැනි ක්රියාවලියක සාන්ද්රණ ක්රියාකාරිත්වය වැඩි වේ.
එපමණක් නොව, ස්වාභාවික වායුව දහනය කිරීමේදී ඇති වන ජල වාෂ්ප යනු වායුගෝලීය අංශු හා දූෂක ද්රව්ය පු pul ් ary ුසීය ඇල්වෝලියාවට මාරු කරන විට ප්රවාහනය කිරීමකි.
ස්වාභාවික වායුව දහනය කිරීමේදී, බහු අවයවික ඇරෝමැටික හයිඩ්රොකාබන අඩංගු aerosols ද සෑදී ඇත. ඒවා ශ්වසන පද්ධතියට අහිතකර ලෙස බලපාන අතර ඒවා පිළිකා කාරක වේ. ඊට අමතරව, හයිඩ්රොකාබන මගින් අවදානමට ලක්වන පුද්ගලයින් තුළ නිදන්ගත විෂ සහිත වීමට හේතු වේ.
ස්වාභාවික වායුව දහනය කිරීමේදී බෙන්සීන්, ටොලුයින්, එතිල්බෙන්සීන් සහ සයිලීන් සෑදීම ද මිනිස් සෞඛ්යයට අහිතකර ය. බෙන්සීන් එළිපත්තට වඩා බෙහෙවින් අඩු මාත්රාවලින් පිළිකා කාරක ලෙස හැඳින්වේ. බෙන්සීන් වලට නිරාවරණය වීම පිළිකා ඇතිවීමේ අවදානම, විශේෂයෙන් ලියුකේමියාව සමඟ සම්බන්ධ වේ. බෙන්සීන් වල සංවේදීකරණ බලපෑම් නොදනී.
සංවිධානාත්මක සංයුක්ත. සමහර ස්වාභාවික වායු සංරචකවල ඊයම්, තඹ, රසදිය, රිදී සහ ආසනික් ඇතුළු විෂ සහිත බැර ලෝහවල ඉහළ සාන්ද්රණයක් අඩංගු විය හැකිය. ට්රයිමෙතිලාර්සෙනයිට් (සීඑච් 3) 3 ඒ වැනි කාබනික ලෝහමය සංකීර්ණ ස්වරූපයෙන් මෙම ලෝහ ස්වාභාවික වායුවේ පවතී. මෙම විෂ සහිත ලෝහවල කාබනික අනුකෘතිය සමඟ ඇති සම්බන්ධතාවය ලිපිඩවල ද්රාව්ය කරයි. මෙය ඉහළ මට්ටමේ අවශෝෂණයකට සහ මිනිස් ඇඩිපෝස් පටක වල ජෛව ගණනය කිරීමේ ප්රවණතාවයකට මග පාදයි. ටෙට්රමෙතිල්ප්ලම්බිට් (සීඑච් 3) 4 පීබී සහ ඩිමෙතිල්මර්කුරි (සීඑච් 3) 2 එච්ජී වල ඉහළ විෂ වීම මිනිස් සෞඛ්යයට බලපෑමක් ඇති කරයි, මන්ද මෙම ලෝහවල මෙතිලීකරණය කළ සංයුතිය ලෝහවලට වඩා විෂ සහිත බැවිනි. කාන්තාවන්ගේ කිරි දෙන කාලය තුළ මෙම සංයෝග විශේෂයෙන් භයානක වන්නේ මෙම අවස්ථාවේ දී ලිපිඩ ශරීරයේ මේද තැන්පතු වලින් සංක්රමණය වන බැවිනි.
ඩිමෙතිල්මර්කුරි (CH3) 2Hg යනු අධික ලිපොෆිලිසිටි බව නිසා විශේෂයෙන් භයානක කාබනික ලෝහමය සංයෝගයකි. මෙතිල්මර්කුරි ආශ්වාසයෙන් මෙන්ම සම හරහා ශරීරයට ඇතුළත් කළ හැකිය. ආමාශ ආන්ත්රයික පත්රිකාවේ මෙම සංයෝගය අවශෝෂණය 100% ක් පමණ වේ. බුධ ග්රහයාට උච්චාරණය කරන ලද නියුරොටොක්සික් බලපෑමක් ඇති අතර මිනිස් ප්රජනක ක්රියාකාරිත්වයට බලපෑම් කිරීමේ දේපල ඇත. විෂ විද්යාවට ජීවීන් සඳහා ආරක්ෂිත රසදිය මට්ටම පිළිබඳ දත්ත නොමැත.
ආසනික් වල කාබනික සංයෝග ද ඉතා විෂ සහිත වේ, විශේෂයෙන් ඒවායේ පරිවෘත්තීය විනාශය (පරිවෘත්තීය සක්රීය කිරීම) සමඟ ඉහළ අකාබනික අකාබනික ආකාර ඇති වේ.
ස්වාභාවික වායු දහනයේ නිෂ්පාදන. නයිට්රජන් ඩයොක්සයිඩ් පු pul ් ary ුසීය පද්ධතිය මත ක්රියා කිරීමට සමත් වන අතර එමඟින් අනෙකුත් ද්රව්ය වලට ආසාත්මිකතා වර්ධනයට පහසුකම් සපයයි, පෙනහළු ක්රියාකාරිත්වය අඩු කරයි, ආසාදිත පෙනහළු රෝග වලට ගොදුරු වීමේ හැකියාව සහ බ්රොන්පයිල් ඇදුම සහ අනෙකුත් ශ්වසන රෝග ඇති කරයි. මෙය ළමුන් තුළ විශේෂයෙන් උච්චාරණය වේ.
ස්වාභාවික වායුව දහනය කිරීමෙන් නිපදවන N02 වලට හේතු විය හැකි බවට සාධක ඇත:
- පු pul ් ary ුසීය පද්ධතියේ දැවිල්ල සහ වැදගත් පෙනහළු ක්රියාකාරිත්වය අඩුවීම;
- හුස්ම හිරවීම, හුස්ම හිරවීම සහ රෝගය වැළඳීම වැනි ඇදුම වැනි රෝග ලක්ෂණ වැඩි වීමේ අවදානම. ගෑස් උදුන මත ආහාර පිසින කාන්තාවන් තුළ මෙන්ම ළමුන් තුළද මෙය බහුලව දක්නට ලැබේ;
- පෙනහළු ආරක්ෂණයේ ප්රතිශක්තිකරණ යාන්ත්රණයන්හි අඩුවීමක් හේතුවෙන් බැක්ටීරියා පෙනහළු රෝගවලට ඇති ප්රතිරෝධය අඩු කිරීම;
- මිනිසුන්ගේ සහ සතුන්ගේ ප්රතිශක්තිකරණ පද්ධතියට අහිතකර බලපෑම් ඇති කිරීම;
- අනෙකුත් සංරචක වලට ආසාත්මිකතා ප්රතික්රියා වර්ධනය කිරීමට සහායකයකු ලෙස නිරාවරණය වීම;
- සංවේදීතාව වැඩි කිරීම සහ අහිතකර අසාත්මිකතාවන්ට අසාත්මිකතා වැඩි කිරීම.
ස්වාභාවික වායුවේ දහන නිෂ්පාදනවල පරිසරය දූෂණය කරන හයිඩ්රජන් සල්ෆයිඩ් (H2S) තරමක් ඉහළ සාන්ද්රණයක් ඇත. එය 50.ppm ට වඩා අඩු සාන්ද්රණයක විෂ වන අතර 0.1-0.2% සාන්ද්රණයක මාරාන්තික වේ. ශරීරයට මෙම සංයෝගය ඩෙටොක්සයිෆ් කිරීමේ යාන්ත්රණයක් ඇති හෙයින්, හයිඩ්රජන් සල්ෆයිඩ්වල විෂ වීම නිරාවරණ කාලයට වඩා එහි බලපෑම් සාන්ද්රණය සමඟ සම්බන්ධ වේ.
හයිඩ්රජන් සල්ෆයිඩ්වල ප්රබල ගන්ධයක් තිබුණද, එහි අඛණ්ඩ අඩු සාන්ද්රණ බලපෑම නිසා සුවඳ පිළිබඳ හැඟීම නැති වී යයි. නොදැනුවත්වම මෙම වායුවේ භයානක මට්ටම්වලට නිරාවරණය වන පුද්ගලයින්ට විෂ සහිත බලපෑමක් ඇති කිරීමට මෙය හේතු වේ. වාසස්ථානවල වාතයේ ඇති සැලකිය යුතු සාන්ද්රණයන් ඇස් සහ නාසය සහ උගුර කෝපයට හේතු වේ. මධ්යස්ථ මට්ටම් නිසා හිසරදය, කරකැවිල්ල මෙන්ම කැස්ස සහ හුස්ම ගැනීමේ අපහසුතා ඇති වේ. ඉහළ මට්ටම් කම්පනය, කම්පනය, කෝමා වැනි රෝග වලට ගොදුරු වේ. හයිඩ්රජන් සල්ෆයිඩ්වල උග්ර විෂ සහිත බලපෑම් වලින් පසුව දිවි ගලවා ගත් අය, ඇම්නේෂියා, කම්පනය, අසමතුලිතතාවය සහ සමහර විට වඩාත් බරපතල මොළයට හානි වැනි ස්නායු ආබාධ ඇති වේ.
සාපේක්ෂව ඉහළ හයිඩ්රජන් සල්ෆයිඩ් සාන්ද්රණයක උග්ර විෂ වීම ප්රකට කරුණකි, කෙසේ වෙතත්, අවාසනාවකට මෙන්, මෙම සං .ටකයේ නිදන්ගත අඩු ROS නිරාවරණය පිළිබඳ තොරතුරු නොමැත.
රේඩොන් රේඩෝන් (222Rn) ස්වාභාවික වායුවෙහි ද ඇති අතර එය නල මාර්ගයෙන් ගෑස් උදුන වෙත ලබා දිය හැකි අතර එය පරිසර දූෂණයට හේතු වේ. රේඩෝන් ඊයම් දිරාපත් වන හෙයින් (210Pb හි අර්ධ ආයු කාලය දින 3.8 කි), මෙය පයිප්ප හා උපකරණවල අභ්යන්තර පෘෂ් aces යන් ආවරණය කරන විකිරණශීලී ඊයම් තුනී ස්ථරයක් (සාමාන්ය thickness ණකම 0.01 සෙ.මී.) නිර්මාණය කිරීමට හේතු වේ. විකිරණශීලී ඊයම් තට්ටුවක් සෑදීම විකිරණශීලීතාවයේ පසුබිම් අගය විනාඩියකට විසුරුවා හැරීම් දහස් ගණනකින් වැඩි කරයි (සෙන්ටිමීටර 100 ක භූමි ප්රමාණයකට වඩා). එය ඉවත් කිරීම ඉතා අපහසු වන අතර පයිප්ප ප්රතිස්ථාපනය කිරීම අවශ්ය වේ.
විෂ සහිත බලපෑම් ඉවත් කිරීමට සහ රසායනිකව සංවේදී රෝගීන්ට සහනයක් ගෙන ඒමට ගෑස් උපකරණ ක්රියා විරහිත කිරීම පමණක් ප්රමාණවත් නොවන බව මතක තබා ගත යුතුය. වැඩ නොකරන ගෑස් උදුනක් පවා වසර ගණනාවක් තිස්සේ එය අවශෝෂණය කර ඇති ඇරෝමැටික සංයෝග විමෝචනය කරන බැවින් ගෑස් උපකරණ පරිශ්රයෙන් සම්පූර්ණයෙන්ම ඉවත් කළ යුතුය.
ස්වාභාවික වායුවේ සමුච්චිත බලපෑම්, ඇරෝමැටික වල බලපෑම, මිනිස් සෞඛ්යයට දහන නිෂ්පාදන නිශ්චිතවම නොදනී. සංයෝග කිහිපයක බලපෑම ගුණ කළ හැකි යැයි උපකල්පනය කර ඇති අතර, දූෂක කිහිපයක බලපෑමෙන් ලැබෙන ප්රතිචාරය පුද්ගල බලපෑම්වල එකතුවට වඩා වැඩි විය හැකිය.
මේ අනුව, මිනිස් හා සත්ව සෞඛ්යය ගැන සැලකිලිමත් වන ස්වාභාවික වායුවේ ලක්ෂණ:
- ගිනි අවුලුවන සහ පුපුරන සුළු;
- asfixic ගුණාංග;
- පරිශ්රයේ වායු දූෂණය;
- විකිරණශීලී මූලද්රව්ය (රේඩෝන්) පැවතීම;
- අධික විෂ සහිත සංයෝගවල දහන නිෂ්පාදනවල අන්තර්ගතය;
- විෂ සහිත ලෝහවල හෝඩුවාවක් තිබීම;
- ස්වාභාවික වායුවට එකතු කරන විෂ සහිත ඇරෝමැටික සංයෝගවල අන්තර්ගතය (විශේෂයෙන් බහු රසායනික සංවේදීතාවන් ඇති පුද්ගලයින් සඳහා);
- සංවේදී කිරීමට වායු සංරචක වලට ඇති හැකියාව.
A.S. ඉසර්ලින්
දහන ක්රියාවලියේ පදනම වන්නේ ඔක්සිකාරක කාරකයක් සමඟ ඉන්ධන ඒකාබද්ධ කිරීමේ රසායනික ප්රතික්රියා ය. ගෑස් දහනය කිරීමේ ක්රියාවලිය සඳහා විශේෂ කොන්දේසි නිර්මාණය කළ යුතුය. පළමුව, ප්රමාණවත් ඔක්සිකාරකයක් (බොහෝ විට වාතය) සැපයීම හා ඒවා මිශ්ර කිරීම අවශ්ය වේ. දෙවනුව, වායු-වායු මිශ්රණයට ගිනිගැනීමේ සාන්ද්රණ සීමාවන් තිබිය යුතු අතර ජ්වලන ප්රභවයක් නිර්මාණය කළ යුතුය. තෙවනුව, දහන ක්රියාවලියේ වර්ධනය සඳහා කොන්දේසි නිර්මානය කිරීම අවශ්ය වේ, එනම් යම් උෂ්ණත්ව මට්ටමක්.
මිශ්රණය සෑදීම (වාතය සමඟ වායුව ඒකාකාරව මිශ්ර කිරීම) සමස්ත දහන ක්රියාවලියේ එක් ප්රධාන අදියරකි. රසායනික ශක්තිය තාප ශක්තිය බවට පරිවර්තනය කිරීමේදී ඉන්ධන ගමන් කරන තවත් අදියරයන් බොහෝ දුරට රඳා පවතින්නේ මිශ්ර කිරීමේ ක්රියාවලිය මත ය. දහන කලාපයේ සෑම විටම ඉහළ උෂ්ණත්ව මට්ටමක් පිහිටුවා ඇති හෙයින්, රසායනික දහන ප්රතික්රියා සඳහා වැය කරන කාලය සෑම විටම මිශ්ර කිරීමේ ක්රියාවලියට ගතවන කාලයට වඩා සැලකිය යුතු තරම් අඩුය.
නවීන අදහස්වලට අනුකූලව වායු ප්රවාහය තුළ ගෑස් ඉන්ධන දහනය කිරීම චාලක හා විසරණය කිරීමේ මූලධර්ම මත පදනම් වේ.
දහනය කිරීමේ වේගය තීරණය කරන ගෑස් දහනයේ මුළු කාලය,
TP TS ~ 1 "~ X1
Ts යනු ඔක්සිකාරක කාරකය සමඟ වායුව මිශ්ර කිරීම සඳහා අවශ්ය වන මිශ්රණ කාලයයි; mx යනු රසායනික ප්රතික්රියා වල කාලයයි.
එම්.සී.<Стх, то практически тп«т*. В этом случае процесс протекает в кинетической области. Если же, наоборот, Тс^-Тх, то Тп»тс и, следовательно, процесс протекает в диффузионной области.
චාලක කලාපයේ දහන ක්රියාවලියේදී, දහනය වීමේ වේගය මෙම දහනය කළ මිශ්රණයේ ගුණාංග මත රඳා පවතී, ප්රතික්රියා පරිමාවේ උෂ්ණත්වය සහ දහන කලාපයේ ප්රතික්රියාකාරක සාන්ද්රණය, එනම් රසායනික චාලක නීති මගින් පාලනය වේ. ඒ අතරම, චාලක කලාපයේ ක්රියාවලියේ වේගය ජලවිදුලි සාධක මත රඳා නොපවතී, එනම් ප්රවාහ අනුපාතය මත ප්රතික්රියා කුටියේ ජ්යාමිතික මානයන් යනාදිය.
ඊට පටහැනිව, විසරණය වන කලාපයේ, ක්රියාවලියේ වේගය ජලවිදුලි සාධක මගින් තීරණය වන අතර එය චාලක මත රඳා නොපවතී. මෙම ප්රදේශය තුළ, දහනය කළ හැකි මිශ්රණයේ ගුණාංග සහ උෂ්ණත්ව සාධකය තීරණාත්මක කාර්යභාරයක් ඉටු කරයි. සාපේක්ෂව සරල ජලවිදුලි මාධ්යයන් මිශ්ර කිරීමේ තීව්රතාවයට බලපෑම් කළ හැකි අතර එමඟින් විසරණය වන පිහාටුවේ ලක්ෂණ වෙනස් වේ.
චාලක මූලධර්මය සමඟ, දාහකයේ සමජාතීය වායු-වායු මිශ්රණයක් සාදනු ලබන අතර එය දහන කුටියට පෝෂණය වේ. එබැවින්, එවැනි මිශ්රණයක් දහනය කිරීම සියලු ප්රධාන ලක්ෂණවල (තාප ආතතිය, අතිරික්ත වාතය ආදිය) නියත අගයකින් ඉදිරියට යයි. තනිකරම චාලක දහනය සිදුවන්නේ තත්වය යටතේ පමණි А 0 1,0. අ<1 кинетическое горение протекает лишь на первой стадии, т. е. до тех пор, пока не израсходован весь кислород смеси. Остаток горючих компонентов, разбавленных продуктами сгорания, может быть сожжен только при условии подвода дополнительного окислителя (воздуха).
දහනය කිරීමේ විසරණය කිරීමේ මූලධර්මය මඟින් මිශ්රණය ආරම්භයේදීම දැවී යන ක්රියාවලියක් මතුවීම සඳහා එවැනි තත්වයන් නිර්මාණය කිරීම අදහස් කරයි, එනම් ඉන්ධන සහ ඔක්සිකාරකය සුදුසු ප්රමාණාත්මක අනුපාතයකින් ස්පර්ශ වන විට. විසරණය දහනය කිරීමේ ක්රියාවලිය පාලනය කරනු ලබන්නේ දාහකයේ සැලසුම සහ මෙහෙයුම් පරාමිතීන් වෙනස් කිරීම මගින් මිශ්රණය සෑදීමේ තීව්රතාවය වෙනස් කිරීමෙනි. එහි ප්රති As ලයක් වශයෙන්, තාක්ෂණික අවශ්යතා මත පදනම්ව, මිශ්ර කලාපය කෙටි කිරීම හෝ එහි දිගුව ලබා ගත හැකිය.
ප්රායෝගිකව, ගෑස් දහනය බොහෝ විට භාවිතා කරනු ලැබේ, මෙම මූලධර්ම දෙකම ඒකාබද්ධ කරයි. මෙම අවස්ථාවේ දී, වාතයේ කොටසක් දාහකයේ ඇති වායුව සමඟ පූර්ව මිශ්ර වී ඇති අතර, ඉතිරි සියල්ල සම්පූර්ණ දහනය සඳහා අවශ්ය වන අතර එය සෘජුවම දහන කලාපයට පෝෂණය වේ. මෙම අනුපාතය වෙනස් කිරීමෙන් ඔබට ගෑස් පන්දමේ දිගට බලපෑම් කළ හැකිය. බොහෝ දාහකයන් තුළ වාත ප්රවාහයට යම් කෝණයකින් වායුව සපයනු ලැබේ.
බොහෝ අධ්යයනයන් මිශ්ර කිරීමේ ක්රියාවලිය අධ්යයනය සඳහා කැප කර ඇත. සාමාන්ය රටා කිහිපයක් සැකසීමට මෙය අපට ඉඩ දෙයි.
සෘජු ප්රවාහ ගෑස් දාහකයන් සඳහා, මිශ්ර කිරීම වඩා හොඳය, දාහකයේ හරස්කඩේ විශාල කොටස ගෑස් ජෙට් ආවරණය කරයි, එනම්, ගෑස් ජෙට් වල පරාසය වැඩි වේ. අධික වේගයෙන් ගලා බසින දාහක වලදී යමෙකු දිගු දුර ගෑස් ජෙට් සඳහා උත්සාහ නොකළ යුතුය.
වායු ප්රවාහයේ විකෘතිය වැඩි කිරීමෙන් දාහකයේ හරස්කඩට ඉහළින් වායුව හා වාතය නැවත බෙදා හැරීම, වාතය සමඟ වායුව මිශ්ර වීමේ තීව්රතාව වැඩි වීම සහ දාහකයේ ප්රතිලෝම ධාරා වල මධ්යම කලාපයේ වැඩි වීමක් සිදු වේ.
මිශ්ර කිරීමේ ක්රියාවලිය මත වායු ප්රවාහයේ ඇඹරීමේ බලපෑමේ ස්වභාවය අනෙක් තීරණය කරන පරාමිතීන් මත පදනම්ව වෙනස් වේ. මේ අනුව, දාහකයේ පර්යන්ත කලාපවලට වායුව සපයන විට (එහි වර්ගය නොසලකා), ප්රවාහ ඇඹරීම වැඩිවීම මිශ්රණය සෑදීමේදී සැලකිය යුතු දියුණුවක් ඇති කරයි. ඊට පටහැනිව, දාහකයේ මධ්යම කලාපයට ගෑස් සැපයූ විට, ඇඹරීමේ වර්ධනය, රීතියක් ලෙස, ක්රියාවලිය වැඩිදියුණු කිරීමට හේතු නොවේ, “විසඳුම.
අප පිළිස්සීම ලෙස හඳුන්වන සංසිද්ධිවල සංයෝජනය ඉදිරියට යා හැක්කේ එක් අනුක්රමයකින්, එක් අදියරක සිට තවත් අදියරකට පමණි. ස්ථාවර හරයක් සහිත ගෑස් සහ දියර ඉන්ධන දහනය කිරීමේ ස්ථායී තත්වයේ ක්රියාවලිය පිළිබඳ පහත රූපසටහන් ජීඑෆ් නෝර් විසින් ලබා දෙයි, එය ඔහු පේළියට කැඳවයි (රූපය 1). මූලික සංකීර්ණ පයිෙරොජනික් වියෝජනය අවශ්ය නොවන සරල අණු (උදාහරණයක් ලෙස හයිඩ්රජන්) වලින් සමන්විත ගෑස් ඉන්ධන දහනය කිරීමේදී සරලම ප්රවාහ ක්රමය සිදු වේ (රූපය 1, අ)ගෑස් හෝ ද්රව හයිඩ්රොකාබන් ඉන්ධන දහනය කරන්නේ කවදාද, ඒ 6
පේළියේ දහනය කිරීමේ ක්රියාවලිය සංකීර්ණ ය: තවත් අතරමැදි අවධියක් ඇත - පයිරජන් වියෝජනය. දියර ඉන්ධන සඳහා, මෙම අදියර වාෂ්පීකරණ අවධියට පෙර (රූපය 1.6). ප්රවාහ යෝජනා ක්රමය ක්රියාත්මක කිරීම සඳහා දහන කුටීරයේ ප්රමාණවත් උෂ්ණත්ව මට්ටමක් අවශ්ය වන අතර අඛණ්ඩ ප්රවාහයන්හි ඉන්ධන සහ ඔක්සිකාරක සපයනු ලැබේ. ප්රතික්රියා සම්පූර්ණ කිරීමෙන් පසු දහනය කිරීමේ නිෂ්පාදන දහන ප්රභවයෙන් අඛණ්ඩව ඉවත් කරනු ලැබේ.
වායුවේ වායු අන්තර්ගතය නිශ්චිත (එක් එක් වායුව සඳහා) සීමාවන් තුළ පවතින විට පමණක් ගෑස්-වායු මිශ්රණය දැල්වෙන බව දන්නා කරුණකි. අඩු වායු අන්තර්ගතයක් සහිතව, දහනය කිරීමේදී නිකුත් වන තාප ප්රමාණය මිශ්රණයේ යාබද ස්ථර ජ්වලන උෂ්ණත්වයට ගෙන ඒමට ප්රමාණවත් නොවේ. ගෑස්-වායු මිශ්රණයේ වායු අන්තර්ගතය අධික වූ විට ද එය නිරීක්ෂණය කෙරේ. දහන වාතයේ ඔක්සිජන් නොමැතිකම උෂ්ණත්ව මට්ටම අඩුවීමට හේතු වන අතර එහි ප්රති the ලයක් ලෙස මිශ්රණයේ යාබද ස්ථර රත් නොවේ
ෆ්ලෑෂ් පොයින්ට් මෙම අවස්ථා දෙක පහළ සහ ඉහළ ගිනිගැනීමේ සීමාවන්ට අනුරූප වේ (වගුව 1). එමනිසා, වායුව සමඟ වායුව මිශ්ර කිරීමට අමතරව, නිශ්චිත අනුපාතයකින්, මිශ්රණය ජ්වලනය සඳහා ආරම්භක කොන්දේසි නිර්මාණය කළ යුතුය.
|
වගුව / වාතයේ විවිධ වායූන්ගේ ගිනි අවුලුවන සහ ජ්වලන උෂ්ණත්වයේ සීමාවන්
|
දහනය කළ හැකි වායූන් ඔක්සිකරණය අඩු උෂ්ණත්වවලදී කළ හැකි නමුත් අඩු ප්රතික්රියා අනුපාතය හේතුවෙන් එය ඉතා සෙමින් ඉදිරියට යයි. උෂ්ණත්වය ඉහළ යන විට, ස්වයංක්රීයකරණය ආරම්භ වීමට පෙර ඔක්සිකරණ ප්රතික්රියා අනුපාතය වැඩිවේ (මන්දගාමී ඔක්සිකරණය වෙනුවට ස්වයංසිද්ධ දහනය කිරීමේ ක්රියාවලිය ආරම්භ වේ). මෙයින් අදහස් කරන්නේ ජ්වලන උෂ්ණත්වයට රත් කරන ලද දහනය කළ හැකි මිශ්රණයට එවැනි ශක්තියක් ඇති අතර එය පරිසරයට තාපය අහිමිවීම සඳහා වන්දි ගෙවීම පමණක් නොව, ජ්වලනය සඳහා දහන කලාපයට ඇතුළු වන වායු-වායු මිශ්රණය උණුසුම් කිරීම සහ සකස් කිරීම ද සපයයි.
ගෑස් ජ්වලන උෂ්ණත්වය ගෑස්-වායු මිශ්රණයේ දහනය කළ හැකි වායුවේ අන්තර්ගතය, පීඩනය, මිශ්රණය රත් කිරීමේ ක්රමය යනාදිය ඇතුළු සාධක ගණනාවක් මත රඳා පවතී. එබැවින් එය නිශ්චිත අගයක් නොවේ. පටිත්තෙහි. 1 මඟින් වාතයේ දැවෙන වායූන්ගේ ජ්වලන උෂ්ණත්වය පෙන්වයි.
ප්රායෝගිකව, දහනය කළ හැකි මිශ්රණ ජ්වලනය කිරීමේ ක්රම දෙකක් තිබේ: ස්වයං ජ්වලනය සහ ජ්වලනය.
සමඟ ස්වයං ජ්වලනය දහනය කළ හැකි වායු-වායු මිශ්රණයේ මුළු පරිමාව ක්රමයෙන් ජ්වලන උෂ්ණත්වයට ගෙන එනු ලබන අතර පසුව මිශ්රණය බාහිර තාප නිරාවරණයකින් තොරව දැල්වෙයි.
තාක්ෂණය බහුලව භාවිතා වන්නේ දෙවන ක්රමයයි ජ්වලනය. මෙම ක්රමයේදී, මුළු වායු-වායු මිශ්රණය ජ්වලන උෂ්ණත්වයට රත් කිරීම අවශ්ය නොවේ; සීතල මිශ්රණය පරිමාවේ එක් අවස්ථාවක දී ඉහළ උෂ්ණත්ව ප්රභවයක් (ස්පාර්ක්, උණුසුම් ශරීරය, නියමු දැල්ල ආදිය) දැල්වීමට ප්රමාණවත් වේ. එහි ප්රති As ලයක් ලෙස, ජ්වලනය ස්වයංක්රීයව ගිනිදැල් ප්රචාරණය මගින් මිශ්රණයේ සම්පූර්ණ පරිමාවට සම්ප්රේෂණය වන අතර එය ක්ෂණිකව සිදු නොවන නමුත් යම් අවකාශීය ප්රවේගයකින් යුක්ත වේ. මෙම වේගය හැඳින්වේ දැවෙන වේගය වායු-වායු මිශ්රණයේ දී එය දහනය ප්රවාහය සහ ස්ථාවර කිරීම සඳහා කොන්දේසි තීරණය කරන වැදගත්ම ලක්ෂණයයි. පහත දැක්වෙන පරිදි, දාහකයන්ගේ ස්ථායිතාව ගිනි පැතිරීමේ වේගය හා සම්බන්ධ වේ.
මේ අනුව, ගෑස් ඉන්ධන දහනය කිරීමේ ක්රියාවලිය සමන්විත වන්නේ වායුව සමඟ වායුව මිශ්ර කිරීම, ජ්වලන උෂ්ණත්වයට ලබාගත් මිශ්රණය රත් කිරීම, එය දැල්වීම සහ දහනය කිරීමේ ප්රතික්රියා සිදු කිරීමත් සමඟ තාපය මුදා හැරීමත් සමඟ ය. එපමණක් නොව, දහන ප්රතික්රියා ක්ෂණිකව පාහේ සිදුවන බැවින් වායුව සමඟ වායුව මිශ්ර කිරීම සහ මිශ්රණය රත් කිරීම බොහෝ වේලාවක් ගත වේ.
තාක්ෂණික ක්රියාවලිය මත පදනම්ව (බොයිලර් ඒකකයේ වාෂ්ප හා උණු වතුර නිෂ්පාදනය, උදුන ස්ථාපනය කිරීමේදී නිෂ්පාදන උණුසුම් කිරීම යනාදිය), දහන ක්රියාවලියට එහි අවසාන ලක්ෂණ වෙනස් කිරීමෙන් බලපෑම් කිරීම අවශ්ය වේ. පරිච්ඡේදයේ දක්වා ඇති විවිධ සැලසුම් ශිල්පීය ක්රම මගින් මෙය සාක්ෂාත් කරගනු ලැබේ. අයි.
වායු දහනය කිරීමේදී විදුලි පන්දමක පරිමාවේ උෂ්ණත්ව ක්ෂේත්රයන් අතිරික්ත වාතයේ විවිධ සංගුණක සමඟ සංසන්දනය කිරීමකි. එවැනි සංසන්දනයක් සඳහා උදාහරණයක් පය. 2 පරායත්තතාවයක් ලෙස තුණ්ඩ පිටවන විෂ්කම්භය 35 mm විෂ්කම්භයක් සහිත දාහකයක් සඳහා
|
|
කොහෙද සහ - දැල්ලෙහි වත්මන් උෂ්ණත්ව අගය, °; £ උපරිම - විදුලි පන්දමේ උපරිම උෂ්ණත්වය (මනින ලද), ° C; X.- මිනුම් ස්ථානයේ සිට විදුලි පන්දමේ ආරම්භය දක්වා දුර, m; ඇත - මිනුම් ස්ථානයේ සිට පන්දම් අක්ෂයට ඇති දුර, m; Th - දාහක තුණ්ඩයේ විෂ්කම්භය, m.
අත්තික්කා වලින්. 2 අතිරික්ත වාතයේ සංගුණක තුන සඳහා උෂ්ණත්ව ව්යාප්තියේ ප්රස්තාර පෙන්වයි. සහ ඛණ්ඩාංක X / d= O දාහකයේ තුණ්ඩයේ ප්රතිදාන කොටස හා ඛණ්ඩාංකයට අනුරූප වේ යූ / ඩී= 0 - පන්දම් අක්ෂය.
රූපයෙන් දැකිය හැකි පරිදි, නිදහස් විදුලි පන්දමේ උෂ්ණත්ව ව්යාප්තිය අසමාන වේ. ප්රාථමික වාතයේ කුඩා අතිරික්තයන් සමඟ, උදාහරණයක් ලෙස, a = 0.5, ප්ලූම් තුළ අභ්යන්තර හරයක් පැවතීම උෂ්ණත්ව ක්ෂේත්රය බෙහෙවින් විකෘති කරන අතර එය පෙලගැසී ඇත්තේ x / s / = 10 ට පමණක් වන අතර, = 0.75 දී පෙළගැස්වීම දැනටමත් සිදු වේ X / d= 2.5, සහ ඊට පෙර = 1.0 සමඟ - සමඟ X / d = 1.0.
විදුලි පන්දමේ අක්ෂයට වඩා දුරින් ආරම්භක කොටස්වල විවෘත විදුලි පන්දම්වල ඉහළම උෂ්ණත්වය නිරීක්ෂණය කෙරේ Y / d =0.5, පසුව විදුලි පන්දම මැද. තවද, අතිරික්ත වාතයේ සංගුණකය වැඩි වීමත් සමඟ උපරිම උෂ්ණත්වය දාහකයේ මුඛයට මාරු කරනු ලැබේ. ඉතින්, දුරින් මනිනු ලබන a = 0.75 හි ඉහළම උෂ්ණත්වය X / d= 2.5, සහ a = 1.0 විට - දුරින් X / d = 1.0.
 ප්ලූම් හි C02 හි උෂ්ණත්වය හා සාන්ද්රණය බෙදා හැරීම අපි ඒකාබද්ධව සලකා බලන විට, උපරිමය සමපාත වේ.
ප්ලූම් හි C02 හි උෂ්ණත්වය හා සාන්ද්රණය බෙදා හැරීම අපි ඒකාබද්ධව සලකා බලන විට, උපරිමය සමපාත වේ.
C02 හි උෂ්ණත්වය සහ අන්තර්ගතය. එහි ප්රති, ලයක් වශයෙන්, දැල්ලේ උපරිම උෂ්ණත්ව මට්ටම ද දහනය කළ හැකි පිළිස්සුම් මට්ටමේ උපරිම අගයට අනුරූප වේ.
වායුව දහනය කිරීමෙන් නිකුත් වන තාපයෙන් කොටසක් අහිමි වීම නොවැළැක්විය හැකිය. කෙසේ වෙතත්, දහන ක්රියාවලිය නිසි ලෙස කළමනාකරණය කිරීමෙන් ඒවා අවම මට්ටමකට අඩු කළ හැකිය. සලකා බලන්න. මෙම පාඩු පියවා ගැනීම.
ගෑස් ඉන්ධන දහනය කිරීමේදී පහත සඳහන් තාප අලාභ සිදු වේ: පිටතට යන වායූන් සමඟ, රසායනික අසම්පූර්ණ දහනයෙන් සහ පරිසරයට. ප්රතිලෝම ශේෂයේ තනි තාප අලාභ තීරණය කිරීම මත පදනම්ව, ඒකකයේ කාර්යක්ෂමතාව, ° / o ගණනය කළ හැකිය:
කොහෙද<72 - потери тепла с уходящими газами, %; - потери тепла
රසායනික අසම්පූර්ණ දහනයෙන්,%; Q5 - පරිසරයට තාප අලාභය,%.
පිටතට යන වායූන් සමඟ තාප අලාභය - ඒකකයෙන් පිටවන දහන නිෂ්පාදනවල භෞතික තාපය ප්රධාන ඒවා වේ. ඒවා මුළුමනින්ම තුරන් කිරීම කළ නොහැකි නමුත් අඩුවීමක් සඳහා උත්සාහ කිරීම අවශ්ය වේ. පිටවන වායූන් සමඟ තාප අලාභය වායූන්ගේ උෂ්ණත්වය හා ඒවායේ ප්රමාණය මත රඳා පවතී. නළ ගෑස් උෂ්ණත්වය අඩු වන තරමට තාපය අඩු වනු ඇත, එබැවින් සාධාරණ සීමාවන් තුළ නළ ගෑස් උෂ්ණත්වය අඩු කිරීමට ඔබ උත්සාහ කළ යුතුය. තාප අලාභය සඳහා නළ වායු උෂ්ණත්වයේ බලපෑම මේසයෙන් දැකිය හැකිය. 2
වගුව 2
|
ස්වාභාවික වායුව දහනය කිරීමේදී පිටතට යන වායූන් සමඟ තාප අලාභය,%
|
පිටතට යන වායූන්ගෙන් තාපය නැතිවීම සාමාන්යයෙන් ප්රකාශ වන්නේ පවතින මුළු තාපයේ ප්රතිශතයක් ලෙස ය, එනම් ඉන්ධන දහනය කිරීමේ තාපයෙන් ය. උදාහරණයක් ලෙස ස්වාභාවික වායුව දහනය කිරීමේදී තාප අලාභය 700 kcal / m3 නම්, එසේ නම්
700-100 ___ 24 ° /
ඒකකයෙන් පිටවන වායූන් ගණන දාහකය ක්රියා කරන අතිරික්ත වාතයේ සංගුණකය සහ චූෂණ කෝප්ප මත රඳා පවතී.
ඒකකයේ කාන්දුවීම් හරහා වාතය. දාහකයේ පිටවන ස්ථානයේ අතිරික්ත වාතයේ සංගුණකය සහ ඒකකයට වාතය උරා ගැනීම වැඩි වන තරමට පිටවන වායූන් සමඟ තාප අලාභය වැඩි වේ. පටිත්තෙන්. 2, aa = 1.2-5-1.6 සමඟ දහන නිෂ්පාදනවල සමස්ත අතිරික්ත වායු අනුපාතයෙහි වෙනසක් 10.5 සිට 13.2% දක්වා නළ වායූන් සමඟ තාප අලාභය වැඩි කරන බව පෙනේ (නියත නළ වායු උෂ්ණත්වයේ 240 ° C දී).
මේ අනුව, නළ වායූන් සමඟ තාප අලාභය අවම කිරීම සඳහා, අවම අවසර ලත් අතිරික්ත වායු අනුපාතය සහිත දහන ක්රියාවලියක් පැවැත්වීම, ඒකකයේ ඉහළම ity නත්වය සහතික කිරීම සහ නළ වායු උෂ්ණත්වය අඩු කිරීම සාක්ෂාත් කර ගැනීම අවශ්ය වේ.
රසායනික අසම්පූර්ණ වායු දහනයෙන් සිදුවන තාප අලාභ සිදුවන්නේ වාතය හිඟයක්, ගෑස් දාහකයක මිශ්ර වීම සහ දහන කලාපයේ උෂ්ණත්ව මට්ටමේ තියුණු අඩුවීමක් ඇති විටය. එහි ප්රති As ලයක් ලෙස වායුව දහනය කිරීම අසම්පූර්ණ හා දහනය කළ හැකි සංරචක (උදාහරණයක් ලෙස හයිඩ්රජන්, කාබන් මොනොක්සයිඩ් ආදිය) දහනය කිරීමේ නිෂ්පාදන සමඟ පිටවෙයි. මෙය ඉන්ධනවල රසායනික ශක්තිය අඩුවෙන් භාවිතා කිරීමට සහ ඒකකයේ කාර්යක්ෂමතාව අඩු කිරීමට හේතු වේ. දහන නිෂ්පාදනවල දහනය කළ හැකි සං components ටකවල කුඩා අන්තර්ගතයක් පවා රසායනික අසම්පූර්ණ දහනයෙන් සැලකිය යුතු තාප අලාභයක් සිදු කරයි. දහන නිෂ්පාදනවල 0.7% හයිඩ්රජන් සහ 0.5% කාබන් මොනොක්සයිඩ් අඩංගු යැයි සිතමු. ස්ථාපනය පිටුපස අතිරික්ත වායු අනුපාතයක් සහිත ඒකකයේ ස්වාභාවික වායුව පුළුස්සා දමනු ලැබුවේ a = 1.5. රසායනික අසම්පූර්ණ දහනයෙන් තාප අලාභය k 450 kcal / m3 හෝ
සහ ___ 450-100 පූ /
මේ අනුව, ඉහත උදාහරණයෙන්, දහන නිෂ්පාදනවල දහනය කළ හැකි සංරචක සම්පූර්ණයෙන්ම නොපැවතීම හෝ අවම අගය විය යුතු බව පෙනේ.
පරිසරයට සිදුවන තාප අලාභ සිදුවන්නේ ඒකකයේ බිත්ති අවට වාතයට වඩා ඉහළ උෂ්ණත්වයක් තිබීම හේතුවෙනි. මෙම පාඩු වල විශාලත්වය ප්රධාන වශයෙන් රඳා පවතින්නේ ඒකකයේ පිටත බිත්ති සහ සංසරණ වාතය අතර උෂ්ණත්ව වෙනස, බිත්ති මතුපිට ප්රමාණය, පෙදරේරු ද්රව්යයේ තාප සන්නායකතාවය සහ එහි .ණකම මත ය. පරිසරයට සිදුවන පාඩු න්යායාත්මකව ගණනය කරනු ලැබේ හෝ ඒකකයේ සැලසුම හා ක්රියාකාරිත්වය මත පදනම්ව තාප ගණනය කිරීමේ සම්මතයන්ගෙන් ගනු ලැබේ.
ඒකකයේ වායුව දහනය කිරීමේදී සිදුවන සියලු තාප අලාභයන් අපි සාරාංශ කොට ඒවා 100 සිට අඩු කළහොත්, අපි ඒකකයේ කාර්යක්ෂමතාව ලබා ගනිමු. උදාහරණයක් ලෙස, ඉහත අංක භාවිතා කරමින් ගන්න<75 равным 3,60%, тогда к. п. д. агрегата
ටී] = 100- (8.24 + 5.28 + 3.60) = 82.88% *
ගෑස් දහනය යනු පහත ක්රියාදාමයන්ගේ එකතුවකි:
Air දහනය කළ හැකි වායුව වාතය සමඟ මිශ්ර කිරීම,
The මිශ්රණය උණුසුම් කිරීම
දහනය කළ හැකි සංරචකවල තාප වියෝජනය,
The වාතයේ ඔක්සිජන් සමඟ දහනය කළ හැකි සං of ටකවල ජ්වලනය හා රසායනික සංයෝජනය, පන්දමක් සෑදීම හා දැඩි තාප උත්පාදනය සමඟ.
මීතේන් දහනය සිදුවන්නේ ප්රතික්රියාවෙනි:
CH 4 + 2O 2 = CO 2 + 2H 2 O.
ගෑස් දහනය සඳහා අවශ්ය කොන්දේසි:
දහනය කළ හැකි වායුව හා වාතය අවශ්ය අනුපාතය සහතික කිරීම,
Ign ජ්වලන උෂ්ණත්වයට උණුසුම.
ගෑස්-ගෑස් මිශ්රණය පහළ ජ්වලන සීමාවට වඩා අඩු නම්, එය දහනය නොවේ.
ඉහළ ජ්වලන සීමාවට වඩා ගෑස්-වායු මිශ්රණයේ වැඩි වායුවක් තිබේ නම්, එය සම්පූර්ණයෙන්ම දැවී නොයනු ඇත.
වායුවේ සම්පූර්ණ දහනය කිරීමේ නිෂ්පාදනවල සංයුතිය:
· CO 2 - කාබන් ඩයොක්සයිඩ්
· H 2 O - ජල වාෂ්ප
* N 2 - නයිට්රජන් (දහනය කිරීමේදී එය ඔක්සිජන් සමඟ ප්රතික්රියා නොකරයි)
ගෑස් අසම්පූර්ණ දහනය කිරීමේ නිෂ්පාදනවල සංයුතිය:
· CO - කාබන් මොනොක්සයිඩ්
· C - සබන්.
ස්වාභාවික වායුවේ 1 m 3 දහනය සඳහා වාතය 9.5m 3 ක් අවශ්ය වේ. ප්රායෝගිකව, වායු ප්රවාහය සෑම විටම වැඩි වේ.
ආකල්ප තථ්ය පරිභෝජනයන්යායාත්මකව වාතය අවශ්ය වියදමඅතිරික්ත වාතයේ සංගුණකය ලෙස හැඳින්වේ: α = L / L t.,
කොහේද: එල් - තථ්ය පරිභෝජනය;
L t - න්යායාත්මකව අවශ්ය ප්රවාහය.
අතිරික්ත වායු අනුපාතය සෑම විටම එකකට වඩා වැඩිය. ස්වාභාවික වායුව සඳහා එය 1.05 - 1.2 වේ.
2. ක්ෂණික ජල තාපකවල අරමුණ, උපාංගය සහ ප්රධාන ලක්ෂණ.
ගෑස් ජල තාපක ගලා යාම. ජලය නිස්සාරණය කිරීමේදී යම් උෂ්ණත්වයකට ජලය රත් කිරීමට නිර්මාණය කර ඇත.ප්රවාහය හරහා ගමන් කරන ජල තාපක තාප බලය මත පදනම්ව බෙදා ඇත: 33600, 75600, 105000 kJ, ස්වයංක්රීයකරණ මට්ටමට අනුව - ඉහළම සහ පළමු පන්ති වලට. කේ.පී.ඩී. ජල තාපක 80% ක්, ඔක්සයිඩ් අන්තර්ගතය 0.05% ට වඩා වැඩි නොවේ, චොපර් පිටුපස දහන නිෂ්පාදනවල උෂ්ණත්වය අවම වශයෙන් 180 ° C වේ. මූලධර්මය පදනම් වී ඇත්තේ ජලය ගන්නා කාලය තුළ ජලය රත් කිරීම මත ය.
ක්ෂණික ජල තාපකවල ප්රධාන නෝඩ් වන්නේ: ගෑස් දාහක උපාංගය, තාපන හුවමාරුව, ස්වයංක්රීය පද්ධතිය සහ ගෑස් අලෙවිසැල. අඩු පීඩන වායුව එන්නත් දාහකයට පෝෂණය වේ. දහන නිෂ්පාදන තාපන හුවමාරුකාරකයක් හරහා ගමන් කර චිමිනියට මුදා හරිනු ලැබේ. දහනයේ තාපය තාපන හුවමාරුව හරහා ගලා යන ජලයට මාරු කරනු ලැබේ. ගිනි කුටිය සිසිල් කිරීම සඳහා තාපකය හරහා ජලය ගලා යන දඟරයක් ලෙස සේවය කරයි. ගෑස් ක්ෂණික ජල තාපක ගෑස් පිටාර උපකරණ සහ තෙරපුම් බ්රේකර් වලින් සමන්විත වන අතර, කෙටිකාලීන තෙරපුම උල්ලං of නය වුවහොත් ගෑස් දැවෙන උපකරණයක දැල්ල වඳවීම වළක්වයි. චිමිනියට ප්රවේශ වීම සඳහා දුමාරයක් තිබේ.
ගෑස් ක්ෂණික ජල තාපකය - වී.පී.ජී.ආවරණයේ ඉදිරිපස බිත්තියේ: ගෑස් ටැප් පාලක තුණ්ඩයක්, සොලෙනොයිඩ් කපාටය ශක්තිජනක කිරීම සඳහා බොත්තමක් සහ ජ්වලනය සහ ප්රධාන දාහක දැල්ල නිරීක්ෂණය කිරීම සඳහා නැරඹුම් කවුළුවක්. දුම් පිටවන උපකරණයක් උපාංගයේ ඉහළින් පිහිටා ඇති අතර, උපාංගය ගෑස් හා ජල පද්ධතියට සම්බන්ධ කිරීම සඳහා ශාඛා පයිප්ප පතුලේ පිහිටා ඇත. වායුව සොලෙනොයිඩ් කපාටයට ඇතුළු වන අතර, ගෑස්-ගෑස් දාහක ඒකකයේ ගෑස් අවහිර කිරීමේ වෑල්ව අනුක්රමිකව නියමු දාහකය ක්රියාත්මක කර ප්රධාන දාහකයට ගෑස් සපයයි.
ජ්වලනයේ අනිවාර්ය ක්රියාකාරිත්වය සමඟ ප්රධාන දාහකයට ගෑස් පරිභෝජනය අවහිර කිරීම තාපගතිකයක් මඟින් ක්රියාත්මක වන විද්යුත් චුම්භක කපාටයක් මඟින් සිදු කෙරේ. ජල පරිභෝජනය පැවතීම මත පදනම්ව, ප්රධාන දාහකයට ගෑස් සැපයුම අවහිර කරනු ලබන්නේ ජල වාරණ කපාටයේ පටලයෙන් කඳ හරහා ධාවනය වන කපාටයක් මගිනි.
වායුමය ඉන්ධන දහනය කිරීම පහත සඳහන් භෞතික හා රසායනික ක්රියාවලීන්ගේ එකතුවකි: දහනය කළ හැකි වායුව වාතය සමඟ මිශ්ර කිරීම, මිශ්රණය උණුසුම් කිරීම, දහනය කළ හැකි සං of ටකවල තාප වියෝජනය, ජ්වලනය සහ වායු ඔක්සිජන් සමඟ දහනය කළ හැකි මූලද්රව්යවල රසායනික සංයෝජනය.
ගෑස්-වායු මිශ්රණයේ ස්ථායී දහනය කළ හැක්කේ දහනය කළ හැකි වායුව හා වාතය අවශ්ය ප්රමාණයට දහන පෙරමුණට අඛණ්ඩව සැපයීමෙනි, ඒවා තරයේ මිශ්ර කර ජ්වලන උෂ්ණත්වයට හෝ ස්වයං ජ්වලනයට රත් කරන්න (වගුව 5).
ගෑස්-වායු මිශ්රණය ජ්වලනය සිදු කළ හැකිය:
- ගෑස්-වායු මිශ්රණයේ මුළු පරිමාව ස්වයංක්රීයව ජ්වලන උෂ්ණත්වයට රත් කිරීම. මෙම ක්රමය අභ්යන්තර දහන එන්ජින්වල භාවිතා වන අතර එහිදී ගෑස්-වායු මිශ්රණය යම් පීඩනයකට වේගවත් සම්පීඩනය මගින් රත් කරනු ලැබේ;
- ජ්වලන විදේශීය ප්රභවයන් භාවිතා කිරීම (ජ්වලන යනාදිය). මෙම අවස්ථාවේ දී, සියලු ගෑස් / වායු මිශ්රණය ජ්වලන උෂ්ණත්වයට රත් නොකෙරේ, නමුත් එහි කොටසක්. ගෑස් දාහකවල වායූන් දහනය කිරීමේදී මෙම ක්රමය භාවිතා වේ;
- දැවෙන ක්රියාවලියේදී අඛණ්ඩව පවතින විදුලි පන්දම.
වායුමය ඉන්ධන දහනය ආරම්භ කිරීම සඳහා අණුක බන්ධන බිඳ දමා නව ඒවා නිර්මාණය කිරීම සඳහා යම් ශක්තියක් අවශ්ය වේ.
නිදහස් පරමාණු, රැඩිකලුන් සහ අනෙකුත් ක්රියාකාරී අංශු විශාල සංඛ්යාවක් මතුවීම හා අතුරුදහන් වීම හා සම්බන්ධ සමස්ත ප්රතික්රියා යාන්ත්රණය පෙන්නුම් කරන වායුමය ඉන්ධන දහනය සඳහා රසායනික සූත්රය සංකීර්ණ වේ. එබැවින්, සරල කිරීම සඳහා, ඔවුන් වායු දහනය කිරීමේ ප්රතික්රියා වල ආරම්භක හා අවසාන තත්වයන් ප්රකාශ කරන සමීකරණ භාවිතා කරයි.
හයිඩ්රොකාබන් වායූන් C m H n ලෙස දක්වන්නේ නම්, ඔක්සිජන් තුළ මෙම වායූන් දහනය කිරීමේ රසායනික ප්රතික්රියාව සමීකරණය කරයි.
C m H n + (m + n / 4) O 2 = mCO 2 + (n / 2) H 2 O,
m යනු හයිඩ්රොකාබන් වායුවේ ඇති කාබන් පරමාණු ගණන; n යනු වායුවේ ඇති හයිඩ්රජන් පරමාණු ගණන; (m + n / 4) - වායුවේ සම්පූර්ණ දහනය සඳහා අවශ්ය ඔක්සිජන් ප්රමාණය.
වායූන් දහනය කිරීම සඳහා වන සමීකරණ සූත්රයට අනුකූලව ව්යුත්පන්න කර ඇත:
- මීතේන් CH 4 + 2O 2 = СO 2 + 2Н 2 O.
- එතේන් සී 2 එච් 6 + 3,5O 2 = 2СO 2 + ЗН 2 ඕ
- බියුටේන් සී 4 එච් 10 + 6.5 ඕ 2 = 4СO 2 + 5Н 2 0
- ප්රොපේන් සී 3 එච් 8 + 5 ඕ 3 = ЗСО 2 + 4Н 2 ඕ.
වායු දහනයේ ප්රායෝගික තත්වයන් තුළ ඔක්සිජන් පිරිසිදු ස්වරූපයෙන් නොගන්නා අතර එය වාතයේ සංයුතියට ඇතුළත් වේ. වාතය පරිමාවෙන් නයිට්රජන් 79% කින් සහ ඔක්සිජන් 21% කින් සමන්විත වන බැවින් සෑම ඔක්සිජන් පරිමාවකටම 100: 21 = 4.76 වාතය පරිමාව හෝ 79: 21 = = 3.76 නයිට්රජන් පරිමාව අවශ්ය වේ. එවිට වාතයේ ඇති මීතේන් දහනය කිරීමේ ප්රතික්රියාව පහත පරිදි ලිවිය හැකිය:
CH 4 + 2O 2 + 2 * 3.76N 2 = CO 2 + 2H 2 O + 7.52N 2.
මීතේන් 1 m 3 දහනය කිරීම සඳහා ඔක්සිජන් 1 m 3 සහ නයිට්රජන් 7.52 m 3 හෝ වාතය 2 + 7.52 = 9.52 m 3 අවශ්ය බව සමීකරණයෙන් දැකිය හැකිය.
මීතේන් 1 m 3, කාබන් ඩයොක්සයිඩ් 1 m 3, ජල වාෂ්ප 2 m 3 සහ නයිට්රජන් 7.52 m 3 දහනය කිරීමේ ප්රති result ලයක් ලෙස ලබා ගනී. පහත වගුවේ දැක්වෙන්නේ වඩාත් සුලභ ගිනි අවුලුවන වායූන් සඳහා මෙම දත්තයි.
ගෑස්-වායු මිශ්රණයේ දහන ක්රියාවලිය සඳහා, වායු-වායු මිශ්රණයේ ඇති වායුව හා වාතය ප්රමාණය යම් සීමාවන් තුළ තිබිය යුතුය. මෙම සීමාවන් ගිනි අවුලුවන සීමාවන් හෝ පුපුරන සුලු සීමාවන් ලෙස හැඳින්වේ. පහළ සහ ඉහළ ගිනිගැනීමේ සීමාවන් ඇත. ජ්වලනය සිදුවන පරිමාව අනුව ප්රතිශතයකින් ප්රකාශිත ගෑස්-වායු මිශ්රණයේ අවම වායු අන්තර්ගතය අඩු ගිනි අවුලුවීමේ සීමාව ලෙස හැඳින්වේ. අතිරේක තාපය නොමැතිව මිශ්රණය දැල්වීමට වඩා ඉහළින් ඇති වායු-වායු මිශ්රණයේ උපරිම වායු අන්තර්ගතය ඉහළ ගිනි අවුලුවීමේ සීමාව ලෙස හැඳින්වේ.
සමහර වායූන් දහනය කිරීමේදී ඔක්සිජන් හා වාතය ප්රමාණය
|
අවශ්ය වායුව 1 m 3 දහනය කිරීම සඳහා m 3 |
1 m 3 වායුව දහනය කරන විට m 3 |
දහනයේ තාපය He, kJ / m 3 |
|||||
|
ඔක්සිජන් |
ඩයොක්සයිඩ් කාබන් |
||||||
|
කාබන් මොනොක්සයිඩ් |
|||||||
ගෑස්-වායු මිශ්රණයේ අඩු ගිනි අවුලුවන සීමාවට වඩා අඩු වායුවක් තිබේ නම් එය දහනය නොවේ. ගෑස්-වායු මිශ්රණයේ ප්රමාණවත් වාතය නොමැති නම්, දහනය සම්පූර්ණයෙන්ම ඉදිරියට යන්නේ නැත.
වායූන්ගේ නිෂ්ක්රීය අපද්රව්ය පුපුරන සුලු සීමාවන්හි විශාලත්වයට විශාල බලපෑමක් ඇති කරයි. වායුවේ බැලස්ට් අන්තර්ගතයේ වැඩි වීම (N 2 සහ CO 2) ගිනි අවුලුවීමේ සීමාවන් පටු කරන අතර, බැලස්ට් හි අන්තර්ගතය යම් සීමාවන්ට වඩා වැඩි වීමත් සමඟ ගෑස්-වායු මිශ්රණය කිසිදු වායුවක් හා වාතයක් සඳහා දැල්වෙන්නේ නැත (පහත වගුව).
නිෂ්ක්රීය වායුවේ පරිමාව දහනය කළ හැකි වායුවේ පරිමාව 1 ක් වන අතර එමඟින් වායු වායු මිශ්රණය පුපුරන සුලු වේ.
සම්පූර්ණ වායු දහනය සඳහා අවශ්ය කුඩාම වාතය න්යායාත්මක වායු ප්රවාහය ලෙස හැඳින්වෙන අතර එය ලුතිනන් විසින් දක්වනු ලැබේ, එනම් ගෑස් ඉන්ධනවල ශුද්ධ කැලරි වටිනාකම 33520 kJ / m නම් 3 1 න් දහනය කිරීම සඳහා න්යායාත්මකව අවශ්ය වාතය ප්රමාණය ගෑස් 3 ක්
එල්= (33 520/4190) / 1.1 = 8.8 m 3.
කෙසේ වෙතත්, සැබෑ වායු ප්රවාහය සෑම විටම න්යායාත්මක එක ඉක්මවා යයි. න්යායාත්මක වායු ප්රවාහය සමඟ සම්පූර්ණ වායු දහනය ලබා ගැනීම ඉතා අපහසු බව මෙය පැහැදිලි කරයි. එබැවින්, වායුව දහනය කිරීම සඳහා ඕනෑම ගෑස් ස්ථාපනයක් අතිරික්ත වාතය සමඟ ක්රියා කරයි.
ඉතින්, ප්රායෝගික වායු ප්රවාහය
L n = αL ටී,
කොහෙද එල් එන් - ප්රායෝගික වායු ප්රවාහය; α - අතිරික්ත වාතයේ සංගුණකය; එල් - න්යායාත්මක වායු ප්රවාහය.
අතිරික්ත වායු අනුපාතය සෑම විටම එකකට වඩා වැඩිය. ස්වාභාවික වායුව සඳහා, එය α = 1.05 - 1.2. සංගුණකය α සත්ය වායු ප්රවාහය න්යාය ඉක්මවා යන වාර ගණන පෙන්වයි. එසේ නම් α = 1, එවිට වායු-වායු මිශ්රණය හැඳින්වේ stoichiometric.
සමඟ α = 1.2 වායු දහනය 20% කින් අතිරික්ත වාතය සමඟ සිදු කෙරේ. රීතියක් ලෙස, වායූන් දහනය කිරීම a හි අවම අගයක් සහිතව සිදුවිය යුතුය, මන්දයත් අතිරික්ත වාතය අඩු වීමත් සමඟ නළ වායූන් සමඟ තාප අලාභය අඩු වේ. දහනය සඳහා සහභාගී වන වාතය ප්රාථමික හා ද්විතීයික වේ. ප්රාථමික වායුව සමඟ මිශ්ර කිරීම සඳහා දාහකයට ඇතුළු වන වාතය; ද්විතියික - දහන කලාපයට ඇතුළු වන වාතය වායුව සමඟ මිශ්ර නොව වෙන වෙනම.


 පර්ම් හි මීටර කියවීම් මාරු කරන්නේ කෙසේද?
පර්ම් හි මීටර කියවීම් මාරු කරන්නේ කෙසේද? මුළුතැන්ගෙයි තුවා සේදීම
මුළුතැන්ගෙයි තුවා සේදීම ජන පිළියම් වල බිත්ති මත අච්චුව ඉවත් කරන්නේ කෙසේද?
ජන පිළියම් වල බිත්ති මත අච්චුව ඉවත් කරන්නේ කෙසේද?