දහන ඔක්සිකරණය. දහන ක්\u200dරියාවලීන්ගේ භෞතික රසායනික පදනම්
සංකල්පයේ අර්ථ නිරූපනයේ වෙනස්කම් දැවෙන කතුවරුන්ගේ විද්\u200dයාත්මක අවශ්\u200dයතා දිශාව නිසා. අපගේ මතය අනුව, දහනය පිළිබඳ පහත දැක්වෙන අර්ථ දැක්වීම GPA කාර්ය මණ්ඩලයේ ප්\u200dරායෝගික අවශ්\u200dයතා සපුරාලයි.
පිළිස්සීම - එය ස්වයං-තිරසාර සංකීර්ණ භෞතික-රසායනික ක්\u200dරියාවලියක් වන අතර එය වේගයෙන් ගලා යන රසායනික ඔක්සිකරණ ප්\u200dරතික්\u200dරියා මත පදනම් වන අතර තාපය හා ආලෝකය විශාල ප්\u200dරමාණයක් නිකුත් වේ.
දහනය කිරීමේදී ප්\u200dරමුඛතම ක්\u200dරියාවලිය රසායනික ඔක්සිකරණ ප්\u200dරතික්\u200dරියාවකි; විවිධ භෞතික ක්\u200dරියාවලීන්ගේ පෙනුමට හේතුව මෙයයි: තාප හුවමාරුව, ප්\u200dරතික්\u200dරියාකාරක මාරු කිරීම, විකිරණ යනාදිය. මෙම භෞතික ක්\u200dරියාවලීන් ඔවුන්ගේම නීති අනුව වර්ධනය වේ. රසායනික ඔක්සිකරණ ක්\u200dරියාවලීන් ඒවායේ ප්\u200dරවාහ අනුපාතය අනුව විශාල විභවයක් ඇත, නමුත් සැබෑ ගින්න මත දැවෙන අනුපාතය අඩුය භෞතික ක්\u200dරියාවලීන්ගේ වේගය අනුව සීමා වේ.
දහනය කිරීමේදී සිදුවන රසායනික ප්\u200dරතික්\u200dරියා බහු ස්ථර වේ, ...
සහ වඩාත්ම වැදගත් දෙය නම් දාමය. සිදුවන ක්\u200dරියාවලීන්ගේ යාන්ත්\u200dරණය අවබෝධ කර නොගෙන, ගිනි පැතිරීමට හේතු, එහි වේගයෙහි වෙනස, දහන උෂ්ණත්වයේ විශාලත්වය යනාදිය තේරුම් ගත නොහැක.
දහනය අතරතුර රසායනික ප්\u200dරතික්\u200dරියා වල යාන්ත්\u200dරණය
“රසායනික චාලක විද්\u200dයාව” යන මාතෘකාව යටතේ රසායනික ප්\u200dරතික්\u200dරියා සිදුවන්නේ ප්\u200dරතික්\u200dරියාකාරක සංරචක (අණු, පරමාණු, රැඩිකලුන්) contact ජුව සම්බන්ධ වන නමුත් ඒවායේ ශක්තිය යම් ශක්ති සීමාවක් ඉක්මවා යන අවස්ථාවන්හිදී පමණි. දහනය කිරීමේදී ප්\u200dරතික්\u200dරියා කරන සංරචක (ඉන්ධන සහ ඔක්සිකාරක) සහ ප්\u200dරතික්\u200dරියා නිෂ්පාදනවල ශක්තිය ප්\u200dරස්ථාරිකව වෙනස් කරන්න (රූපය 1.1.)
අබ්සිස්සා අක්ෂය දහන ප්\u200dරතික්\u200dරියා මාර්ගය පෙන්වන අතර ඕඩිනේට් අක්ෂය ශක්තිය නියෝජනය කරයි. - ප්\u200dරතික්\u200dරියා කරන සංරචකවල සාමාන්\u200dය ආරම්භක ශක්තිය, - දහන නිෂ්පාදනවල සාමාන්\u200dය ශක්තිය.
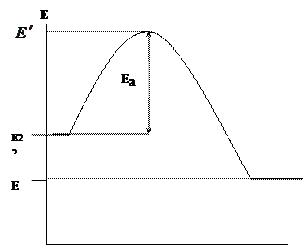 |
රූපය 1.1. දහනය කිරීමේදී ප්\u200dරතික්\u200dරියාකාරක සහ ප්\u200dරතික්\u200dරියා නිෂ්පාදනවල ශක්තිය වෙනස් වීම
අන්තර්ක්\u200dරියාකාරිත්වයට ඇතුළු වීමට අවශ්\u200dය ශක්තිය ඇති ඉන්ධන සහ ඔක්සිකාරක කාරකයේ ක්\u200dරියාකාරී අංශු පමණි, එනම්. බලශක්ති බාධකය ජය ගැනීමට හැකියාව ඇත. සාමාන්\u200dය ශක්තියට සාපේක්ෂව ක්\u200dරියාකාරී අංශුවල අතිරික්ත ශක්තිය සක්\u200dරීය ශක්තිය ලෙස හැඳින්වේ. දහනය කිරීමේදී සිදුවන ප්\u200dරතික්\u200dරියා බාහිර තාපය නිසා ![]() . සාදන ලද දහන නිෂ්පාදනවල ශක්තිය හා ආරම්භක ද්\u200dරව්\u200dය (ඉන්ධන සහ ඔක්සිකාරක) වල වෙනස ප්\u200dරතික්\u200dරියා වල තාප බලපෑම තීරණය කරයි:
. සාදන ලද දහන නිෂ්පාදනවල ශක්තිය හා ආරම්භක ද්\u200dරව්\u200dය (ඉන්ධන සහ ඔක්සිකාරක) වල වෙනස ප්\u200dරතික්\u200dරියා වල තාප බලපෑම තීරණය කරයි:
 |
දහනය කළ හැකි මිශ්\u200dරණයේ උෂ්ණත්වය වැඩිවීමත් සමඟ ක්\u200dරියාකාරී අණු වල අනුපාතය වැඩිවේ.
අවදානම් .1.2. උෂ්ණත්වයකදී අණු අතර ශක්ති ව්\u200dයාප්තිය පෙන්වයි.අපේ ශක්ති අක්ෂය දිගේ සක්\u200dරිය ශක්තියට සමාන අගයක් සටහන් කළහොත්, අපි ලබා දී ඇති උෂ්ණත්වයේ දී මිශ්\u200dරණයේ ඇති ක්\u200dරියාකාරී අණු වල භාගය ලබා ගනිමු. තාප ප්\u200dරභවයක ක්\u200dරියාකාරිත්වය යටතේ, මිශ්\u200dරණයේ උෂ්ණත්වය අගයක් දක්වා ඉහළ ගොස් තිබේ නම්, එවිට ක්\u200dරියාකාරී අණු වල අනුපාතය වැඩි වන අතර, එහි ප්\u200dරති the ලයක් වශයෙන් දහන ප්\u200dරතික්\u200dරියා වේගය වැඩි වේ.
කෙසේ වෙතත්, සැලකිය යුතු පූර්ව රත්කිරීමක දී ඒවායේ වර්ධනයට අවශ්\u200dය නොවන රසායනික ප්\u200dරතික්\u200dරියා ඇත. මේවා දාම ප්\u200dරතික්\u200dරියා.
දාම ප්\u200dරතික්\u200dරියා න්\u200dයායේ පදනම වන්නේ ආරම්භක ද්\u200dරව්\u200dය වහාම අවසන් නිෂ්පාදනයට පරිවර්තනය නොවන බවට උපකල්පනය කිරීමයි, නමුත් ක්\u200dරියාකාරී අතරමැදි නිෂ්පාදන ඇතිවීමත් සමඟ ය.
ප්\u200dරාථමික රසායනික ප්\u200dරතික්\u200dරියාවේ නිෂ්පාදිතයට විශාල ශක්තියක් ඇති අතර එය ප්\u200dරතික්\u200dරියාකාරක නිෂ්පාදනවල අණු ision ට්ටනය කිරීමේදී හෝ විකිරණ හේතුවෙන් අවට අවකාශයේ විසුරුවා හැරිය හැකි අතර ප්\u200dරතික්\u200dරියාකාරක සංරචකවල අණු වෙත මාරු කර ඒවා ක්\u200dරියාකාරී තත්වයකට පත් කළ හැකිය. ප්\u200dරතික්\u200dරියාකාරකවල මෙම ක්\u200dරියාකාරී අණු (පරමාණු, රැඩිකලුන්) ප්\u200dරතික්\u200dරියා දාමයක් ජනනය කරයි, එහිදී ශක්තිය එක් අණුවක සිට තවත් අණුවකට මාරු වේ. එබැවින් එවැනි ප්\u200dරතික්\u200dරියා දාම ප්\u200dරතික්\u200dරියා ලෙස හැඳින්වේ.

දාම ප්\u200dරතික්\u200dරියාවක මූලික අවධීන්හි පිහිටුවා ඇති රසායනිකව ක්\u200dරියාකාරී අණු, පරමාණු, රැඩිකලුන් - දාම සම්බන්ධතා - ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ලෙස හැඳින්වේ. ක්\u200dරියාකාරී මධ්\u200dයස්ථාන බොහොමයක් පරමාණු සහ රැඩිකලුන් වේ. නමුත් මේ නිසා ඒවා අස්ථායි, මන්ද අක්\u200dරීය නිෂ්පාදන ඇතිවීමත් සමඟ නැවත එක්වීමේ ප්\u200dරතික්\u200dරියා වලට ඇතුල් විය හැකිය.
එක් ආරම්භක සක්\u200dරීය මධ්\u200dයස්ථානයකින් සාදන ලද දාමයේ දිග, සබැඳි ලක්ෂ ගණනක් කරා ළඟා විය හැකිය. දාම ප්\u200dරතික්\u200dරියා වල චාලක නීති මූලික වශයෙන් රඳා පවතින්නේ එක් දාම සම්බන්ධකයක් තුළ ක්\u200dරියාකාරී මධ්\u200dයස්ථාන කීයක් පිහිටුවා ඇත්ද යන්න මතය. මුල් ක්\u200dරියාකාරී මධ්\u200dයස්ථානයේ සහභාගීත්වය ඇතිව, එක් ක්\u200dරියාකාරී මධ්\u200dයස්ථානයක් පමණක් සෑදී ඇත්නම්, එවැනි දාම ප්\u200dරතික්\u200dරියාවක් නොකැඩූ ලෙස හැඳින්වේ, නමුත් එක් දාම සම්බන්ධකයක් තුළ ක්\u200dරියාකාරී මධ්\u200dයස්ථාන දෙකක් හෝ වැඩි ගණනක් පිහිටුවා ඇත්නම්, මෙම දාම ප්\u200dරතික්\u200dරියාව අතු ලෙස හැඳින්වේ. අතු දාම ප්\u200dරතික්\u200dරියා වල වේගය හිම කුණාටුවක් මෙන් වැඩි වන අතර එය දහනය කිරීමේදී ඔක්සිකරණ රසායනික ප්\u200dරතික්\u200dරියා ස්වයං-ත්වරණයට හේතුවකි, මන්ද ඒවායින් බොහොමයක් අතු දාම ප්\u200dරතික්\u200dරියා වල යාන්ත්\u200dරණය ලක්ෂණයකි.
ඕනෑම දහන ප්\u200dරතික්\u200dරියාවක් පාහේ තාප හා දාම ප්\u200dරතික්\u200dරියා යාන්ත්\u200dරණයක සලකුණු තිබිය හැකිය. පළමු ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල මූලාරම්භය තාප ස්වභාවයක් විය හැකි අතර, දාම යාන්ත්\u200dරණයක් මඟින් ක්\u200dරියාකාරී අංශුවල ප්\u200dරතික්\u200dරියාව තාප උත්පාදනය, දහනය කළ හැකි මිශ්\u200dරණය උණුසුම් කිරීම සහ නව ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල තාප න්\u200dයෂ්ටිය සඳහා හේතු වේ.
ඕනෑම දාම ප්\u200dරතික්\u200dරියාවක් සමන්විත වන්නේ න්\u200dයෂ්ටිය, අඛණ්ඩව හා දාම අවසන් කිරීමේ මූලික අවධීන්ගෙනි.
දාම සම්භවයඅන්තරාසර්ග ප්\u200dරතික්\u200dරියාවකි. නිදහස් රැඩිකලුන් සෑදීම (එනම්, නිදහස් සංයුජතා ඇති පරමාණු හෝ පරමාණු කාණ්ඩ, උදාහරණයක් ලෙස, ![]() ) ආරම්භක ද්\u200dරව්\u200dයවල අණු වලින්, සමහර විට ඒකවර්ණ හෝ ද්වි අණුක අන්තර්ක්\u200dරියාකාරිත්වයේ ප්\u200dරති මෙන්ම, දහනය කළ හැකි මිශ්\u200dරණයට බාහිර බලපෑම්වල ප්\u200dරති result ලයක් ලෙස - ආරම්භය.
) ආරම්භක ද්\u200dරව්\u200dයවල අණු වලින්, සමහර විට ඒකවර්ණ හෝ ද්වි අණුක අන්තර්ක්\u200dරියාකාරිත්වයේ ප්\u200dරති මෙන්ම, දහනය කළ හැකි මිශ්\u200dරණයට බාහිර බලපෑම්වල ප්\u200dරති result ලයක් ලෙස - ආරම්භය.
විශේෂ ද්රව්ය එකතු කිරීමෙන් ආරම්භය සිදු කළ හැකිය. ආරම්භකයින්, පහසුවෙන් නිදහස් රැඩිකලුන් සෑදීම (නිදසුනක් ලෙස, පෙරොක්සයිඩ්, රසායනිකව ක්\u200dරියාකාරී වායූන්), අයනීකරණ විකිරණ ක්\u200dරියාකාරිත්වය යටතේ, ආලෝකයේ ක්\u200dරියාකාරිත්වය යටතේ - ඡායා රසායනික ආරම්භය. උදාහරණයක් ලෙස ක්ලෝරීන් සමඟ හයිඩ්\u200dරජන් අන්තර්ක්\u200dරියා කිරීම
![]()
සාමාන්\u200dය තත්වයන් යටතේ එය ඉතා සෙමින් ඉදිරියට යන අතර ශක්තිමත් ආලෝකකරණයක් යටතේ (හිරු එළියෙන් මැග්නීසියම් සමඟ දැවීම) එය පිපිරීමක් සමඟ ඉදිරියට යයි.
ප්\u200dරතික්\u200dරියා වලට දාම අඛණ්ඩව දාම ප්\u200dරතික්\u200dරියා වල මූලික අවධීන් ඇතුළත් වන අතර එමඟින් නිදහස් සංයුජතාව ආරක්ෂා කර ගැනීම සහ ආරම්භක ද්\u200dරව්\u200dයවල වියදම් හා ප්\u200dරතික්\u200dරියා නිෂ්පාදන සෑදීමට මග පාදයි.
දාම ආරම්භය:
![]()
දාම ශාඛා:
![]()
![]()
විවෘත පරිපථය:
සමජාතීය
![]()
විෂමජාතීය
දාමයේ වර්ධනයත් සමඟ, ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය ප්\u200dරමාණවත් තරම් විශාල වූ විට, නව ක්\u200dරියාකාරී මධ්\u200dයස්ථානයක් ජනනය නොකර ක්\u200dරියාකාරී මධ්\u200dයස්ථානය ප්\u200dරතික්\u200dරියා කරන එවැනි සම්බන්ධකයක් ඇති කළ හැකිය. මෙම සංසිද්ධිය දාම විවේකයක් ලෙස හැඳින්වේ.
විවෘත පරිපථය සමජාතීය හා විෂමජාතීය විය හැකිය.
ස්ථාවර නිෂ්පාදන සෑදීම සඳහා රැඩිකලුන් හෝ පරමාණු එකිනෙකා සමඟ අන්තර්ක්\u200dරියා කිරීමෙන් හෝ නව ක්\u200dරියාකාරී මධ්\u200dයස්ථාන උත්පාදනය නොකර ප්\u200dරධාන ක්\u200dරියාවලියට විදේශීය වන අණුවක් සමඟ ක්\u200dරියාකාරී මධ්\u200dයස්ථානයක ප්\u200dරතික්\u200dරියා කිරීමෙන් සමජාතීය දාම අවසන් කිරීම කළ හැකිය.
යාත්රාවේ බිත්ති මත විෂමජාතීය විවෘත පරිපථයක් ඇති වන අතර, දහන ප්\u200dරතික්\u200dරියාව හෝ gas න ක්ෂුද්\u200dර කොටස්වල පෘෂ් surface ය වායු අවධියේ පවතින අතර සමහර විට විශේෂයෙන් හඳුන්වා දෙනු ලැබේ (නිදසුනක් ලෙස කුඩු නිවා දමන විට මෙන්). විෂමජාතීය දාම බිඳවැටීමේ යාන්ත්\u200dරණය solid න අංශු හෝ ද්\u200dරව්\u200dය මතුපිට සක්\u200dරීය මධ්\u200dයස්ථානවල අවශෝෂණය සමඟ සම්බන්ධ වේ. විෂමජාතීය දාම අවසන් කිරීමේ වේගය දැඩි ලෙස රඳා පවතින්නේ දහනය සිදුවන යාත්\u200dරාවේ පරිමාවට බිත්තිවල මතුපිට ප්\u200dරමාණය හා අනුපාතය මත ය. මේ අනුව, යාත්රාවේ විෂ්කම්භය අඩු කිරීමෙන් දහන ප්රතික්රියාවේ වේගය සැලකිය යුතු ලෙස අඩු කරයි. ගිනි බාධක නිර්මාණය කිරීම මේ මත පදනම් වේ.
අතු දාම ප්\u200dරතික්\u200dරියාවකට උදාහරණයක් වන්නේ ඔක්සිජන් තුළ හයිඩ්\u200dරජන් දහනය කිරීමේ ප්\u200dරතික්\u200dරියාවයි.
දාම ආරම්භය:
![]()
දාම ශාඛා:
![]()
![]()
විවෘත පරිපථය:
සමජාතීය
![]()
විෂමජාතීය
හයිඩ්\u200dරොකාබන් දහනය
හයිඩ්\u200dරජන් සහ කාබන් මොනොක්සයිඩ්වල දහන ක්\u200dරියාවලීන් පරීක්ෂා කිරීමෙන් දහන ප්\u200dරතික්\u200dරියා යාන්ත්\u200dරණයේ සංකීර්ණත්වය පෙන්නුම් කරයි. H 2 සහ CO සම්බන්ධයෙන් ගත් කල, ප්\u200dරතික්\u200dරියාව බොහෝ මූලික අවධීන් සහ අතරමැදි නිෂ්පාදනවල සහභාගීත්වය සමඟ දාමයක් ලෙස ඉදිරියට යයි. එබැවින් වඩාත් සංකීර්ණ ද්\u200dරව්\u200dයවල දහන ප්\u200dරතික්\u200dරියා යාන්ත්\u200dරණය වන හයිඩ්\u200dරොකාබන වඩාත් සංකීර්ණ වන අතර මෙම සංයෝගවල ජ්වලනය හා දහනය කිරීමේ ක්\u200dරියාවලීන් සමඟ ඇති වන බලපෑම් වඩාත් විවිධාකාර වේ යැයි අපේක්ෂා කිරීම ස්වාභාවිකය.
හයිඩ්\u200dරොකාබන දහනය කිරීමේ ක්\u200dරියාවලියේදී රසායනික පරිණාමනය වීමේ ස්වභාවය පිළිබඳ දැනට පවතින තොරතුරු, නිරීක්ෂණය කරන ලද බලපෑම් යම් දළ වශයෙන් පැහැදිලි කිරීමට අපට ඉඩ සලසයි.
හයිඩ්\u200dරොකාබන් ගිනිදැල්වල, දැනටමත් දන්නා ක්\u200dරියාකාරී අංශු වන එච් ×, ඕඑච් ×, ඕ with සමඟ වඩාත් සංකීර්ණ ව්\u200dයුහයක අතරමැදි නිෂ්පාදන විශාල සංඛ්\u200dයාවක් ඇති බව තහවුරු විය. සමහර අවස්ථාවලදී ඒවා නව දාමයන් මතුවීමේ ප්\u200dරභවයන් බවට පත්වේ. හයිඩ්\u200dරොකාබන ජ්වලනය හා දහනය කිරීමේ ක්\u200dරියාවලීන්හි ප්\u200dරධාන කාර්යභාරය පහත දැක්වෙන අතරමැදි සංයෝග මගින් ඉටු කරයි:
1. හයිඩ්\u200dරොකාබන් අණුවක් වන හයිඩ්\u200dරොකාබන් රැඩිකලුන්, හයිඩ්\u200dරජන් පරමාණු එකක් හෝ කිහිපයක් ඉවත් කර ඇත. මෙම අපද්\u200dරව්\u200dය ඇල්කයිල් ලෙස හැඳින්වේ (CH 3 - මෙතිල්; සී 2 එච් 5 - එතිල්; සී 3 එච් 7 - ප්\u200dරොපයිල්, ආදිය). ඒවායේ ඉහළ ප්\u200dරතික්\u200dරියාකාරිත්වය හේතුවෙන් නිදහස් ඇල්කයිල් දිගු කාලයක් නොපවතී. අතරමැදි නිෂ්පාදන ලෙස ගිනිදැල් වල ඉදිරිපත් කරන්න. වෙනත් අණු සමඟ අන්තර්ක්\u200dරියා කරන විට ඒවා ස්වාධීන ව්\u200dයුහාත්මක කණ්ඩායමක් ලෙස හැසිරේ. හයිඩ්\u200dරොකාබන් රැඩිකල්ස්
සාමාන්\u200dයයෙන් ආර් අක්ෂරයෙන් නිරූපණය කෙරේ.
2. පෙරොක්සයිඩ් යනු R-OO-R ’යන පොදු සූත්\u200dරයේ සංයෝග වේ.
3. ඇල්ඩිහයිඩ් - වර්ග සංයෝග
සරලම ඇල්ඩිහයිඩ වන්නේ ෆෝමික් (ෆෝමල්ඩිහයිඩ්) HCOOH සහ ඇසිටික් (ඇසිටැල්ඩිහයිඩ්) CH 3 COH ය. හයිඩ්\u200dරොකාබන අසම්පූර්ණ දහනය කිරීමේ නිෂ්පාදනවල මෙම ද්\u200dරව්\u200dය සෑම විටම පවතී.
හයිඩ්\u200dරොකාබන දහනය කිරීමේදී දම්වැල සෑදීම හයිඩ්\u200dරොකාබන් රැඩිකලුන් සෑදෙන ඕනෑම ප්\u200dරතික්\u200dරියාවක් විය හැකිය. මෙය නිදහස් මෙතිල් කාණ්ඩ දෙකක් සෑදීම සමඟ ඊතන් අණුවක දිරාපත්වීමේ ප්\u200dරතික්\u200dරියාවක් විය හැකිය:
සී 2 එච් 6 × × සීඑච් 3
හෝ ඔක්සිජන් සමඟ හයිඩ්\u200dරොකාබනයක ප්\u200dරතික්\u200dරියාව:
RH + O 2 × O HO 2 + × R.
දම්වැල් අඛණ්ඩව පැවතීම සෑදීමේ ප්\u200dරතික්\u200dරියා වල ප්\u200dරති as ලයක් ලෙස සිදු වේ | පෙරොක්සයිඩ් හෝ හයිඩ්\u200dරොපෙරොක්සයිඩ්:
R + O 2 ® ROO ×
ROO × + RH ® ROOH + R ×
හයිඩ්\u200dරොපෙරොක්සයිඩ් දිරාපත්වීමේදී දම්වැල් අතු සිදු කරනු ලැබේ:
ROOH® × RO + × OH
ලබා දී ඇති ප්\u200dරතික්\u200dරියා අනුක්\u200dරමය ප්\u200dරතික්\u200dරියා පද්ධතියේ පෙරොක්සයිඩ් සංයෝග සාන්ද්\u200dරණය ක්\u200dරමයෙන් වැඩි කිරීමට හේතු වේ.
පෙරොක්සයිඩ්, රැඩිකලුන්, × OH සහ × H සමුච්චය වීමට සමගාමීව සමාන්තර ප්\u200dරතික්\u200dරියා සිදුවීමට පටන් ගනී:
ROOH + × OH ® ROO × + H 2 O.
මෙම ප්\u200dරතික්\u200dරියා බාහිර තාපය; ඔවුන් විශාල තාපයක් ගලා යන විට.
ප්\u200dරතික්\u200dරියාකාරක මිශ්\u200dරණයේ උෂ්ණත්වය ඉහළ යාමත් සමඟ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල කාර්යභාරය පහත දැක්වෙන අනුපිළිවෙලින් එක් අතරමැදි නිෂ්පාදනයක් සිට තවත් එකක් දක්වා ගමන් කරයි: ඇල්කයිල් හයිඩ්\u200dරොපෙරොක්සයිඩ්, ඇසයිල් හයිඩ්\u200dරොපෙරොක්සයිඩ්, ඇල්ඩිහයිඩ්.
ඉහළ උෂ්ණත්ව කලාපයේ (600-800 ° C) කාලයාගේ ඇවෑමෙන් ප්\u200dරතික්\u200dරියා මිශ්\u200dරණයේ සංයුතියේ වෙනස්වීම් පිළිබඳ පර්යේෂණාත්මක අධ්\u200dයයනවලින් පෙනී යන්නේ ආරම්භක හයිඩ්\u200dරොකාබන CO 2 සහ H 2 O හි අවසාන දහන නිෂ්පාදන බවට පරිවර්තනය කිරීමේ ක්\u200dරියාවලිය අදියර දෙකකට බෙදා ඇති බවයි: පළමුවැන්න ඉතා ඉහළ අනුපාතයකින් සිදු වේ. CO වෙත හයිඩ්\u200dරොකාබන් ඔක්සිකරණය වීම. දෙවන, මන්දගාමී, අවධියේදී CO CO 2 ට ඔක්සිකරණය වේ
දහනය කිරීමේදී රසායනික ප්\u200dරතික්\u200dරියා අනුපාතය කෙරෙහි විවිධ සාධකවල බලපෑම
ප්\u200dරතික්\u200dරියා කරන ද්\u200dරව්\u200dයවල සාන්ද්\u200dරණය මත දහන ප්\u200dරතික්\u200dරියා අනුපාතය රඳා පැවතීම ප්\u200dරකාශනය මගින් නිරූපණය කළ හැකිය
![]() (1)
(1)
කොහේද: k 0 - ප්\u200dරතික්\u200dරියා අනුපාතය නියතය,
කඳුකරයෙන් - දහනය කළ හැකි ද්\u200dරව්\u200dයයක සාන්ද්\u200dරණය, kmol / m 3,
හරි සමඟ - ඔක්සිකාරක කාරකයේ සාන්ද්\u200dරණය, kmol / m 3,
x, y යනු පිළිවෙලින් ඉන්ධන සහ ඔක්සිකාරක සඳහා ප්\u200dරතික්\u200dරියා ඇණවුම් වේ.
ඉහත සඳහන් කළ පරිදි, ප්\u200dරතික්\u200dරියා (1) හි සාරාංශ සමීකරණය දහන ප්\u200dරතික්\u200dරියාවේ සත්\u200dය යාන්ත්\u200dරණය පිළිබිඹු නොකරයි, එය බහු ස්ථර හා බොහෝ විට දාම වේ, එබැවින් සමීකරණයේ ප්\u200dරතික්\u200dරියා නියෝග (2) සෑම විටම සමීකරණයේ (1) ස්ටොයිකොමිතික සංගුණකවල අගය සමඟ සමපාත නොවේ.
දහනය කළ හැකි ද්\u200dරව්\u200dයවල සාන්ද්\u200dරණය වැඩි වන තරමට දැවෙන වේගය වැඩි වන බව එයින් කියවේ.
දැවෙන ප්\u200dරතික්\u200dරියා අනුපාතය උෂ්ණත්වය මත රඳා පවතී:
e - ස්වාභාවික ල ar ු ගණකයේ පදනම
E සහ - සක්\u200dරිය ශක්තිය, kJ / kmol,
R යනු විශ්ව වායු නියතය, R \u003d 8.314 kJ / (K.kmol)
ටී - උෂ්ණත්වය, කේ.
මෙම සමීකරණය උෂ්ණත්වය මත රසායනික ප්\u200dරතික්\u200dරියා අනුපාතය රඳා පැවතීම පිළිබඳ අර්හීනියස් නීතියේ ප්\u200dරකාශනයකි. පටු පරාසයක උෂ්ණත්වයක් සඳහා සරල ආකාරයකින්, ඔබට වැන්ට්-හොෆ් රීතිය භාවිතා කළ හැකිය: සෑම 10 0 ක් සඳහාම උෂ්ණත්වය ඉහළ යාමත් සමඟ රසායනික ප්\u200dරතික්\u200dරියා වේගය 2-4 ගුණයකින් වැඩි වේ.
මේ අනුව, දහනය කිරීමේදී දහනය කළ හැකි ද්\u200dරව්\u200dයයක රසායනික ඔක්සිකරණ ප්\u200dරතික්\u200dරියාවක වේගය වැඩිවන උෂ්ණත්වය සමඟ තියුනු ලෙස වැඩි වන අතර ඉහළ, සක්\u200dරීය ශක්තිය අඩු වේ.
දහනය කිරීමේදී ඔක්සිකරණ ප්\u200dරතික්\u200dරියා අනුපාතය ද පීඩනය මත රඳා පවතී.
පීඩනය වැඩිවීම දහනය කළ හැකි වායුමය ද්\u200dරව්\u200dය හා ඔක්සිකාරක පරිමාව සාන්ද්\u200dරණය වැඩි කිරීමට හේතු වේ. ප්රායෝගිකව, මෙය වැඩි වන පීඩනය සමඟ, බොහෝ ද්රව්යවල දහන ප්රතික්රියා වේගය වැඩි වේ.
අධික පීඩනයකදී උණුසුම් ගිනිදැල් ඇති වේ.
ඉහත සඳහන් කළ පරිදි රසායනික ඔක්සිකරණ ප්\u200dරතික්\u200dරියා අතිශයින්ම තාපජ වේ, එබැවින් දැවීම විශාල තාප ප්\u200dරමාණයක් මුදා හැරීම සමඟ සිදුවන අතර එම නිසා ඉහළ උෂ්ණත්වයකින් ඉදිරියට යයි. උදාහරණයක් ලෙස, දැව දැවෙන උෂ්ණත්වය 700-800 0 is, තෙල් නිෂ්පාදන - ඊටත් වඩා වැඩි - 1300-1500 0 С.
අඩු පීඩනවලදී, ඊනියා සීතල ගිනිදැල් ඇතිවිය හැකිය. මෙම අවස්ථාවේ දී දහන දාමයේ රසායනික ප්\u200dරතික්\u200dරියාවේ ස්වයං ත්වරණය සමස්ථානික ප්\u200dරකාරයේදී සිදු වේ. මෙය සිදුවන්නේ දහනය කළ හැකි මිශ්\u200dරණයේ නිශ්චිත සංයුතියකින් සහ පරිසරයේ යම් තත්වයකිනි. සමස්ථානික ස්වයං ත්වරණය ප්\u200dරමාණවත් තරම් ක්\u200dරියාකාරී, නමුත් තරමක් ස්ථායී අතරමැදි නිෂ්පාදන සහිත මිශ්\u200dරණයන් සඳහා සාමාන්\u200dය වන අතර එය දම්වැල්වල අතු අඩුවීමට හේතු වන අතර එහි ප්\u200dරති heat ලයක් ලෙස තාප උත්පාදනය අඩුවීම තාප සින්ක් හේතුවෙන් පරිසරයට විසුරුවා හරිනු ලබන අතර ස්ථායී අතරමැදි නිෂ්පාදන උණුසුම් කිරීම සඳහා අර්ධ වශයෙන් වැය වේ. දිලිසීමක් ඇති අතර එය රසායන ද්\u200dරවයක් වන අතර උණුසුම් ගිනිදැල්වල සිදුවන රත් වූ දහන නිෂ්පාදනවල තාප විකිරණය නොවේ.
ඊට අමතරව, දහනය සිදුවන යාත්රාවේ බිත්තිවලට සීතල ගිනිදැල් පෙනුම බෙහෙවින් බලපායි. ක්\u200dරියාකාරී මධ්\u200dයස්ථාන විනාශ කිරීමේ ක්\u200dරියාවලියට ඒවා උත්ප්\u200dරේරක බලපෑමක් ඇති කරයි, එනම්. විෂමජාතීය විවෘත පරිපථයක් ඇත. මෙම ක්\u200dරියාවලියේ තීව්\u200dරතාවය තීරණය වන්නේ යාත්රා බිත්ති දෙසට ක්\u200dරියාකාරී මධ්\u200dයස්ථාන විසරණය වීමේ වේගයෙනි. පීඩනය අඩු කිරීම මෙම ක්\u200dරියාවලියට දායක වේ. පීඩනය අඩු කිරීමෙන් උණුසුම් ඒවා වෙනුවට සීතල ගිනිදැල් ඇතිවීමට පමණක් නොව, සමහර තත්වයන් තුළ (නිදසුනක් ලෙස, පටු යාත්රා වල) දහනය සම්පූර්ණයෙන් නතර කිරීමට පවා හේතු වේ.
ඉහත සඳහන් කළ පරිදි, දහන ක්\u200dරියාවලියේ රසායනික පරිවර්තනයන් විවිධ භෞතික ක්\u200dරියාවලීන් මතුවීමට තුඩු දෙයි: සංවහනය, තාප සන්නායකතාවය සහ විකිරණ හේතුවෙන් තාප හුවමාරුව, ප්\u200dරතික්\u200dරියාකාරක මාරු කිරීම යනාදිය.
මේ අනුව, දැවෙන රසායනික පරිණාමනය, තාපය මුදා හැරීම සහ විකිරණ (බොහෝ විට ආලෝකය ඇතුළුව, එනම් වර්ණාවලියේ දෘශ්\u200dයමාන කොටස ඇතුළුව) සං three ා තුනකින් සංලක්ෂිත සංකීර්ණ ස්වයං-තිරසාර භෞතික-රසායනික ක්\u200dරියාවලියක් ලෙස සංලක්ෂිත කළ හැකිය. මෙම සං signs ා කිසිවක් නොමැති වීමෙන් ඇඟවෙන්නේ, ප්\u200dරශ්නයට භාජනය වන ක්\u200dරියාවලියට විදුලි බුබුලක් “දැවීම” (රසායනික පරිවර්තනයක් නොමැත), ලෝහ විඛාදනය (ආලෝක විමෝචනයක් නොමැති අතර එය ප්\u200dරායෝගිකව නොවැදගත් තාප උත්පාදනය) යනාදිය ඇතුළත් නොවන බවයි.
මිතුරන් සමඟ බෙදා ගන්න:වාරිමාර්ග සෑම විටම රසායනික පරිවර්තනයන් සමඟ සම්බන්ධ වේ. වාතයේ දහනය - ඔක්සිජන් සමඟ දහනය කළ හැකි ද්\u200dරව්\u200dයයක අන්තර්ක්\u200dරියා. කෙසේ වෙතත්, දහන ක්\u200dරියාවලියේදී නයිට්\u200dරජන්, හේලයිඩ් සහ ඕසෝන් ඔක්සයිඩ ඔක්සිකාරක ලෙස ක්\u200dරියා කළ හැකි බව මතක තබා ගත යුතුය. නිෂ්පාදනයේ එක් ප්\u200dරභවයක් පමණක් සහභාගී වීමෙන් සිදුවන දන්නා දහන ක්\u200dරියාවලීන් - වේගයෙන් දිරාපත් විය හැකි සංයෝග. එවැනි සංයෝග සඳහා උදාහරණ වන්නේ ඇසිටිලීන් සහ හයිඩ්\u200dරසීන් ය.
දහනය කිරීමේදී සිදුවන රසායනික ක්\u200dරියාවලීන් අතිශයින්ම සංකීර්ණ ය. සරලම අවස්ථාව සඳහා වුවද - ඔක්සිජන් වල හයිඩ්\u200dරජන් දහනය කිරීම, සාමාන්\u200dයකරණය කළ සමීකරණයට ස්වරූපය ඇත
2H 2 + 0 2 \u003d 2H 2 0,
මූලික අදියර දුසිම් කිහිපයක් ස්ථාපිත කර අධ්\u200dයයනය කර ඇත.
අද වන විට, හයිඩ්\u200dරජන්, කාබන් මොනොක්සයිඩ්, මීතේන් සහ එතේන් වැනි ද්\u200dරව්\u200dය කිහිපයක් පමණක් දහනය කිරීමේදී රසායනික පරිණාමනය කිරීමේ යාන්ත්\u200dරණයන් ප්\u200dරමාණවත් ලෙස අධ්\u200dයයනය කර ඇත. මෙම දැනුම බොහෝ ද්\u200dරව්\u200dයවල ජ්වලනය හා දහනය කිරීමේ තත්වයන් පුරෝකථනය කිරීමට යොදා ගනී.
2.1. දාම ප්\u200dරතික්\u200dරියා
දාම ප්\u200dරතික්\u200dරියා, සාමාන්\u200dය රසායනික පරිවර්තනයන්ට වෙනස්ව, ක්\u200dරියාකාරී අංශුවක එක් එක් මූලික ක්\u200dරියාවෙහි පෙනුම මගින් සංලක්ෂිත වේ: යුගලනය නොකළ ඉලෙක්ට්\u200dරෝනයක් සහිත පරමාණුවක්, නිදහස් රැඩිකල් හෝ අයන. ක්\u200dරියාකාරී අංශුවල පෙනුම ආරම්භක ද්\u200dරව්\u200dය ප්\u200dරතික්\u200dරියා නිෂ්පාදන බවට පරිවර්තනය කිරීමේ දාමයක් ඇති කරයි. පරමාණු, නිදහස් රැඩිකලුන් සහ අයන සංයුජතා සංතෘප්ත අණු වලට වඩා ප්\u200dරතික්\u200dරියාශීලී වේ. එබැවින් රසායනික බන්ධන බිඳ දැමීම හා ක්\u200dරියාකාරී අංශු සෑදීම සඳහා සැලකිය යුතු බලශක්ති පිරිවැයක් තිබියදීත්, ප්\u200dරතික්\u200dරියාවක දාම සංවර්ධනය බොහෝ විට අණු අතර inte ජු අන්තර්ක්\u200dරියා වලට වඩා ශක්තිජනක ලෙස වඩා ප්\u200dරයෝජනවත් වේ.
දහන ක්\u200dරියාවලීන් ප්\u200dරධාන වශයෙන් සිදුවන්නේ දාම යාන්ත්\u200dරණයක් මගිනි. දාම ප්\u200dරතික්\u200dරියා - අදියර කිහිපයකින් සිදුවන සංකීර්ණ ප්\u200dරතික්\u200dරියා, නියෝජනය කරන්නේ:
සක්\u200dරීය අංශු සෑදී ඇති දම්වැල්වල ආරම්භය (ආරම්භය);
නව ක්\u200dරියාකාරී අංශු සෑදෙන ප්\u200dරති result ලයක් ලෙස ක්\u200dරියාකාරී අංශු ආරම්භක ද්\u200dරව්\u200dය සමඟ රසායනික අන්තර්ක්\u200dරියා වලට ඇතුළු වන දාමයේ අඛණ්ඩතාවය;
අවසාන ප්\u200dරතික්\u200dරියා නිෂ්පාදන සෑදීමත් සමඟ ක්\u200dරියාකාරී අංශුවල “මරණය” සිදුවන දම්වැල් කැඩීම
දම්වැල්වල ආරම්භය විවිධ තත්වයන් යටතේ සිදුවිය හැකිය. උදාහරණයක් ලෙස, විද්\u200dයුත් විසර්ජනයක තාප ශක්තිය හෝ අයනීකරණ විකිරණ ක්\u200dරියාකාරිත්වය යටතේ අණු වි ociation ටනය වීමේ ප්\u200dරති result ලයක් ලෙස. සක්\u200dරීය අංශුවල මරණය සිදුවන්නේ ඒවා නැවත එකතු වන විට *, නිදහස් රැඩිකලුන් අන්තර්ක්\u200dරියා කරන විට (සමජාතීය දාම බිඳවැටීම), ක්\u200dරියාකාරී අංශු solid න පෘෂ් aces යන් (විෂමජාතීය දාම කැඩීම) සමඟ අන්තර්ක්\u200dරියා කරන විට හෝ දහන නිෂේධක සමඟ ප්\u200dරතික්\u200dරියා කිරීමේ ප්\u200dරති result ලයක් ලෙස ය.
නොකැඩූ සහ අතු දාම ප්\u200dරතික්\u200dරියා ඇත. දාමය අඛණ්ඩව පවත්වා ගෙන යාමේ ප්\u200dරතික්\u200dරියා වලදී පරිභෝජනය කරන සෑම ක්\u200dරියාකාරී අංශුවක් සඳහාම නොකැඩූ, නැවත ඉස්මතු වේ. ආරම්භක සක්\u200dරීය අංශුවකට සාදන ලද නිෂ්පාදන අණු ගණන දාමයේ දිග ලෙස හැඳින්වේ. දහන ප්\u200dරතික්\u200dරියා වල දම්වැල්වල දිග ලක්ෂ ගණන සිට දස දහස් ගණනක් වේ. දහන නිෂේධක වැනි ක්\u200dරියාකාරී අංශු සමඟ effectively ලදායී ලෙස අන්තර්ක්\u200dරියා කළ හැකි ද්\u200dරව්\u200dයවල සුළු මිශ්\u200dරණයන් මගින් නොබැඳි දාම ප්\u200dරතික්\u200dරියා වල වේගය බලපායි.
සමහර ද්\u200dරව්\u200dය - ආරම්භකයින් - ක්\u200dරියාකාරී අංශු සෑදීමට පහසුකම් සපයන අතර එමඟින් නොබැඳි දාම ප්\u200dරතික්\u200dරියා වේගවත් කරයි.
දාමයේ අඛණ්ඩතාවය සමඟ පරිභෝජනය කරන එක් ක්\u200dරියාකාරී අංශුවකට අතු දාම ප්\u200dරතික්\u200dරියා වලදී ක්\u200dරියාකාරී අංශු දෙකක් හෝ වැඩි ගණනක් සෑදී ඇත. ඔවුන්ගෙන් එක් අයෙකු ප්\u200dරාථමික දාමය දිගටම කරගෙන යන අතර අනෙක් අය නව දම්වැල් ආරම්භ කර අතු බෙදී යයි (රූපය 2.1).
ප්\u200dරතිසංයෝජනය යනු ආරෝපිත අංශු වලින් උදාසීන පරමාණු හෝ අණු සෑදීමේ ක්\u200dරියාවලියයි. නැවත එකතු කිරීමේදී ඇති වන පරමාණු සහ අණු භූමියේ හෝ උද්දීපිත තත්වයේ පැවතිය හැකිය.
රූපය. 2.1. ප්\u200dරතික්\u200dරියා දාමයේ ක්\u200dරමානුකූල නිරූපණය:
අ) දාමයේ එක් එක් සම්බන්ධකයේ අතු බෙදීම
6) දුර්ලභ අතු
උදාහරණයක් ලෙස, දාම ආරම්භක ප්\u200dරතික්\u200dරියාවේ හයිඩ්\u200dරජන් දහනය කිරීමේදී:
සක්\u200dරීය පරමාණුවක් සෑදී ඇත. දාම අඛණ්ඩ ප්\u200dරතික්\u200dරියා වලදී:

නව දාමවල ආරම්භය වන සක්\u200dරීය පරමාණු සංඛ්\u200dයාවේ වැඩි වීමක් දක්නට ලැබේ.
ශාඛා දාම ප්\u200dරතික්\u200dරියා ස්ථිතික මාදිලියකින් ඉදිරියට යා හැකි අතර, අතු බෙදීමේ වේගය සක්\u200dරීය අංශුවල මරණ අනුපාතයට වඩා අඩු වන අතර, අතු බෙදීමට වඩා සෙමින් මරණය සිදුවන ස්ථිතික නොවන අවස්ථාවන්හිදී. අවසාන අවස්ථාවේ දී, දාම ප්\u200dරතික්\u200dරියාවේ වේගය on ාතීය ලෙස වැඩි වන අතර එය සීමා වන්නේ ආරම්භක ද්\u200dරව්\u200dය පරිභෝජනයෙන් පමණි. ස්ථිතික සිට ස්ථිතික නොවන මාදිලියට මාරුවීම ප්\u200dරතික්\u200dරියා වල කොන්දේසි වල සුළු වෙනසක් සමඟ හදිසියේම සිදු වේ: උෂ්ණත්වය, පීඩනය හෝ එක් ප්\u200dරතික්\u200dරියාකාරකයක සාන්ද්\u200dරණය. එවැනි වේගවත් ත්වරණයක් ප්\u200dරතික්\u200dරියා මිශ්\u200dරණයේ ස්වයං ජ්වලනය හෝ දාම පිපිරීමක් ලෙස සැලකේ.
දහන ක්\u200dරියාවලීන් පිළිබඳ න්\u200dයායක් නිර්මාණය කිරීම සඳහා අතු දාම ප්\u200dරතික්\u200dරියා සොයා ගැනීම ඉතා වැදගත් විය. ජ්වලන වර්ග දෙකක් ඇති බව සනාථ වේ: තාප හා දාමය. රටා සකසා ඇත
පරිච්ඡේදය 2. රසායනික ක්\u200dරියාවලීන් දැවෙන
දාම ක්\u200dරියාවලීන්ගේ න්\u200dයායට, ගිනිගැනීම් වලදී දහන ක්\u200dරියාවලීන්හි වර්ධනයට සහ මර්දනයට effectively ලදායී ලෙස බලපෑම් කළ හැකිය.
දම්වැල්වල ආරම්භය.ආරම්භක සක්\u200dරීය මධ්\u200dයස්ථානවල න්\u200dයෂ්ටිකකරණ ක්\u200dරියාවලිය, නොකැඩූ දාම ප්\u200dරතික්\u200dරියා වර්ධනය කිරීමේදී විශාල කාර්යභාරයක් ඉටු කරයි. දාම අවසන් කිරීමේ ප්\u200dරතික්\u200dරියා වලදී ක්\u200dරියාකාරී මධ්\u200dයස්ථාන අහිමි වීම සඳහා එය වන්දි ලබා දේ. මෙම යාන්ත්\u200dරණය සක්\u200dරීය මධ්\u200dයස්ථාන සමුච්චය කිරීමේ ආරම්භක කාල පරිච්ඡේදයේදී ස්ථිතික තන්ත්\u200dරයක් ගොඩනැගීම සඳහා කොන්දේසි තීරණය කරයි. අඩු ආරම්භක අනුපාතයක් සමඟ, මෙම කාල පරිච්ඡේදය සැලකිය යුතු ය.
ගිනිදැල් වල බොහෝ රසායනික ප්\u200dරතික්\u200dරියා සක්\u200dරීය මධ්\u200dයස්ථානවල සැලකිය යුතු බලශක්ති සංචිතයක් ඇත. මෙම තත්වයන් යටතේ, ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ආරම්භ කිරීම සැලකිය යුතු බලශක්ති බාධකයක් ජය ගැනීම හා සම්බන්ධ වේ.
මෙම අවස්ථාවේ දී, වැදගත් කාර්යභාරයක් ඉටු කරනුයේ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සැලකිය යුතු අනුපාතයක් ඇතිවීම සහතික කරන සාධක මගිනි: රසායනිකව ක්\u200dරියාකාරී ආකලන, විකිරණ, විද්\u200dයුත් විසර්ජන, විකිරණශීලී ක්ෂය නිෂ්පාදන.
ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ජනනය කිරීමට බෙහෙවින් පහසුකම් සපයන සාධක අතර විෂමජාතීය ප්\u200dරතික්\u200dරියා සටහන් කළ යුතුය. Surface න පෘෂ් on යක් මත අවශෝෂණය වන දහනය කළ හැකි ද්\u200dරව්\u200dයවල අණු වල අන්තර් ක්\u200dරියාකාරී බන්ධන දුර්වල වන අතර ඒවා කැඩීමට අඩු බලශක්ති වියදම් අවශ්\u200dය වේ. මෙම තත්වයන් යටතේ, ක්\u200dරියාකාරී මධ්\u200dයස්ථාන උත්පාදනය කිරීමේ වේගය ගෑස් පරිමාවට වඩා සැලකිය යුතු ලෙස වැඩි ය. දහනය කළ හැකි මිශ්\u200dරණයේ සං of ටකවල විෂමජාතීය අන්තර්ක්\u200dරියාකාරිත්වයේ සක්\u200dරීය ශක්තිය ද සමජාතීය එකකට වඩා අඩුය. තථ්\u200dය දහන ක්\u200dරියාවලීන් යටතේ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල විෂමජාතීය ආරම්භය, නොනවතින දාම ක්\u200dරියාවලීන් සහිත ස්ථිතික තන්ත්\u200dරයක වේගවත් ජයග්\u200dරහණය සඳහා වැදගත් සාධකයකි.
සමහර ලක්ෂණ පරමාණුක සංරචකවල සහභාගීත්වය සමඟ සිදුවන නොබැඳි දාම ප්\u200dරතික්\u200dරියා මගින් සංලක්ෂිත වේ. පුනර්ජනනයකින් තොරව ක්\u200dරියාකාරී මධ්\u200dයස්ථාන සමඟ අන්තර්ක්\u200dරියා කරන අපද්\u200dරව්\u200dය නොමැති විට, දාම අවසන් කිරීම සිදුවිය හැක්කේ පරමාණු ත්\u200dරිත්ව ගැටුම් හා පෘෂ් on ය මත නැවත එකතු වූ විට පමණි.
ඕනෑම උෂ්ණත්වයකදී සියලුම වායුමය ද්\u200dරව්\u200dය අර්ධ වශයෙන් වි oci ටනය වේ. සමහර අණු පරමාණු වලට කැඩී යයි. මෙම අවස්ථාවේ දී, වි ociation ටන ක්\u200dරියාවලීන් සහ පරමාණු අණු බවට සම්බන්ධ වීම අතර සමතුලිතතාවයක් පවතී. වි diss ටනයේ උපාධිය on ාතීය ලෙස උෂ්ණත්වය මත රඳා පවතී.
දම්වැල් කැඩෙන දහනය කළ හැකි මිශ්\u200dරණයේ අපද්\u200dරව්\u200dය නොමැති නම්, ප්\u200dරතික්\u200dරියාවේ පරමාණුක සංරචක සාන්ද්\u200dරණය ප්\u200dරායෝගිකව නොවෙනස්ව පවතී. ප්\u200dරතික්\u200dරියාවට ඇතුළු වූ පරමාණු එකවරම ප්\u200dරතිනිර්මාණය වේ
කොරොල්චෙන්කෝ ඒ. දහනය හා පිපිරුම් ක්\u200dරියාවලි
ලිචී. ආරම්භක ආරම්භය ප්\u200dරතික්\u200dරියා නොකරන ලද පද්ධතියට සමාන ප්\u200dරමාණයකින් ප්\u200dරතික්\u200dරියා කරන පරමාණු සඳහා වන්දි ලබා දේ. ස්ථිතික ප්\u200dරතික්\u200dරියාව මෙම ක්\u200dරියාවලියට බලපාන්නේ නැත. අණුවේ පරමාණු අතර අවම ප්\u200dරබල බන්ධනයකින් වෙන් කොට දැක්වෙන ප්\u200dරතික්\u200dරියාවේ එක් අංගයක ශේෂය මෙම ක්\u200dරමයේ ලාක්ෂණික ලක්ෂණයකි. මෙම අවස්ථාවේ දී තවත් පරමාණුක සං component ටකයක සාන්ද්\u200dරණය අර්ධ විද්\u200dයාත්මක නමුත් වඩා සමතුලිත වේ.
දහන ප්\u200dරතික්\u200dරියා සමජාතීයව ආරම්භ කිරීමත් සමඟ, ස්ථිතික තන්ත්\u200dරය ස්ථාපිත වන්නේ නිශ්චිත කාලයකට පසුවය, වි diss ටනය සඳහා විශාල සක්\u200dරීය ශක්තියක් අවශ්\u200dය වේ. මෙම කාල පරිච්ෙඡ්දය තුළ, වි ociation ටන අනුපාතය නැවත එකතු කිරීමේ අනුපාතය ඉක්මවා යන අතර ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ප්\u200dරතික්\u200dරියා පද්ධතියේ රැස් වේ. ක්\u200dරියාවලි දෙකෙහිම අනුපාත සංසන්දනය කරනු ලබන්නේ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සමතුලිතතාවයට සාන්ද්\u200dරණය වැඩි කිරීමෙන් පසුව පමණි. මෙම කාල සීමාව ප්\u200dරේරණ කාලය ලෙස හැඳින්වේ.
ප්\u200dරතික්\u200dරියා කලාපයේ උත්ප්\u200dරේරකයක් ලෙස surface න පෘෂ් of යක් පැවතීම තාප ගතික සමතුලිතතාවයේ තත්වය වෙනස් නොකරයි. උත්ප්\u200dරේරකය ඉදිරි හා ප්\u200dරතිලෝම ප්\u200dරතික්\u200dරියා වලට සමානව බලපායි. ක්\u200dරියාකාරී මධ්\u200dයස්ථාන මතු වන්නේ surface න පෘෂ් on යක් මත පමණක් නොව එය බිඳ දමමිනි. කෙසේ වෙතත්, උත්ප්\u200dරේරකයක් පැවතීම සමතුලිත වි ociation ටන තත්වයක් ළඟා කර ගැනීම වේගවත් කරයි.
දාම කැඩීමේ ප්\u200dරතික්\u200dරියා වලට සහභාගී විය හැකි දහනය කළ හැකි මිශ්\u200dරණයේ සක්\u200dරීය ද්\u200dරව්\u200dය තිබේ නම් ඒවා ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය අඩු කරයි. මෙම අවස්ථාවේ දී, ආරම්භක සංරචක වලින් එකක සමතුලිත වි diss ටනය බාධා වන අතර එය ප්\u200dරතික්\u200dරියාව මන්දගාමී වන අතර එය අවසන් වීමට හේතු විය හැක.
අත්හදා බැලීම්වලින් පෙනී යන්නේ බාහිර ප්\u200dරභවයක් මගින් නොබැඳි දාම ප්\u200dරතික්\u200dරියාවක් ආරම්භ කරන විට (නිදසුනක් ලෙස ආලෝක ප්\u200dරභවයක්), දහන ක්\u200dරියාවලි සංවර්ධනයේ ආරම්භක අවධියේදී ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය සැලකිය යුතු ලෙස සමතුලිතතාවය ඉක්මවා යා හැකි බවයි.
අතු දාම ප්\u200dරතික්\u200dරියා අතරතුර, ආරම්භක ආරම්භයේ කොන්දේසි ප්\u200dරතික්\u200dරියාවේ වර්ධනය කෙරෙහි සැලකිය යුතු බලපෑමක් ඇති කරයි. මන්දගාමී ක්\u200dරියාවලීන්හිදී, අර්ධ වශයෙන් ප්\u200dරතික්\u200dරියා කරන ලද මිශ්\u200dරණයක් ආරම්භක එකට එකතු කිරීම ප්\u200dරේරක කාලය කෙටි කරන අතර ගිනි දහනය කිරීමේ මොහොත වේගවත් කරයි.
දම්වැල් අඛණ්ඩව.නොබැඳි දාම ප්\u200dරතික්\u200dරියා වල ලක්ෂණයක් වන්නේ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණයේ අර්ධ ස්ථායිතාවයි. විවෘත පරිපථයක් නොමැති විට, සක්\u200dරීය අංශු සෑදී ඇත
අදියර 2. දහනය අතරතුර රසායනික ක්\u200dරියාවලි
ඔවුන් වියදම් කරන මුදලම. නව පැන නගින්නේ ආරම්භක අවස්ථාවේදී පමණි. සක්\u200dරීය මධ්\u200dයස්ථාන උත්පාදනය හා දාම අවසන් කිරීම සමාන අනුපාතයන් සමඟ, ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල නිරන්තර සාන්ද්\u200dරණය සහ ස්ථිතික ප්\u200dරතික්\u200dරියා ක්\u200dරමයක් ස්ථාපිත කෙරේ. ආරම්භක සංරචක පරිභෝජනය කරන බැවින් ප්\u200dරතික්\u200dරියා අනුපාතය අඩු වේ.
අතු දාම ප්\u200dරතික්\u200dරියාවකදී, ආරම්භක පද්ධතියේ කොන්දේසි නොසලකා ප්\u200dරතික්\u200dරියා පද්ධතියේ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය වැඩි වේ. හිම වලසුන්ගේ චරිතයක් ඇති ස්වයං-වේගවත් ප්\u200dරතික්\u200dරියා මාදිලිය ක්\u200dරියාත්මක කිරීම. මෙම අවස්ථාවේ දී, ආරම්භක සංරචක ප්\u200dරතික්\u200dරියාවේ අවසාන නිෂ්පාදන බවට පරිවර්තනය කිරීම සඳහා එක් ආරම්භක ක්\u200dරියාකාරී මධ්\u200dයස්ථානයක් ප්\u200dරමාණවත් වේ.
අතු බෙදී ගිය වටිනා ප්\u200dරතික්\u200dරියාවක චාලක සමීකරණය පහත පරිදි වේ. කාලයාගේ ඇවෑමෙන් ස්ථාවර ආරම්භක සංරචකවල සාන්ද්\u200dරණයේ වෙනස පළමු දළ වශයෙන් නොසලකා හැරිය හැකි අතර, ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණයේ වේගවත් වෙනස්කම් පමණක් සැලකිල්ලට ගත හැකිය. පි.මෙම වේගයෙහි වෙනස්වීම් තීරණය වන්නේ ආරම්භක ආරම්භක වේගය සහ අතු බෙදීම් හා දාම අවසන් කිරීමේ ප්\u200dරතික්\u200dරියා වල අනුපාතය අනුව ය. ආරම්භක ආරම්භක අනුපාතය පද්ධතිය තුළ පවතින ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය මත රඳා නොපවතී. අතු බෙදීම් හා කැඩී යාමේ ක්\u200dරියාවලීන් සක්\u200dරීය මධ්\u200dයස්ථානවල සාන්ද්\u200dරණයට සමානුපාතික වේ. මෙම තත්වයන් යටතේ, ක්\u200dරියාකාරී මධ්\u200dයස්ථාන පිහිටුවීමේ හා වියදම්වල සමස්ත ශේෂය තීරණය කරනුයේ ආරම්භක, අතු බෙදීම් සහ කැඩී යාමේ ක්\u200dරියාවලීන්ගේ අනුපාතවල එකතුවෙනි:
![]() (2.1)
(2.1)
අතු සහ කැඩී යාමේ ප්\u200dරතික්\u200dරියා වල අනුපාත නියතයන් සහ ඒවා වේ. දැක්වෙන්නේ, අපට ලැබෙන්නේ:
![]() (2.2)
(2.2)
සක්\u200dරීය මධ්\u200dයස්ථානවල සාන්ද්\u200dරණයේ කාලය ව්\u200dයුත්පන්න වන විට
ධනාත්මක වේ. කාලයත් සමඟ ප්\u200dරතික්\u200dරියා වේගය වැඩිවේ. අතු දාම ප්\u200dරතික්\u200dරියා වල මෙම ලක්ෂණය වන්නේ ශාඛා ප්\u200dරතික්\u200dරියා වේගය දාම අවසන් කිරීමේ ප්\u200dරතික්\u200dරියා අනුපාතය ඉක්මවා යන විට එවැනි පාලන තන්ත්\u200dරයන්හි ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ගුණ කිරීම ය.
කොරොල්චෙන්කෝ ඒ. දහනය හා පිපිරුම් ක්\u200dරියාවලි
ප්\u200dරතික්\u200dරියාව ආරම්භ වීමට පෙර පද්ධතියේ ක්\u200dරියාකාරී මධ්\u200dයස්ථාන නොතිබුණි නම්, එනම්. දීටී\u003d 0, n \u003d 0 සමීකරණයේ ඒකාග්\u200dරතාවය (2.2) ලබා දෙන්නේ:
![]() (2.3)
(2.3)
CO හි සමස්ත ප්\u200dරතික්\u200dරියා අනුපාතය තීරණය වන්නේ ශාඛා ක්\u200dරියාවලියේ වේගය අනුව ය. අවසාන නිෂ්පාදන සෑදී ඇත්තේ මෙම ප්\u200dරතික්\u200dරියාව තුළ පමණි. එක් එක් මූලික දාම අතු බෙදීම් සඳහා, අවසාන නිෂ්පාදනයේ අණු සෑදී ඇත. එය පහත දැක්වේ:
![]() (2.4)
(2.4)
කාලයාගේ ඇවෑමෙන් දාම ප්\u200dරතික්\u200dරියාවක වර්ධනය තීරණය වන්නේ අතු හා දාම අවසන් කිරීමේ ප්\u200dරතික්\u200dරියා වල අනුපාත නියතයන්ගේ අනුපාතයෙනි. සමීකරණයේ on ාතකය (2.4) ධනාත්මක වන අතර නැවත ප්\u200dරති-
ක්\u200dරියාව අසීමිත ලෙස වේගවත් වේ. ප්\u200dරතික්\u200dරියාවේ වර්ධනයේ ආරම්භක කාල පරිච්ඡේදයේදී, පහත සම්බන්ධතාවය සත්\u200dය වේ:
ආරම්භක ආරම්භක වේගය කුඩා බැවින් ආරම්භක කාල පරිච්ඡේදයේදී සැලකිය යුතු රසායනික පරිවර්තනයක් සිදු නොවේ. යම් කාලයකට පසු, අගය එකකට වඩා සැලකිය යුතු ලෙස වැඩි වේ. ඊට පසු, සමීකරණ (2.4) ට අනුකූලව ප්\u200dරතික්\u200dරියා අනුපාතය වේගයෙන් වැඩි වීමට පටන් ගන්නා අතර එය ඉතා විශාල අගයන් කරා ළඟා වේ.
දාම ප්\u200dරතික්\u200dරියාවක් වර්ධනය කිරීමේදී ප්\u200dරමාද කාල පරිච්ඡේදයක් (ප්\u200dරේරණ කාල පරිච්ඡේදයක්) පැවතීමට හේතුව ප්\u200dරතික්\u200dරියා පද්ධතියේ ක්\u200dරියාකාරී මධ්\u200dයස්ථාන නිශ්චිත සංඛ්\u200dයාවක් එක්රැස් කිරීමේ අවශ්\u200dයතාවයයි. මෙම රසායනික පරිවර්තනය සැලකිය යුතු වූ පසු පමණි.
දාම ප්\u200dරතික්\u200dරියා වල ප්\u200dරේරණ කාල පරිච්ඡේදයේ විශාලත්වය තීරණය වන්නේ අතු බෙදීම් සහ දාම අවසන් කිරීමේ ක්\u200dරියාවලීන්ගේ අනුපාතයන් මිස ආරම්භක ආරම්භක වේගය නොවේ. අනෙක් අතට, අතු බෙදීම් හා කැඩී යාමේ ප්\u200dරතික්\u200dරියා එක් එක් ප්\u200dරතික්\u200dරියා පද්ධතියේ රසායනික ලක්ෂණ නිසා වේ; ඒවා තීරණය වන්නේ උෂ්ණත්වය හා ආරම්භක සංරචකවල සාන්ද්\u200dරණය මත රඳා පැවතීමෙනි. සඳහා දාම ප්\u200dරතික්\u200dරියා වල සුවිශේෂත්වය
අතු බෙදීමේ ක්\u200dරියාවලියට සැලකිය යුතු සක්\u200dරීය ශක්තියක් අවශ්\u200dය වන අතර, කැඩී යාමේ ක්\u200dරියාවලියේ අනුපාත නියතයේ උෂ්ණත්ව සංගුණකය බිංදුවට ආසන්න වේ. වර්ග තුනේම දම්වැල් අවසන් කිරීමේ ප්\u200dරතික්\u200dරියා වලදී: තොග සහ විෂමජාතීය ප්\u200dරතිසංයෝජනයන්හිදී, ක්\u200dරියාකාරී අපද්\u200dරව්\u200dය සමඟ රැඩිකලුන්ගේ අන්තර්ක්\u200dරියා වලදී, සක්\u200dරීය කිරීමේ ශක්තීන් ශුන්\u200dය වේ.
උෂ්ණත්වය ඉහළ යාම, මිශ්\u200dරණයේ සම්පූර්ණ පීඩනය හෝ ප්\u200dරතික්\u200dරියාකාරක සං of ටකවල සාන්ද්\u200dරණය වෙනස් වීමත් සමඟ අතු හා කැඩී යාමේ අනුපාත නියතයන්හි වෙනසක් සිදුවිය හැකි අතර ප්\u200dරතික්\u200dරියාව ස්ථිතික සිට ස්ථිතික නොවන ලෙස වෙනස් වේ. මෙම ක්\u200dරියාවලියේ සුවිශේෂත්වය පවතින්නේ ප්\u200dරතික්\u200dරියා අනුපාතය නොසැලකිලිමත් අගයක සිට අසීමිත ලෙස ඉහළ යන එකක් දක්වා වෙනස් කිරීමේ දී එක් මාදිලියක සිට තවත් ක්\u200dරමයකට හදිසියේ මාරුවීම තුළ ය.
සමහර දාම ප්\u200dරතික්\u200dරියා වල ප්\u200dරවාහය සාපේක්ෂව ස්ථායී නමුත් ක්\u200dරියාකාරී මධ්\u200dයස්ථාන උත්පාදනය කිරීමේ හැකියාව ඇති අතරමැදි නිෂ්පාදන සෑදීම සමඟ සිදු වේ. පෙරොක්සයිඩ් සහ ඇල්ඩිහයිඩ සෑදෙන අතරමැදි ලෙස එවැනි ප්\u200dරතික්\u200dරියා වලට හයිඩ්\u200dරොකාබන් දහන ප්\u200dරතික්\u200dරියා ඇතුළත් වේ. මෙය දම්වැල අතු බෙදීමට හේතු වේ. කෙසේ වෙතත්, අතරමැදි නිෂ්පාදනවල සාපේක්ෂ ස්ථායිතාව හේතුවෙන් ප්\u200dරතික්\u200dරියාවේ ත්වරණය කාලයත් සමඟ විහිදේ. එවැනි මන්දගාමී අතු දාමයන් පරිහානිය ලෙස හැඳින්වේ.
සුපුරුදු රැඩිකල් ශාඛා යාන්ත්\u200dරණය සමඟ දාම ප්\u200dරතික්\u200dරියා, රීතියක් ලෙස, රැඩිකලුන්ගේ ඉහළ ක්\u200dරියාකාරිත්වය හේතුවෙන්, ඉතා ඉක්මණින් ඉදිරියට යයි. එහි ප්\u200dරති ing ලයක් ලෙස රැඩිකලුන් එක්කෝ වේගවත් වේගවත් ප්\u200dරතික්\u200dරියාවක් ආරම්භ කරයි, නැතහොත් නැවත එකතු වී ක්\u200dරියාවලියෙන් ඉවත් වේ.
විවෘත පරිපථය ඕනෑම අංශු වායු අණුවක් මෙන් ක්\u200dරියාකාරී අංශුව ප්\u200dරතික්\u200dරියා පද්ධතිය තුළ අහඹු ලෙස චලිත වන අතර අනෙක් අණු සමඟ ගැටේ. ඒ අතරම, වෙනත් ක්\u200dරියාකාරී අංශුවක් හෝ අණුවක් සමඟ අන්තර්ක්\u200dරියාකාරිත්වයේ යම් ගැටුමක දී නව ක්\u200dරියාකාරී අංශුවක් සෑදීමේදී යම්කිසි සම්භාවිතාවක් ඇත. ප්\u200dරතික්\u200dරියා දාමයේ වර්ධනය නිෂ්ක්\u200dරීය අණු වල බ්\u200dරව්නියානු චලිතයට සමාන වේ, නමුත් ක්\u200dරියාකාරී මධ්\u200dයස්ථාන මාරු කිරීම රසායනික ප්\u200dරතික්\u200dරියාවක් සමඟ සිදු වේ. වර්ග දෙකක හෝ වැඩි ගණනක දාම විකල්ප ක්\u200dරියාකාරී මධ්\u200dයස්ථාන සංවර්ධනය කිරීමේ මාවතේ.
කොරොල්චෙන්කෝ ඒ. දහනය හා පිපිරුම් ක්\u200dරියාවලි
ක්\u200dරියාකාරී අංශුව පුනර්ජනනයකින් තොරව ප්\u200dරතික්\u200dරියා නොකරන මොහොත දක්වා ප්\u200dරතික්\u200dරියා දාමය දිගටම පවතී. මෙම අවස්ථාවේ දී, ඊනියා විවෘත පරිපථය සිදු වේ. දාම ප්\u200dරතික්\u200dරියා වල චාලක විද්\u200dයාවේ බිඳවැටීමේ ක්\u200dරියාවලීන් විශාල කාර්යභාරයක් ඉටු කරයි. ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල මරණයට හේතු වන ප්\u200dරතික්\u200dරියා වර්ග දෙකක් තිබේ:
සමජාතීය බිඳීමක් (ප්\u200dරතික්\u200dරියා මිශ්\u200dරණයේ පරිමාවේ මරණය);
විෂමජාතීය බිඳීම (surface න පෘෂ් on යක් මත මරණය) ක්\u200dරියාවලි දෙකෙන් එකක් සමඟ සමජාතීය දම්වැල් කැඩීම කළ හැකිය:
රැඩිකලුන් නැවත එකතු වන විට හෝ විවිධ රසායනිකව ක්\u200dරියාකාරී සංරචක සක්\u200dරීය මධ්\u200dයස්ථාන සමඟ අන්තර්ක්\u200dරියා කරන විට ඒවා ප්\u200dරතිජනනය නොකරයි.
විෂමජාතීය දාම බිඳවැටීම සිදුවන්නේ දහනය කිරීමේදී ඇතිවන පස් අංශු මත හෝ burn න දැවෙන ද්\u200dරව්\u200dය මතුපිට ය. Surface න පෘෂ් on යක් මත විවෘත පරිපථයක් ගෑස් මිශ්\u200dරණයේ සිට ක්\u200dරියාකාරී පෘෂ් aces යන් අතුරුදහන් වන මෙම පෘෂ් to යට විහිදීම ලෙස සැලකිය හැකිය. Surface න පෘෂ් on යක් මත නැවත එක්වීමේ යාන්ත්\u200dරණය නම්, ප්\u200dරතික්\u200dරියාශීලීත්වය වැඩි කරන ක්\u200dරියාකාරී අංශුව පෘෂ් on ය මතට ගසාගෙන යාමයි. මෙම ක්\u200dරියාවලිය සඳහා ශක්තිය හා අවකාශීය බාධක නොමැති බැවින් යාබද අඩවි වල ගිලී ඇති රැඩිකලුන් එකිනෙකා සමඟ නැවත එකතු වේ. නැවත එක්වීමේ ප්\u200dරති result ලයක් ලෙස පිහිටුවන ලද ස්ථායී සංයෝගවල අණු තවදුරටත් දාම ප්\u200dරතික්\u200dරියාවක වර්ධනයට සම්බන්ධ නොවේ.
කෙසේ වෙතත්, surface න පෘෂ් with යක් සහිත ක්\u200dරියාකාරී අංශුවක සෑම ision ට්ටනයක්ම එහි adsorption වෙත යොමු නොවේ. සමහර විට එය මතුපිටින් පිළිබිඹු වේ. Center න පෘෂ් by යකින් ක්\u200dරියාකාරී මධ්\u200dයස්ථානයක් අවශෝෂණය වීමේ සම්භාවිතාව නවාතැන් සංගුණකය ලෙස හැඳින්වේ. මෙම සංගුණකය සක්\u200dරීය අංශුවේ හා පෘෂ් of යේ රසායනික සම්බන්ධතාවයේ ලක්ෂණයකි. ප්රායෝගිකව වැදගත් අවස්ථාවන්හිදී, බිත්තියේ පරාවර්තනයෙන් පසු ක්රියාකාරී අංශුව එයින් දුරස් නොවේ. එහි නවාතැන් සිදුවන තෙක් බිත්තිය සමඟ නව isions ට්ටන ඇතිවීමේ සම්භාවිතාවක් ඇත. මෙම ක්\u200dරියාවලිය නිසා, ඇතැම් කොන්දේසි යටතේ, ප්\u200dරතික්\u200dරියා අනුපාතය නවාතැන් සංගුණකයෙන් ප්\u200dරායෝගිකව ස්වාධීන වේ. මෙම ක්\u200dරියාවලිය යුරෝපා සංගමය වැනි ආකාරයකින් ඉදිරියට යයි
* Sorption - පරිසරයේ ha න ද්\u200dරව්\u200dයයක body න ශරීරයක් (හෝ දියර) මගින් අවශෝෂණය කර ගැනීම. අවශෝෂණය කරන ශරීරය සෝර්බන්ට් ලෙස හැඳින්වේ- sorbate. සෝර්බන්ට් (අවශෝෂණය) සහ පෘෂ් layer ීය තට්ටුව (adsorption) හි සමස්ත ස්කන්ධයේ අවශෝෂණය වෙන්කර හඳුනා ගන්න. S න සෝර්බන්ට් සහ සෝර්බේට් මතුපිට අතර රසායනික වර්ගයේ අන්තර්ක්\u200dරියා නිසා ඇති වන විස්ථාපනය රසායන ද්\u200dරව්\u200dය ලෙස හැඳින්වේ.
__________________________ අදියර 2. දහනය අතරතුර රසායනික ක්\u200dරියාවලි
සෑම .ට්ටනයකදීම විවෘත පරිපථයක් සිදුවී ඇත්නම්. පෘෂ් at යේ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය ශුන්\u200dය විය හැක.
ප්\u200dරතික්\u200dරියාකාරක මිශ්\u200dරණයේ සක්\u200dරීය අපද්\u200dරව්\u200dය නොමැති විට, දම්වැල් කැඩී යාම solid න පෘෂ් on යන් මත හෝ සමජාතීය ලෙස විශාල වශයෙන් රැඩිකලුන් නැවත එකතු කිරීමෙන් සිදුවිය හැක. සැබෑ ගිනිගැනීම් වලදී, දෙවන ක්\u200dරමය ප්රධාන වශයෙන් ක්රියාත්මක වේ.
දාම ප්\u200dරතික්\u200dරියා වල චාලකයට යම් බලපෑමක් ඇති කිරීමෙන් නිෂ්ක්\u200dරීය වායූන්ගේ ප්\u200dරතික්\u200dරියා පද්ධතියේ ආකලන ඇත. නිෂ්ක්\u200dරීය ආකලන සක්\u200dරීය අංශු සමඟ isions ට්ටන ගණන වැඩි කරයි, දාම කැඩී යාමේ සම්භාවිතාව වැඩි කරයි, ඒ අනුව සමස්ත ප්\u200dරතික්\u200dරියාව වළක්වයි.
ප්\u200dරතික්\u200dරියාකාරක ආකලන හඳුන්වා දීමෙන් දාම ප්\u200dරතික්\u200dරියා වඩාත් effective ලදායී ලෙස නිෂේධනය කරනු ලැබේ - ප්\u200dරතික්\u200dරියාකාරක මිශ්\u200dරණයට ප්\u200dරතිරෝධක. නිෂේධකයෝ ක්\u200dරියාකාරී මධ්\u200dයස්ථාන සමඟ අන්තර්ක්\u200dරියා කරන අතර ප්\u200dරතික්\u200dරියාවට නායකත්වය දෙමින් දාමය බිඳ දමති. නිෂේධිත මිශ්\u200dරණයේ ප්\u200dරතික්\u200dරියා වල චාලක විද්\u200dයාව තීරණය වන්නේ ක්\u200dරියාකාරී මධ්\u200dයස්ථාන සමඟ අන්තර්ක්\u200dරියා කරන විට නිෂේධකය සහ ප්\u200dරතික්\u200dරියාවේ ප්\u200dරධාන කොටස් අතර තරඟයේ කොන්දේසි අනුව ය. නිෂේධකයේ ඉහළ කාර්යක්ෂමතාව සහ නව ක්\u200dරියාකාරී මධ්\u200dයස්ථාන උත්පාදනය කිරීමේ මධ්\u200dයස්ථ අනුපාතය සමඟ, දැනටමත් නිෂේධනයේ කුඩා ආකලන මගින් දාම ප්\u200dරතික්\u200dරියා පා course මාලාව සම්පූර්ණයෙන්ම යටපත් කළ හැකිය.
ගිනි හා පිපිරුම් ආරක්ෂාව සඳහා නිෂේධනය කිරීමේ ක්\u200dරියාවලීන් ඉතා වැදගත් වේ. නිෂේධක භාවිතය මඟින් දහන ක්\u200dරියාවලියට impact ලදායී ලෙස බලපෑම් කිරීමට ඉඩ ලබා දේ.
2.2. හයිඩ්\u200dරජන් දහනය කිරීමේදී රසායනික ක්\u200dරියාවලීන්
ඔක්සිජන් අණුවක් සමඟ හයිඩ්\u200dරජන් අණුවක අන්තර්ක්\u200dරියාකාරිත්වය අනුක්\u200dරමික අවධීන් මාලාවක් හරහා සංකීර්ණ ආකාරයකින් ඉදිරියට යයි. හයිඩ්\u200dරජන් දහනය සිදුවන්නේ දාම යාන්ත්\u200dරණයකින් වන අතර අංශු සක්\u200dරීය මධ්\u200dයස්ථානවල කාර්යභාරය ඉටු කරයි. හයිඩ්\u200dරජන් දහනය කිරීමේදී මූලික ප්\u200dරතික්\u200dරියා වල අනුක්\u200dරමය හා වැදගත්කම හයිඩ්\u200dරජන් ගිනි දැල්වීම හා වර්ධනය සඳහා විවිධ තත්වයන් සඳහා විස්තරාත්මකව විස්තර කෙරේ.
පර්යේෂණාත්මක හා පරිගණක ක්\u200dරම භාවිතා කරමින් ස්වයංක්\u200dරීයකරණ මාදිලියේ හයිඩ්\u200dරජන් දහනය කිරීමේ ක්\u200dරියාවලිය පිළිබඳ වඩාත් සවිස්තරාත්මක විශ්ලේෂණය මහාචාර්ය ඒ. එන්. බරටෝව් විසින් සිදු කරන ලදී. මූලික මූලික ප්\u200dරතික්\u200dරියා දහහතරක් ඇතුළුව ක්\u200dරියාවලියේ පහත යෝජනා ක්\u200dරමය ඔහු යෝජනා කළේය:
කොරොල්චෙන්කෝ ඒ. දහනය හා පිපිරුම් ක්\u200dරියාවලි
සක්\u200dරීය මධ්\u200dයස්ථානවල ආරම්භය සිදුවන්නේ ප්\u200dරතික්\u200dරියා මගිනි
![]()
ප්\u200dරතික්\u200dරියා දාමය අඛණ්ඩව පවත්වාගෙන යාම
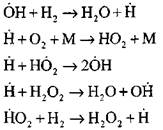
දම්වැල් අතු
 |
විවෘත පරිපථය
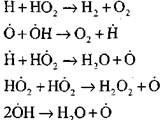 |
ස්වයංක්\u200dරීයකරණ ක්\u200dරියාවලියේ ආරම්භක අවධියේදී හයිඩ්\u200dරජන් පරමාණු සාන්ද්\u200dරණය කිරීම ආරම්භක හයිඩ්\u200dරජන් අන්තර්ගතයේ වැදගත් අංගයකි. දාම ප්\u200dරතික්\u200dරියාවක් වර්ධනය වීමත් සමඟ අණුක හයිඩ්\u200dරජන් පරිවර්තනය කිරීමේ වේගය තත්පරයට සියගණනකින් පරිභෝජනය කරන තරමට ඉහළ යයි.
2.3. කාබන් මොනොක්සයිඩ් දහනය කිරීමේදී රසායනික ප්\u200dරතික්\u200dරියා
ඔක්සිජන් සමඟ කාබන් මොනොක්සයිඩ් අන්තර්ක්\u200dරියා කිරීම දහනය කිරීමේ ක්\u200dරියාවලීන් සඳහා ප්\u200dරධාන ප්\u200dරතික්\u200dරියාවකි. කාලය තුළ මෙම ප්\u200dරතික්\u200dරියාවේ ගමන් මග
__________________________ පරිච්ඡේදය 2. රසායනික ක්\u200dරියාවලියදැවෙන විට
බොහෝ අවස්ථා වලදී කාබන් අඩංගු ද්\u200dරව්\u200dය දහනය කිරීමේ නීති තීරණය වේ. ප්\u200dරතික්\u200dරියාව අතු දාම යාන්ත්\u200dරණයකින් සංලක්ෂිත වේ. එය විශේෂාංග ගණනාවක් ඇත.
CO සහ 0 2 සම්පූර්ණයෙන්ම වියළි මිශ්\u200dරණයකට දැල්වීමට හා දහනය කිරීමට නොහැකි බවට දීර් time කාලයක් තිස්සේ විශ්වාසයක් පැවතුනි. කෙසේ වෙතත්, ස්කන්ධ වර්ණාවලීක්ෂයක් භාවිතා කරමින් ජලය නොමැතිකම අධීක්ෂණය කරන ලද පරිස්සමින් සකස් කරන ලද අත්හදා බැලීම්වලින් පෙනී ගියේ වියළි මිශ්\u200dරණයකට ජ්වලනය ද කළ හැකි බවයි. පද්ධතිය තුළ CO + 0 2 ජල වාෂ්ප හෝ හයිඩ්\u200dරජන් පැවතීම, හැකි ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ගණන වැඩි කිරීමෙන් ජ්වලනය හා දහනය කිරීමේ ක්\u200dරියාවලිය සක්\u200dරීය කරන බව සැලකිල්ලට ගත යුතුය. අඩු සාන්ද්\u200dරණයක දී ජලයේ වේගවත් බලපෑම විශේෂයෙන් කැපී පෙනේ.
ජල වාෂ්ප හෝ කාබන් මොනොක්සයිඩ් දහනය කිරීම හෝ හයිඩ්\u200dරජන් කුඩා එකතු කිරීම පහත සඳහන් මූලික ක්\u200dරියාවලීන්ගේ සහභාගීත්වයෙන් සිදු වේ:

ප්\u200dරතික්\u200dරියා (VI) මගින් සෑදී ඇති රැඩිකලුන් වන H0 2 දාමය (ප්\u200dරතික්\u200dරියාව VIII) දිගටම කරගෙන යා හැකිය. නැතහොත් ප්\u200dරතික්\u200dරියා මගින් (IX-XII) බිඳවැටීමට තුඩු දිය හැකිය.
CO හි මන්දගාමී ඔක්සිකරණය දාම පිපිරීමක් බවට පරිවර්තනය කිරීමේ කොන්දේසි තක්සේරු කිරීම සඳහා, රැඩිකල් H0 2 හරහා දාම බිඳවැටීමේ සම්භාවිතාව තක්සේරු කරමු; දාමය අවසන් කිරීමේදී ප්\u200dරතික්\u200dරියා (X) සහ (XI) වල කාර්යභාරය වැදගත් නොවන බව මෙහිදී අපි සැලකිල්ලට ගනිමු
ප්\u200dරතික්\u200dරියා (IX) හා සසඳන විට, 1000 K අනුපිළිවෙලෙහි උෂ්ණත්වවල ක්\u200dරියාවලි (IX-XI) අනුපාත නියතයන් එකිනෙකට සමීප බැවින් රැඩිකලුන්ගේ සාන්ද්\u200dරණය හයිඩ්\u200dරජන් පරමාණු සාන්ද්\u200dරණයට වඩා බෙහෙවින් අඩු ය. එබැවින්, රැඩිකල් H0 2 හරහා විවෘත පරිපථයක සම්භාවිතාව ස්වරූපයෙන් ලිවිය හැකිය:
1000K උෂ්ණත්වයකදී
එබැවින් එය සපයා ඇත
![]()
![]()
විශාලත්ව බලපෑම
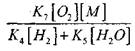
සමීකරණය විසඳීමේදී (2.7) දුර්වල වනු ඇත.
අදියර 2. දහනය අතරතුර රසායනික ක්\u200dරියාවලි
සම්බන්ධයෙන් ![]() හෝ
හෝ ![]() (නිරීක්ෂණය කර ඇති දේ
(නිරීක්ෂණය කර ඇති දේ
තාත්වික ගිනිදැල් සමඟ), සමීකරණය (2.7) ස්වරූපයට පරිවර්තනය වේ:
![]() (2.8)
(2.8)
මේ අනුව, වාතයේ කාබන් මොනොක්සයිඩ් දහනය කිරීමේ තත්වය බොහෝ දුරට තීරණය වන්නේ හයිඩ්\u200dරජන් දහනය පැවතීම හා රටා අනුව ය. CO (ඔක්සිකරණය) මගින් ඔක්සිකරණය රඳා පවතින්නේ හයිඩ්\u200dරජන් සම්බන්ධ ප්\u200dරතික්\u200dරියා වල ඇති OH රැඩිකලුන්ගේ සාන්ද්\u200dරණය මත ය.
හයිඩ්\u200dරජන් පරමාණු කෙරෙහි ඉහළ ඇල්මක් ඇති ද්\u200dරව්\u200dයවල ප්\u200dරතික්\u200dරියාශීලී පද්ධතියට කුඩා ආකලන හඳුන්වා දෙන විට කාබන් මොනොක්සයිඩ් දහන ප්\u200dරතික්\u200dරියා වල සුවිශේෂත්වය එහි වේගවත් නිෂේධනය තුළ පවතී. CO දහනය වළක්වන එවැනි ද්\u200dරව්\u200dය වන්නේ හයිඩ්\u200dරොකාබන වල හැලයිඩ් සහ හැලෝ-ව්\u200dයුත්පන්නයන් ය. ප්\u200dරතික්\u200dරියා මගින් හයිඩ්\u200dරජන් පරමාණු සමඟ අන්තර්ක්\u200dරියා කරන විට ප්\u200dරතික්\u200dරියා දාම අවසන් වීම නිසා ඒවායේ නිශේධනීය බලපෑම
2.4. හයිඩ්\u200dරොකාබන් දහනය
හයිඩ්\u200dරජන් සහ කාබන් මොනොක්සයිඩ්වල දහන ක්\u200dරියාවලීන් පරීක්ෂා කිරීමෙන් දහන ප්\u200dරතික්\u200dරියා යාන්ත්\u200dරණයේ සංකීර්ණත්වය පෙන්නුම් කරයි. H 2 සහ CO සම්බන්ධයෙන් ගත් කල, ප්\u200dරතික්\u200dරියාව බොහෝ මූලික අවධීන් සහ අතරමැදි නිෂ්පාදනවල සහභාගීත්වය සමඟ දාමයක් ලෙස ඉදිරියට යයි. එබැවින් වඩාත් සංකීර්ණ ද්\u200dරව්\u200dයවල දහන ප්\u200dරතික්\u200dරියා යාන්ත්\u200dරණය වන හයිඩ්\u200dරොකාබන වඩාත් සංකීර්ණ වන අතර මෙම සංයෝගවල ජ්වලනය හා දහනය කිරීමේ ක්\u200dරියාවලීන් සමඟ ඇති වන බලපෑම් වඩාත් විවිධාකාර වේ යැයි අපේක්ෂා කිරීම ස්වාභාවිකය.
හයිඩ්\u200dරොකාබන දහනය කිරීමේ ක්\u200dරියාවලියේදී රසායනික උන්නතාංශවල ස්වභාවය පිළිබඳ දැනට පවතින තොරතුරු මඟින් නිරීක්ෂණය කරන ලද බලපෑම් යම් දළ වශයෙන් පැහැදිලි කිරීමට අපට ඉඩ සලසයි.
හයිඩ්\u200dරොකාබන් ගිනිදැල්වල, දැනටමත් දන්නා ක්\u200dරියාකාරී අංශු සමඟ, වඩාත් සංකීර්ණ ව්\u200dයුහයක අතරමැදි නිෂ්පාදන විශාල සංඛ්\u200dයාවක් ඇති බව තහවුරු විය. සමහර අවස්ථාවලදී ඒවා නව දාමයන් මතුවීමේ ප්\u200dරභවයන් බවට පත්වේ. හයිඩ්\u200dරොකාබන ජ්වලනය හා දහනය කිරීමේ ක්\u200dරියාවලීන්හි ප්\u200dරධාන කාර්යභාරය පහත දැක්වෙන අතරමැදි සංයෝග මගින් ඉටු කරයි:
කොරොල්චෙන්කෝ ඒ. දහනය හා පිපිරුම් ක්\u200dරියාවලි
1. අණුවක් වන හයිඩ්\u200dරොකාබන් රැඩිකලුන්ස්
හයිඩ්\u200dරජන් පරමාණු එකක් හෝ කිහිපයක් ඉවත් කළ ලෙවෝඩෝරෝඩා. මේවා
අපද්\u200dරව්\u200dය ඇල්කයිල් ලෙස හැඳින්වේ (CH 3 - මෙතිල්; සී 2 එච් 5 - එතිල්; සී 3 එච් 7 - ප්\u200dරොපයිල් සහ
ආදිය). එහි ඉහළ ප්\u200dරතික්\u200dරියාකාරිත්වය හේතුවෙන් නිදහස් ඇල්කයිල්
දිගු කාලයක් පවතින්නේ නැත. අතරමැදි ලෙස ගිනිදැල් වල ඉදිරිපත් කරන්න
නිෂ්පාදන. වෙනත් අණු සමඟ අන්තර් ක්\u200dරියා කරන විට හැසිරේ
ස්වාධීන ව්\u200dයුහාත්මක කණ්ඩායමක් ලෙස. හයිඩ්\u200dරොකාබන් රැඩිකල්ස්
සාමාන්\u200dයයෙන් ආර් අක්ෂරයෙන් නිරූපණය කෙරේ.
2. පෙරොක්සයිඩ් - සාමාන්\u200dය සූත්\u200dරයේ R-00-R සංයෝග.
3. ඇල්ඩිහයිඩ් - වර්ග සංයෝග
![]()
සරලම ඇල්ඩිහයිඩ වන්නේ ෆෝමික් (ෆෝමල්ඩිහයිඩ්) සහ ඇසිටික් (ඇසිටැල්ඩිහයිඩ්) ![]() . මෙම ද්රව්ය සියල්ලම වේ
. මෙම ද්රව්ය සියල්ලම වේ
හයිඩ්\u200dරොකාබන අසම්පූර්ණ දහනය කිරීමේ නිෂ්පාදනවල පවතී.
හයිඩ්\u200dරොකාබන දහනය කිරීමේදී දම්වැල සෑදීම හයිඩ්\u200dරොකාබන් රැඩිකලුන් සෑදෙන ඕනෑම ප්\u200dරතික්\u200dරියාවක් විය හැකිය. මෙය නිදහස් මෙතිල් කාණ්ඩ දෙකක් සෑදීම සමඟ ඊතන් අණුවක දිරාපත්වීමේ ප්\u200dරතික්\u200dරියාවක් විය හැකිය:
![]()
හෝ ඔක්සිජන් සමඟ හයිඩ්\u200dරොකාබනයක ප්\u200dරතික්\u200dරියාව:
![]()
දම්වැල් අඛණ්ඩව පැවතීම සෑදීමේ ප්\u200dරතික්\u200dරියා වල ප්\u200dරති as ලයක් ලෙස සිදු වේ | පෙරොක්සයිඩ් හෝ හයිඩ්\u200dරොපෙරොක්සයිඩ්:
![]()
හයිඩ්\u200dරොපෙරොක්සයිඩ් දිරාපත්වීමේදී දම්වැල් අතු සිදු කරනු ලැබේ:
අදියර 2. දහනය අතරතුර රසායනික ක්\u200dරියාවලි
ලබා දී ඇති ප්\u200dරතික්\u200dරියා අනුක්\u200dරමය ප්\u200dරතික්\u200dරියා පද්ධතියේ පෙරොක්සයිඩ් සංයෝග සාන්ද්\u200dරණය ක්\u200dරමයෙන් වැඩි කිරීමට හේතු වේ.
පෙරොක්සයිඩ්, රැඩිකලුන් සහ ආරම්භය සමුච්චය වීමට සමගාමීව
සමාන්තර ප්\u200dරතික්\u200dරියා ඇත:

මෙම ප්\u200dරතික්\u200dරියා බාහිර තාපය; ඔවුන් විශාල තාපයක් ගලා යන විට.
ප්\u200dරතික්\u200dරියාකාරක මිශ්\u200dරණයේ උෂ්ණත්වය ඉහළ යාමත් සමඟ ක්\u200dරියාකාරී මධ්\u200dයස්ථානවල කාර්යභාරය පහත දැක්වෙන අනුපිළිවෙලින් එක් අතරමැදි නිෂ්පාදනයක් සිට තවත් නිෂ්පාදනයක් දක්වා ගමන් කරයි: ඇල්කයිල් හයිඩ්\u200dරොපෙරොක්සයිඩ්, ඇසයිල් හයිඩ්\u200dරොපෙරොක්සයිඩ්, ෆෝමල්ඩිහයිඩ්.
ඉහළ උෂ්ණත්ව කලාපයේ (600-800) C) කාලයාගේ ඇවෑමෙන් ප්\u200dරතික්\u200dරියා මිශ්\u200dරණයේ සංයුතියේ වෙනස්වීම් පිළිබඳ පර්යේෂණාත්මක අධ්\u200dයයනවලින් පෙනී යන්නේ ආරම්භක හයිඩ්\u200dරොකාබන අවසාන දහන නිෂ්පාදන බවට පරිවර්තනය කිරීමේ ක්\u200dරියාවලිය අදියර දෙකකට බෙදා ඇති බවයි: පළමුවැන්න ඉතා ඉහළ අනුපාතයකින් සිදුවන අතර හයිඩ්\u200dරොකාබන් CO වෙත ඔක්සිකරණය වේ. දෙවන, මන්දගාමී, අවධියේදී, CO ඔක්සිකරණය වේ. ඉතා වැදගත් නිගමනයක් පහත දැක්වේ: කාබන් මොනොක්සයිඩ් දහනය කිරීමේ ලක්ෂණ මගින් හයිඩ්\u200dරොකාබන් දහනය කිරීමේ නීති බොහෝමයක් පැහැදිලි කළ හැකිය.
2.5. කාබන් දහනය
කාබන් දහනය ඉදිරියට යන්නේ විෂමජාතීය ක්\u200dරියාවලියක යාන්ත්\u200dරණය අනුව ය. එහි නිශ්චිතතාව පවතින්නේ වායුමය ඔක්සිකාරකයක් (වාතයේ ඔක්සිජන්) අවට අවකාශයේ සිට දැවෙන .න ද්\u200dරව්\u200dයයක මතුපිටට මාරු කිරීමේ ක්\u200dරියාවලියෙන් රසායනික අවධිය හුදකලා ලෙස සැලකිය නොහැකි බැවිනි. දැවෙන වේගය කාබන්හි රසායනික ගුණාංග සහ ඉන්ධන මතුපිටට ඔක්සිජන් සැපයීමේ ක්\u200dරියාවලිය තීරණය කරන ලක්ෂණ යන දෙකම මත රඳා පවතී. දහන කලාපයට ඔක්සිජන් සැපයීම විසරණය මගින් සිදු කරනු ලැබේ
කොරොල්චෙන්කෝ ඒ. දහනය හා පිපිරුම් ක්\u200dරියාවලි
බොහෝ සාධක මත රඳා පවතී: දැවෙන ශරීරයේ හැඩය සහ ප්\u200dරමාණය, වායුමය මාධ්\u200dයයේ චලනය, ඔක්සිජන් විසරණය කිරීමේ සංගුණක සහ ප්\u200dරතික්\u200dරියා නිෂ්පාදන යන දෙකම ඉන්ධන මතුපිටට ඉහළින් ඇති අවකාශයේ සහ ගල් අඟුරු සහ කෝක් වල ඇති ඉරිතැලීම් හා සිදුරු සැලකිය යුතු ප්\u200dරමාණයකින්.
විෂමජාතීය කාබන් දහනය කිරීමේ ලක්ෂණ නිදර්ශනය කිරීම සඳහා, 900 ° C උෂ්ණත්වයකට රත් කරන ලද උදුනක තබා ඇති වෙනම ගල් අඟුරු කැබැල්ලක හැසිරීම අපි සලකා බලමු. ආරම්භක මොහොතේදී, ගල් අඟුරු දහනය සිදුවන්නේ එහි මතුපිට අසල පිහිටා ඇති ඔක්සිජන් වියදමින් ය. එය භාවිතා කිරීමෙන් පසුව, උනුසුම් වූ පෘෂ් around ය වටා දහන නිෂ්පාදන තට්ටුවක් සාදයි. දැවෙන වේගය අඩු වනු ඇති අතර ගෑස් අවකාශයේ දුර බැහැර ප්\u200dරදේශවලින් ඔක්සිජන් නොපැමිණියේ නම් ක්\u200dරියාවලිය නතර විය හැකිය.
මෙම ප්\u200dරවාහය සිදුවන්නේ විසරණය හරහා වන අතර, දැවෙන වේගය විසරණය වන ප්\u200dරවාහය මගින් තීරණය වේ. විසරණය වීමේ තීව්\u200dරතාවය බොහෝ දුරට රඳා පවතින්නේ දැවෙන පෘෂ් near ය අසල වායු මාධ්\u200dයයේ චලනයේ තීව්\u200dරතාවය සහ ස්වභාවය මත ය. රසායනික ප්\u200dරතික්\u200dරියා වේගය ප්\u200dරධාන වශයෙන් තීරණය වන්නේ උෂ්ණත්වය අනුව ය. විෂමජාතීය ප්\u200dරතික්\u200dරියා මෙන්ම සමජාතීය ද අරේ-නියස් නීතියට අවනත වේ.
ඉහළ උෂ්ණත්වවලදී, කාබන්හි ඔක්සිකරණ ප්\u200dරතික්\u200dරියාව ඉතා ඉක්මණින් ඉදිරියට යන අතර පෘෂ් to යට ඔක්සිජන් විහිදුවීම මඟින් ක්\u200dරියාවලියේ සම්පූර්ණ වේගය සීමා වේ.
මේ අනුව, කාබන් දහනය කිරීමේ ක්\u200dරියාවලිය විවිධ ස්වභාවයේ ක්\u200dරියාවලීන් දෙකකින් සමන්විත වේ: වායු අවකාශයේ සිට වායු ඔක්සිජන් එහි පරිභෝජනය කරන ස්ථානයට ප්\u200dරවාහනය කිරීමේ ක්\u200dරියාවලිය සහ carbon න කාබන් මතුපිට සමඟ එහි රසායනික අන්තර්ක්\u200dරියා ක්\u200dරියාවලිය. මෙම ක්\u200dරියාදාමයන් දෙකම එකිනෙකට සම්බන්ධ වී ඇති නමුත් සෑම එකක්ම තමන්ගේම නීති ඇත. මෙම ක්\u200dරියාවලීන්ගෙන් වඩාත් වැදගත් වන්නේ ඔක්සිජන් පරිභෝජනය කිරීමේ ක්\u200dරියාවලිය වන අතර එය විවිධ රසායනික ප්\u200dරතික්\u200dරියා මගින් සංලක්ෂිත වේ.
කාබන් සමඟ ඔක්සිජන් සංයෝජනය කිරීමේ සංකීර්ණ ප්\u200dරතික්\u200dරියාවේ යාන්ත්\u200dරණය සමන්විත වන්නේ C X 0 Y වර්ගයේ අතරමැදි භෞතික රසායනික සංකීර්ණයක් හරහා CO සහ C0 2 ඔක්සයිඩ දෙකක් එකවර සෑදීමෙනි, පසුව එය CO සහ. මෙම ඔක්සයිඩ අතර අනුපාතය දැවෙන තත්වයන් මත රඳා පවතී. ඒ අනුව, දැවෙන කාබන් ප්\u200dරතික්\u200dරියා සඳහා සමීකරණය පහත පරිදි ලිවිය හැකිය:
අදියර 2. දහනය අතරතුර රසායනික ක්\u200dරියාවලි
එවිට කාබන් මොනොක්සයිඩ් දහනය කිරීමේ සමජාතීය ප්\u200dරතික්\u200dරියාවක් ඉදිරියට යයි:
2.3 වගන්තියේ සාකච්ඡා කර ඇති යාන්ත්\u200dරණය.
මෙම ප්\u200dරතික්\u200dරියාව කාබන් මතුපිට අසල සිදුවිය හැක, ඉතින්ගල් අඟුරු ස්කන්ධය තුළ, එහි සිදුරු හා ඉරිතැලීම් වල.
තවත් ප්\u200dරතික්\u200dරියාවක් වන්නේ උණුසුම් කාබන් සහ කාබන් ඩයොක්සයිඩ් අතර විෂමජාතීය ප්\u200dරතික්\u200dරියාවකි:
![]()
ඔක්සිජන් හිඟයක් ඇති නමුත් කාබන්හි උෂ්ණත්වය ප්\u200dරමාණවත් තරම් ඉහළ මට්ටමක පවතින විට එය සැලකිය යුතු වේගයකින් ගලා යයි.
විස්තර කර ඇති ප්\u200dරතික්\u200dරියා වල සංයෝජනය මගින් කාබන් දහනය කිරීමේ නිෂ්පාදනවල සංයුතිය තීරණය වේ.
සංයුක්ත ක්\u200dරියාවලීන්ගේ ප්\u200dරබලතාවය
| ආර් |
ගිනි අවුලුවන මිශ්\u200dරණයන්හි වාරිමාර්ග සිදුවන්නේ ඔවුන්ගේ ස්වයං ජ්වලනය, බාහිර ප්\u200dරභවයක් මගින් ජ්වලනය කිරීම හෝ ස්වයංසිද්ධ දහනය හේතුවෙන් විය හැකිය. ස්වයං-ජ්වලනය හා ජ්වලනය කිරීමේ ක්\u200dරියාවලීන් වායුමය, ද්\u200dරව හෝ state න තත්වයේ පවතින ද්\u200dරව්\u200dයයන්ගේ ලක්ෂණයක් නම්, ස්වයංසිද්ධ දහනය යනු solid න ද්\u200dරව්\u200dයවල (විශේෂයෙන් සිහින් ව බෙදී ඇති තත්වයේ) හෝ සංවර්ධිත පෘෂ් with යක් සහිත ද්\u200dරව්\u200dය මත බෙදා හරින ඉහළ තාපාංක ද්\u200dරවයකි.
3.1. ස්වයං ජ්වලනය. ලිපි ද්\u200dරව්\u200dය න්\u200dයාය
සරලව කිවහොත්, දහනය යනු සැලකිය යුතු තාප ප්\u200dරමාණයක් සහ ආලෝකය විමෝචනය වීමත් සමඟ වායුගෝලීය ඔක්සිජන් මගින් ද්\u200dරව්\u200dය ඔක්සිකරණය කිරීමේ වේගවත් බාහිර තාප ක්\u200dරියාවලියක් ලෙස වටහා ගනු ලැබේ.
දහනය යනු දහනය කළ හැකි ද්\u200dරව්\u200dයයක හා ඔක්සිකාරක කාරකයේ අන්තර්ක්\u200dරියාකාරිත්වයේ සංකීර්ණ භෞතික-රසායනික ක්\u200dරියාවලියක් මෙන්ම ඇතැම් ද්\u200dරව්\u200dය දිරාපත් වීම, විශාල තාප ප්\u200dරමාණයක් මුදා හැරීම හා ආලෝකය විමෝචනය වීමත් සමඟ ස්වයං-වේගවත් පරිවර්තනයකින් සංලක්ෂිත වේ. සාමාන්\u200dයයෙන් 21 සාන්ද්\u200dරණයක් සහිත වායු ඔක්සිජන් ඔක්සිකාරක කාරකයක් ලෙස සම්බන්ධ වේ. ගැන %. දහනය කිරීමේ ක්\u200dරියාවලිය මතුවීම හා සංවර්ධනය කිරීම සඳහා දහනය කළ හැකි ද්\u200dරව්\u200dයයක්, ඔක්සිකාරක කාරකයක් සහ ජ්වලන ප්\u200dරභවයක් අවශ්\u200dය වන අතර ඉන්ධන සහ ඔක්සිකාරක කාරකය අතර යම් රසායනික ප්\u200dරතික්\u200dරියාවක් ආරම්භ කරයි.
දහනය, රීතියක් ලෙස, වායු අවධියේදී සිදු වේ, එබැවින් දහනය සෑදීම හා පවත්වා ගැනීම සඳහා ensed නීභවනය වූ තත්වයක (ද්\u200dරව සහ ids න) දහනය කළ හැකි ද්\u200dරව්\u200dය ගෑස්කරණයට (වාෂ්පීකරණය, වියෝජනය) භාජනය කළ යුතුය. තාපය හා ස්කන්ධ හුවමාරු ක්\u200dරියාවලීන්, වායු ගතික සාධක, රසායනික ප්\u200dරතික්\u200dරියා වල චාලක විද්\u200dයාව සහ වෙනත් සාධක මෙන්ම බාහිර තත්වයන් සහ සංවර්ධන ක්\u200dරියාවලියේ ස්වභාවය අතර ඇති ප්\u200dරතිපෝෂණය නිසා දහනය වෙන්කර හඳුනාගත හැකිය.
2.4.2.1. දහන ක්\u200dරියාවලි වර්ගීකරණය.
පිළිස්සීම විය හැකිය සමජාතීය සහ විෂමජාතීය ගිනි අවුලුවන ද්\u200dරව්\u200dය හා ඔක්සිකාරක එකතු කිරීමේ තත්වය මත පදනම්ව.
සමජාතීය දහනය සිදුවන්නේ දහනය කළ හැකි මිශ්\u200dරණයේ ප්\u200dරතික්\u200dරියාකාරක සංරචක එකම සමස්ථ තත්වයක් ඇති විටය. සමජාතීය පිළිස්සීම විය හැකිය චාලක සහ විසරණය දහනය කළ හැකි සං of ටක මිශ්\u200dරණය සෑදීමේ කොන්දේසි සහ රසායනික ප්\u200dරතික්\u200dරියා හා මිශ්\u200dරණ සෑදීමේ අනුපාතය මත පදනම්ව. එක් හෝ තවත් දහන ක්\u200dරමයක් සාක්ෂාත් කරගනු ලැබේ, නිදසුනක් ලෙස, ගින්නක් ඇතිවීමේදී, දහන ක්\u200dරියාවලියේ කුමන අදියරයන් සීමා කරන්නේද යන්න මත පදනම්ව: මිශ්\u200dරණ සෑදීමේ වේගය හෝ රසායනික ප්\u200dරතික්\u200dරියා අනුපාතය.
චාලක යනු පූර්ව මිශ්\u200dර වායුව හෝ වාෂ්ප-වායු මිශ්\u200dරණයන් දහනය කිරීමයි (ක්\u200dරියාවලියේ සීමිත අවධිය රසායනික ප්\u200dරතික්\u200dරියා වේගයයි), එය බොහෝ විට පුපුරන සුළු ලක්ෂණයක් ඇත (මිශ්\u200dරණය සීමිත අවකාශයක පිහිටුවා ඇත්නම්) එකවර නිකුත් කරන ශක්තියට මෙම අවකාශයෙන් ඔබ්බට විසුරුවා හැරීමට කාලයක් නොමැත. දහන කලාපයට අඛණ්ඩව ඉන්ධන සැපයුමක් සහිත කුඩා විවෘත අවකාශයක දහනය කළ හැකි මිශ්\u200dරණය කලින් නිර්මාණය කර ඇත්නම් චාලක දහනය ද සන්සුන් විය හැකිය.
දහන කලාපයේ කෙලින්ම දහනය කළ හැකි මිශ්\u200dරණයක් නිර්මාණය කිරීමේදී, විසරණය කිරීමේ ක්\u200dරියාවලිය හේතුවෙන් ඔක්සිකාරකය එයට ඇතුළු වන විට, දහනය කිරීමේ ක්\u200dරමය අවබෝධ වේ. විෂමජාතීය දැවෙන.
දහනය කළ හැකි ද්\u200dරව්\u200dයයක සහ ඔක්සිකාරකයේ විවිධ සමස්ථ තත්වයන් යටතේ විෂමජාතීය දහනය සිදු කෙරේ. විෂමජාතීය දහනය කිරීමේදී, වැදගත් කාර්යභාරයක් ඉටු කරනු ලබන්නේ ensed නීභූත දහනය කළ හැකි ද්\u200dරව්\u200dය වලින් (ද්\u200dරව, ids න) ප්\u200dරතික්\u200dරියා කලාපයට සෑදී ඇති වාෂ්ප ප්\u200dරවාහයේ තීව්\u200dරතාවයෙනි.
වායු ගතික ස්ථාන වලින්, පිළිස්සීම විය හැකිය ලැමිනාර්සහ කැලඹිලි සහිත.
දහනය කළ හැකි මිශ්\u200dරණයේ සං the ටක රෙනෝල්ඩ්ස් නිර්ණායකයේ (0) කුඩා අගයන් සමඟ ප්\u200dරතික්\u200dරියා කලාපයට ඇතුළු වන විට දහන ක්\u200dරියාවලියේ ලැමිනර් ප්\u200dරකාරය සිදු කෙරේ.< ආර් ඊ < 200), т.е. в основном за счёт молекулярной диффузии. Процесс характеризуется малыми скоростями газовыхඉන්ධන සහ ඔක්සිකාරක ගලා යයි සහ අභ්\u200dයවකාශයේ ප්\u200dරතික්\u200dරියා කලාපයේ (ගිනි ඉදිරිපස) ස්ථර බෙදා හැරීම. මෙම අවස්ථාවේ දී දැවෙන අනුපාතය දහනය කළ හැකි මිශ්රණය සෑදීමේ වේගය මත රඳා පවතී.
දහනය කළ හැකි මිශ්\u200dරණයේ සං the ටක රෙනෝල්ඩ්ස් නිර්ණායකයේ (230) විශාල අගයන් සහිත ප්\u200dරතික්\u200dරියා කලාපයට ඇතුළු වූ විට ක්\u200dරියාවලියේ කැළඹිලි ආකාරය අවබෝධ වේ.< ආර් ඊ< 10000). පිළිස්සීම මෙම ප්\u200dරකාරයේදී වායු ප්\u200dරවේගය වැඩි වීමත් සමඟ සිදු වේ ඇළ දොළඔවුන්ගේ චලනයේ ලැමිෙන්ටරි භාවය බාධා වන විට. කැළඹිලි සහිත දහනය කිරීමේ ක්\u200dරමයේදී, ගෑස් ජෙට් වල කැළඹීම ප්\u200dරතික්\u200dරියාකාරක සං of ටක මිශ්\u200dර කිරීම වැඩි දියුණු කරන අතර එමඟින් අණුක විසරණය සිදුවන පෘෂ් area වර්ග area ලය වැඩි වන අතර එහි ප්\u200dරති space ලයක් ලෙස අභ්\u200dයවකාශයේ ගිනි පැතිරීමේ වේගය වැඩි වේ.
අභ්\u200dයවකාශයේ ගිනි පැතිරීමේ වේගය පහත පරිදි බෙදී ඇත.
– deflagration(ගිනි පැතිරීමේ වේගය කිහිපයක් m / s);
– පුපුරන සුලු (ගින්නෙහි වේගය දස දහස් ගණනක් වේ m / sනමුත් වාතයේ ශබ්දය ප්\u200dරචාරණය කිරීමේ වේගයට වඩා වැඩි නොවේ (344) m / s));
– පුපුරා යාම (ගිනිදැල් ප්\u200dරචාරණය කිරීමේ වේගය වාතයේ ශබ්දයේ වේගයට වඩා වැඩිය).
රසායනික ප්\u200dරතික්\u200dරියා වල ගැඹුර අනුව, පිළිස්සීම විය හැකිය සම්පූර්ණයි සහ අසම්පූර්ණයි.
සම්පූර්ණ දහනය සමඟ ප්\u200dරතික්\u200dරියාව අවසානය දක්වා ඉදිරියට යයි, එනම්. ඉන්ධන සහ ඔක්සිකාරක සමඟ එකිනෙකා සමඟ තවදුරටත් අන්තර්ක්\u200dරියා කිරීමට නොහැකි ද්\u200dරව්\u200dය සෑදීමට පෙර (දහනය කළ හැකි ද්\u200dරව්\u200dය හා ඔක්සිකාරකයේ ආරම්භක අනුපාතය හැඳින්වේ stoichiometric). නිදසුනක් ලෙස, ප්\u200dරතික්\u200dරියාව අනුව ඉදිරියට යන මීතේන් සම්පූර්ණ දහනය සලකා බලන්න
සී.එච් 4 + 2ඕ 2 = CO 2 + 2එච් 2 ඕ+ ප්\u200dරශ්නය -
කොහෙද ප්\u200dරශ්නය - - බාහිර තාප ප්\u200dරතික්\u200dරියාවෙන් නිකුත් වන තාපය, ජේ.
හයිඩ්\u200dරොකාබනවල සම්පූර්ණ දහනයත් සමඟ ප්\u200dරතික්\u200dරියා නිෂ්පාදන වන්නේ කාබන් ඩයොක්සයිඩ් සහ ජලය, එනම් විෂ නොවන හා දහනය කළ නොහැකි ද්\u200dරව්\u200dයයි. ඉන්ධන සහ ඔක්සිකාරකයේ ස්ටොයිකියෝමිතික අනුපාතය සහ දහනය කළ හැකි මිශ්\u200dරණයේ ඇති ස්ටොයිකියෝමිතික අන්තර්ගතයට සාපේක්ෂව ඔක්සිකාරක අතිරික්තයක් සමඟ පූර්ණ දහනය අවබෝධ කර ගත හැකිය.
අසම්පූර්ණ දහනය රසායනික ප්\u200dරතික්\u200dරියාවක අසම්පූර්ණකම මගින් සංලක්ෂිත වේ, එනම්. ඔක්සිකාරක කාරකයක් ඉදිරිපිට ඇති ප්\u200dරතික්\u200dරියා නිෂ්පාදන සමඟ එය තවදුරටත් අන්තර්ක්\u200dරියා කළ හැකිය. අසම්පූර්ණ දහනය සිදුවන්නේ දහනය කළ හැකි මිශ්\u200dරණයේ ඇති ප්\u200dරමාණවත් නොවන (ස්ටොයිකියෝමිතික හා සසඳන විට) ඔක්සිකාරක අන්තර්ගතයෙනි. අසම්පූර්ණ දහනයක ප්\u200dරති result ලයක් ලෙස, උදාහරණයක් ලෙස, හයිඩ්\u200dරොකාබන, විෂ සහිත හා දහනය කළ හැකි සංරචක සෑදීම CO, එච් 2, බෙන්ස්පිරීන්, සමඟ (සබන්), කාබනික දුම්මල ආදිය රසායනික සංයෝග හා මූලද්\u200dරව්\u200dය 300 ක් පමණ වේ.
වෙනත් දේ සමාන වන අතර, සම්පූර්ණ දහනය සමඟ, අසම්පූර්ණ තත්වයන්ට වඩා ඉහළ උෂ්ණත්වයක් වර්ධනය වේ.
2.4.2.2. දහනය කිරීමේ ප්රධාන යාන්ත්රණ.
දහනය තාපය හා ආලෝක විමෝචනය සමඟ සිදුවන අතර පද්ධතියේ තාපය සමුච්චය වීම හා සම්බන්ධ ක්\u200dරියාවලියේ ප්\u200dරගතිශීලී ස්වයං ත්වරණය යටතේ සිදු වේ ( තාප දහනය) හෝ ප්\u200dරතික්\u200dරියා වල සක්\u200dරීය අතරමැදි නිෂ්පාදන උත්ප්\u200dරේරණය කිරීම ( දාම දැවීම).
තාප දහනය බාහිර තාප ප්\u200dරතික්\u200dරියාවකදී සිදුවිය හැකි අතර පද්ධතිය තුළ රැස් වන තාපයේ බලපෑම යටතේ වේගයෙන් වැඩි වන අතර එය උෂ්ණත්වය ඉහළ යාමට හේතු වේ. ප්\u200dරතික්\u200dරියාවෙන් තාප ආදානය පරිසරයට සිදුවන තාප අලාභය ඉක්මවා යන විට පද්ධතිය ස්වයං-තාපය ලබා ගන්නා අතර එය දහනය කළ හැකි මිශ්\u200dරණයේ ස්වයං ජ්වලනය සමඟ අවසන් වේ. මෙම තත්වයන් යටතේ, ප්\u200dරතික්\u200dරියාවේ ස්වයංසිද්ධ වර්ධනයක් නිරීක්ෂණය කරනු ලබන අතර, එහි ප්\u200dරති products ලයක් ලෙස ලැබෙන නිෂ්පාදන ආලෝකය විමෝචනය කිරීමට පටන් ගන්නා උෂ්ණත්වයකට රත් කිරීමෙන් (900 ට වඩා °). තාප දහනයට වායු ඔක්සිජන් හා එය නොමැතිව ක්\u200dරියාදාමයන් ඇතුළත් වේ (පුපුරණ ද්\u200dරව්\u200dය, ඕසෝන්, ඇසිටිලීන් සහ පෙරොක්සයිඩ් දිරාපත් වීම (උදාහරණයක් ලෙස) එච් 2 ඔහ් 2), හැලජන්, සල්ෆර් ආදිය සමඟ සමහර ලෝහවල අන්තර්ක්\u200dරියාකාරිත්වය).
දම්වැල් දහනය කළ හැක්කේ දාම ක්\u200dරියාවලිය ජ්වලනය හෝ පිපිරීමේ පදනම වන ප්\u200dරතික්\u200dරියා වලදී පමණි. දෙවැන්න ක්\u200dරියාකාරී මධ්\u200dයස්ථාන (නිදහස් රසායනික බන්ධන සහිත පරමාණු සහ අණු) ප්\u200dරතිජනනය කරන අස්ථායී අතරමැදි ප්\u200dරතික්\u200dරියා නිෂ්පාදන සෑදීම සමඟ ක්\u200dරියාවලිය වේගවත් කරයි. ප්\u200dරමාණවත් ක්\u200dරියාකාරී මධ්\u200dයස්ථාන සමුච්චය කිරීම දාම ක්\u200dරියාවලිය තාපයට මාරුවීමට සහ මිශ්\u200dරණයේ උෂ්ණත්වය එහි ස්වයංක්\u200dරීයකරණය දක්වා වැඩි කිරීමට දායක වේ. එවැනි ක්\u200dරියාකාරී මධ්\u200dයස්ථාන පැන නගින්නේ අණු වල තාප කම්පන චලනයේ වේගය වැඩිවීමේ ප්\u200dරති result ලයක් ලෙස වන අතර දම්වැල් අතු බෙදීම නිසා ඒවා ගුණනය වේ. දාම යාන්ත්\u200dරණය හරහා සිදුවන ප්\u200dරතික්\u200dරියා වල ආරම්භක අවධියේදී, ප්\u200dරතික්\u200dරියා කරන ද්\u200dරව්\u200dයවල රසායනික ශක්තිය ප්\u200dරධාන වශයෙන් නව ක්\u200dරියාකාරී මධ්\u200dයස්ථාන පිහිටුවීමට ගමන් කරයි. සක්\u200dරීය මධ්\u200dයස්ථානවල සාන්ද්\u200dරණය වෙනස් කිරීමේ ක්\u200dරියාවලිය සමීකරණය මගින් විස්තර කෙරේ:
![]() (1)
(1)
කොහෙද n - ප්රතික්රියා කලාපයේ ක්රියාකාරී මධ්යස්ථාන සංඛ්යාව;
τ - කාලය;
w 0 - සක්\u200dරීය මධ්\u200dයස්ථානවල න්\u200dයෂ්ටික අනුපාතය;
φ - අතු බෙදීමේ වේගය සහ දාමය අවසන් කිරීමේ වෙනස නිරන්තරයෙන් සංලක්ෂිත කිරීම.
පදාර්ථයේ ව්\u200dයුහයේ අණුක චාලක සිද්ධාන්තයේ (එම්කේටී) දෘෂ්ටි කෝණයෙන් රසායනික දහන ප්\u200dරතික්\u200dරියා සිදුවන්නේ ඉන්ධන හා ඔක්සිකාරක අණු වල අන්තර්ක්\u200dරියාකාරිත්වයේ ප්\u200dරති as ලයක් වශයෙනි. දහනය කළ හැකි මිශ්\u200dරණයේ සංරචක දෙක අතර අණුක අන්තර්ක්\u200dරියාකාරිත්වයේ බලයන් ඉතා කුඩා දුරකින් දිස්වන අතර, පසුව වැඩිවීමත් සමඟ තියුනු ලෙස අඩු වේ. එබැවින්, ඉන්ධන සහ ඔක්සිකාරක අණු අතර අන්තර්ක්\u200dරියාකාරිත්වය සිදුවිය හැක්කේ ඒවායේ පූර්ණ අභිසාරීතාවයෙන් පමණක් වන අතර එය ision ට්ටනයක් ලෙස සැලකිය හැකිය. එහි ප්\u200dරති sequently ලයක් වශයෙන්, ඉන්ධන සහ ඔක්සිකාරක කාරකය අතර රසායනික ප්\u200dරතික්\u200dරියාවට පෙර සං components ටක මිශ්\u200dර කිරීම හා අණු වල ප්\u200dරත්\u200dයාස්ථ ision ට්ටනයේ භෞතික ක්\u200dරියාකාරිත්වය සිදුවිය යුතුය.
ඒකක පරිමාවකට වායු අණු isions ට්ටන ගණන පහසුවෙන් ගණනය කළ හැකිය. උදාහරණයක් ලෙස, හයිඩ්\u200dරජන් සහ ඔක්සිජන් (2) ස්ටොයිකොමිතික මිශ්\u200dරණයක් සඳහා එච් 2 + ඔහ් 2) 288 ක උෂ්ණත්වයකදී වෙත සහ වායුගෝලීය පීඩනය (~ 101325 පා1 සඳහා isions ට්ටන ගණන සමඟ 1 දී cm 3 8.3 · 10 28 දක්වා ළඟා වේ. මෙම සියලු isions ට්ටන රසායනික ප්\u200dරතික්\u200dරියාවකට තුඩු දුන්නේ නම්, මුළු මිශ්\u200dරණය ඉතා ඉක්මණින් ප්\u200dරතික්\u200dරියා කරයි. පුහුණුවීම්වලින් පෙනී යන්නේ මෙම තත්වයන් යටතේ දහන ප්\u200dරතික්\u200dරියාව කිසිසේත් සිදු නොවන බවයි මෙම සියලු isions ට්ටන රසායනික අන්තර්ක්\u200dරියා වලට තුඩු දෙන්නේ නැත.
රසායනික ප්\u200dරතික්\u200dරියාවක් සිදුවීමට නම්, ප්\u200dරතික්\u200dරියා කරන අණු උද්දීපිත තත්වයක තිබිය යුතුය. අණු වල පරමාණු වලට නිදහස් සංයුජතා එකක් හෝ දෙකක් ඇති විට එවැනි උද්දීපනය රසායනික විය හැකිය (එවැනි අණු රැඩිකලුන් ලෙස හැඳින්වෙන අතර ඒවා දක්වනු ලැබේ, උදාහරණයක් ලෙස සී.එච් 3 , ඕ.එච් , සී.එච් 2, ආදිය) සහ භෞතික විට, මන්දගාමී උනුසුම් වීමේ ප්\u200dරති the ලයක් ලෙස අණු තීරණාත්මක අගයට වඩා චාලක ශක්තිය ලබා ගනී.
පවතින බන්ධන බිඳ දැමීමට හෝ දුර්වල කිරීමට අවශ්\u200dය ශක්තිය ඇති අණු රසායනික ප්\u200dරතික්\u200dරියාවක ක්\u200dරියාකාරී මධ්\u200dයස්ථාන ලෙස හැඳින්වේ.
ක්\u200dරියාකාරී තත්වයේ සහ සාමාන්\u200dය තත්වයේ අණු වල ශක්ති සංචිතයේ සාමාන්\u200dය මට්ටම් අතර වෙනස, එනම්. අක්\u200dරිය, අවිනිශ්චිත තත්වය, සක්\u200dරිය ශක්තිය ලෙස හැඳින්වේ ( ඊ අ). සක්\u200dරීය ශක්තියේ සංඛ්\u200dයාත්මක අගය වැඩි වන තරමට මෙම ප්\u200dරතික්\u200dරියාකාරක යුගලය රසායනික ප්\u200dරතික්\u200dරියාවකට ඇතුළු වීම වඩාත් අපහසු වේ. එබැවින්, සක්\u200dරිය ශක්තිය යනු දහනය කළ හැකි ද්\u200dරව්\u200dයවල ගිනි අවදානම පිළිබඳ වක්\u200dර දර්ශකයකි.
සූත්\u200dරය මඟින් ඔබට සක්\u200dරිය ශක්තිය තක්සේරු කළ හැකිය:
කොහෙද ඊ අ- සක්\u200dරීය ශක්තිය ජේ;
k - බෝල්ට්ස්මාන් නියතය, 1.38 · 10 –23 ට සමාන වේ ජේ;
ටී- නිරපේක්ෂ උෂ්ණත්වය වෙත.
ප්\u200dරධාන රසායනික දහන ක්\u200dරියාවලියේ ප්\u200dරවාහයේ ස්වභාවය භෞතික ක්\u200dරියාවලි ගණනාවක් මත රඳා පවතී:
- ප්\u200dරතික්\u200dරියාකාරක සහ ප්\u200dරතික්\u200dරියා නිෂ්පාදන චලනය (විසරණය කිරීමේ ක්\u200dරියාවලි);
- තාප මුදා හැරීම සහ බෙදා හැරීම (තාප හුවමාරු ක්රියාවලි);
- තාපය හා පදාර්ථ හුවමාරුව සහතික කරන වායුගතික හා ජලවිදුලි තත්වයන් (සංවහන ක්\u200dරියාවලීන්).
මෙම සාධක සැලකිල්ලට ගැනීමේ අවශ්\u200dයතාවය දහන ක්\u200dරියාවලීන් පිළිබඳ අධ්\u200dයයනය සහ න්\u200dයායාත්මක විස්තරය සැලකිය යුතු ලෙස සංකීර්ණ කරයි.
රත් වූ විට වායුව (වාෂ්ප) අවධියක් ඇති නොවන solid න ද්\u200dරව්\u200dය දහනය කිරීම විෂමජාතීය වන අතර එය අතුරු මුහුණතේ සිදු වේ. එබැවින් ඉහත සලකා බැලූ සාධක සමඟ ක්\u200dරියාවලියේ ස්වභාවය, phase න අවධි පෘෂ් of යේ ප්\u200dරමාණය හා ස්වභාවය අතිශයින් වැදගත් කාර්යභාරයක් ඉටු කරයි (මෙය විශේෂයෙන් වැදගත් වේ aerosols).
2.4.2.3. ජ්වලන ස්පන්දනය.
දහනය කළ හැකි ද්\u200dරව්\u200dයයක් සහ ඔක්සිකාරක කාරකයකට අමතරව, දහනය සිදුවීම සඳහා ආරම්භක ශක්ති ආවේගයක් අවශ්\u200dය වේ (බොහෝ විට සම්පූර්ණ තාප මුදා හැරීම), එමඟින් දහනය කළ හැකි මිශ්\u200dරණයේ කුඩා පරිමාවක් ජ්වලනය වීමට හේතු වන අතර ඉන් පසුව දහනය එය බෙදා හරින අවකාශය පුරා පැතිරෙයි.
තාපය ගොඩනැගීම ප්\u200dරවර්ධනය කරන භෞතික, රසායනික හා ක්ෂුද්\u200dරජීව විද්\u200dයාත්මක ක්\u200dරියාවලීන් සිදු වූ විට ජ්වලනයේ ආවේගයක් ඇතිවිය හැකිය. මෙම ක්\u200dරියාවලීන්ගේ ස්වභාවය අනුව ස්පන්දන පිළිවෙලින් බෙදා ඇත භෞතික, රසායනිකසහ ක්ෂුද්\u200dරජීව විද්\u200dයාත්මක.
රසායනික ක්\u200dරියාවලියක ප්\u200dරති not ලයක් නොවන තාපයක් ජනනය වන විට, මෙම ආවේගය තාපය ලෙස සැලකේ. පද්ධතිය උණුසුම් වීමට හේතු වන තාප ස්පන්දනයේ බලපෑම විය හැක්කේ:
– සම්බන්ධතා - දහනය කළ හැකි මිශ්රණය එහි ප්රභවය සමඟ ස්පර්ශ වීම නිසා තාප හුවමාරුව සිදු කරනු ලැබේ;
– විකිරණ- දහනය කළ හැකි මිශ්\u200dරණයේ තාප හුවමාරුව සිදුවන්නේ තාපන ප්\u200dරභවයකින් විද්\u200dයුත් චුම්භක විකිරණයෙනි;
– සංවහනය - දහනය කළ හැකි පද්ධතියට තාප හුවමාරුව සිදුවන්නේ ද්\u200dරව්\u200dයයක් (වාතය හෝ චලනය වන වෙනත් වායුවක්) මගිනි;
– හයිඩ්රොලික් (ගතික) - ගෑස් මිශ්\u200dරණයේ පරිමාව සී rapid ්\u200dරයෙන් අඩුවීම නිසා තාපය ඇතිවීමත් සමඟ දෙවැන්නෙහි පීඩනය වැඩි වීමත් සිදුවේ.
තාප ආවේගයේ ප්රධාන ප්රභවයන් වන්නේ:
- විවෘත දැල්ල (උෂ්ණත්වය ~ 1500 °);
- රත් වූ මතුපිට (උෂ්ණත්වය\u003e 900 °);
- යාන්ත්\u200dරික ස්පාර්ක් (උෂ්ණත්වය ~ 1200 °)
- විදුලි ස්පාර්ක් (උෂ්ණත්වය 6000 දක්වා °).
රසායනික හා ක්ෂුද්\u200dරජීවී ස්පන්දන අතරතුර, පද්ධතියේ තාපය සමුච්චය වීම සිදුවන්නේ රසායනික ප්\u200dරතික්\u200dරියාවක්, භෞතික රසායනික ක්\u200dරියාවලියක් (නිදසුනක් ලෙස, adsorption) සහ දහනය කළ හැකි ද්\u200dරව්\u200dයය ආහාර වන ක්ෂුද්\u200dර ජීවීන්ගේ වැදගත් ක්\u200dරියාකාරිත්වය හේතුවෙනි.
2.4.2.4. දහන ප්\u200dරතික්\u200dරියා වල වේගය.
පොදුවේ දහන ක්\u200dරියාවලියේ වේගය තීරණය වන්නේ සමීකරණයෙනි:
 (3)
(3)
කොහෙද අ , ආ - ප්රතික්රියාශීලී සංරචක සාන්ද්රණය;
τ - කාලය
හෝ 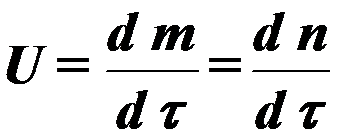 (4)
(4)
කොහෙද m, n - දහන නිෂ්පාදන සාන්ද්\u200dරණය.
දැවෙන වේගය වැඩිවීමත් සමඟම කාල ඒකකයකට පද්ධතිය තුළට ඇතුළු වන තාප ප්\u200dරමාණය වැඩි වීමත්, එහි ප්\u200dරති ence ලයක් ලෙස දැවෙන උෂ්ණත්වය ඉහළ යාමත් සමඟ සිදු වේ.
2.4.2.5. දැවෙන උෂ්ණත්වය
දහනය අතරතුර, මුදා හරින ලද තාපය සියල්ලම ප්\u200dරතික්\u200dරියා මිශ්\u200dරණයේ උෂ්ණත්වය ඉහළ නැංවීම සඳහා වැය නොකෙරේ, මන්ද යත් එයින් කොටසක් පාඩු ලෙස පරිභෝජනය කරන බැවිනි:
- රසායනික හා භෞතික යටි දැල්වීම, යටි දැවෙන සංගුණකය මගින් ගණනය කරනු ලැබේ ( β );
- විකිරණ ශරීරයේ උෂ්ණත්වය, එහි එකතුව හා රසායනික ස්වභාවය අනුව ගිනිදැල්වල විද්\u200dයුත් චුම්භක විකිරණය. මෙම යැපීම තීරණය වන්නේ විකිරණශීලී ශරීරයේ කළු පැහැයේ සංගුණකයෙනි ( ε ) සහ විද්\u200dයුත් චුම්භක විකිරණවල තරංග ආයාමය;
- සන්නායක-සංවහන පාඩු.
මෙම පදනම මත, දහනය කිරීමේ ක්\u200dරියාවලියේදී ප්\u200dරධාන උෂ්ණත්ව වර්ග 3 ක් ඇත:
- කැලරිමිතික;
- න්\u200dයායාත්මක (ගණනය කළ);
- ඇත්ත.
දහන ක්\u200dරියාවලියේදී මුදා හරින සියලුම තාපය දහන නිෂ්පාදන උණුසුම් කිරීම සඳහා භාවිතා කරන විට කැලරිමිතික උෂ්ණත්වය ළඟා වේ, උදාහරණයක් ලෙස බෙන්සීන් දහනය කිරීමේදී - 2533 වෙත, ගෑස්ලීන් - 2315 වෙතහයිඩ්\u200dරජන් - 2503 වෙතස්වාභාවික වායුව - 2293 වෙත.
න්\u200dයායාත්මක (ගණනය කළ) උෂ්ණත්වය තීරණය වන්නේ දහන නිෂ්පාදන වි diss ටනය වීමෙන් සිදුවන තාප අලාභය සැලකිල්ලට ගනිමිනි. හයිඩ්\u200dරොකාබන් දහනය කළ හැකි ද්\u200dරව්\u200dයවල දහන නිෂ්පාදන සැලකිය යුතු ලෙස වි ociation ටනය කිරීම ආරම්භ වන්නේ\u003e 2000 ක උෂ්ණත්වයකිනි වෙත. නිෂ්පාදන තත්වයන් යටතේ ගින්නක් ඇති වන විට එවැනි ඉහළ උෂ්ණත්වයන් ප්\u200dරායෝගිකව හමු නොවේ. එබැවින් මෙම අවස්ථාවන්හි වි ociation ටනය හේතුවෙන් සිදුවන තාප අලාභයන් නීතියක් ලෙස සැලකිල්ලට නොගනී.
පරිසරයට සිදුවන තාප අලාභය සැලකිල්ලට ගනිමින් දහනයේ සත්\u200dය උෂ්ණත්වය තීරණය වන අතර දහනය කළ හැකි සියලුම ද්\u200dරව්\u200dය සඳහා පාහේ ඩොලර් 1300 - 1700 වේ. වෙත.


 ස්වාභාවික වායු දහනය කිරීමේ ක්\u200dරම
ස්වාභාවික වායු දහනය කිරීමේ ක්\u200dරම පර්ම් හි මීටර කියවීම් මාරු කරන්නේ කෙසේද?
පර්ම් හි මීටර කියවීම් මාරු කරන්නේ කෙසේද? මුළුතැන්ගෙයි තුවා සේදීම
මුළුතැන්ගෙයි තුවා සේදීම