Η καύση καλείται. Χημικές διεργασίες κατά την καύση
Ορισμένοι βασικοί ορισμοί
Ο αριθμός των ατόμων και των μορίων εκφράζεται εύκολα με όρους ποσότητες ουσίας είτε ο αριθμός των γραμμομορίων της ουσίας. Ένα γραμμάριο ύλης αντιστοιχεί σε 6.023,10 23 σωματίδια (άτομα και μόρια). Ο αριθμός N A = 6.023 ∙ 10 23 mol -1 ονομάζεται αριθμός Avogadro. Κλάσμα μορίων x iσυνιστώσα i είναι ο λόγος του αριθμού των γραμμομορίων n i συνιστώσα i στο συνολικό αριθμό γραμμομορίων n = Σn i μίγματα ( x i = n i / n).
Μάζα m είναι μια θεμελιώδης ιδιότητα μιας ουσίας (η μονάδα μέτρησης στο σύστημα SI είναι χιλιόγραμμο). Το κλάσμα μάζας Wi είναι η αναλογία μάζας m i συνιστώσα i στη συνολική μάζα του μείγματος m = Σ m i (Wi = m i / m).
Μοριακό βάρος (ή μοριακό βάρος) i(g / mol) Εγώ - είναι η μάζα ενός γραμμομορίου αυτού του συστατικού. Έτσι, για τον ατομικό άνθρακα, το μοριακό υδρογόνο, το οξυγόνο και το μεθάνιο έχουμε: Mc = 12 g / mol, Mn2 = 2 g / mol, Mo2 = 32 g / mol, Mn4 = 16 g / mol. Η μέση γραμμομοριακή μάζα του μίγματος Μ (g / mol) μπορεί να εκφραστεί ως προς τα γραμμομοριακά κλάσματα των συστατικών (Μ = x i M i).
Προσδιορισμός των διεργασιών καύσης
Κάψιμο - Πρόκειται για μια σύνθετη φυσικοχημική διαδικασία στην οποία οι εύφλεκτες ουσίες και τα υλικά υπό την επίδραση υψηλών θερμοκρασιών εισέρχονται σε χημική αλληλεπίδραση με έναν οξειδωτικό παράγοντα (οξυγόνο στον αέρα), μετατρέποντας σε προϊόντα καύσης και συνοδεύονται από έντονες εκπομπές θερμότητας και φωτός.
Οι αναγκαίες συνθήκες για την εμφάνιση της διαδικασίας καύσης:
Η παρουσία καύσιμης ουσίας (GV).
Η παρουσία ενός οξειδωτικού παράγοντα (O.) - αέρα οξυγόνου.
Η παρουσία μιας πηγής ανάφλεξης (I.Z.).
Το καύσιμο υλικό πρέπει να θερμαίνεται σε μια ορισμένη θερμοκρασία στην οποία θα ξεκινήσει η διαδικασία οξείδωσης.
Για να θερμανθεί μια εύφλεκτη ουσία σε μια ορισμένη θερμοκρασία, απαιτείται κάποια ισχύς ανάφλεξης.
Για να διατηρηθεί η διαδικασία καύσης, απαιτούνται ορισμένες συγκεντρώσεις καυσίμου και οξειδωτικού.
Οι πιο σημαντικές διεργασίες καύσης είναι η μεταφορά θερμότητας και μάζας. Η συνηθέστερη ιδιότητα της καύσης είναι η εμφάνιση μιας φλόγας και η μετακίνησή της σε όλο το εύφλεκτο μίγμα με μεταφορά θερμότητας ή διάχυση των ενεργών σωματιδίων από τη ζώνη καύσης σε ένα φρέσκο εύφλεκτο μίγμα.
Φλόγες - Αυτή είναι μια ορατή εκδήλωση καύσης. Ονομάζεται επίσης ζώνη καύσης. Αυτό είναι το μέρος του χώρου όπου συμβαίνει ο μετασχηματισμός του εύφλεκτου μείγματος σε προϊόντα πλήρους και ατελούς καύσης.
Οι κύριες παράμετροι της διαδικασίας καύσης, που οδηγούν σε θάνατο και προκαλούν υλική ζημιά, είναι:
Μεγάλη ποσότητα θερμότητας.
Υψηλή θερμοκρασία.
Τοξική σύνθεση των προϊόντων καύσης.
Η διαδικασία καύσης από την άποψη της μοριακής κινητικής θεωρίας των αερίων
Το Σχ. 2.1. Η αναλογία των δραστικών μορίων εξαρτάται από τη θερμοκρασία: T 2\u003e T 1
Όταν το καύσιμο μείγμα θερμαίνεται με αέριο αυξάνει την υπερβολική ενέργεια.
Η διαφορά μεταξύ της μέσης ενεργειακής στάθμης των μορίων στην ενεργό κατάσταση και του μέσου επιπέδου της αδρανούς κατάστασης ονομάζεται ενέργεια ενεργοποίησης. Αυτό μπορεί να αναπαρασταθεί γραφικά (Σχήμα 2).

Το Σχ. 2.2. Ενεργειακό διάγραμμα της πορείας αντίδρασης G.V. + O. ® PG: ενέργεια E - ενεργοποίηση ενέργειας? Q xr - θερμική επίδραση της αντίδρασης καύσης
Η ενέργεια που απελευθερώνεται ως αποτέλεσμα της αλληλεπίδρασης των "πρώτων" αντιδρώντων μορίων μεταφέρεται σε γειτονικά μόρια. Είναι ενθουσιασμένοι, η διαδικασία επαναλαμβάνεται γύρω από τα αντιδρώντα μόρια με μεγάλη συχνότητα και ένταση. Ενα αυτοσυντηρούμενο, αυτο-επιταχυνόμενο σε ολόκληρο το μίγμα της αντίδρασης (2H2 + 02) διαδικασία χημικής αλληλεπίδρασης ξεκινά, συνοδεύεται από το σχηματισμό μορίων νερού και την απελευθέρωση θερμότητας στο περιβάλλον και συνοδεύεται από φωταύγεια, δηλ. δημιουργείται και εξαπλώνεται η διαδικασία καύσης.
Όσο μεγαλύτερη είναι η αριθμητική τιμή της πράξης Ε, τόσο πιο δύσκολο είναι να γίνει αυτό το ζεύγος συστατικών να εισέλθει σε χημική αλληλεπίδραση. Επομένως, η τιμή της πράξης Ε είναι έμμεσος δείκτης του βαθμού πυρκαγιάς αυτού του χημικού συστήματος.
Τύποι και τρόποι καύσης
Η καύση μπορεί να ταξινομηθεί με τις ακόλουθες παραμέτρους:
1. Ανάλογα με την κατάσταση των καυσίμων συστατικών που αναμιγνύονται:
α) Κινητική - καύση μιγμάτων αερίου ή ατμού-αέριου. Δεδομένου ότι το μείγμα καυσίμου και οξειδωτικού είναι έτοιμο για καύση μέχρι να αναφλεγεί, ο συνολικός ρυθμός της διαδικασίας καύσης εξαρτάται μόνο από το ρυθμό της χημικής αντίδρασης της καύσης. Αν υπάρχει τέτοια καύση σε κλειστό ή περιορισμένο όγκο, τότε μπορεί να συμβεί έκρηξη. Δεδομένου ότι η ενέργεια που απελευθερώνεται κατά την καύση του μίγματος δεν έχει χρόνο να εκκενωθεί πέρα από αυτόν τον όγκο, αυξάνοντας την πίεση, οι δομές μπορεί να καταστραφούν.
β) η διάχυση και η καύση διάχυσης ονομάζεται καύση όταν ο σχηματισμός ενός καύσιμου μέσου (μίγμα καυσίμου και οξειδωτικού) λαμβάνει χώρα πριν από τη ζώνη καύσης ή στη ζώνη καύσης.
2. Ανάλογα με την ένταση λήψης καύσιμων συστατικών στη ζώνη χημικής αντίδρασης:
α) στρωτή, ενώ τα συστατικά του εύφλεκτου μίγματος εισέρχονται στη ζώνη καύσης σχετικά ήρεμα. Στην περίπτωση αυτή, η αριθμητική τιμή του κριτηρίου Reynolds, που χαρακτηρίζει το θερμοδυναμικό καθεστώς, θα είναι σημαντικά μικρότερη από την κρίσιμη (Re<2300).
β) τυρβώδης, με τα συστατικά του εύφλεκτου μίγματος να εισέρχονται στη ζώνη καύσης με μεγάλη ταχύτητα. Ο αριθμός Reynolds στην περίπτωση αυτή είναι μεγαλύτερος από 2300.
3. Σύμφωνα με την κατάσταση της συνάθροισης των συστατικών του εύφλεκτου μείγματος:
α) ομοιογενές καύσιμο και οξειδωτικό είναι στην ίδια συγκεντρωτική κατάσταση (αέρια);
β) τα ετερογενή (πολυφασικά) καύσιμα και τα οξειδωτικά βρίσκονται σε διαφορετικές συγκεντρωτικές καταστάσεις.
4. Όσον αφορά την ταχύτητα διάδοσης της ζώνης χημικής αντίδρασης της καύσης:
α) κατανομή (αργής) εκτόνωσης της ζώνης χημικής αντίδρασης (ταχύτητα από 0,5 έως 50 m / s) ·
β) έκρηξη (εκρηκτική), όταν η ζώνη της χημικής αντίδρασης της καύσης διαδίδεται με την ταχύτητα ενός κύματος κρούσης (από αρκετές εκατοντάδες μέτρα ανά δευτερόλεπτο έως αρκετά χιλιόμετρα ανά δευτερόλεπτο).
Ο χώρος στον οποίο καίγονται οι ατμοί ή τα αέρια καλείται με φλόγα .
Οι φλόγες από πλαστικές ύλες προ-αναμεμιγμένες. Σε πλανητικές φλόγες ενός προ-αναμεμιγμένου μίγματος, το καύσιμο και το οξειδωτικό αναμειγνύονται πριν από την έναρξη της καύσης και η ροή είναι στρωτή.
Η φλόγα του προ-αναμεμιγμένου μίγματος καλείται στοιχειομετρική εάν το καύσιμο (ο υδρογονάνθρακας) και ο οξειδωτής (οξυγόνο - 02) καταναλώνουν ο ένας τον άλλο εντελώς, σχηματίζοντας διοξείδιο του άνθρακα (CO 2) και νερό (H 2 O). Εάν υπάρχει πλεόνασμα καυσίμου, λένε ότι το μείγμα είναι πλούσιο και αν υπάρχει περίσσεια οξειδωτικού, λένε ότι το μίγμα είναι φτωχό.
Εξετάστε τα απλούστερα παραδείγματα:
1) 2Η 2 + Ο 2 - 2Η 2Ο - στοιχειομετρικό μείγμα,
2) ΟΗ2 + Ο2 - 2Η2Ο + Η2 - πλούσιο μίγμα (Η2 σε περίσσεια),
3) CH4 + ZO2 → 2H2O + C02 + 02 - άπαχο μίγμα (O2 σε περίσσεια).
Κάθε σύμβολο σε μια τέτοια εξίσωση χημικής αντίδρασης αντιστοιχεί σε ένα γραμμομόριο μιας ουσίας. Έτσι, η πρώτη από αυτές τις εξισώσεις σημαίνει ότι δύο γραμμομόρια Η2 αντιδρούν με ένα γραμμομόριο 02 για να σχηματίσουν δύο γραμμομόρια Η2Ο.
Εάν η εξίσωση της χημικής αντίδρασης είναι γραμμένη με τέτοιο τρόπο ώστε να περιγράφει την αντίδραση μόνο ενός γραμμομορίου καυσίμου, τότε το γραμμομοριακό κλάσμα του καυσίμου σε ένα στοιχειομετρικό μείγμα μπορεί εύκολα να προσδιοριστεί από τη σχέση
x βουνά, stokh = 1 / ((1 + v)
Εδώ vδηλώνει τον αριθμό των γραμμομορίων του 02 στην εξίσωση αντίδρασης με το σχηματισμό CO2 και Η2Ο. Ένα παράδειγμα είναι η αντίδραση
Η2 + 0.5O2 → Η2Ο, ν = 0.5, χ Η2, stoch = 2/3
Εάν ο οξειδωτής είναι αέρας, τότε πρέπει να ληφθεί υπόψη ότι ο ξηρός αέρας περιέχει μόνο 21% οξυγόνο, καθώς και 78% άζωτο και 1% ευγενή αέρια. Έτσι, για τον αέρα, XN2 = 3.762 XO2. Από εδώ τα μοριακά κλάσματα για το στοιχειομετρικό μείγμα με τον αέρα θα είναι ίσα
x βουνά, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
όπου v όπως προηγουμένως σημαίνει τον αριθμό των γραμμομορίων του 02 στην εξίσωση αντίδρασης της πλήρους μετατροπής ενός γραμμομορίου καυσίμου σε CO 2 και H 2 O. Μερικά παραδείγματα τιμών v και μοριακά κλάσματα καυσίμου για στοιχειομετρικά μείγματα καυσίμου με αέρα παρουσιάζονται στον Πίνακα 1.
Προ-αναμεμιγμένα μείγματα καυσίμου και αέρα (στην περίπτωση αυτή, μια κατάλληλη ποσότητα Ν2 πρέπει να προστεθεί στην εξίσωση αντίδρασης, βλ. Πίνακα 1) χαρακτηρίζονται από την ισοδύναμη αναλογία για τον αέρα:
(x w / x βουνά) / (xw, stoch / x βουνά, στοίβα) = (w w / w βουνά) / (w w, stoch / w βουνά, stoch)
ή την αμοιβαιότητα - της ισοδύναμης αναλογίας καυσίμων F (F = 1 / λ). Αυτός ο τύπος μπορεί να μετασχηματιστεί για να είναι σε θέση να προσδιορίσει το μέγεθος των γραμμομοριακών κλασμάτων του μίγματος κατά αξία F:
x βουνά = 1 / ((1+ (4,762 ∙ v) / F), xw = 1 - x βουνά,
X βάρος / 4.762, = 3.762
Παραδείγματα τιμών v και μοριακά κλάσματα καυσίμου x βουνά, stoichi για στοιχειομετρικά μείγματα καυσίμου με αέρα
Η άρδευση συνοδεύεται πάντα από χημικούς μετασχηματισμούς. Καύση στον αέρα - αλληλεπίδραση μιας εύφλεκτης ουσίας με οξυγόνο. Ωστόσο, πρέπει να ληφθεί υπόψη ότι τα οξείδια του αζώτου, τα αλογονίδια και το όζον μπορούν να λειτουργήσουν ως οξειδωτικά μέσα στη διαδικασία καύσης. Γνωστές διεργασίες καύσης που συμβαίνουν με τη συμμετοχή μίας μόνο πηγής του προϊόντος - ενώσεις ικανές για ταχεία αποσύνθεση. Παραδείγματα τέτοιων ενώσεων είναι το ακετυλένιο και η υδραζίνη.
Οι χημικές διεργασίες που συμβαίνουν κατά την καύση είναι εξαιρετικά περίπλοκες. Ακόμα και για την απλούστερη περίπτωση - η καύση υδρογόνου στο οξυγόνο, η γενικευμένη εξίσωση του οποίου έχει τη μορφή
2Η 2 + 0 2 = 2Η 2 0,
Αρκετές δωδεκάδες στοιχειώδεις φάσεις έχουν καθιερωθεί και μελετηθεί.
Μέχρι σήμερα, οι μηχανισμοί χημικών μετασχηματισμών κατά την καύση λίγων μόνο ουσιών, όπως το υδρογόνο, το μονοξείδιο του άνθρακα, το μεθάνιο και το αιθάνιο, έχουν μελετηθεί με αρκετή λεπτομέρεια. Αυτή η γνώση χρησιμοποιείται για την πρόβλεψη των συνθηκών ανάφλεξης και καύσης πολλών ουσιών.
2.1. Αλυσίδες αντιδράσεις
Οι αλυσιδωτές αντιδράσεις, σε αντίθεση με τους συνήθεις χημικούς μετασχηματισμούς, χαρακτηρίζονται από την εμφάνιση σε κάθε στοιχειώδη πράξη ενός ενεργού σωματιδίου: ενός ατόμου με ένα μη ζευγαρωμένο ηλεκτρόνιο, μια ελεύθερη ρίζα ή ένα ιόν. Η εμφάνιση ενεργών σωματιδίων προκαλεί μια αλυσίδα μετασχηματισμών των αρχικών υλικών σε προϊόντα αντίδρασης. Τα άτομα, οι ελεύθερες ρίζες και τα ιόντα είναι πιο δραστικά από τα κεκορεσμένα με σθένους μόρια. Επομένως, παρά το σημαντικό ενεργειακό κόστος που απαιτείται για να διασπαστούν οι χημικοί δεσμοί και ο σχηματισμός δραστικών σωματιδίων, η αλυσιδωτή ανάπτυξη μιας αντίδρασης συχνά αποδεικνύεται ενεργητικά πιο ευεργετική από την άμεση αλληλεπίδραση μεταξύ μορίων.
Οι διεργασίες καύσης πραγματοποιούνται κυρίως μέσω ενός μηχανισμού αλυσίδας. Αλυσιδωτές αντιδράσεις - πολύπλοκες αντιδράσεις που λαμβάνουν χώρα σε διάφορα στάδια, που αντιπροσωπεύουν:
Η προέλευση των αλυσίδων (έναρξη), στην οποία σχηματίζονται τα ενεργά σωματίδια.
Η συνέχιση των αλυσίδων, στις οποίες τα ενεργά σωματίδια εισέρχονται σε χημική αλληλεπίδραση με τα αρχικά υλικά, ως αποτέλεσμα των οποίων σχηματίζονται νέα δραστικά σωματίδια.
Η θραύση των αλυσίδων στις οποίες συμβαίνει ο «θάνατος» των ενεργών σωματιδίων με το σχηματισμό των τελικών προϊόντων αντίδρασης
Η προέλευση των αλυσίδων μπορεί να συμβεί υπό διάφορες συνθήκες. Για παράδειγμα, ως αποτέλεσμα της αποσύνδεσης των μορίων υπό τη δράση της θερμικής ενέργειας ή της ιονίζουσας ακτινοβολίας σε ηλεκτρική εκκένωση. Ο θάνατος ενεργών σωματιδίων συμβαίνει όταν ανασυνδυαστούν * όταν αλληλεπιδράσουν οι ελευθέρες ρίζες (ομοιογενής θραύση της αλυσίδας), όταν τα ενεργά σωματίδια αλληλεπιδρούν με στερεές επιφάνειες (ετερογενής θραύση της αλυσίδας) ή ως αποτέλεσμα της αντίδρασής τους με αναστολείς καύσης.
Υπάρχουν αντιδράσεις μη διακλαδισμένης και διακλαδισμένης αλυσίδας. Στο ανοικτό για κάθε ενεργό σωματίδιο που καταναλώνεται στις αντιδράσεις της συνέχισης της αλυσίδας, υπάρχει μια επανεμφανιζόμενη. Ο αριθμός των μορίων προϊόντων που σχηματίζονται ανά αρχικό ενεργό σωματίδιο ονομάζεται μήκος αλυσίδας. Το μήκος των αλυσίδων στις αντιδράσεις καύσης κυμαίνεται από εκατοντάδες χιλιάδες έως δεκάδες εκατομμύρια. Ο ρυθμός αντιδράσεων αδιατάρακτης αλυσίδας μπορεί να επηρεαστεί από μικρές προσμίξεις ουσιών που μπορούν να αλληλεπιδράσουν αποτελεσματικά με δραστικά σωματίδια, όπως αναστολείς καύσης.
Ορισμένες ουσίες - οι εκκινητές - διευκολύνουν τον σχηματισμό δραστικών σωματιδίων και έτσι επιταχύνουν τις αντιδράσεις ανοικτής αλυσίδας.
Στις αντιδράσεις διακλαδισμένης αλυσίδας σε ένα ενεργό σωματίδιο, που καταναλώνεται με τη συνέχιση της αλυσίδας, σχηματίζονται δύο ή περισσότερα δραστικά σωματίδια. Ένας από αυτούς συνεχίζει την κύρια αλυσίδα, ενώ άλλοι αρχίζουν νέες αλυσίδες, σχηματίζοντας διακλάδωση (εικόνα 2.1).
"Ο ανασυνδυασμός είναι η διαδικασία σχηματισμού ουδέτερων ατόμων ή μορίων από φορτισμένα σωματίδια. Τα άτομα και τα μόρια που σχηματίζονται κατά τη διάρκεια του ανασυνδυασμού μπορεί να είναι στο έδαφος ή σε διεγερμένη κατάσταση.
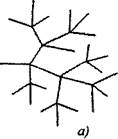
Το Σχ. 2.1. Σχηματική αναπαράσταση των αλυσίδων αντίδρασης:
α) διακλάδωση σε κάθε σύνδεσμο της αλυσίδας
6) σπάνια διακλάδωση
Για παράδειγμα, κατά την καύση του υδρογόνου στην αντίδραση έναρξης της αλυσίδας:
σχηματίζεται ένα ενεργό άτομο. Στην αντίδραση συνέχισης της αλυσίδας:

υπάρχει μια αύξηση στον αριθμό των ενεργών ατόμων που είναι η αρχή των νέων αλυσίδων.
Οι αντιδράσεις διακλαδισμένης αλυσίδας μπορούν να προχωρήσουν σε σταθερή κατάσταση, στην οποία η ταχύτητα διακλάδωσης είναι μικρότερη από την ταχύτητα θανάτου των ενεργών σωματιδίων και σε μη στατική κατάσταση, όπου ο θάνατος συμβαίνει πιο αργά από τη διακλάδωση. Στην τελευταία περίπτωση, η ταχύτητα της αλυσιδωτής αντίδρασης αυξάνεται εκθετικά και περιορίζεται μόνο από την κατανάλωση των πρώτων υλών. Η μετάβαση από τη στατική σε μη στατική λειτουργία παρουσιάζεται απότομα με ελαφρά μεταβολή στις συνθήκες της αντίδρασης: θερμοκρασία, πίεση ή συγκέντρωση ενός από τα αντιδραστήρια. Μια τέτοια ταχεία επιτάχυνση θεωρείται αυτοανάφλεξη του μίγματος αντίδρασης ή έκρηξη της αλυσίδας.
Η ανακάλυψη αντιδράσεων διακλαδισμένης αλυσίδας είχε μεγάλη σημασία για τη δημιουργία μιας θεωρίας των διεργασιών καύσης. Αποδεικνύεται ότι υπάρχουν δύο τύποι ανάφλεξης: θερμική και αλυσιδωτή. Τα μοτίβα έχουν ρυθμιστεί
Κεφάλαιο 2. Χημικές διεργασίες στο καύση
η θεωρία των διαδικασιών της αλυσίδας, μπορεί να επηρεάσει αποτελεσματικά την ανάπτυξη και την καταστολή των διεργασιών καύσης κατά τη διάρκεια των πυρκαγιών.
Η προέλευση των αλυσίδων.Η διαδικασία σχηματισμού πυρήνων των αρχικών ενεργών κέντρων παίζει σημαντικό ρόλο στην ανάπτυξη αντιδράσεων με ανοικτές αλυσίδες. Αντισταθμίζει την απώλεια ενεργών κέντρων κατά τη διάρκεια των αντιδράσεων τερματισμού της αλυσίδας. Αυτός ο μηχανισμός καθορίζει τις συνθήκες για τον σχηματισμό ενός στατικού καθεστώτος κατά την αρχική περίοδο συσσώρευσης ενεργών κέντρων. Με χαμηλό ρυθμό έναρξης, αυτή η περίοδος μπορεί να είναι σημαντική.
Οι περισσότερες από τις χημικές αντιδράσεις στις φλόγες έχουν ένα σημαντικό ενεργειακό απόθεμα ενεργών κέντρων. Υπό αυτές τις συνθήκες, η έναρξη των ενεργών κέντρων συνδέεται με την υπέρβαση ενός σημαντικού ενεργειακού φραγμού.
Στην περίπτωση αυτή, ένας σημαντικός ρόλος διαδραματίζουν παράγοντες που εξασφαλίζουν ένα σημαντικό ρυθμό εμφάνισης ενεργών κέντρων: χημικά ενεργά πρόσθετα, ακτινοβολία, ηλεκτρική εκκένωση, προϊόντα ραδιενεργού αποσύνθεσης.
Μεταξύ των παραγόντων που διευκολύνουν σε μεγάλο βαθμό την δημιουργία ενεργών κέντρων, πρέπει να σημειωθούν ετερογενείς αντιδράσεις. Στα μόρια εύφλεκτων ουσιών προσροφημένων σε μια στερεή επιφάνεια, οι διατοτομικοί δεσμοί εξασθενούν και η θραύση τους απαιτεί μικρότερη κατανάλωση ενέργειας. Υπό αυτές τις συνθήκες, ο ρυθμός δημιουργίας ενεργών κέντρων είναι σημαντικά υψηλότερος από τον όγκο του αερίου. Η ενέργεια ενεργοποίησης στην ετερογενή αλληλεπίδραση των συστατικών του εύφλεκτου μείγματος είναι επίσης χαμηλότερη από ό, τι στην περίπτωση ενός ομοιογενούς. Η ετερογενής εκκίνηση ενεργών κέντρων υπό συνθήκες πραγματικών διεργασιών καύσης είναι ένας σημαντικός παράγοντας στην επιτάχυνση της επίτευξης ενός σταθερού καθεστώτος με διεργασίες μη διακλαδισμένης αλυσίδας.
Ορισμένα χαρακτηριστικά χαρακτηρίζουν αντιδράσεις ανοικτής αλυσίδας που εμφανίζονται με τη συμμετοχή ατομικών συστατικών. Ελλείψει προσμίξεων που αλληλεπιδρούν με ενεργά κέντρα χωρίς αναγέννηση, ο τερματισμός της αλυσίδας καθίσταται δυνατή μόνο όταν τα άτομα ανασυνδυαστούν με τριπλές συγκρούσεις και στην επιφάνεια.
Σε οποιαδήποτε θερμοκρασία, όλες οι αέριες ουσίες αποσυντίθενται εν μέρει. Μερικά από τα μόρια καταρρέουν σε άτομα. Σε αυτή την περίπτωση, υπάρχει μια ισορροπία μεταξύ των διαδικασιών διαχωρισμού και της ένωσης των ατόμων σε μόρια. Ο βαθμός διάστασης εκθετικά εξαρτάται από τη θερμοκρασία.
Εάν δεν υπάρχουν ακαθαρσίες στο εύφλεκτο μίγμα που θραύει τις αλυσίδες, η συγκέντρωση των ατομικών συστατικών της αντίδρασης παραμένει ουσιαστικά αμετάβλητη. Τα άτομα που εισήλθαν στην αντίδραση αναδημιουργούνται αμέσως στο ίδιο
Korolchenko A.Ya. Διεργασίες καύσης και έκρηξης
lichi. Η αρχική εκκίνηση αντισταθμίζει τα αντιδρώντα άτομα στην ίδια ποσότητα όπως στο μη αντιδραστικό σύστημα. Η στατική αντίδραση δεν επηρεάζει αυτή τη διαδικασία. Η ισορροπία ενός από τα συστατικά της αντίδρασης, η οποία διακρίνεται από τον λιγότερο ισχυρό δεσμό μεταξύ των ατόμων στο μόριο, είναι ένα χαρακτηριστικό χαρακτηριστικό αυτού του τρόπου. Η συγκέντρωση ενός άλλου ατομικού συστατικού στην περίπτωση αυτή είναι quasiistationary, αλλά περισσότερο ισορροπία.
Με την ομοιογενή έναρξη αντιδράσεων καύσης, το σταθερό καθεστώς θα καθιερωθεί μόνο μετά από ένα ορισμένο χρονικό διάστημα, αφού η διάσταση απαιτεί μεγάλη ενέργεια ενεργοποίησης. Κατά τη διάρκεια αυτής της περιόδου, ο ρυθμός διάστασης υπερβαίνει τον ρυθμό ανασυνδυασμού και τα ενεργά κέντρα συσσωρεύονται στο σύστημα αντίδρασης. Οι ρυθμοί και των δύο διαδικασιών συγκρίνονται μόνο μετά την αύξηση της συγκέντρωσης των ενεργών κέντρων στην ισορροπία. Αυτή η χρονική περίοδος ονομάζεται περίοδος επαγωγής.
Η παρουσία μιας στερεής επιφάνειας ως καταλύτη στη ζώνη αντίδρασης δεν αλλάζει την κατάσταση της θερμοδυναμικής ισορροπίας. Ο καταλύτης επηρεάζει εξίσου τις αντιδράσεις εμπρός και πίσω. Τα ενεργά κέντρα δεν προέρχονται μόνο από μια στέρεη επιφάνεια, αλλά επίσης σβήνουν. Ωστόσο, η παρουσία ενός καταλύτη επιταχύνει την επίτευξη μιας κατάστασης διαχωρισμού ισορροπίας.
Εάν υπάρχουν δραστικές ουσίες στο εύφλεκτο μίγμα, οι οποίες είναι σε θέση να συμμετέχουν σε αντιδράσεις θραύσης της αλυσίδας, μειώνουν τη συγκέντρωση των ενεργών κέντρων. Σε αυτή την περίπτωση, διαταράσσεται η διάσταση ισορροπίας ενός από τα αρχικά συστατικά, γεγονός που επιβραδύνει την αντίδραση και μπορεί να οδηγήσει σε τερματισμό της.
Τα πειράματα δείχνουν ότι όταν αρχίζει μια αντίδραση ανοικτής αλύσου από μια εξωτερική πηγή (για παράδειγμα μια πηγή φωτός), η συγκέντρωση των ενεργών κέντρων στο αρχικό στάδιο της διαδικασίας της καύσης μπορεί να υπερβεί σημαντικά την ισορροπία.
Κατά τη διάρκεια των αντιδράσεων διακλαδισμένης αλυσίδας, οι συνθήκες αρχικής έναρξης έχουν σημαντικό αντίκτυπο στην ανάπτυξη της αντίδρασης. Σε αργά κινούμενες διαδικασίες, η προσθήκη ενός μερικώς αντιδρώντος μίγματος στην αρχική μειώνει την περίοδο επαγωγής και επιταχύνει τη στιγμή της καύσης της φλόγας.
Η συνέχιση των αλυσίδων.Χαρακτηριστικό χαρακτηριστικό των αντιδράσεων με ανοικτές αλυσίδες είναι η οιονεί ακινησία της συγκέντρωσης των ενεργών κέντρων. Ελλείψει ανοικτού κυκλώματος, τα ενεργά σωματίδια σχηματίζονται στο
Κεφάλαιο 2. Χημικές διεργασίες κατά την καύση
το ίδιο ποσό στο οποίο δαπανώνται. Νέα προκύπτουν μόνο κατά την αρχική εκκίνηση. Με ίσους ρυθμούς δημιουργίας ενεργών κέντρων και τερματισμού της αλυσίδας, δημιουργείται μια σταθερή συγκέντρωση ενεργών κέντρων και ένας στάσιμος τρόπος αντίδρασης. Ο ρυθμός αντίδρασης θα μειωθεί καθώς καταναλώνονται τα αρχικά συστατικά.
Στην περίπτωση αντίδρασης διακλαδισμένης αλύσου, η συγκέντρωση των ενεργών κέντρων στο σύστημα αντίδρασης αυξάνεται ανεξάρτητα από τις συνθήκες της αρχικής τους έναρξης. Εφαρμόστηκε αυτο-επιταχυνόμενος τρόπος αντίδρασης, ο οποίος έχει χαρακτήρα χιονοστιβάδας. Στην περίπτωση αυτή, για τον πλήρη μετασχηματισμό των αρχικών συστατικών στα τελικά προϊόντα της αντίδρασης, αρκεί ένα αρχικό ενεργό κέντρο.
Η κινητική εξίσωση μιας διακλαδισμένης πολύτιμης αντίδρασης έχει ως εξής. Η μεταβολή στις συγκεντρώσεις των σταθερών αρχικών συστατικών με την πάροδο του χρόνου μπορεί να παραμεληθεί σε μια πρώτη προσέγγιση και μόνο ταχύτερες αλλαγές στη συγκέντρωση των ενεργών κέντρων μπορούν να ληφθούν υπόψη. σ.Οι μεταβολές στην ταχύτητα αυτή καθορίζονται από τον ρυθμό αρχικής έναρξης και από την αναλογία των ρυθμών των αντιδράσεων διακλάδωσης και τερματισμού της αλυσίδας. Ο αρχικός ρυθμός έναρξης δεν εξαρτάται από τη συγκέντρωση των ενεργών κέντρων που υπάρχουν στο σύστημα. Οι ρυθμοί διακλάδωσης και θραύσης είναι ανάλογοι με τις συγκεντρώσεις των ενεργών κέντρων. Υπό αυτές τις συνθήκες, η συνολική ισορροπία του σχηματισμού και της δαπάνης ενεργών κέντρων καθορίζεται από το άθροισμα των ρυθμών των διαδικασιών έναρξης, διακλάδωσης και θραύσης:
![]() (2.1)
(2.1)
όπου και είναι οι σταθερές ρυθμού των αντιδράσεων διακλάδωσης και θραύσης. Δηλώνουμε, παίρνουμε:
![]() (2.2)
(2.2)
Όταν το χρονικό παράγωγο της συγκέντρωσης ενεργών κέντρων
είναι θετική. Ο ρυθμός αντίδρασης αυξάνεται με το χρόνο. Αυτό το χαρακτηριστικό των αντιδράσεων διακλαδισμένης αλύσου οφείλεται στον πολλαπλασιασμό των ενεργών κέντρων σε τέτοια συστήματα όταν ο ρυθμός της αντίδρασης διακλάδωσης υπερβαίνει τον ρυθμό της αντίδρασης τερματισμού της αλύσου.
Korolchenko A.Ya. Διεργασίες καύσης και έκρηξης
Εάν πριν από την έναρξη της αντίδρασης το σύστημα δεν περιείχε δραστικά κέντρα, δηλ. στοt= 0, η = 0 ολοκλήρωση της εξίσωσης (2.2) δίνει:
![]() (2.3)
(2.3)
Ο συνολικός ρυθμός αντίδρασης του CO προσδιορίζεται από το ρυθμό της διαδικασίας διακλάδωσης. Τα τελικά προϊόντα σχηματίζονται μόνο κατά τη διάρκεια αυτής της αντίδρασης. Για κάθε περίπτωση διακλαδώσεων στοιχειώδους αλύσου, σχηματίζονται μόρια του τελικού προϊόντος. Ακολουθεί:
![]() (2.4)
(2.4)
Η ανάπτυξη μιας αλυσιδωτής αντίδρασης στο χρόνο προσδιορίζεται από την αναλογία των σταθερών ταχύτητας των αντιδράσεων της διακλάδωσης και του τερματισμού της αλυσίδας και όταν ο εκθέτης στην εξίσωση (2.4) είναι θετικός και επανατοποθετείται,
Η ενέργεια επιταχύνεται απεριόριστα. Στην αρχική περίοδο ανάπτυξης της αντίδρασης ισχύει η ακόλουθη σχέση:
Λόγω του γεγονότος ότι ο ρυθμός αρχικής έναρξης είναι μικρός, δεν υπάρχει αισθητός χημικός μετασχηματισμός στην αρχική περίοδο. Μετά από κάποιο χρονικό διάστημα, η τιμή γίνεται ουσιαστικά μεγαλύτερη από μία. Μετά από αυτό, ο ρυθμός αντίδρασης σύμφωνα με την εξίσωση (2.4) αρχίζει να αυξάνεται ταχέως και φθάνει σε πολύ μεγάλες τιμές, αν και ήταν πρακτικά ανεπαίσθητη πριν.
Η παρουσία μιας περιόδου καθυστέρησης (περίοδος επαγωγής) κατά την ανάπτυξη μιας αλυσιδωτής αντίδρασης οφείλεται στην ανάγκη συσσώρευσης ενός ορισμένου αριθμού ενεργών κέντρων στο σύστημα αντίδρασης. Μόνο μετά την εμφάνιση αυτού του χημικού μετασχηματισμού.
Το μέγεθος της περιόδου επαγωγής στις αλυσιδωτές αντιδράσεις καθορίζει τις αναλογίες των ρυθμών διακλάδωσης και των διεργασιών τερματισμού της αλυσίδας και όχι του ρυθμού αρχικής έναρξης. Με τη σειρά τους, τα ποσοστά αντιδράσεων διακλάδωσης και θραύσης οφείλονται στα χημικά χαρακτηριστικά κάθε συστήματος αντίδρασης · αυτά καθορίζονται από τις εξαρτήσεις από τη θερμοκρασία και τις συγκεντρώσεις των αρχικών συστατικών. Η ιδιαιτερότητα των αλυσιδωτών αντιδράσεων για
είναι ότι οι διαδικασίες διακλάδωσης απαιτούν σημαντική ενέργεια ενεργοποίησης, ενώ ο συντελεστής θερμοκρασίας της σταθεράς ταχύτητας της διαδικασίας θραύσης είναι κοντά στο μηδέν. Στις αντιδράσεις τερματισμού αλυσίδων και των τριών τύπων: στην περίπτωση χύδην και ετερογενών ανασυνδυασμών, στην αλληλεπίδραση ριζών με δραστικές ακαθαρσίες, οι ενεργότητες ενεργοποίησης είναι μηδενικές.
Με την αύξηση της θερμοκρασίας, τη συνολική πίεση του μίγματος ή τη μεταβολή της συγκέντρωσης των αντιδρώντων συστατικών, είναι δυνατή η μεταβολή των σταθερών ταχύτητας διακλάδωσης και θραύσης, στις οποίες η αντίδραση μεταβάλλεται από σταθερή σε μη στάσιμη. Η ιδιαιτερότητα αυτής της διαδικασίας έγκειται στην απότομη μετάβαση από τον ένα τρόπο στον άλλο, στην αλλαγή του ρυθμού αντίδρασης από μια αμελητέα τιμή σε μια απεριόριστα αυξανόμενη.
Η ροή ορισμένων αλυσιδωτών αντιδράσεων συνοδεύεται από το σχηματισμό ενδιάμεσων προϊόντων που είναι συγκριτικά σταθερά, αλλά με την ικανότητα δημιουργίας ενεργών κέντρων. Τέτοιες αντιδράσεις περιλαμβάνουν, για παράδειγμα, αντιδράσεις καύσης υδρογονανθράκων, ως ενδιάμεσα στα οποία σχηματίζονται υπεροξείδια και αλδεΰδες. Αυτό οδηγεί σε μια διακλάδωση της αλυσίδας. Ωστόσο, λόγω της σχετικής σταθερότητας των ενδιάμεσων προϊόντων, η επιτάχυνση της αντίδρασης εκτείνεται με την πάροδο του χρόνου. Τέτοιες αργές αλυσίδες διακλάδωσης ονομάζονται εκφυλισμένες.
Οι αλυσιδωτές αντιδράσεις με τον συνηθισμένο μηχανισμό ριζικής διακλάδωσης, κατά κανόνα, λόγω της υψηλής δραστηριότητας των ριζών, προχωρούν αρκετά γρήγορα. Οι προκύπτουσες ρίζες είτε ξεκινούν μια αντίδραση ταχείας επιτάχυνσης, είτε ανασυνδυάζονται και εξέρχονται από τη διαδικασία.
Ανοικτό κύκλωμα Το ενεργό σωματίδιο, όπως οποιοδήποτε μόριο αερίου, κάνει τυχαίες κινήσεις μέσα στο σύστημα αντίδρασης, συγκρουόμενο με άλλα μόρια. Ταυτόχρονα, υπάρχει κάποια πιθανότητα σε κάποια σύγκρουση αλληλεπίδρασης με ένα άλλο ενεργό σωματίδιο ή μόριο και το σχηματισμό ενός νέου ενεργού σωματιδίου, συνεχίζοντας την πορεία του προηγούμενου. Η ανάπτυξη της αλυσίδας αντίδρασης είναι παρόμοια με την κίνηση Brownian αδρανών μορίων, αν και η μεταφορά ενεργών κέντρων συνοδεύεται από χημική αντίδραση. Στην πορεία ανάπτυξης της αλυσίδας εναλλάσσονται ενεργά κέντρα δύο ή περισσότερων τύπων.
Korolchenko A.Ya. Διεργασίες καύσης και έκρηξης
Η αλυσίδα των αντιδράσεων συνεχίζεται μέχρι τη στιγμή που το ενεργό σωματίδιο δεν αντιδρά χωρίς αναγέννηση. Σε αυτή την περίπτωση, συμβαίνει το αποκαλούμενο ανοικτό κύκλωμα. Οι διεργασίες θραύσης παίζουν σημαντικό ρόλο στην κινητική των αλυσιδωτών αντιδράσεων. Υπάρχουν δύο τύποι αντιδράσεων που οδηγούν στο θάνατο ενεργών κέντρων:
Ομογενής θραύση (θάνατος στον όγκο του μείγματος αντίδρασης).
Ετερογενές σπάσιμο (θάνατος σε στερεή επιφάνεια) Είναι δυνατή η ομοιογενής θραύση αλυσίδων με μία από τις δύο διαδικασίες:
όταν οι ρίζες ανασυνδυάζονται ή όταν διάφορα χημικά δραστικά συστατικά αλληλεπιδρούν με τα ενεργά κέντρα χωρίς αναγέννηση του τελευταίου.
Η ετερογενής θραύση της αλυσίδας εμφανίζεται σε σωματίδια αιθάλης που σχηματίζονται κατά την καύση ή στην επιφάνεια στερεών καυσαερίων. Ένα ανοικτό κύκλωμα σε μια στερεή επιφάνεια μπορεί να θεωρηθεί ως η διάχυση ενεργών κέντρων από το μείγμα αερίων σε αυτή την επιφάνεια στην οποία εξαφανίζονται. Ο μηχανισμός του ανασυνδυασμού σε μια στερεή επιφάνεια είναι ότι το δραστικό σωματίδιο, το οποίο έχει αυξημένη αντιδραστικότητα, είναι προσροφημένο * στην επιφάνεια. Οι ρίζες που απορροφούνται στις γειτονικές θέσεις ανασυνδυάζονται μεταξύ τους, καθώς δεν υπάρχουν ενεργειακά και χωρικά εμπόδια για τη διαδικασία αυτή. Τα μόρια των σταθερών ενώσεων που σχηματίζονται ως αποτέλεσμα του ανασυνδυασμού δεν εμπλέκονται πλέον στην ανάπτυξη αλυσιδωτής αντίδρασης.
Ωστόσο, όχι κάθε σύγκρουση ενός ενεργού σωματιδίου με μια στερεή επιφάνεια οδηγεί στην προσρόφηση του. Ίσως η αντανάκλασή του από την επιφάνεια. Η πιθανότητα προσρόφησης ενός ενεργού κέντρου από μια στερεή επιφάνεια ονομάζεται συντελεστής προσαρμογής. Αυτός ο συντελεστής είναι ένα χαρακτηριστικό της χημικής συγγένειας του ενεργού σωματιδίου και της επιφάνειας. Σε πρακτικά σημαντικές περιπτώσεις, το ενεργό σωματίδιο μετά από ανάκλαση από τον τοίχο δεν απομακρύνεται από αυτό μακριά. Υπάρχει η πιθανότητα νέων συγκρούσεων με τον τοίχο μέχρι να γίνει η διαμονή του. Λόγω αυτής της διαδικασίας, υπό ορισμένες συνθήκες, ο ρυθμός αντίδρασης είναι πρακτικά ανεξάρτητος από τον συντελεστή προσαρμογής. Η διαδικασία προχωρά με τέτοιο τρόπο ώστε η ΕΕ
* Sorption - απορρόφηση από ένα στερεό σώμα (ή υγρό) μιας ουσίας ha του περιβάλλοντος. Το απορροφητικό σώμα ονομάζεται προσροφητικό, απορροφημένο- σορβικό. Διαχωρίστε την απορρόφηση ολόκληρης της μάζας του ροφητικού (απορρόφηση) και του επιφανειακού στρώματος (προσρόφηση). Η προσρόφηση λόγω της αλληλεπίδρασης του χημικού τύπου μεταξύ της επιφάνειας του στερεού ροφητικού και του σορβικού ονομάζεται χημειορρόφηση.
__________________________ Κεφάλαιο 2. Χημικές διεργασίες κατά την καύση
αν παρουσιαστεί ανοικτό κύκλωμα σε κάθε σύγκρουση. Η συγκέντρωση των ενεργών κέντρων στην επιφάνεια μπορεί να θεωρηθεί μηδενική.
Απουσία δραστικών προσμίξεων στο αντιδρών μίγμα, η θραύση των αλυσίδων μπορεί να συμβεί είτε σε στερεές επιφάνειες είτε ομοιογενώς με ανασυνδυασμό ριζών στο κύριο σώμα. Σε πραγματικές πυρκαγιές, ο δεύτερος τρόπος υλοποιείται κυρίως.
Ορισμένες επιδράσεις στην κινητική των αλυσιδωτών αντιδράσεων έχουν πρόσθετα στο σύστημα αντίδρασης αδρανών αερίων. Τα αδρανή πρόσθετα αυξάνουν τον αριθμό των συγκρούσεων με δραστικά σωματίδια, αυξάνουν την πιθανότητα θραύσης της αλυσίδας και, κατά συνέπεια, αναστέλλουν τη συνολική αντίδραση.
Η αποτελεσματικότερη αναστολή των αλυσιδωτών αντιδράσεων επιτυγχάνεται με την εισαγωγή δραστικών προσθέτων - αναστολέων στο αντιδρών μίγμα. Οι αναστολείς αλληλεπιδρούν με τα ενεργά κέντρα, οδηγώντας την αντίδραση, σπάζοντας την αλυσίδα. Η κινητική της αντίδρασης στο ανασταλμένο μίγμα προσδιορίζεται από τις συνθήκες ανταγωνισμού μεταξύ του αναστολέα και των κύριων συστατικών της αντίδρασης όταν αλληλεπιδρά με δραστικά κέντρα. Με την υψηλή απόδοση του αναστολέα και τον μέτριο ρυθμό δημιουργίας νέων ενεργών κέντρων, ήδη μικρά πρόσθετα του αναστολέα μπορούν να καταστείλουν πλήρως την πορεία της αλυσιδωτής αντίδρασης.
Οι διαδικασίες αναστολής έχουν μεγάλη σημασία στην πρακτική της πυρασφάλειας και της έκρηξης. Η χρήση αναστολέων σας επιτρέπει να επηρεάζετε αποτελεσματικά τις διαδικασίες καύσης.
2.2. Χημικές διεργασίες κατά την καύση υδρογόνου
Η αλληλεπίδραση ενός μορίου υδρογόνου με ένα μόριο οξυγόνου προχωρά με πολύπλοκο τρόπο μέσω μιας σειράς διαδοχικών σταδίων. Έχει πλέον εδραιωθεί ότι η καύση του υδρογόνου συμβαίνει με έναν μηχανισμό αλυσίδας, με τα σωματίδια να παίζουν ρόλο ενεργών κέντρων. Η αλληλουχία και η σημασία των στοιχειωδών αντιδράσεων κατά την καύση του υδρογόνου περιγράφονται με μεγάλη λεπτομέρεια για διάφορες συνθήκες για την εμφάνιση και ανάπτυξη φλόγας υδρογόνου.
Η πιο λεπτομερής ανάλυση της διαδικασίας καύσης υδρογόνου στον τρόπο λειτουργίας αυτόματης διάσπασης χρησιμοποιώντας πειραματικές και υπολογιστικές μεθόδους πραγματοποιήθηκε από τον καθηγητή Α. Ν. Μπαρατόφ. Πρότεινε το ακόλουθο σχήμα της διαδικασίας, περιλαμβάνοντας δεκατέσσερις βασικές στοιχειώδεις αντιδράσεις:
Korolchenko A.Ya. Διεργασίες καύσης και έκρηξης
Η προέλευση των ενεργών κέντρων εμφανίζεται με αντίδραση
![]()
Συνέχιση της αλυσίδας των αντιδράσεων
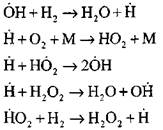
Αλυσίδες διακλάδωσης
 |
ανοικτό κύκλωμα
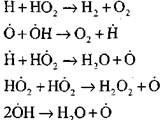 |
Η συγκέντρωση ατόμων υδρογόνου στο αρχικό στάδιο της διαδικασίας αυτοανάφλεξης είναι ένα ασήμαντο μέρος της αρχικής περιεκτικότητας σε υδρογόνο. Με την ανάπτυξη μιας αλυσιδωτής αντίδρασης, ο ρυθμός μετατροπής του μοριακού υδρογόνου γίνεται τόσο μεγάλος που καταναλώνεται σε εκατοστά του δευτερολέπτου.
2.3. Χημικές αντιδράσεις κατά την καύση μονοξειδίου του άνθρακα
Η αλληλεπίδραση του μονοξειδίου του άνθρακα με το οξυγόνο είναι μια σημαντική αντίδραση στις διεργασίες καύσης. Η πορεία αυτής της αντίδρασης κατά τη διάρκεια
__________________________ Κεφάλαιο 2. Χημική διεργασίαs κατά την καύση
πολλές περιπτώσεις καθορίζουν τους νόμους της καύσης των ουσιών που περιέχουν άνθρακα. Η αντίδραση χαρακτηρίζεται από μηχανισμό διακλαδισμένης αλυσίδας. Έχει μια σειρά από χαρακτηριστικά.
Για πολύ καιρό υπήρχε η πεποίθηση ότι ένα εντελώς ξηρό μίγμα CO και 0 δεν θα μπορούσε να αναφλεγεί και να καεί. Εν τούτοις, προσεκτικά καθορισθέντα πειράματα στα οποία η απουσία ύδατος παρακολουθήθηκε χρησιμοποιώντας ένα φασματογράφημα μάζας έδειξε ότι η ανάφλεξη είναι επίσης δυνατή για ένα ξηρό μίγμα. Πρέπει να σημειωθεί ότι η παρουσία CO + 0 2 υδρατμών ή υδρογόνου στο σύστημα ενεργοποιεί τη διαδικασία ανάφλεξης και καύσης αυξάνοντας τον αριθμό των πιθανών ενεργών κέντρων. Η επίδραση επιτάχυνσης του νερού είναι ιδιαίτερα αισθητή σε χαμηλές συγκεντρώσεις.
Η καύση μονοξειδίου του άνθρακα παρουσία υδρατμών ή μικρές προσθήκες υδρογόνου συμβαίνει με τη συμμετοχή των ακόλουθων στοιχειωδών διεργασιών:

Οι ρίζες Η02, οι οποίες σχηματίζονται από την αντίδραση (VI), μπορούν να συνεχίσουν την αλυσίδα (αντίδραση VIII) ή να οδηγήσουν στη θραύση της με αντίδραση (IX-XII).
Για να αξιολογήσουμε τις συνθήκες για τη μετάβαση της βραδείας οξείδωσης του CO σε μια έκρηξη της αλυσίδας, ας εκτιμήσουμε την πιθανότητα αλυσιδωτής διάσπασης μέσω της ρίζας H0 2. εδώ λαμβάνουμε υπόψη ότι ο ρόλος των αντιδράσεων (Χ) και (XI) στον τερματισμό της αλυσίδας θα είναι ασήμαντος από την άποψη της
σε σύγκριση με την αντίδραση (IX), καθώς οι σταθερές ταχύτητας των διεργασιών (IX-XI) σε θερμοκρασίες της τάξης των 1000 Κ είναι πλησίον μεταξύ τους, αλλά η συγκέντρωση των ριζών είναι πολύ χαμηλότερη από τη συγκέντρωση των ατόμων υδρογόνου, επειδή οι ρίζες έχουν υψηλότερη χημική δραστικότητα. Επομένως, η πιθανότητα ενός ανοιχτού κυκλώματος μέσω της ριζικής H0 2 μπορεί να γραφτεί στη μορφή:
Σε θερμοκρασία 1000K
Συνεπώς, με την προϋπόθεση ότι
![]()
![]()
μεγέθους
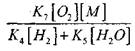
στην επίλυση της εξίσωσης (2.7) θα είναι αδύναμη.
Κεφάλαιο 2. Χημικές διεργασίες κατά την καύση
Στην περίπτωση του ![]() ή
ή ![]() (αυτό που παρατηρείται στο
(αυτό που παρατηρείται στο
πραγματικές φλόγες ΜΕ), η εξίσωση (2.7) μετατρέπεται στη μορφή:
![]() (2.8)
(2.8)
Έτσι, η κατάσταση της καύσης μονοξειδίου του άνθρακα στον αέρα καθορίζεται σε μεγάλο βαθμό από την παρουσία και τα πρότυπα καύσης υδρογόνου. Η οξείδωση του CO από την αντίδραση (Ι) εξαρτάται από τη συγκέντρωση των ριζών ΟΗ που σχηματίζονται στις αντιδράσεις που περιλαμβάνουν υδρογόνο.
Η ιδιαιτερότητα της αντίδρασης καύσης του μονοξειδίου του άνθρακα έγκειται στην ταχεία αναστολή του όταν μικρά πρόσθετα εισάγονται στο αντιδραστικό σύστημα ουσιών με υψηλή συγγένεια για άτομα υδρογόνου. Τέτοιες ουσίες που αναστέλλουν την καύση του CO είναι αλογονίδια και αλογονο-παράγωγα υδρογονανθράκων. Η ανασταλτική δράση τους οφείλεται στον τερματισμό των αλυσίδων αντίδρασης όταν αλληλεπιδρούν με άτομα υδρογόνου από την αντίδραση
2.4. Καύση υδρογονανθράκων
Μια εξέταση των διεργασιών καύσης του υδρογόνου και του μονοξειδίου του άνθρακα δείχνει την πολυπλοκότητα του μηχανισμού αντίδρασης καύσης. Στην περίπτωση των Η2 και CO, η αντίδραση προχωρά ως αλυσίδα με τη συμμετοχή πολλών στοιχειωδών σταδίων και ενδιάμεσων προϊόντων. Ως εκ τούτου, είναι φυσικό να αναμένουμε ότι ο μηχανισμός αντιδράσεων καύσης των πιο σύνθετων ουσιών - υδρογονανθράκων - είναι ακόμη πιο πολύπλοκος και οι επιδράσεις που συνοδεύουν τις διαδικασίες ανάφλεξης και καύσης αυτών των ενώσεων είναι πιο ποικίλες.
Οι διαθέσιμες σήμερα πληροφορίες σχετικά με τη φύση των χημικών αυξήσεων των υδρογονανθράκων κατά τη διαδικασία της καύσης τους μας επιτρέπουν να εξηγήσουμε τις παρατηρούμενες επιδράσεις με κάποια προσέγγιση.
Διαπιστώθηκε ότι σε φλόγες υδρογονανθράκων, μαζί με ήδη γνωστά ενεργά σωματίδια, υπάρχει ένας μεγάλος αριθμός ενδιάμεσων προϊόντων μιας πιο πολύπλοκης δομής. Σε ορισμένες περιπτώσεις, γίνονται πηγές εμφάνισης νέων αλυσίδων. Ο κύριος ρόλος στις διεργασίες ανάφλεξης και καύσης υδρογονανθράκων διαδραματίζουν οι ακόλουθοι τύποι ενδιάμεσων ενώσεων:
Korolchenko A.Ya. Διεργασίες καύσης και έκρηξης
1. ρίζες υδρογονάνθρακα, το οποίο είναι ένα μόριο
levodoroda, η οποία απομάκρυνε ένα ή περισσότερα άτομα υδρογόνου. Αυτά
τα υπολείμματα ονομάζονται αλκύλιο (CH3-μεθύλιο, C2H5-αιθύλιο, C3H7-προπύλιο και
κ.λπ.). Λόγω της υψηλής αντιδραστικότητας του, ελεύθερα αλκύλια
δεν υπάρχουν για μεγάλο χρονικό διάστημα. Παρουσιάστε στις φλόγες ως ενδιάμεσες
προϊόντα. Όταν αλληλεπιδρά με άλλα μόρια συμπεριφέρονται
ως ανεξάρτητη δομική ομάδα. Ρίζες υδρογονανθράκων
που συνήθως αντιπροσωπεύεται από το γράμμα R.
2. Υπεροξείδια - ενώσεις του γενικού τύπου R-00-R ".
3. Αλδεΰδες - Ενώσεις τύπου
![]()
Οι απλούστερες αλδεΰδες είναι μυρμηκική (φορμαλδεΰδη) και οξική (ακεταλδεϋδη) ![]() . Αυτές οι ουσίες είναι όλες
. Αυτές οι ουσίες είναι όλες
υπάρχουν σε προϊόντα ατελούς καύσης υδρογονανθράκων.
Ο σχηματισμός αλυσίδας κατά την καύση υδρογονανθράκων μπορεί να είναι οποιαδήποτε αντίδραση στην οποία σχηματίζονται ρίζες υδρογονάνθρακα. Αυτό μπορεί να είναι μια αντίδραση αποσύνθεσης ενός μορίου αιθανίου με το σχηματισμό δύο ελεύθερων μεθύλ ομάδων:
![]()
ή την αντίδραση ενός υδρογονάνθρακα με οξυγόνο:
![]()
Η συνέχιση των αλυσίδων συμβαίνει ως αποτέλεσμα των αντιδράσεων σχηματισμού | υπεροξείδιο ή υδροϋπεροξείδιο:
![]()
Η αλυσιδωτή διακλάδωση διεξάγεται κατά την διάρκεια της αποσύνθεσης του υδροϋπεροξειδίου:
Κεφάλαιο 2. Χημικές διεργασίες κατά την καύση
Η δεδομένη σειρά αντιδράσεων οδηγεί σε σταδιακή αύξηση της συγκέντρωσης ενώσεων υπεροξειδίου στο σύστημα αντίδρασης.
Ταυτόχρονα με τη συσσώρευση υπεροξειδίων, ριζών και εκκίνησης
Υπάρχουν παράλληλες αντιδράσεις:

Αυτές οι αντιδράσεις είναι εξωθερμικές. όταν ρέουν μια μεγάλη ποσότητα θερμότητας.
Με την αύξηση της θερμοκρασίας του μίγματος της αντίδρασης, ο ρόλος των ενεργών κέντρων περνά από ένα ενδιάμεσο προϊόν στο άλλο με την ακόλουθη σειρά: αλκυλοϋδροϋπεροξείδια, ακυλοϋδροϋπεροξείδια, φορμαλδεΰδες.
Πειραματικές μελέτες των αλλαγών στην σύνθεση του μίγματος της αντίδρασης με το χρόνο σε υψηλές θερμοκρασίες (600-800 ° C) δείχνουν ότι η διαδικασία της μετατροπής των υδρογονανθράκων ζωοτροφών στα τελικά προϊόντα καύσης irazdelen σε δύο στάδια: το πρώτο, που ρέει σε πολύ υψηλή ταχύτητα, η οξείδωση των υδρογονανθράκων προς CO. Στο δεύτερο, αργό στάδιο, το CO είναι οξειδωμένο στο. Ακολουθεί ένα πολύ σημαντικό συμπέρασμα: πολλοί από τους νόμους της καύσης των υδρογονανθράκων μπορούν να εξηγηθούν από τα χαρακτηριστικά της καύσης του μονοξειδίου του άνθρακα.
2.5. Καύση άνθρακα
Η καύση των προϊόντων άνθρακα μέσω μίας ετερογενούς διαδικασίας μηχανισμό, η ιδιαιτερότητα της οποίας είναι ότι η χημική βήμα δεν μπορεί να εξεταστεί μεμονωμένα από τη διαδικασία οξειδωτικό αέριο (οξυγόνο αέρας) μεταφορά από τον περιβάλλοντα χώρο στην επιφάνεια της καύσης στερεών. Ο ρυθμός καύσης εξαρτάται τόσο από τις χημικές ιδιότητες του άνθρακα όσο και από τα χαρακτηριστικά που καθορίζουν τη διαδικασία παροχής οξυγόνου στην επιφάνεια του καυσίμου. Η παροχή οξυγόνου στη ζώνη καύσης πραγματοποιείται με διάχυση και ως εκ τούτου
Korolchenko A.Ya. Διεργασίες καύσης και έκρηξης
εξαρτάται από πολλούς παράγοντες: το σχήμα και το μέγεθος του καύσιμου σώματος, την κίνηση του αέριου μέσου, τους συντελεστές διάχυσης του οξυγόνου και τα προϊόντα αντίδρασης τόσο στον χώρο πάνω από την επιφάνεια του καυσίμου όσο και στις ρωγμές και τους πόρους που περιέχονται στον άνθρακα και στον οπτάνθρακα σε σημαντικές ποσότητες.
Για την απεικόνιση των χαρακτηριστικών της ετερογενούς καύσης άνθρακα, θεωρούμε τη συμπεριφορά ενός χωριστού τεμαχίου άνθρακα τοποθετημένου σε έναν κλίβανο θερμαινόμενο σε θερμοκρασία 900 ° C. Στην αρχική στιγμή, η καύση του άνθρακα θα συμβεί σε βάρος του οξυγόνου που βρίσκεται κοντά στην επιφάνεια του. Αφού εξαντληθεί, σχηματίζεται ένα στρώμα προϊόντων καύσης γύρω από τη θερμαινόμενη επιφάνεια. Ο ρυθμός καύσης θα μειωθεί και η διαδικασία θα μπορούσε να σταματήσει εάν δεν υπήρχε οξυγόνο που προέρχεται από πιο απομακρυσμένες περιοχές του χώρου αερίου.
Αυτή η ροή λαμβάνει χώρα διαμέσου διάχυσης και ο ρυθμός καύσης θα προσδιορίζεται από τη ροή διάχυσης. Η ένταση διάχυσης εξαρτάται σε μεγάλο βαθμό από την ένταση και τη φύση της κίνησης του αερίου μέσου κοντά στην επιφάνεια καύσης. Ο ρυθμός χημικής αντίδρασης καθορίζεται κυρίως από τη θερμοκρασία. Οι ετερογενείς αντιδράσεις, καθώς και οι ομοιογενείς, υπακούουν στον νόμο Arre-nius.
Σε υψηλές θερμοκρασίες, η αντίδραση οξείδωσης του άνθρακα προχωράει πολύ γρήγορα και η συνολική ταχύτητα της διαδικασίας περιορίζεται από τη διάχυση του οξυγόνου στην επιφάνεια.
Έτσι, η διαδικασία καύσης άνθρακα αποτελείται από δύο διεργασίες διαφορετικής φύσης: τη διαδικασία μεταφοράς οξυγόνου αέρα από τον χώρο του αερίου στον τόπο της κατανάλωσής του και τη διαδικασία της χημικής αλληλεπίδρασής του με την επιφάνεια του στερεού άνθρακα. Και οι δύο αυτές διαδικασίες είναι αλληλένδετες, αλλά το καθένα έχει τους δικούς του νόμους. Η πιο σημαντική από αυτές τις διεργασίες είναι η διαδικασία κατανάλωσης οξυγόνου, η οποία χαρακτηρίζεται από μια ποικιλία χημικών αντιδράσεων.
Ο μηχανισμός της πολύπλοκης αντίδρασης του συνδυασμού οξυγόνου με άνθρακα συνίσταται στον ταυτόχρονο σχηματισμό δύο οξειδίων του CO και του C02 μέσω ενός ενδιάμεσου φυσικοχημικού συμπλόκου του τύπου C X 0 Y, το οποίο στη συνέχεια χωρίζεται σε CO και. Η αναλογία μεταξύ αυτών των οξειδίων εξαρτάται από τις συνθήκες καύσης. Κατά συνέπεια, η εξίσωση για την αντίδραση του καύσιμου άνθρακα μπορεί να γραφτεί ως εξής:
Κεφάλαιο 2. Χημικές διεργασίες κατά την καύση
Κατόπιν μια ομοιογενής αντίδραση καύσης μονοξειδίου του άνθρακα προχωρά:
ο μηχανισμός του οποίου εξετάζεται στο τμήμα 2.3.
Αυτή η αντίδραση μπορεί να λάβει χώρα κοντά στην επιφάνεια του άνθρακα, έτσικαι μέσα στη μάζα του άνθρακα, στους πόρους και τις ρωγμές του.
Μια άλλη αντίδραση είναι μια ετερογενής αντίδραση μεταξύ θερμού άνθρακα και διοξειδίου του άνθρακα:
![]()
Ρεύει με αξιοσημείωτη ταχύτητα σε μέρη όπου υπάρχει έλλειψη οξυγόνου, αλλά όπου η θερμοκρασία του άνθρακα είναι αρκετά υψηλή.
Ο συνδυασμός των αντιδράσεων που περιγράφονται προσδιορίζει τη σύνθεση των προϊόντων καύσης άνθρακα.
ΠΡΟΒΟΛΗ ΤΩΝ ΔΙΑΔΙΚΑΣΙΩΝ ΚΑΥΣΗΣ
| R |
Η άρδευση σε εύφλεκτα μείγματα μπορεί να συμβεί ως αποτέλεσμα της αυτοαναφλέξεως, της ανάφλεξης από εξωτερική πηγή ή της αυθόρμητης καύσης. Εάν οι μέθοδοι αυτοανάφλεξης και ανάφλεξης είναι χαρακτηριστικές για ουσίες που είναι σε αέρια, υγρή ή στερεή κατάσταση, τότε η αυθόρμητη καύση είναι χαρακτηριστική των στερεών υλικών (ειδικά αυτών που είναι σε τελείως διαμερισμένη κατάσταση) ή των υγρών υψηλής βρασμού που διανέμονται σε υλικά με ανεπτυγμένη επιφάνεια.
3.1. Αυτο-ανάφλεξη. Στατική θεωρία
Μια φωτιά είναι μια ανεξέλεγκτη καύση που αναπτύσσεται σε χρόνο και χώρο, επικίνδυνη για τους ανθρώπους και προκαλώντας υλική ζημιά.
Οι κίνδυνοι πυρκαγιάς στους ανθρώπους είναι ανοικτή φωτιά, σπινθήρες, πυρετός, τοξικά προϊόντα καύσης, καπνός, μειωμένο οξυγόνο, κατάρρευση κτιρίων ή εγκαταστάσεων.
Η καύση είναι μια ταχεία διαδικασία φυσικοχημικής αντίδρασης, η οποία συνοδεύεται από την απελευθέρωση θερμότητας και καπνού, την εμφάνιση φλόγας ή τη διάβρωση. Υπό κανονικές συνθήκες, η καύση είναι η διαδικασία οξείδωσης ή συνδυασμού μιας εύφλεκτης ουσίας με ατμοσφαιρικό οξυγόνο. Ωστόσο, ορισμένες ουσίες (για παράδειγμα συμπιεσμένο ακετυλένιο, χλωριούχο άζωτο, όζον) μπορούν να εκραγούν χωρίς οξυγόνο για να σχηματίσουν θερμότητα και φλόγα. Κατά συνέπεια, η καύση μπορεί να προκύψει από αντιδράσεις όχι μόνο της ένωσης, αλλά και της αποσύνθεσης. Είναι επίσης γνωστό ότι το υδρογόνο και πολλά μέταλλα μπορούν να καούν στην ατμόσφαιρα του χλωρίου, του χαλκού σε ατμούς θείου, του μαγνησίου σε διοξείδιο του άνθρακα, κλπ.
Η πιο επικίνδυνη καύση που συμβαίνει κατά την οξείδωση μιας εύφλεκτης ουσίας με οξυγόνο στον αέρα. Ταυτόχρονα, είναι απαραίτητο να υπάρχει μία πηγή ανάφλεξης ικανή να τροφοδοτεί την απαιτούμενη ποσότητα ενέργειας στο σύστημα καυσίμου. Οι πιο συνηθισμένες πηγές ανάφλεξης είναι: οι σπινθήρες που εμφανίζονται όταν παρουσιάζουν δυσλειτουργίες στον ηλεκτρολογικό εξοπλισμό, χτυπήματα μεταλλικών σωμάτων, συγκόλληση, εργασίες σφυρηλάτησης. θερμότητα που παράγεται από την τριβή. τεχνολογικές συσκευές θέρμανσης. πυροσβεστικές συσκευές. θερμότητα αδιαβατικής συμπίεσης. σπινθήρα από στατικό ηλεκτρισμό. υπερθέρμανση των ηλεκτρικών επαφών. χημικές αντιδράσεις που προχωρούν με την απελευθέρωση θερμότητας.
Η θερμοκρασία θέρμανσης αυτών των πηγών είναι διαφορετική. Έτσι, ο σπινθήρας που συμβαίνει όταν χτυπηθεί ένα μεταλλικό σώμα μπορεί να έχει θερμοκρασία έως 1900 ° C, η φλόγα ενός αγώνα είναι περίπου. 800 ° C, το κύριο τύμπανο του μεταφορέα ταινιών κατά τη διάρκεια της ολίσθησης είναι μέχρι 600 ° C, και στη θερμότητα της ηλεκτρικής εκκένωσης η θερμοκρασία φτάνει τους 10.000 ° C, με σχεδόν στιγμιαίες χημικές αντιδράσεις.
Η καύση μπορεί να είναι πλήρης και ελλιπής. Με πλήρη καύση, που εμφανίζεται με περίσσεια οξυγόνου, τα προϊόντα αντίδρασης είναι διοξείδιο του άνθρακα, νερό, άζωτο, διοξείδιο του θείου. Η ατελής καύση λαμβάνει χώρα με μια ανεπάρκεια του οξυγόνου, τα προϊόντα καύσης σε αυτή την περίπτωση είναι δηλητηριώδη και εύφλεκτα υλικά - μονοξείδιο του άνθρακα, αλκοόλες, κετόνες, αλδεΰδες, κτλ για την πλήρη καύση του καύσιμου ύλης απαιτεί ένα ορισμένο ποσό αέρα: 1 kg από ξύλο - 4,18, τύρφη - 5. , 8, προπάνιο - 23,8 m3.
Η διαδικασία καύσης μπορεί να φανταστεί ως εξής. Ένα ψυχρό καύσιμο μέσον με την εισαγωγή θερμικής ώθησης θερμαίνεται, υπάρχει έντονη οξείδωση του εύφλεκτου μέσου με οξυγόνο και πρόσθετη απελευθέρωση θερμότητας. Αυτό, με τη σειρά του, οδηγεί στη θέρμανση του γειτονικού στρώματος εύφλεκτου υλικού, στο οποίο επίσης λαμβάνει χώρα έντονη χημική αντίδραση. Με μια τέτοια καύση στοιβάδας καυσίμου μιας εύφλεκτης ουσίας, η ζώνη καύσης κινείται. Η ταχύτητα αυτής της κίνησης καθορίζει την ένταση της διαδικασίας καύσης και είναι το πιο σημαντικό χαρακτηριστικό της. Η διαδικασία της θέρμανσης, οξείδωσης και καύσης στρώματος με στρώση συνεχίζεται μέχρις ότου εξαντληθεί ολόκληρος ο όγκος εύφλεκτου υλικού.
Η στενή ζώνη στην οποία θερμαίνεται η ουσία και λαμβάνει χώρα η χημική αντίδραση ονομάζεται μέτωπο φλόγας.
Τα εύφλεκτα συστήματα μπορούν να είναι χημικά ομοιογενή και ετερογενή. Τα χημικώς ομοιογενή συστήματα είναι μείγματα καυσίμων αερίων, ατμών ή σκόνης με αέρα, στα οποία αναμιγνύονται ομοιόμορφα η καύσιμη ύλη και ο αέρας. Η καύση τέτοιων συστημάτων ονομάζεται ομοιογενής. Σε χημικά ανομοιογενή συστήματα, η εύφλεκτη ύλη και ο αέρας δεν αναμειγνύονται και έχουν διασύνδεση. Αυτά είναι συχνά στερεά εύφλεκτα υλικά και η καύση τους ονομάζεται ετερογενής.
Ο συνολικός χρόνος καύσης του εύφλεκτου μείγματος Tg είναι το άθροισμα του χρόνου που απαιτείται για την επαφή μεταξύ της καύσιμης ουσίας και του οξυγόνου τ ^ και του χρόνου κατά τον οποίο λαμβάνει χώρα η ίδια η χημική ουσία, την αντίδραση οξείδωσης τχ
Ανάλογα με την αναλογία αυτών των δύο όρων διακρίνονται η διάχυση και η κινητική καύση. Κατά την καύση στερεών καυσίμων ουσιών, ο απαιτούμενος χρόνος για να διεισδύσει (διάχυτος) οξυγόνο στην επιφάνεια της ουσίας είναι πολύ μεγαλύτερος από τον χρόνο χημικής αντίδρασης · επομένως, ο συνολικός ρυθμός καύσης προσδιορίζεται πλήρως από το ρυθμό διάχυσης του οξυγόνου στην καύσιμη ουσία. Η καύση τέτοιων ουσιών απαντάται συχνότερα στις πυρκαγιές και καλείται διάχυτη. Η καύση, η ταχύτητα της οποίας καθορίζεται από το ρυθμό της χημικής αντίδρασης, ονομάζεται κινητική. Αυτός ο τύπος καύσης είναι χαρακτηριστικός των ομοιογενών καυσίμων συστημάτων.
Διαχωρίστε την θερμιδομετρική, θεωρητική και πραγματική θερμοκρασία καύσης.
Η θερμιδομετρική θερμοκρασία καύσης αναφέρεται στη θερμοκρασία στην οποία θερμαίνονται τα προϊόντα πλήρους καύσης, αν όλη η θερμότητα που απελευθερώνεται δαπανάται για τη θέρμανση τους, η ποσότητα του αέρα είναι θεωρητικά αναγκαία, οι ουσίες καίγονται εντελώς και η αρχική θερμοκρασία είναι 0 ° С. Οι απώλειες θερμότητας θεωρούνται μηδενικές. Εάν η αρχική θερμοκρασία του καυσίμου και του αέρα είναι 0 ° C, τότε η θερμιδομετρική θερμοκρασία καύσης
![]()
όπου Qn είναι η καθαρή θερμογόνος δύναμη της καύσιμης ουσίας, kcal / kg. V είναι ο όγκος των προϊόντων καύσης, m3 / kg. c είναι η μέση ογκομετρική θερμική ισχύς των προϊόντων καύσης, kcal / m3 · deg.
Συνεπώς, η θερμιδομετρική θερμοκρασία καύσης εξαρτάται μόνο από τις ιδιότητες της καύσιμης ουσίας και δεν εξαρτάται από την ποσότητα της. Η θεωρητική θερμοκρασία καύσης λαμβάνει υπόψη την απώλεια θερμότητας κατά τη διάρκεια της καύσης για να διαχωριστεί. Η θερμιδομετρική θερμοκρασία καύσης είναι η υψηλότερη για μια καύσιμη ουσία και χρησιμοποιείται για την ποιοτική αξιολόγηση. Στην πραγματικότητα, κατά την καύση, υπάρχουν πάντα απώλειες θερμότητας λόγω ακτινοβολίας, θέρμανσης του υπερβολικού αέρα και του περιβάλλοντος.
Η πραγματική θερμοκρασία καύσης είναι η θερμοκρασία φωτιάς. Διακρίνετε τη θερμοκρασία της εσωτερικής και εξωτερικής φωτιάς. Η θερμοκρασία της εξωτερικής φωτιάς είναι η θερμοκρασία της φλόγας και η εσωτερική θερμοκρασία είναι η θερμοκρασία του καπνού στο δωμάτιο. Οι πραγματικές θερμοκρασίες που αναπτύσσονται σε περίπτωση πυρκαγιάς λόγω απώλειας θερμότητας στο περιβάλλον, θέρμανσης προϊόντων καύσης και δομών
πάντα λιγότερο από θεωρητικό κατά 30 ... 50%. Για παράδειγμα, η θεωρητική θερμοκρασία καύσης βενζίνης είναι 1730 ° C, και η πραγματική θερμοκρασία είναι 1400 ° C.
Ένα μείγμα καυσίμων ατμών και αερίων με έναν οξειδωτικό παράγοντα μπορεί να καίει μόνο με μια συγκεκριμένη περιεκτικότητα καυσίμου σε αυτό.
Η χαμηλότερη συγκέντρωση καυσίμου αερίου στην οποία είναι ήδη δυνατή η καύση ονομάζεται χαμηλότερο όριο συγκέντρωσης ανάφλεξης (LEL). Η υψηλότερη συγκέντρωση στην οποία εξακολουθεί να είναι δυνατή η καύση ονομάζεται ανώτερο όριο συγκέντρωσης ανάφλεξης (AIPW). Η περιοχή συγκέντρωσης που βρίσκεται μέσα σε αυτά τα όρια ονομάζεται περιοχή ανάφλεξης. Η ανάφλεξη είναι μια φωτιά (η αρχή της καύσης), συνοδευόμενη από την εμφάνιση μιας φλόγας. Αυτή είναι μια σταθερή μακρά καύση, η οποία δεν σταματά ακόμα και μετά την αφαίρεση της πηγής ανάφλεξης. Οι τιμές του κατώτερου και του ανώτερου ορίου ανάφλεξης εξαρτώνται από τις ιδιότητες του αερίου, του ατμού και της σκόνης των μιγμάτων αέρα, την περιεκτικότητα των αδρανών συστατικών στο εύφλεκτο μείγμα. Η προσθήκη αδρανών αερίων στο εύφλεκτο μείγμα περιορίζει την περιοχή ανάφλεξης και τελικά το καθιστά άκαυστο. Περιορίστε σημαντικά τα όρια ανάφλεξης, ορισμένες ακαθαρσίες που επιβραδύνουν την αντίδραση καύσης. Οι πιο δραστικοί από αυτούς είναι οι αλογονωμένοι υδρογονάνθρακες. Και οι δύο σημαντικές ιδιότητες χρησιμοποιούνται για να σταματήσουν την καύση. Η μείωση της πίεσης του μείγματος κάτω από την ατμοσφαιρική πίεση επίσης περιορίζει την περιοχή ανάφλεξης και σε μια ορισμένη πίεση το μίγμα καθίσταται άκαυστο. Η αύξηση της πίεσης του εύφλεκτου μείγματος επεκτείνει την περιοχή ανάφλεξης, αλλά, κατά κανόνα, ελαφρά. Η αύξηση της θερμοκρασίας του εύφλεκτου μείγματος επεκτείνει την περιοχή ανάφλεξης. Η συγκέντρωση της ανάφλεξης επηρεάζεται επίσης από τη δύναμη της πηγής ανάφλεξης.
Δεν υπάρχουν μόνο συγκεντρώσεις, αλλά και όρια θερμοκρασίας ανάφλεξης.
Τα όρια θερμοκρασίας για την ανάφλεξη ατμών στον αέρα είναι εκείνες οι θερμοκρασίες μιας καύσιμης ουσίας στην οποία οι κορεσμένοι ατμοί της σχηματίζουν συγκεντρώσεις που αντιστοιχούν στο κατώτερο ή ανώτερο όριο συγκέντρωσης της ανάφλεξης. Η θερμοκρασία ανάφλεξης είναι η χαμηλότερη θερμοκρασία στην οποία μια ουσία αναφλέγεται ή αρχίζει να καπνίζει και συνεχίζει να καίγεται ή να καίγεται μετά την αφαίρεση της πηγής ανάφλεξης. Η θερμοκρασία ανάφλεξης χαρακτηρίζει την ικανότητα μιας ουσίας να αυτο-καύση. Εάν η θερμοκρασία ανάφλεξης μιας ουσίας απουσιάζει, τότε αναφέρεται ως αργή καύση ή άκαυστη.
Η επιτάχυνση της αντίδρασης οξείδωσης υπό την επίδραση της θερμοκρασίας οδηγεί σε αυτο-ανάφλεξη. Σε αντίθεση με τη διαδικασία ανάφλεξης, στην οποία μόνο ένα περιορισμένο μέρος του όγκου - η επιφάνεια - αναφλέγεται, η αυτοανάφλεξη συμβαίνει σε ολόκληρο τον όγκο της ουσίας. Η θερμοκρασία αυτοανάφλεξης θεωρείται ως η χαμηλότερη θερμοκρασία, στην οποία πρέπει να θερμαίνεται η ουσία, έτσι ώστε να αναφλεγεί ως αποτέλεσμα της περαιτέρω αυτό-οξείδωσης. Η αυτό-ανάφλεξη είναι δυνατή μόνο εάν η ποσότητα θερμότητας που απελευθερώνεται κατά τη διάρκεια της διαδικασίας οξείδωσης υπερβαίνει την αποδέσμευση θερμότητας στο περιβάλλον.
Η θερμοκρασία αυτοανάφλεξης δεν είναι σταθερή για μια ουσία, δεδομένου ότι εξαρτάται σε μεγάλο βαθμό από τις συνθήκες προσδιορισμού της. Για τη λήψη συγκριτικών δεδομένων, ο εξοπλισμός δοκιμής και η μέθοδος για τον προσδιορισμό της θερμοκρασίας αυτοανάφλεξης αερίων και ατμών είναι τυποποιημένα (GOST 13920-68). Η χαμηλότερη θερμοκρασία που προσδιορίζεται με την πρότυπη μέθοδο, στην οποία το μείγμα αερίων και ατμών με αέρα πρέπει να θερμαίνεται ομοιόμορφα για να αναφλεγεί χωρίς να εισάγεται εξωτερική πηγή ανάφλεξης σε αυτό, ονομάζεται τυπική θερμοκρασία αυτοανάφλεξης.
Ένας τύπος αυθόρμητης ανάφλεξης είναι αυθόρμητη καύση, δηλ. Καύση ως αποτέλεσμα της αυτοθέρμανσης χωρίς την επίδραση μιας πηγής ανάφλεξης. Η διαφορά μεταξύ αυθόρμητης ανάφλεξης και αυθόρμητης καύσης είναι στο μέγεθος της θερμοκρασίας. Η αυθόρμητη καύση συμβαίνει σε θερμοκρασία περιβάλλοντος, και για αυτοανάφλεξη είναι απαραίτητο να θερμανθεί η ουσία από το εξωτερικό.

 Υποδοχή των ενδείξεων μετρητών παροχής ζεστού και κρύου νερού
Υποδοχή των ενδείξεων μετρητών παροχής ζεστού και κρύου νερού Υπολογισμός της περιοχής των αεραγωγών διαφόρων σχημάτων και εξαρτημάτων
Υπολογισμός της περιοχής των αεραγωγών διαφόρων σχημάτων και εξαρτημάτων Χημεία διεργασιών καύσης. Εκρηκτική ενέργεια
Χημεία διεργασιών καύσης. Εκρηκτική ενέργεια Τι θα συμβεί αν δεν διαβιβάζετε μετρήσεις μετρητών
Τι θα συμβεί αν δεν διαβιβάζετε μετρήσεις μετρητών