Naziva se paljenje. Kemijski procesi tijekom izgaranja
Neke osnovne definicije
Broj atoma i molekula prikladno je izražen u količina tvari ili broj molova tvari, Jedan mol tvari odgovara 6.023 23 10 23 čestica (atoma i molekula). Broj N A = 6,023 23 10 23 mol -1 naziva se Avogadro broj. Mole frakcija x isastavni dio ja je omjer broja molova n ja sastavni dio ja na ukupan broj mola n =. n ja mješavine ( x i = n i / n).
težina m je temeljno svojstvo tvari (mjerna jedinica u SI sustavu je kilogram). Maseni udio Wi je omjer mase m i sastavni dio ja do ukupne mase smjese m = ∑ m i (Wi = m i / m).
Molekulska masa (ili molekulska masa) M ja(g / mol) komponenta ja - masa jednog mola ove komponente. Dakle, za atomski ugljik, molekularni vodik, kisik i metan imamo: M c = 12 g / mol, Mn2 = 2 g / mol, Mo2 = 32 g / mol, Mn 4 = 16 g / mol. Prosječna molarna masa smjese M (g / mol) može se izraziti molarnim frakcijama komponenti (M = x i M i).
Određivanje procesa izgaranja
spaljivanje - Riječ je o složenom fizikalno-kemijskom procesu u kojem zapaljive tvari i materijali pod utjecajem visokih temperatura ulaze u kemijsku interakciju s oksidirajućim sredstvom (kisikom u zraku), pretvarajući se u produkte izgaranja, a koje prati intenzivna emisija topline i svjetla.
Uvjeti potrebni za pojavu procesa izgaranja:
Prisutnost zapaljive tvari (GV);
Prisutnost oksidacijskog sredstva (O.) - kisika u zraku;
Prisutnost izvora paljenja (I.Z.).
Zapaljivi materijal mora biti zagrijan na određenu temperaturu na kojoj počinje proces oksidacije;
Za zagrijavanje zapaljive tvari do određene temperature potrebna je izvjesna snaga izvora paljenja;
Za održavanje procesa izgaranja potrebne su određene koncentracije goriva i oksidatora.
Najvažniji procesi izgaranja su prijenos topline i mase. Najčešće svojstvo gorenja je pojava plamena i njegovo pomicanje kroz zapaljivu smjesu prijenosom topline ili difuzijom aktivnih čestica iz zone izgaranja u svježu zapaljivu smjesu.
vatra - Ovo je vidljiva manifestacija spaljivanja. Također se naziva zona paljenja. To je dio prostora u kojem dolazi do pretvaranja zapaljive smjese u produkte potpunog i nepotpunog izgaranja.
Glavni parametri procesa izgaranja, koji dovode do smrti i materijalne štete, su:
Velika količina topline;
Visoka temperatura;
Toksični sastav produkata izgaranja.
Proces izgaranja sa stajališta molekularne kinetičke teorije plinova
Sl. 2.1. Udio aktivnih molekula ovisno o temperaturi: T2\u003e T1
Kada se zagrijava plin zapaljiva smjesa u njoj povećava višak energije.
Razlika između prosječne razine energije molekula u aktivnom stanju i prosječne razine neaktivnog stanja naziva se energija aktivacije. To se može grafički prikazati (slika 2).

Sl. 2.2. Energetski dijagram tijeka reakcije G.V. + O. ® PG: E akt - aktivacijska energija; Q xr - toplinski učinak reakcije izgaranja
Energija oslobođena kao rezultat interakcije "prvih" reagiranih molekula prenosi se na susjedne molekule. Oni su uzbuđeni, proces se ponavlja oko reagiranih molekula s velikom učestalošću i intenzitetom. Počinje samoodrživi, samo-ubrzavajući proces cijele reakcijske smjese (2H2 + O2) kemijske interakcije, praćen formiranjem molekula vode i oslobađanjem topline u okolinu i praćen luminiscencijom, tj. nastaje i širi proces gorenja.
Što je viša numerička vrijednost E-čina, to je teže napraviti taj par komponenti ući u kemijsku interakciju. Stoga je vrijednost E akta indirektni pokazatelj stupnja opasnosti od požara tog kemijskog sustava.
Vrste i načini izgaranja
Izgaranje se može klasificirati prema sljedećim parametrima:
1. Prema stanju miješanja gorivih komponenti:
a) kinetika - izgaranje prethodno izmiješanih mješavina plina ili para-zrak. Budući da je mješavina goriva i oksidanta spremna za izgaranje dok se ne zapali, ukupna brzina procesa izgaranja ovisi samo o brzini kemijske reakcije izgaranja. Ako se takvo izgaranje dogodi u zatvorenom ili ograničenom volumenu, može doći do eksplozije. Budući da energija koja se oslobađa tijekom izgaranja smjese nema vremena za ispuštanje izvan tog volumena, povećanjem tlaka, strukture se mogu uništiti;
b) difuzija, difuzijsko sagorijevanje naziva se izgaranje, kada nastajanje zapaljivog medija (mješavina goriva i oksidatora) nastaje prije zone izgaranja ili u zoni izgaranja.
2. Prema intenzitetu primanja zapaljivih komponenata u zoni kemijske reakcije:
a) laminarno, dok komponente gorive smjese relativno mirno ulaze u zonu izgaranja. U ovom slučaju, numerička vrijednost Reynoldsovog kriterija, koji karakterizira termodinamički režim, bit će značajno manji od kritičnog (Re<2300).
b) turbulentno, pri čemu komponente gorive smjese ulaze u zonu izgaranja velikom brzinom. Reynoldsov broj je u ovom slučaju veći od 2300.
3. Prema stanju agregacije komponenti gorive smjese:
a) homogeno gorivo i oksidans su u istom agregatnom stanju (plinovito);
b) heterogeni (višefazni) - gorivo i oksidans u različitim agregatnim stanjima.
4. O brzini širenja zone kemijske reakcije izgaranja:
a) deflagracija (sporo) raspodjela zone kemijske reakcije (brzina od 0,5 do 50 m / s);
b) detonacija (eksploziv), kada se zona kemijske reakcije sagorijevanja širi brzinom udarnog vala (od nekoliko stotina metara u sekundi do nekoliko kilometara u sekundi).
Zove se prostor u kojem izgaraju pare ili plinovi plamenom .
Laminarni plamenovi su prethodno izmiješani. U laminarnom plamenu prethodno miješane smjese, gorivo i oksidans se miješaju prije početka izgaranja, a protok je laminarni.
Naziva se plamen prethodno izmiješane smjese stehiometrijski ako se gorivo (ugljikovodik) i oksidans (kisik - O2) potpuno konzumiraju, tvore ugljični dioksid (CO 2) i vodu (H20). Ako postoji višak goriva, kažu da je mješavina bogata, a ako postoji višak oksidansa, kažu da je smjesa loša.
Razmislite o najjednostavnijim primjerima:
1) 2H2 + O2 → 2H2O - stehiometrijska smjesa,
2) ZN 2 + O 2 → 2H 2 O + N 2 - bogata smjesa (N 2 u suvišku),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - siromašna smjesa (O 2 u suvišku).
Svaki simbol u takvoj jednadžbi kemijske reakcije odgovara jednom molu tvari. Prema tome, prva od ovih jednadžbi znači da dva mola H2 reagiraju s jednim molom O2 kako bi tvorili dva mola H20.
Ako je jednadžba kemijske reakcije zapisana na takav način da opisuje reakciju samo jednog mola goriva, tada se molarni udio goriva u stehiometrijskoj smjesi može lako odrediti iz odnosa
x planine, stokh = 1 / ((1 + v)
ovdje voznačava broj molova O2 u jednadžbi reakcije s formiranjem CO2 i H20. Primjer je reakcija
H2 + 0,5O2 → H20, v = 0,5, xH2, stoh = 2/3
Ako je oksidant zrak, tada treba uzeti u obzir da suhi zrak sadrži samo 21% kisika, kao i 78% dušika i 1% plemenitih plinova. Tako, za zrak, XN2 = 3.762 XO2. Odavde će molarne frakcije za stehiometrijsku smjesu s zrakom biti jednake
x planine, stokh = 1 / (((1 + v 76 4.762), ![]() ,
,
gdje v kao i prije znači broj molova O2 u jednadžbi reakcije potpunog pretvaranja jednog mola goriva u CO2 i H20. Neki primjeri vrijednosti v i molarne frakcije goriva za stehiometrijske smjese goriva s zrakom prikazane su u tablici 1.
Prethodno izmiješane smjese goriva i zraka (u ovom slučaju, odgovarajuća količina N2 mora se dodati u reakcijsku jednadžbu, vidi tablicu 1) karakterizirana omjerom ekvivalenta za zrak:
λ = (x w / x planine) / (x w, stoch / x planine, stoh) = (w w / w planine) / (w w, stoch / w planine, stoch)
ili recipročni omjer ekvivalenta goriva F (F = 1 / λ). Ova formula se može transformirati da bi se mogla odrediti vrijednost molarnih frakcija smjese prema vrijednosti F:
x planine = 1 / ((1+ (4,762) v) / F), x w = 1 - x planine,
X težina / 4,762, = 3,762
Primjeri v vrijednosti i molskih udjela goriva x planine, stoichi za stehiometrijske smjese goriva s zrakom
navodnjavanje je uvijek popraćeno kemijskim transformacijama. Izgaranje u zraku - interakcija gorive tvari s kisikom. Međutim, treba imati na umu da oksidi dušika, halogenidi i ozon mogu djelovati kao oksidanti u procesu izgaranja. Poznati procesi izgaranja koji se odvijaju uz sudjelovanje samo jednog izvora proizvoda - spojeva koji se mogu brzo razgraditi. Primjeri takvih spojeva su acetilen i hidrazin.
Kemijski procesi koji se odvijaju tijekom izgaranja izuzetno su složeni. Čak i za najjednostavniji slučaj - izgaranje vodika u kisiku, čija opća jednadžba ima oblik
2H2 + 0 2 = 2H2O,
uspostavljeno je i proučavano nekoliko desetaka osnovnih stadija.
Do danas su dovoljno detaljno proučavani mehanizmi kemijskih transformacija tijekom izgaranja samo nekoliko tvari, kao što su vodik, ugljikov monoksid, metan i etan. Ovo znanje se koristi za predviđanje uvjeta paljenja i izgaranja mnogih tvari.
2.1. Lančane reakcije
Lančane reakcije, za razliku od običnih kemijskih transformacija, karakterizira pojava u svakom elementarnom činu aktivne čestice: atom s nesparenim elektronom, slobodni radikal ili ion. Pojava aktivnih čestica uzrokuje lanac transformacije polaznih materijala u produkte reakcije. Atomi, slobodni radikali i ioni su reaktivniji od molekula zasićenih valencijom. Stoga, unatoč znatnim troškovima energije koji su potrebni za razbijanje kemijskih veza i formiranje aktivnih čestica, razvoj lanca reakcije često se pokaže energetski korisnijim od izravne interakcije između molekula.
Procesi sagorijevanja uglavnom se odvijaju kroz lančani mehanizam. Lančane reakcije - složene reakcije koje se odvijaju u nekoliko faza, a predstavljaju:
Podrijetlo lanaca (inicijacija), u kojem se formiraju aktivne čestice;
Nastavak lanaca u kojima aktivne čestice ulaze u kemijsku interakciju s polaznim materijalima, što rezultira stvaranjem novih aktivnih čestica;
Lomljenje lanaca u kojem se "smrt" aktivnih čestica događa s formiranjem konačnih produkata reakcije
Podrijetlo lanaca može se dogoditi pod različitim uvjetima. Na primjer, kao rezultat disocijacije molekula pod djelovanjem toplinske energije ili ionizirajućeg zračenja, u električnom pražnjenju. Smrt aktivnih čestica nastaje kada se kombiniraju *, kada slobodni radikali međusobno djeluju (homogeni lom lanca), kada aktivne čestice međusobno djeluju s krutim površinama (heterogeni lom lanca) ili kao rezultat njihove reakcije s inhibitorima izgaranja.
Postoje nerazgranate i razgranate lančane reakcije. U nerazgranatoj svakoj aktivnoj čestici koja se konzumira u reakcijama nastavka lanca dolazi do ponovnog pojavljivanja. Broj nastalih molekula produkta po početnoj aktivnoj čestici naziva se duljina lanca. Duljina lanaca u reakcijama izgaranja kreće se od stotina tisuća do desetaka milijuna. Na brzinu reakcija nerazgranatog lanca mogu utjecati manje smjese tvari koje mogu učinkovito djelovati s aktivnim česticama, kao što su inhibitori izgaranja.
Neke tvari - inicijatori - olakšavaju stvaranje aktivnih čestica i time ubrzavaju nerazgranate lančane reakcije.
U razgranatim lančanim reakcijama na jednu aktivnu česticu, konzumiranu s nastavkom lanca, formiraju se dvije ili više aktivnih čestica. Jedan od njih nastavlja primarni lanac, dok drugi započinju nove lance, stvarajući grananje (sl. 2.1).
"Rekombinacija je proces stvaranja neutralnih atoma ili molekula iz nabijenih čestica. Atomi i molekule nastale tijekom rekombinacije mogu biti u tlu ili u pobuđenom stanju.
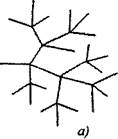
Sl. 2.1. Shematski prikaz reakcijskih lanaca:
a) grananje u svakoj vezi lanca
6) rijetko grananje
Na primjer, tijekom izgaranja vodika u reakciji inicijacije lanca:
nastaje aktivni atom. U reakciji nastavka lanca:

povećava se broj aktivnih atoma koji su početak novih lanaca.
Reakcije razgranatog lanca mogu se nastaviti u stacionarnom modu, u kojem je brzina grananja manja od brzine smrti aktivnih čestica, te u nestacionarnom, u kojem se smrt događa sporije od grananja. U potonjem slučaju, brzina lančane reakcije eksponencijalno raste i ograničena je samo potrošnjom polaznih materijala. Prijelaz iz stacionarnog u nestacionarni način dolazi naglo s malom promjenom uvjeta reakcije: temperature, tlaka ili koncentracije jednog od reaktanata. Takvo brzo ubrzanje se smatra samo-paljenjem reakcijske smjese ili lančanom eksplozijom.
Otkriće razgranatih lančanih reakcija bilo je od velike važnosti za stvaranje teorije procesa izgaranja. Dokazano je da postoje dvije vrste paljenja: toplinska i lančana. Uzorci postavljeni u
Poglavlje 2. Kemijski procesi u spaljivanje
teorija lančanih procesa može učinkovito utjecati na razvoj i suzbijanje procesa izgaranja tijekom požara.
Podrijetlo lanaca.Proces nukleacije početnih aktivnih centara igra veliku ulogu u razvoju nerazgranatih lančanih reakcija. Kompenzira gubitak aktivnih centara tijekom reakcija završetka lanca. Taj mehanizam određuje uvjete za formiranje stacionarnog režima u početnom razdoblju akumulacije aktivnih središta. S malom brzinom iniciranja, ovo razdoblje može biti značajno.
Većina kemijskih reakcija u plamenu ima značajnu energetsku zalihu aktivnih centara. U tim uvjetima pokretanje aktivnih centara povezano je s prevladavanjem značajne energetske barijere.
U ovom slučaju, važnu ulogu igraju čimbenici koji osiguravaju značajnu stopu pojavljivanja aktivnih centara: kemijski aktivnih aditiva, zračenja, električnog pražnjenja, radioaktivnih proizvoda raspadanja.
Među čimbenicima koji uvelike olakšavaju stvaranje aktivnih centara, treba spomenuti heterogene reakcije. U molekulama zapaljivih tvari koje se adsorbiraju na krutu površinu, međatomatske veze su oslabljene i njihovo lomljenje zahtijeva manje potrošnje energije. Pod tim uvjetima brzina stvaranja aktivnih centara znatno je viša nego u volumenu plina. Aktivacijska energija u heterogenoj interakciji komponenti gorive smjese je također niža nego u slučaju homogene. Heterogena inicijacija aktivnih centara u uvjetima stvarnih procesa izgaranja važan je čimbenik ubrzanog postizanja stacionarnog režima s procesima nerazgranatog lanca.
Neke značajke karakteriziraju nerazgranate lančane reakcije koje se događaju uz sudjelovanje atomskih komponenti. U odsutnosti nečistoća koje interagiraju s aktivnim središtima bez regeneracije, završetak lanca postaje moguć samo kada se atomi rekombiniraju pomoću trostrukih sudara i na površini.
Na bilo kojoj temperaturi, sve plinovite tvari su djelomično razdvojene. Neke molekule se razlažu na atome. U ovom slučaju postoji ravnoteža između procesa disocijacije i ujedinjenja atoma u molekule. Stupanj disocijacije eksponencijalno ovisi o temperaturi.
Ako u gorivoj smjesi ne postoje nečistoće koje razbijaju lance, koncentracija atomskih komponenti reakcije ostaje praktički nepromijenjena. Atomi koji su ušli u reakciju odmah se regeneriraju u istom
Korolchenko A.Ya. Procesi izgaranja i eksplozije
lichestve. Početna inicijacija kompenzira reagirane atome u istoj količini kao u nereaktivnom sustavu. Stacionarna reakcija ne utječe na taj proces. Ravnoteža jedne od komponenti reakcije, koja se razlikuje po najmanje jakoj vezi između atoma u molekuli, karakteristična je značajka ovog načina. Koncentracija druge atomske komponente u ovom slučaju je kvazistacionarna, ali više ravnoteža.
Uz homogeno pokretanje reakcija izgaranja, stacionarni režim će se uspostaviti tek nakon određenog vremenskog razdoblja, budući da disocijacija zahtijeva veliku energiju aktivacije. Tijekom tog perioda brzina disocijacije premašuje brzinu rekombinacije, a aktivni centri se akumuliraju u reakcijskom sustavu. Stope oba procesa uspoređuju se tek nakon povećanja koncentracije aktivnih centara u ravnotežu. Ovo vremensko razdoblje naziva se razdoblje indukcije.
Prisutnost krute površine kao katalizatora u reakcijskoj zoni ne mijenja stanje termodinamičke ravnoteže. Katalizator jednako utječe na reakcije naprijed i natrag. Aktivni centri ne samo da potječu na čvrstoj površini, već se i na njemu lome. Međutim, prisutnost katalizatora ubrzava postizanje stanja ravnoteže disocijacije.
Ako su u zapaljivoj smjesi prisutne aktivne tvari koje mogu sudjelovati u reakcijama lomljenja lanca, one smanjuju koncentraciju aktivnih središta. U tom slučaju narušava se ravnotežna disocijacija jedne od početnih komponenti, što usporava reakciju i može dovesti do njenog prestanka.
Pokusi pokazuju da kod pokretanja lančane reakcije s vanjskim izvorom (npr. Izvor svjetla) koncentracija aktivnih središta u početnom stadiju razvoja procesa izgaranja može značajno premašiti ravnotežu.
Tijekom reakcija razgranatog lanca, uvjeti inicijalne inicijacije imaju značajan utjecaj na razvoj reakcije. U sporim procesima dodavanje djelomično reakcijske smjese na početnu skraćuje razdoblje indukcije i ubrzava vrijeme izgaranja plamena.
Nastavak lanaca.Karakteristična značajka nerazgranatih lančanih reakcija je kvazi-stacionarnost koncentracije aktivnih centara. U odsutnosti otvorenog kruga, aktivne čestice se formiraju u
Poglavlje 2. Kemijski procesi tijekom izgaranja
isti iznos u kojem se troše. Novo se pojavljuje tek na početku inicijacije. Uz jednake stope generiranja aktivnih centara i lančanog završetka, uspostavljaju se konstantne koncentracije aktivnih centara i stacionarni režim reakcije. Brzina reakcije će se smanjiti kako se početne komponente troše.
U slučaju razgranate lančane reakcije, koncentracija aktivnih centara u reakcijskom sustavu raste bez obzira na uvjete njihove inicijalne inicijacije. Implementiran je samoubrzujući reakcijski način, koji ima lavinski karakter. U tom slučaju, za potpunu transformaciju početnih komponenti u konačne produkte reakcije, dovoljan je jedan početni aktivni centar.
Kinetička jednadžba razgranate vrijedne reakcije je kako slijedi. Promjena koncentracija stabilnih polaznih komponenti tijekom vremena može se zanemariti do prve aproksimacije, a mogu se uzeti u obzir samo brže promjene koncentracije aktivnih centara. br.Promjene u toj brzini određuju se brzinom inicijalnog pokretanja i omjerom brzina reakcija grananja i završetka lanca. Inicijalna brzina inicijacije ne ovisi o koncentraciji aktivnih centara prisutnih u sustavu. Brzine procesa grananja i loma proporcionalne su koncentracijama aktivnih centara. Pod tim uvjetima ukupna ravnoteža formacije i potrošnje aktivnih centara određena je zbrojem brzina procesa inicijacije, grananja i loma:
![]() (2.1)
(2.1)
gdje su i konstante brzine reakcija grananja i loma. Označavajući, dobivamo:
![]() (2.2)
(2.2)
Kada je vrijeme derivat koncentracije aktivnih centara
je pozitivan. Brzina reakcije raste s vremenom. Ova značajka razgranatih lančanih reakcija je posljedica umnožavanja aktivnih centara u takvim režimima kada brzina reakcije grananja prelazi brzinu reakcije završetka lanca.
Korolchenko A.Ya. Procesi izgaranja i eksplozije
Ako prije početka reakcije sustav nije sadržavao aktivne centre, tj. ut= 0, n = 0 integracija jednadžbe (2.2) daje:
![]() (2.3)
(2.3)
Ukupna brzina reakcije CO određena je brzinom procesa grananja. Konačni proizvodi nastaju samo tijekom ove reakcije. Za svaki elementarni lanac grananja, nastaju molekule konačnog proizvoda. Slijedi:
![]() (2.4)
(2.4)
Razvoj lančane reakcije u vremenu određen je omjerom konstanti brzine reakcija grananja i završetka lanca, i kada je eksponent u jednadžbi (2.4) pozitivan i
djelovanje je neograničeno ubrzano. U početnom razdoblju razvoja reakcije vrijedi sljedeće:
S obzirom na činjenicu da je brzina inicijalne inicijacije mala, u početnom razdoblju nema zamjetne kemijske transformacije. Nakon nekog vremena, vrijednost postaje bitno veća od jedne. Nakon toga brzina reakcije u skladu s jednadžbom (2.4) počinje brzo rasti i dostiže vrlo velike vrijednosti, premda je prije bila praktički neprimjetna.
Prisutnost perioda kašnjenja (indukcijsko razdoblje) tijekom razvoja lančane reakcije posljedica je potrebe akumuliranja određenog broja aktivnih centara u reakcijskom sustavu. Tek nakon toga kemijska transformacija postaje vidljiva.
Veličina indukcijskog razdoblja u lančanim reakcijama određuje omjere brzina grananja i procesa završetka lanca, a ne brzinu inicijalne inicijacije. S druge strane, brzine reakcija grananja i loma uzrokovane su kemijskim svojstvima svakog reakcijskog sustava, a određuju se ovisnosti o temperaturi i koncentracijama polaznih komponenti. Osobitost lančanih reakcija za
je da procesi grananja zahtijevaju značajnu energiju aktivacije, dok je temperaturni koeficijent konstante brzine procesa loma blizu nule. U reakcijama završetka lanaca svih triju tipova: u slučaju rasutih i heterogenih rekombinacija, u interakciji radikala s aktivnim nečistoćama, energija aktivacije je nula.
S povećanjem temperature, ukupnim tlakom smjese, ili promjenom koncentracije reagirajućih komponenata, moguća je promjena konstanti brzina grananja i loma, pri čemu se reakcija mijenja iz stacionarnog u nestacionarno. Osobitost ovog procesa leži u naglom prijelazu iz jednog načina rada u drugi, promjenom brzine reakcije iz zanemarive vrijednosti u neograničeno rastuću.
Protok nekih lančanih reakcija popraćen je formiranjem međuproizvoda koji su relativno stabilni, ali sa sposobnošću stvaranja aktivnih centara. Takve reakcije uključuju, na primjer, reakcije izgaranja ugljikovodika, kao intermedijere u kojima nastaju peroksidi i aldehidi. To dovodi do grananja lanca. Međutim, zbog relativne stabilnosti međuproizvoda, ubrzanje reakcije se proteže tijekom vremena. Takvi sporo razgranati lanci nazivaju se degenerirani.
Lančane reakcije s uobičajenim radikalnim mehanizmom grananja, u pravilu, zbog visoke aktivnosti radikala, odvijaju se vrlo brzo. Nastali radikali ili iniciraju brzu reakciju, ili se rekombiniraju i napuštaju proces.
Otvoreni krug Aktivna čestica, kao i svaka molekula plina, čini slučajna kretanja unutar reakcijskog sustava, sudarajući s drugim molekulama. Istodobno, postoji određena vjerojatnost pri nekom sudaru interakcije s drugom aktivnom česticom ili molekulom i formiranjem nove aktivne čestice, nastavljajući put prethodne. Razvoj reakcijskog lanca sličan je Brownovom gibanju inertnih molekula, premda je prijenos aktivnih centara popraćen kemijskom reakcijom. Na putu razvoja lanca izmjenjuju se aktivni centri dvaju ili više vrsta.
Korolchenko A.Ya. Procesi izgaranja i eksplozije
Lanac reakcija se nastavlja do trenutka kada aktivna čestica ne reagira bez regeneracije. U tom slučaju dolazi do tzv. Otvorenog kruga. Procesi loma imaju veliku ulogu u kinetici lančanih reakcija. Postoje dvije vrste reakcija koje dovode do smrti aktivnih centara:
Homogeni prekid (smrt u volumenu reakcijske smjese);
Heterogeni prekid (smrt na čvrstoj površini) Homogeni lom lanaca moguć je jednim od dvaju procesa:
kada se radikali rekombiniraju ili kada različite kemijski aktivne komponente međusobno djeluju s aktivnim centrima bez regeneracije potonjih.
Heterogeni lom lanca događa se na česticama čađe koje nastaju tijekom izgaranja ili na površini čvrstih materijala. Otvoreni krug na čvrstoj površini može se smatrati difuzijom aktivnih centara iz mješavine plina na tu površinu na kojoj nestaju. Mehanizam rekombinacije na čvrstoj površini je da se aktivna čestica, koja ima povećanu reaktivnost, sorbira * na površini. Radikali koji se sorbiraju na susjednim mjestima rekombiniraju se međusobno, budući da za taj proces nema energetskih i prostornih prepreka. Molekule stabilnih spojeva nastalih kao rezultat rekombinacije više nisu uključene u razvoj lančane reakcije.
Međutim, nije svaki sudar aktivne čestice s čvrstom površinom dovodio do njegove adsorpcije. Možda njegov odraz s površine. Vjerojatnost adsorpcije aktivnog centra na krutu površinu naziva se koeficijent smještaja. Ovaj koeficijent je karakteristika kemijskog afiniteta aktivne čestice i površine. U praktično važnim slučajevima, aktivna čestica nakon odbijanja od zida se ne udaljava daleko od nje. Postoji vjerojatnost novih sudara sa zidom do njegovog smještaja. Zbog tog procesa, pod određenim uvjetima, brzina reakcije je praktički neovisna od koeficijenta smještaja. Proces se odvija na takav način kao EU
* Sorpcija - apsorpcija čvrstog tijela (ili tekućine) supstance ha okoliša. Upijajuće tijelo se naziva sorbent, apsorbirano- sorbat. Razlikovati apsorpciju cijele mase sorbenta (apsorpcija) i površinskog sloja (adsorpcija). Sorpcija zbog interakcije kemijskog tipa između površine čvrstog sorbenta i sorbata naziva se kemisorpcija.
__________________________ Poglavlje 2. Kemijski procesi tijekom izgaranja
ako je došlo do otvorenog kruga pri svakom sudaru. Koncentracija aktivnih centara na površini može se uzeti kao nula.
U odsutnosti aktivnih nečistoća u reakcijskoj smjesi, lom lanaca može se pojaviti ili na krutim površinama ili homogeno rekombinacijom radikala u masi. U stvarnim požarima drugi se put uglavnom provodi.
Određeni utjecaj na kinetiku lančanih reakcija ima aditive u reakcijskom sustavu inertnih plinova. Inertni aditivi povećavaju broj sudara s aktivnim česticama, povećavaju vjerojatnost loma lanca i, sukladno tome, sprječavaju cjelokupnu reakciju.
Učinkovitije inhibiranje lančanih reakcija postiže se uvođenjem reaktivnih aditiva - inhibitora u reakcijsku smjesu. Inhibitori stupaju u interakciju s aktivnim centrima, vodeći reakciju, razbijajući lanac. Kinetika reakcije u inhibiranoj smjesi određena je uvjetima natjecanja između inhibitora i glavnih komponenti reakcije pri interakciji s aktivnim centrima. Uz visoku učinkovitost inhibitora i umjerenu brzinu stvaranja novih aktivnih centara, već mali aditivi inhibitora mogu potpuno potisnuti tijek lančane reakcije.
Procesi inhibicije su od velike važnosti u praksi zaštite od požara i eksplozije. Upotreba inhibitora omogućuje učinkovito djelovanje na procese izgaranja.
2.2. Kemijski procesi tijekom izgaranja vodika
Interakcija molekule vodika s molekulom kisika odvija se na složen način kroz niz uzastopnih faza. Sada je čvrsto utvrđeno da se izgaranje vodika odvija putem lančanog mehanizma, pri čemu čestice igraju ulogu aktivnih središta. Redoslijed i značaj elementarnih reakcija tijekom izgaranja vodika detaljno su opisani za različite uvjete nastanka i razvoja plamena vodika.
Najdetaljniju analizu procesa izgaranja vodika u režimu samozapaljivosti korištenjem eksperimentalnih i računskih metoda proveo je profesor A. N. Baratov. Predložio je sljedeću shemu procesa, uključujući četrnaest osnovnih elementarnih reakcija:
Korolchenko A.Ya. Procesi izgaranja i eksplozije
Podrijetlo aktivnih centara nastaje reakcijom
![]()
Nastavak lanca reakcija
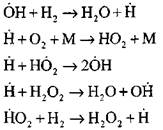
Granski lanci
 |
otvoreni krug
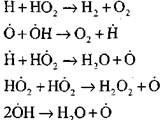 |
Koncentracija atoma vodika u početnoj fazi procesa samozapaljivosti je neznatan dio početnog sadržaja vodika. S razvojem lančane reakcije, brzina konverzije molekularnog vodika postaje toliko visoka da se konzumira u stotinki sekunde.
2.3. Kemijske reakcije pri sagorijevanju ugljičnog monoksida
Interakcija ugljik monoksida s kisikom glavna je reakcija u procesima izgaranja. Tijekom ove reakcije
__________________________ Poglavlje 2. Kemijski procesna gori
u mnogim slučajevima određuje zakone izgaranja tvari koje sadrže ugljik. Reakcija je karakterizirana razgranatim lančanim mehanizmom. Ima niz značajki.
Dugo vremena postojalo je uvjerenje da se potpuno suha smjesa CO i 0 2 ne može zapaliti i spaliti. Međutim, pažljivo postavljeni eksperimenti u kojima je praćena odsutnost vode korištenjem masenog spektrografa pokazali su da je paljenje moguće i za suhu smjesu. Treba napomenuti da prisutnost CO + 0 2 vodene pare ili vodika u sustavu aktivira proces paljenja i sagorijevanja povećanjem broja mogućih aktivnih centara. Ubrzani učinak vode posebno je uočljiv pri niskim koncentracijama.
Izgaranje ugljičnog monoksida u prisutnosti vodene pare ili malih dodataka vodika odvija se uz sudjelovanje sljedećih osnovnih procesa:

Radikali, H02, koji nastaju reakcijom (VI), mogu nastaviti lanac (reakcija VIII) ili dovesti do njegovog loma reakcijom (IX-XII).
Za procjenu uvjeta prijelaza sporog oksidiranja CO u lančanu eksploziju procijenimo vjerojatnost probijanja lanca kroz radikal H0 2; ovdje uzmemo u obzir da će uloga reakcija (X) i (XI) u prestanku lanca biti beznačajna u smislu
u usporedbi s reakcijom (IX), budući da su konstante brzine procesa (IX-XI) pri temperaturama reda 1000 K blizu jedna drugoj, ali je koncentracija radikala mnogo niža od koncentracije vodikovih atoma, budući da radikali imaju veću kemijsku aktivnost. Stoga se vjerojatnost otvorenog kruga kroz radikal H0 2 može napisati u obliku:
Na temperaturi od 1000K
Stoga, pod uvjetom da
![]()
![]()
učinak magnitude
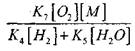
na rješavanje jednadžbe (2.7) će biti slaba.
Poglavlje 2. Kemijski procesi tijekom izgaranja
U slučaju ![]() ili
ili ![]() (što se promatra u
(što se promatra u
stvarni plamen S), jednadžba (2.7) pretvara se u oblik:
![]() (2.8)
(2.8)
Dakle, stanje sagorijevanja ugljičnog monoksida u zraku u velikoj mjeri ovisi o prisutnosti i obrascima sagorijevanja vodika. Oksidacija CO reakcijom (I) ovisi o koncentraciji OH radikala nastalih u reakcijama koje uključuju vodik.
Osobitost reakcije izgaranja ugljičnog monoksida leži u njegovoj brzoj inhibiciji kada se mali aditivi uvode u reaktivni sustav tvari s visokim afinitetom za vodikove atome. Takve tvari koje inhibiraju izgaranje CO su halogenidi i halo-derivati ugljikovodika. Njihov inhibicijski učinak zbog završetka reakcijskih lanaca u interakciji s vodikovim atomima reakcijom
2.4. Izgaranje ugljikovodika
Ispitivanje procesa izgaranja vodika i ugljičnog monoksida pokazuje složenost mehanizma reakcije izgaranja. U slučaju H2 i CO, reakcija se odvija kao lanac uz sudjelovanje mnogih elementarnih faza i međuproizvoda. Stoga je prirodno očekivati da je mehanizam reakcija izgaranja složenijih tvari - ugljikovodika - još složeniji, a učinci koji prate procese paljenja i izgaranja ovih spojeva su raznovrsniji.
Trenutačno dostupne informacije o prirodi kemijskih uzvišenja ugljikovodika u procesu njihovog izgaranja dopuštaju nam da objasnimo uočene učinke nekim približnim vrijednostima.
Utvrđeno je da u plamenu ugljikovodika, uz već poznate aktivne čestice, postoji veliki broj međuproizvoda složenije strukture. U nekim slučajevima oni postaju izvori pojavljivanja novih lanaca. Glavnu ulogu u procesima paljenja i sagorijevanja ugljikovodika imaju sljedeći tipovi međuproizvoda:
Korolchenko A.Ya. Procesi izgaranja i eksplozije
1. Ugljikovodični radikali, koji su molekula
levodoroda, koja je uklonila jedan ili više atoma vodika. ovi
ostaci se nazivaju alkil (CH3-metil; C2H5-etil; C3H7-propil i
itd.) Zbog svoje visoke reaktivnosti, slobodni alkili
ne postoje dugo vremena. Prisutan u plamenu kao srednji
Vladinih proizvoda. Kod interakcije s drugim molekulama ponašajte se
kao neovisna strukturna skupina. Radikali ugljikovodika
obično predstavljen slovom R.
2. Peroksidi - spojevi opće formule R-00-R ".
3. Aldehidi - Spojevi tipa
![]()
Najjednostavniji aldehidi su mravlji (formaldehid) i octena (acetaldehid) ![]() , Sve su to tvari
, Sve su to tvari
su prisutni u proizvodima nepotpunog izgaranja ugljikovodika.
Formiranje lanca tijekom izgaranja ugljikovodika može biti bilo koja reakcija u kojoj se formiraju ugljikovodični radikali. To može biti reakcija razgradnje molekule etana s nastankom dvije slobodne metilne skupine:
![]()
ili reakcija ugljikovodika s kisikom:
![]()
Nastavljanje lanaca nastaje kao rezultat reakcija formiranja peroksid ili hidroperoksid:
![]()
Lančana grananja se provodi tijekom razgradnje hidroperoksida:
Poglavlje 2. Kemijski procesi tijekom izgaranja
Navedeni slijed reakcija dovodi do postupnog povećanja koncentracije peroksidnih spojeva u reakcijskom sustavu.
Istodobno s akumulacijom peroksida, radikala i početkom
postoje paralelne reakcije:

Ove reakcije su egzotermne; kada teče veliku količinu topline.
S povećanjem temperature reakcijske smjese, uloga aktivnih centara prelazi iz jednog međuproizvoda u drugi u sljedećem redoslijedu: alkil hidroperoksidi, acil hidroperoksidi, formaldehidi.
Eksperimentalne studije promjena sastava reakcijske smjese tijekom vremena u visokotemperaturnoj regiji (600-800 ° C) pokazuju da se proces pretvaranja početnih ugljikovodika u konačne produkte izgaranja dijeli u dvije faze: prva, koja se događa vrlo visokom brzinom, oksidira ugljikovodike u CO. U drugoj, sporoj fazi, CO se oksidira u. Slijedi vrlo važan zaključak: mnogi zakoni izgaranja ugljikovodika mogu se objasniti značajkama izgaranja ugljičnog monoksida.
2.5. Izgaranje ugljika
Sagorijevanje ugljika odvija se prema mehanizmu heterogenog procesa, čija specifičnost leži u činjenici da se kemijski stupanj ne može smatrati izoliranim od procesa prijenosa plinovitog oksidanta (kisika zraka) iz okolnog prostora na površinu čvrste mase. Brzina gorenja ovisi o kemijskim svojstvima ugljika i karakteristikama koje određuju proces opskrbe kisika površini goriva. Dovođenje kisika u zonu izgaranja provodi se difuzijom i stoga
Korolchenko A.Ya. Procesi izgaranja i eksplozije
ovisi o mnogim čimbenicima: obliku i veličini tijela koje gori, kretanju plinovitog medija, koeficijentima difuzije kisika i produktima reakcije, kako u prostoru iznad površine goriva tako iu pukotinama i porama koje se nalaze u uglju i koksu u značajnim količinama.
Da bi se ilustrirale značajke heterogenog sagorijevanja ugljika, razmatramo ponašanje zasebnog komada ugljena smještenog u peći zagrijanu na temperaturu od 900 ° C. U početnom trenutku, izgaranje ugljena će se dogoditi na račun kisika koji se nalazi u blizini njegove površine. Nakon što se potroši, oko grijane površine nastaje sloj proizvoda izgaranja. Brzina sagorijevanja će se smanjiti, a proces bi mogao prestati ako ne bi bilo kisika koji dolazi iz udaljenijih područja plinskog prostora.
Taj se protok odvija difuzijom, a brzina gorenja će se odrediti difuzijskim protokom. Intenzitet difuzije uvelike ovisi o intenzitetu i prirodi kretanja plinskog medija u blizini površine za gorenje. Brzina kemijske reakcije uglavnom se određuje temperaturom. Heterogene reakcije, kao i homogene, poštuju Arreyusov zakon.
Na visokim temperaturama oksidacijska reakcija ugljika odvija se vrlo brzo, a ukupna brzina procesa bit će ograničena difuzijom kisika na površinu.
Dakle, proces sagorijevanja ugljika sastoji se od dva procesa različite prirode: procesa prijenosa kisika iz plina iz prostora plina do mjesta njegove potrošnje i procesa njegove kemijske interakcije s površinom čvrstog ugljika. Oba ova procesa međusobno su povezana, ali svaki od njih ima svoje zakone. Najvažniji od tih procesa je proces potrošnje kisika, koji je obilježen različitim kemijskim reakcijama.
Mehanizam složene reakcije kombiniranja kisika s ugljikom sastoji se u istovremenom stvaranju dvaju oksida CO i C02 kroz srednji fizikalno-kemijski kompleks tipa C X 0 Y, koji se zatim razdvaja na CO i. Omjer ovih oksida ovisi o uvjetima sagorijevanja. Prema tome, jednadžba za reakciju sagorijevanja ugljika može se napisati na sljedeći način:
Poglavlje 2. Kemijski procesi tijekom izgaranja
Zatim slijedi homogena reakcija sagorijevanja ugljičnog monoksida:
mehanizam o kojem se raspravlja u odjeljku 2.3.
Ova reakcija može se odvijati u blizini površine ugljika, takoi unutar mase ugljena, u njegovim porama i pukotinama.
Druga reakcija je heterogena reakcija između vrućeg ugljika i ugljičnog dioksida:
![]()
Na mjestima gdje postoji manjak kisika, to je primjetna brzina, ali gdje je temperatura ugljika dovoljno visoka.
Kombinacija opisanih reakcija određuje sastav produkata sagorijevanja ugljika.
POSTUPAK IZGARANJA PROCESA IZGARANJA
| D |
navodnjavanje u zapaljivim smjesama može nastati kao posljedica njihovog samozapaljenja, paljenja vanjskim izvorom ili spontanim izgaranjem. Ako su procesi samozapaljenja i paljenja karakteristični za tvari koje se nalaze u plinovitom, tekućem ili krutom stanju, tada je spontano izgaranje karakteristično za krute materijale (osobito one u fino usitnjenom stanju) ili tekućine visoke vrelišta raspoređene na materijale s razvijenom površinom.
3.1. Samozapaljenja. Stacionarna teorija
Požar je nekontrolirano paljenje koje se razvija u vremenu i prostoru, opasno za ljude i uzrokuje materijalnu štetu.
Opasnost od požara za ljude su otvorena vatra, iskre, vrućica, toksični proizvodi izgaranja, dim, smanjeni kisik, kolaps zgrada ili instalacija.
Izgaranje je fizikalno-kemijska reakcija koja se brzo odvija, praćena oslobađanjem topline i dima, pojavom plamena ili tinjajući. U normalnim uvjetima, izgaranje je proces oksidacije ili kombiniranja zapaljive tvari s atmosferskim kisikom. Međutim, neke tvari (na primjer, komprimirani acetilen, dušikov klorid, ozon) mogu eksplodirati bez kisika da bi se stvorila toplina i plamen. Prema tome, izgaranje može rezultirati reakcijama ne samo spoja, već i razgradnje. Također je poznato da vodik i mnogi metali mogu izgorjeti u atmosferi klora, bakra u parama sumpora, magnezija u ugljičnom dioksidu, itd.
Najopasnije izgaranje koje nastaje tijekom oksidacije zapaljive tvari s kisikom u zraku. Neophodno je imati izvor paljenja koji može napajati potrebnu količinu energije u sustav za gorivo. Najčešći izvori paljenja su: iskre koje se pojavljuju kod kvara električne opreme, udaranja metalnih tijela, zavarivanja, kovanja; toplina koju stvara trenje; tehnološki uređaji za grijanje; vatrogasni aparati; toplina adijabatske kompresije; iskrenje statičkog elektriciteta; pregrijavanje električnih kontakata; kemijske reakcije koje se odvijaju oslobađanjem topline.
Temperatura zagrijavanja ovih izvora je različita. Dakle, iskra koja nastaje kada se metalno tijelo udari može imati temperaturu do 1900 ° C, plamen meča je oko. 800 ° C, vodeći bubanj trakastog transportera tijekom klizanja je do 600 ° C, a u toplini električnog pražnjenja temperatura doseže 10.000 ° C, s gotovo trenutnim kemijskim reakcijama.
Burning može biti potpun i nepotpun. Uz potpuno izgaranje, koje se događa s viškom kisika, reakcijski produkti su ugljični dioksid, voda, dušik, sumporni dioksid. Nepotpuno sagorijevanje nastaje zbog nedostatka kisika, u ovom slučaju su proizvodi izgaranja otrovne i zapaljive tvari - ugljični monoksid, alkoholi, ketoni, aldehidi itd. Za potpuno izgaranje zapaljive tvari potrebna je određena količina zraka: 1 kg drva - 4,18, treseta - 5 kg , 8, propan - 23,8 m3.
Postupak izgaranja može se zamisliti na sljedeći način. Grijani hladni medij s uvođenjem toplinskog impulsa se zagrijava, dolazi do intenzivne oksidacije zapaljivog medija s kisikom i dodatnim oslobađanjem topline. To, zauzvrat, dovodi do zagrijavanja susjednog sloja zapaljivog materijala, u kojem također dolazi do intenzivne kemijske reakcije. S takvim slojem po sloju izgaranja zapaljive tvari, zona izgaranja se pomiče; Brzina tog kretanja određuje intenzitet procesa izgaranja i njegova je najvažnija karakteristika. Proces slojevitog grijanja, oksidacije i izgaranja se nastavlja sve dok se ne potroši cijeli volumen zapaljivog materijala.
Uska zona u kojoj se tvar zagrijava i odvija se kemijska reakcija naziva se prednji dio plamena.
Gorivi sustavi mogu biti kemijski homogeni i heterogeni. Kemijski homogeni sustavi su mješavine zapaljivih plinova, para ili prašine s zrakom, u kojima su zapaljiva tvar i zrak jednoliko miješani. Spaljivanje takvih sustava naziva se homogeno. U kemijski nehomogenim sustavima, zapaljiva tvar i zrak nisu miješani i imaju sučelje. To su često čvrsti zapaljivi materijali i njihovo izgaranje se naziva heterogenim.
Ukupno vrijeme sagorijevanja gorive smjese Tg je zbroj vremena potrebnog za kontakt između gorive tvari i kisika τ k, te vrijeme u kojem se kemikalija odvija, oksidacijska reakcija τ x
Ovisno o omjeru ova dva pojma razlikuju se difuzija i kinetičko sagorijevanje. Prilikom sagorijevanja čvrstih zapaljivih tvari, vrijeme potrebno za prodiranje kisika (difuzno) na površinu tvari je mnogo dulje od vremena kemijske reakcije, stoga je ukupna brzina sagorijevanja u potpunosti određena brzinom difuzije kisika u zapaljivu tvar. Spaljivanje takvih tvari najčešće se javlja na požarima i naziva se difuzno. Izgaranje, čija je brzina određena brzinom kemijske reakcije, naziva se kinetička. Ovaj tip izgaranja karakterističan je za homogene gorive sustave.
Razlikovati kalorimetrijsku, teoretsku i stvarnu temperaturu gorenja.
Kalorimetrijska temperatura sagorijevanja odnosi se na temperaturu na koju se zagrijavaju proizvodi potpune sagorijevanja, ako se sva oslobođena toplina troši na njihovo zagrijavanje, količina zraka teoretski je potrebna, supstance su potpuno izgorjele i početna temperatura je 0 ° C. Pretpostavlja se da su gubici topline jednaki nuli. Ako je početna temperatura goriva i zraka 0 ° C, tada je kalorimetrijska temperatura izgaranja
![]()
gdje je Qn neto kalorična vrijednost zapaljive tvari, kcal / kg; V je volumen proizvoda izgaranja, m3 / kg; c je prosječna volumna toplinska snaga produkata izgaranja, kcal / m3 · deg.
Prema tome, kalorimetrijska temperatura sagorijevanja ovisi samo o svojstvima zapaljive tvari i ne ovisi o njezinoj količini. Teoretska temperatura izgaranja uzima u obzir gubitak topline tijekom izgaranja da se disocira. Kalorimetrijska temperatura pečenja je najviša za zapaljivu tvar i koristi se za kvalitativnu procjenu. U stvarnosti, kada se gori, uvijek postoje gubici topline zbog zračenja, zagrijavanja viška zraka i okoliša.
Stvarna temperatura pečenja je temperatura požara. Razlikujte temperaturu unutarnje i vanjske vatre. Temperatura vanjske vatre je temperatura plamena, a unutarnja temperatura je temperatura dima u prostoriji. Stvarne temperature koje se razvijaju u slučaju požara zbog gubitka topline u okolišu, zagrijavanja proizvoda i struktura izgaranja
uvijek manje od teorijske za 30 ... 50%. Na primjer, teoretska temperatura sagorijevanja benzina je 1730 ° C, a stvarna temperatura je 1400 ° C.
Mješavina zapaljivih para i plinova s oksidirajućim sredstvom može gorjeti samo s određenim sadržajem goriva u njemu.
Najniža koncentracija zapaljivog plina kod kojega je već moguće izgaranje naziva se donja granica koncentracije zapaljenja (LEL). Najviša koncentracija pri kojoj je izgaranje još uvijek moguće naziva se gornja granica koncentracije paljenja (AIPW). Područje koncentracije koje se nalazi unutar tih granica naziva se područje paljenja. Paljenje je vatra (početak paljenja), praćena pojavom plamena. To je postojano dugo spaljivanje, koje se ne zaustavlja ni nakon uklanjanja izvora paljenja. Vrijednosti donje i gornje granice paljenja ovise o svojstvima plina, pare i prašine smjesa zraka, sadržaju inertnih komponenti u zapaljivoj smjesi. Dodavanje inertnih plinova zapaljivoj smjesi sužava područje zapaljenja i na kraju ga čini nezapaljivim. Značajno sužava granice paljenja, neke nečistoće koje usporavaju reakciju izgaranja. Najaktivniji su halogenirani ugljikovodici. Obje označena svojstva koriste se za zaustavljanje paljenja. Smanjenje tlaka smjese ispod atmosferskog tlaka također sužava područje paljenja, a pri određenom tlaku smjesa postaje nezapaljiva. Povećanje tlaka zapaljive smjese proširuje područje paljenja, ali, u pravilu, blago. Povećanje temperature zapaljive smjese proširuje područje paljenja. Na koncentraciju paljenja utječe i snaga izvora paljenja.
Ne postoje samo koncentracije, već i temperaturne granice paljenja.
Temperaturne granice za paljenje para u zraku su temperature zapaljivih tvari kod kojih zasićene pare tvore koncentracije koje odgovaraju donjoj ili gornjoj granici koncentracije paljenja. Temperatura paljenja je najniža temperatura pri kojoj se tvar zapali ili počne tinjati i nastavlja gorjeti ili tinja nakon uklanjanja izvora paljenja. Temperatura paljenja karakterizira sposobnost tvari za samozapaljenje. Ako je temperatura paljenja tvari odsutna, tada se ona naziva polagano ili nezapaljivo.
Ubrzanje oksidacijske reakcije pod djelovanjem temperature dovodi do samozapaljenja. Za razliku od procesa paljenja, u kojem se zapali samo ograničeni dio volumena - površina - samozapaljenje javlja se u cijelom volumenu tvari. Pod temperaturom samozapaljenja podrazumijeva se najniža temperatura, kojoj se tvar mora zagrijati, tako da se ona zapali kao rezultat daljnje auto-oksidacije. Samozapaljenje je moguće samo ako količina topline koja se oslobađa tijekom procesa oksidacije prelazi ispuštanje topline u okoliš.
Temperatura samozapaljenja za tvar nije konstantna, jer u velikoj mjeri ovisi o uvjetima njezina određivanja. Za dobivanje usporednih podataka standardizirana je ispitna naprava i metoda za određivanje temperature samozapaljenja plinova i para (GOST 13920-68). Najniža temperatura određena standardnom metodom, na koju se mješavina plinova i para s zrakom mora ravnomjerno zagrijati kako bi se mogla zapaliti bez uvođenja vanjskog izvora paljenja u nju, naziva se standardna temperatura samozapaljenja.
Vrsta spontanog paljenja je spontano izgaranje, tj. Izgaranje kao rezultat samozagrijavanja bez utjecaja izvora paljenja. Razlika između spontanog paljenja i spontanog izgaranja je u veličini temperature. Spontano izgaranje se događa na temperaturi okoline, a za samozapaljenje potrebno je zagrijavanje tvari izvana.

 Prijem indikatora brojača tople i hladne vode
Prijem indikatora brojača tople i hladne vode Izračunavanje površine zračnih kanala različitih oblika i fitinga
Izračunavanje površine zračnih kanala različitih oblika i fitinga Kemija procesa izgaranja. Energija eksplozije
Kemija procesa izgaranja. Energija eksplozije Što će se dogoditi ako ne šaljete očitanja brojila
Što će se dogoditi ako ne šaljete očitanja brojila