Изгарянето се нарича. Химични процеси при горене
Някои основни определения
Броят на атомите и молекулите е удобно изразен чрез количества вещества или броят на моловете от веществото, Един мол материя отговаря на 6.023 ∙ 10 23 частици (атоми и молекули). Числото N A = 6.023 23 10 23 mol -1 се нарича Авогадро число. Кръвна фракция x iкомпонент аз е отношението на броя на моловете n аз компонент аз към общия брой на моловете n =. n аз смеси ( x i = п i / n).
тегло m е основно свойство на веществото (единицата за измерване в системата SI е килограм). Масовата част Wi е съотношението на масата m i компонент аз до общата маса на сместа m = ∑ m i (Wi = m i / m).
Молекулно тегло (или молекулно тегло) М аз(g / mol) компонент аз - е масата на един мол от този компонент. За атомния въглерод, молекулярния водород, кислорода и метана имаме: M c = 12 g / mol, Mn2 = 2 g / mol, Mo2 = 32 g / mol, Mn 4 = 16 g / mol. Средната моларна маса на сместа М (g / mol) може да бъде изразена като моларни части на компонентите (М = x i M i).
Определяне на горивни процеси
изгаряне - Това е сложен физико-химичен процес, при който запалими вещества и материали под въздействието на високи температури влизат в химично взаимодействие с окислител (кислород във въздуха), превръщайки се в продукти на изгаряне, който се съпровожда от интензивна топлинна и светлинна емисия.
Условията, необходими за възникването на горивния процес:
Наличие на запалимо вещество (GV);
Наличието на окислител (О.) - кислород на въздуха;
Наличие на източник на запалване (I.Z.).
Запалимият материал трябва да бъде загрят до определена температура, при която ще започне процесът на окисление;
За нагряване на запалимо вещество до определена температура се изисква определена мощност на източника на запалване;
За поддържане на горивния процес са необходими определени концентрации на гориво и окислител.
Най-важните горивни процеси са пренос на топлина и маса. Най-често срещаното свойство на изгаряне е появата на пламък и преместването му през горивната смес чрез прехвърляне на топлина или дифузия на активните частици от зоната на горене към свежа горивна смес.
пожар - Това е видима проява на изгаряне. Тя се нарича още зона на изгаряне. Това е частта от пространството, където се случва превръщането на горивната смес в продукти на пълно и непълно изгаряне.
Основните параметри на горивния процес, водещи до смърт и причиняване на материални щети, са:
Голямо количество топлина;
Висока температура;
Токсичен състав на продуктите от горенето.
Процесът на горене от гледна точка на молекулярната кинетична теория на газовете
Фиг. 2.1. Пропорцията на активните молекули в зависимост от температурата: T 2\u003e T 1
Когато се нагрява газ горивна смес в него увеличава излишната енергия.
Разликата между средното енергийно ниво на молекулите в активното състояние и средното ниво на неактивното състояние се нарича енергията на активиране. Това може да бъде представено графично (фиг. 2).

Фиг. 2.2. Енергийна диаграма на курса на реакция G.V. + O. ® PG: E акт - енергия на активиране; Q xr - термичен ефект на реакцията на горене
Енергията, освободена в резултат на взаимодействието на "първите" реагирали молекули, се прехвърля към съседните молекули. Те са развълнувани, процесът се повтаря около реакционните молекули с голяма честота и интензивност. Започва самоподдържащ се, самоускоряващ се към цялата реакционна смес (2H 2 + O 2) процес на химично взаимодействие, придружен от образуването на водни молекули и отделянето на топлина в околната среда и придружен от луминесценция, т.е. възниква и разпространява горенето.
Колкото по-висока е числената стойност на акта Е, толкова по-трудно е тази двойка компоненти да влезе в химическо взаимодействие. Следователно стойността на Е акт е индиректен показател за степента на опасност от пожар на тази химическа система.
Видове и режими на горене
Горенето може да се класифицира по следните параметри:
1. Според състоянието на смесване на горивни компоненти:
а) кинетична - изгаряне на смеси от предварително смесен газ или пара-въздух. Тъй като сместа от гориво и окислител е готова за горене, докато се запали, общата скорост на горивния процес зависи само от скоростта на химическата реакция на горене. Ако такова горене се случи в затворен или ограничен обем, тогава може да възникне експлозия. Тъй като енергията, отделена по време на горенето на сместа, няма време да бъде изхвърлена извън този обем, чрез увеличаване на налягането, структурите могат да бъдат унищожени;
б) дифузия, дифузионното горене се нарича горене, когато образуването на горима среда (смес от гориво и окислител) се случва преди зоната на горене или в зоната на горене.
2. В зависимост от интензивността на постъпването на горивни компоненти в зоната на химичната реакция:
а) ламинарен, докато компонентите на горивната смес влизат в зоната на горене относително спокойно. В този случай числената стойност на критерия на Рейнолдс, която характеризира термодинамичния режим, ще бъде значително по-малка от критичната (Re<2300).
б) турбулентно, като компонентите на горивната смес влизат в горивната зона при висока скорост. Числото на Рейнолдс в този случай е повече от 2300.
3. Според състоянието на агрегиране на компонентите на горивната смес:
а) хомогенно гориво и окислител са в едно и също агрегатно състояние (газообразно);
б) хетерогенна (многофазна) - гориво и окислител в различни агрегативни състояния.
4. За скоростта на разпространение на зоната на химическа реакция на горене:
а) дефлаграционно (бавно) разпределение на зоната на химичната реакция (скорост от 0.5 до 50 m / s);
б) детонация (експлозив), когато зоната на химическа реакция на горене се разпространява със скорост на ударна вълна (от няколко стотин метра в секунда до няколко километра в секунда).
Мястото, в което изгарят парите или газовете, се нарича от пламък .
Ламинарните пламъци са предварително смесени. При ламинарен пламък на предварително смесена смес, горивото и окислителят се смесват преди началото на горенето и потокът е ламинарен.
Пламъкът на смесената смес се нарича стехиометрично ако горивото (въглеводород) и окислителят (кислород - O 2) се консумират напълно, образувайки въглероден диоксид (CO 2) и вода (H 2 O). Ако има излишък на гориво, те казват, че сместа е богата, и ако има излишък на окислител, те казват, че сместа е лоша.
Разгледайте най-простите примери:
1) 2H 2 + O 2 → 2H 2 O - стехиометрична смес,
2) ЗН 2 + О 2 → 2Н 2 O + Н 2 - богата смес (Н 2 в излишък),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - суха смес (O 2 в излишък).
Всеки символ в такова уравнение на химична реакция съответства на един мол от веществото. Следователно, първото от тези уравнения означава, че две мола Н2 реагират с един мол от О2, за да образуват два мола Н20.
Ако уравнението на химическата реакция е написано по такъв начин, че описва реакцията само на един мол гориво, тогава молната част на горивото в стехиометричната смес може лесно да се определи от съотношението
х планини, stokh = 1 / ((1 + v)
тук vозначава броя на моловете О2 в уравнението на реакцията с образуването на С02 и Н20. Пример за това е реакцията
Н2 + 0.5О2 → Н20, v = 0.5, х H2, стох = 2/3
Ако окислителят е въздух, трябва да се има предвид, че сухият въздух съдържа само 21% кислород, както и 78% азот и 1% благородни газове. Така, за въздух, XN2 = 3.762 XO2. От тук моларните фракции за стехиометрична смес с въздух ще бъдат равни
х планини, стох = 1 / (((1 + v 76 4.762), ![]() ,
,
където v както и преди означава броя на моловете на О2 в уравнението на реакцията за пълно превръщане на един мол от гориво в CO 2 и Н 2 О. Някои примери за стойности v и моларните части на горивото за стехиометрични смеси на гориво с въздух са показани в Таблица 1.
Предварително смесени смеси от гориво и въздух (в този случай трябва да се добави подходящо количество N 2 към уравнението на реакцията, виж Таблица 1) се характеризира с коефициент на еквивалентност за въздуха:
λ = (x w / x планини) / (x w, стох / х планини, сто) = (w w / w планини) / (w w, stoch / w планини, стох)
или реципрочната - съотношението еквивалент за горивото Ф (Ф = 1 / λ). Тази формула може да се трансформира, за да може да се определи величината на моларните части на сместа по стойност Ф:
х планини = 1 / ((1+ (4 762) v) / F), x w = 1 - x планини,
X тегло / 4,762, = 3,762
Примери за v стойности и молни фракции на горивото х планини, стоичи за стехиометрични смеси от гориво с въздух
напояването винаги е придружено от химически трансформации. Горене във въздуха - взаимодействието на запалимо вещество с кислорода. Трябва да се има предвид обаче, че оксидите на азота, халидите и озонът могат да действат като окислители в процеса на горене. Известни са процеси на горене с участието на само един източник на продукта - съединения, способни на бързо разлагане. Примери за такива съединения са ацетилен и хидразин.
Химичните процеси, протичащи по време на горенето, са изключително сложни. Дори и за най-простия случай - изгарянето на водород в кислорода, обобщеното уравнение на което има формата
2Н 2 + 0 2 = 2Н 2 0,
установени и проучени са няколко десетки елементарни етапа.
Досега механизмите на химични трансформации при изгарянето на само няколко вещества, като водород, въглероден оксид, метан и етан, са изследвани достатъчно подробно. Това знание се използва за прогнозиране на условията на запалване и горене на много вещества.
2.1. Верижни реакции
Верижните реакции, за разлика от обикновените химически трансформации, се характеризират с появата във всеки елементарен акт на активна частица: атом с несдвоен електрон, свободен радикал или йон. Появата на активни частици предизвиква верига от трансформации на изходните материали в реакционни продукти. Атомите, свободните радикали и йони са по-реактивни, отколкото валентно-наситените молекули. Следователно, въпреки значителните енергийни разходи, необходими за прекъсване на химическите връзки и образуването на активни частици, развитието на веригата на реакцията често се оказва енергийно по-благоприятно от директното взаимодействие между молекулите.
Горивните процеси протичат главно чрез верижен механизъм. Верижни реакции - комплексни реакции, които протичат в няколко етапа, представляващи:
Произходът на веригите (иницииране), в който се образуват активните частици;
Продължаването на веригите, в които активните частици влизат в химично взаимодействие с изходните материали, в резултат на което се образуват нови активни частици;
Счупване на вериги, при което "смъртта" на активните частици настъпва с образуването на крайните реакционни продукти
Произходът на веригите може да възникне при различни условия. Например, в резултат на дисоциация на молекули под действието на топлинна енергия, или йонизиращо лъчение, в електрически разряд. Смъртта на активните частици се случва, когато те се рекомбинират *, когато свободните радикали взаимодействат (хомогенно счупване на веригата), когато активните частици взаимодействат с твърди повърхности (хетерогенно счупване на веригата) или в резултат на реакцията им с инхибитори на горенето.
Има неразклонени и разклонени верижни реакции. В неразклонената за всяка активна частица, консумирана в реакциите на продължаване на веригата, има едно ново възникване. Броят на продуцираните молекули, образувани за начална активна частица, се нарича дължина на веригата. Дължината на веригите в реакциите на горене варира от стотици хиляди до десетки милиони. Скоростта на неразклонените верижни реакции може да бъде повлияна от незначителни примеси на вещества, които могат ефективно да взаимодействат с активни частици, като инхибитори на горенето.
Някои вещества - инициатори - улесняват образуването на активни частици и по този начин ускоряват неразклонените верижни реакции.
В реакции с разклонена верига към една активна частица, консумирана с продължаването на веригата, се образуват две или повече активни частици. Един от тях продължава първичната верига, докато други започват нови вериги, образувайки разклонение (фиг. 2.1).
"Рекомбинацията е процесът на образуване на неутрални атоми или молекули от заредени частици. Атомите и молекулите, които се образуват по време на рекомбинацията, могат да бъдат в земно или вълнуващо състояние.
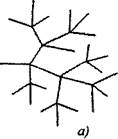
Фиг. 2.1. Схематично представяне на реакционните вериги:
а) разклоняване във всяка връзка на веригата
6) редки разклонения
Например, по време на горенето на водород в реакцията на лансиране на веригата:
образува се активен атом. В реакцията на продължаване на веригата:

има увеличение на броя на активните атоми, които са началото на нови вериги.
Реакциите с разклонена верига могат да протичат в стационарен режим, при който скоростта на разклоняване е по-малка от скоростта на смърт на активните частици и в нестационарната, при която смъртта настъпва по-бавно от разклонението. В последния случай, скоростта на верижната реакция нараства експоненциално и е ограничена само от консумацията на изходните материали. Преходът от стационарен към нестационарен режим протича внезапно с лека промяна в условията на реакцията: температура, налягане или концентрация на един от реагентите. Такова бързо ускорение се счита за самозапалване на реакционната смес или на верижна експлозия.
Откриването на реакции с разклонена верига е от голямо значение за създаването на теория на горивните процеси. Доказано е, че има два вида запалване: топлинна и верижна. Моделите са поставени
Глава 2. Химични процеси при изгаряне
теорията на верижните процеси може ефективно да влияе върху развитието и потискането на горивните процеси по време на пожари.
Произходът на веригите.Процесът на нуклеация на началните активни центрове играе голяма роля в развитието на неразклонени верижни реакции. Той компенсира загубата на активни центрове по време на реакциите на прекратяване на веригата. Този механизъм определя условията за формиране на стационарен режим в началния период на натрупване на активни центрове. С малка скорост на започване този период може да бъде значителен.
Повечето от химичните реакции в пламъците имат значителен енергиен резерв от активни центрове. При тези условия инициирането на активни центрове е свързано с преодоляване на значителна енергийна бариера.
В този случай важна роля играят фактори, които осигуряват значителен темп на възникване на активни центрове: химически активни добавки, радиация, електрически разряд, продукти с радиоактивен разпад.
Сред факторите, които значително улесняват генерирането на активни центрове, трябва да се отбележат хетерогенни реакции. В молекулите на горимите вещества, адсорбирани на твърда повърхност, междуатомните връзки са отслабени и тяхното разрушаване изисква по-малко енергийни разходи. При тези условия скоростта на генериране на активни центрове е значително по-висока, отколкото в обема на газа. Енергията на активиране при хетерогенното взаимодействие на компонентите на горивната смес също е по-ниска, отколкото в случая на хомогенна. Хетерогенното иницииране на активни центрове в условията на действителни горивни процеси е важен фактор за ускореното постигане на стационарен режим с неразклонени верижни процеси.
Някои характеристики характеризират неразклонени верижни реакции, които се случват с участието на атомни компоненти. При отсъствие на примеси, взаимодействащи с активни центрове без регенерация, завършването на веригата става възможно само когато атомите се рекомбинират чрез тройни сблъсъци и на повърхността.
При всяка температура всички газообразни вещества се разделят частично. Някои от молекулите се разпадат на атоми. В този случай съществува равновесие между процесите на дисоциация и обединението на атоми в молекули. Степента на дисоциация експоненциално зависи от температурата.
Ако в горивната смес няма замърсявания, разрушаващи веригите, концентрацията на атомните компоненти на реакцията остава практически непроменена. Атомите, които влизат в реакцията, веднага се регенерират в същите
Королченко А.Я. Процеси на горене и експлозия
lichestve. Първоначалното иницииране компенсира реагиралите атоми в същото количество, както в нереактивната система. Стационарната реакция не влияе на този процес. Балансът на един от компонентите на реакцията, който се отличава с най-малката връзка между атомите в молекулата, е характерна особеност на този режим. Концентрацията на друг атомен компонент в този случай е квазистационарна, но по-равновесна.
С хомогенното иницииране на реакциите на горене, стационарният режим ще се установи само след определен период от време, тъй като дисоциацията изисква голяма енергия на активиране. През този период скоростта на дисоциация надвишава скоростта на рекомбинация и активните центрове се натрупват в реакционната система. Скоростите на двата процеса се сравняват само след повишаване на концентрацията на активните центрове до равновесие. Този период от време се нарича индукционен период.
Наличието на твърда повърхност като катализатор в реакционната зона не променя състоянието на термодинамичното равновесие. Катализаторът се отразява еднакво върху напред и назад реакции. Активните центрове не само произхождат от твърда повърхност, но и се разпадат. Присъствието на катализатор обаче ускорява постигането на равновесно дисоциационно състояние.
Ако в горивната смес присъстват активни вещества, които могат да участват в реакциите на счупване на веригата, те намаляват концентрацията на активните центрове. В този случай се нарушава равновесното разпадане на един от първоначалните компоненти, което забавя реакцията и може да доведе до неговото прекратяване.
Експериментите показват, че когато се инициира неразклонена верижна реакция от външен източник (например светлинен източник), концентрацията на активните центрове в началния етап на развитието на горивния процес може значително да надвиши равновесното.
По време на реакциите с разклонена верига, условията на първоначално иницииране оказват значително влияние върху развитието на реакцията. При бавно движещите се процеси добавянето на частично реагирала смес към първоначалната съкращава периода на индукция и ускорява момента на горене на пламъка.
Продължаването на веригите.Характерна особеност на неразклонените верижни реакции е квазистационарността на концентрацията на активните центрове. При отсъствие на отворена верига, активните частици се образуват
Глава 2. Химични процеси при горене
същата сума, в която се изразходват. Новото възниква само при първоначалното иницииране. С еднакви скорости на генериране на активни центрове и завършване на веригата се установява постоянна концентрация на активни центрове и стационарен реакционен режим. Скоростта на реакцията ще намалее с изчерпването на началните компоненти.
В случай на разклонена верижна реакция, концентрацията на активните центрове в реагиращата система нараства независимо от условията на тяхното първоначално започване. Реализира се самоускоряващ се реакционен режим, който има лавинен характер. В този случай, за пълното превръщане на изходните компоненти в крайните продукти на реакцията, един начален активен център е достатъчен.
Кинетичното уравнение на разклонена ценна реакция е следното. Промяната в концентрациите на стабилните изходни компоненти с течение на времето може да бъде пренебрегната до първото приближение и могат да бъдат взети под внимание само по-бързи промени в концентрацията на активните центрове. п.Промените в тази скорост се определят от скоростта на първоначално иницииране и съотношението на скоростите на реакциите на разклоняване и завършване на веригата. Началната скорост на иницииране не зависи от концентрацията на активните центрове в системата. Скоростите на разклоняване и процеси на разрушаване са пропорционални на концентрациите на активните центрове. При тези условия общият баланс на образуването и разхода на активните центрове се определя от сумата на скоростите на процесите на иницииране, разклоняване и счупване:
![]() (2.1)
(2.1)
където и са константи на скоростта на разклоняване и реакции на счупване. Обозначавайки, получаваме:
![]() (2.2)
(2.2)
Когато времето производно на концентрацията на активни центрове
е положителна. Скоростта на реакцията се увеличава с времето. Тази характеристика на реакциите с разклонена верига се дължи на размножаването на активните центрове в такива режими, когато скоростта на реакцията на разклоняване надвишава скоростта на реакцията на завършване на веригата.
Королченко А.Я. Процеси на горене и експлозия
Ако преди началото на реакцията системата не съдържа активни центрове, т.е. прит= 0, n = 0 интеграция на уравнение (2.2) дава:
![]() (2.3)
(2.3)
Общата скорост на реакцията на СО се определя от скоростта на процеса на разклоняване. Крайните продукти се образуват само по време на тази реакция. За всяко елементарно верижно разклонение се образуват молекули на крайния продукт. От това следва:
![]() (2.4)
(2.4)
Развитието на верижна реакция във времето се определя от съотношението на константи на скоростта на реакциите на разклоняване и завършване на веригата, и когато показателят в уравнение (2.4) е положителен и
действието е безкрайно ускорено. В началния период на развитие на реакцията се поддържа следната връзка:
Поради факта, че скоростта на първоначално иницииране е малка, няма забележима химична трансформация в началния период. След известно време стойността става значително по-голяма от единица. След това скоростта на реакцията в съответствие с уравнение (2.4) започва да нараства бързо и достига много големи стойности, въпреки че преди това е била практически незабележима.
Наличието на период на забавяне (индукционен период) по време на развитието на верижна реакция се дължи на необходимостта от натрупване на определен брой активни центрове в реагиращата система. Едва след тази химична трансформация става забележима.
Величината на индукционния период в верижните реакции определя съотношенията на скоростите на разклоняване и верижните процеси, а не скоростта на първоначално иницииране. От своя страна, скоростите на разклоняване и реакции на счупване се дължат на химичните характеристики на всяка реагираща система, те се определят от зависимости от температурата и концентрациите на изходните компоненти. Особеността на верижните реакции за
процесът на разклоняване изисква значителна енергия на активиране, докато температурният коефициент на константата на скоростта на процеса на счупване е близо до нула. В реакциите на прекратяване на веригите на трите вида: при насипни и хетерогенни рекомбинации, при взаимодействието на радикали с активни примеси, енергиите на активиране са нула.
При повишаване на температурата, общото налягане на сместа или промяна в концентрацията на реагиращите компоненти е възможна промяна в константи на разклоняване и счупване, при която реакцията се променя от стационарно към нестационарно. Особеността на този процес се състои в рязкото преминаване от един режим към друг, при промяна на скоростта на реакция от незначителна стойност към неограничено увеличаваща се.
Потокът на някои верижни реакции е придружен от образуването на междинни продукти, които са сравнително стабилни, но с възможност за генериране на активни центрове. Такива реакции включват, например, реакции на горене на въглеводороди, като междинни съединения, в които се образуват пероксиди и алдехиди. Това води до разклоняване на веригата. Обаче, поради относителната стабилност на междинните продукти, ускоряването на реакцията се простира във времето. Такива бавно разклоняващи се вериги се наричат изродени.
Верижните реакции с обичайния радикален разклонителен механизъм, като правило, поради високата активност на радикалите, протичат доста бързо. Получените радикали или инициират бързо ускоряваща реакция, или рекомбинират и излизат от процеса.
Отворена верига Активната частица, като всяка газова молекула, прави случайни движения вътре в реагиращата система, сблъсквайки се с други молекули. В същото време съществува известна вероятност при някакъв сблъсък на взаимодействие с друга активна частица или молекула и образуването на нова активна частица, продължавайки пътя на предишната. Развитието на реакционната верига е подобно на брауново движение на инертни молекули, въпреки че прехвърлянето на активните центрове е придружено от химическа реакция. По пътя на развитие на веригата се сменят активните центрове на два или повече типа.
Королченко А.Я. Процеси на горене и експлозия
Веригата от реакции продължава до момента, в който активната частица не реагира без регенерация. В този случай възниква така наречената отворена верига. Процесите на счупване играят голяма роля в кинетиката на верижните реакции. Има два вида реакции, водещи до смърт на активни центрове:
Хомогенно разкъсване (смърт в обема на реакционната смес);
Хетерогенно разкъсване (смърт на твърда повърхност) Хомогенно разкъсване на вериги е възможно с един от двата процеса:
когато радикалите се рекомбинират или когато различни химически активни компоненти взаимодействат с активните центрове без регенериране на последните.
Хетерогенното счупване на веригата се наблюдава върху частици сажди, образувани по време на горенето, или върху повърхността на твърди горивни материали. Отворена верига на твърда повърхност може да се разглежда като дифузия на активни центрове от газовата смес към тази повърхност, върху която те изчезват. Механизмът на рекомбинация върху твърда повърхност е, че активната частица, която има повишена реактивност, се сорбира * на повърхността. Радикалите, които се сорбират на съседните места, се рекомбинират помежду си, тъй като няма енергийни и пространствени пречки за този процес. Молекулите на стабилни съединения, образувани в резултат на рекомбинация, вече не участват в развитието на верижна реакция.
Обаче, не всеки сблъсък на активна частица с твърда повърхност води до неговата адсорбция. Може би отражението му от повърхността. Вероятността за адсорбция на активен център от твърда повърхност се нарича коефициент на настаняване. Този коефициент е характеристика на химичния афинитет на активната частица и повърхността. В практически важни случаи активната частица след отразяване от стената не се отдалечава далеч от нея. Съществува вероятност от нови сблъсъци със стената, докато настъпи нейното настаняване. Поради този процес, при определени условия, скоростта на реакцията е практически независима от коефициента на настаняване. Процесът протича по такъв начин, както ЕС
* Сорбция - абсорбция от твърдо тяло (или течност) на вещество ха на околната среда. Абсорбиращото тяло се нарича сорбент, абсорбира се- сорбат. Разграничават абсорбцията на цялата маса на сорбента (абсорбция) и повърхностния слой (адсорбция). Сорбцията, дължаща се на взаимодействието на химичния тип между повърхността на твърдия сорбент и сорбата, се нарича хемосорбция.
__________________________ Глава 2. Химични процеси при горене
ако при всеки сблъсък настъпи отворена верига. Концентрацията на активните центрове на повърхността може да се приеме за нула.
В отсъствието на активни примеси в реакционната смес, счупването на веригите може да се случи или на твърди повърхности, или хомогенно чрез рекомбинация на радикали в обема. В реалните пожари вторият начин се прилага главно.
Определено влияние върху кинетиката на верижните реакции имат добавките в реагиращата система на инертните газове. Инертните добавки увеличават броя на сблъсъците с активни частици, увеличават вероятността от счупване на веригата и съответно възпрепятстват цялостната реакция.
По-ефективно инхибиране на верижните реакции се постига с въвеждането на реактивни добавки - инхибитори в реакционната смес. Инхибиторите взаимодействат с активните центрове, водещи реакцията, разкъсвайки веригата. Кинетиката на реакцията в инхибирана смес се определя от условията на конкуренция между инхибитора и основните компоненти на реакцията при взаимодействие с активни центрове. С високата ефективност на инхибитора и умерената скорост на генериране на нови активни центрове, вече малки добавки на инхибитора могат напълно да потиснат хода на верижната реакция.
Процесите на инхибиране са от голямо значение в практиката на пожарна и експлозивна безопасност. Използването на инхибитори ви позволява ефективно да влияете върху горивните процеси.
2.2. Химични процеси при изгаряне на водород
Взаимодействието на молекула водород с молекула кислород протича сложно чрез серия от последователни етапи. Сега е твърдо установено, че изгарянето на водород става чрез верижен механизъм, като частиците играят ролята на активни центрове. Последователността и значимостта на елементарните реакции при изгарянето на водорода са описани много подробно за различни условия за възникване и развитие на водородни пламъци.
Най-подробният анализ на процеса на изгаряне на водорода в режим на самозапалване с експериментални и изчислителни методи е извършен от проф. А. Н. Баратов. Той предложи следната схема на процеса, включително четиринадесет основни елементарни реакции:
Королченко А.Я. Процеси на горене и експлозия
Произходът на активните центрове се получава чрез реакция
![]()
Продължаване на веригата от реакции
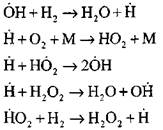
Разклонителни вериги
 |
отворена верига
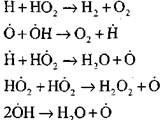 |
Концентрацията на водородните атоми в началния етап на процеса на самозапалване е незначителна част от първоначалното съдържание на водород. С развитието на верижна реакция скоростта на превръщане на молекулен водород става толкова висока, че се консумира в стотни от секундата.
2.3. Химични реакции при изгаряне на въглероден оксид
Взаимодействието на въглеродния монооксид с кислорода е основна реакция за горивните процеси. По време на тази реакция
__________________________ Глава 2. Химичен процеспри изгаряне
много случаи определя законите на изгаряне на въглерод-съдържащи вещества. Реакцията се характеризира с механизъм с разклонена верига. Той има редица функции.
Дълго време имаше убеждение, че една напълно суха смес от СО и 0 2 не може да се запали и изгори. Обаче внимателно поставените експерименти, при които отсъствието на вода се наблюдава с помощта на мас спектрограф, показва, че запалването също е възможно за суха смес. Трябва да се отбележи, че наличието на CO + 0 2 водна пара или водород в системата активира процеса на запалване и горене чрез увеличаване на броя на възможните активни центрове. Ускоряващият ефект на водата е особено забележим при ниски концентрации.
Изгарянето на въглероден оксид в присъствието на водни пари или малки добавки на водород се извършва с участието на следните елементарни процеси:

Радикалите, H02, които се образуват чрез реакция (VI), могат да продължат веригата (реакция VIII) или да доведат до нейното разкъсване чрез реакция (IX-XII).
За да се оценят условията за преминаване на бавното окисление на СО към верижна експлозия, нека да се изчисли вероятността от прекъсване на веригата чрез радикала H0 2; тук вземаме предвид, че ролята на реакциите (X) и (XI) в прекратяването на веригата ще бъде незначителна по отношение на
в сравнение с реакцията (IX), тъй като константи на скоростта на процесите (IX-XI) при температури от порядъка на 1000 K са близки една до друга, но концентрацията на радикалите е много по-ниска от концентрацията на водородните атоми, тъй като радикалите имат по-висока химична активност. Следователно, вероятността за отворена верига чрез радикала H0 2 може да бъде записана във формата:
При температура от 1000K
Следователно при условие, че
![]()
![]()
амплитуден ефект
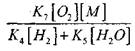
при решаване на уравнение (2.7) ще бъде слабо.
Глава 2. Химични процеси при горене
В случай на ![]() или
или ![]() (това, което се наблюдава в
(това, което се наблюдава в
реални пламъци СО), уравнение (2.7) се преобразува във формата:
![]() (2.8)
(2.8)
Така състоянието на изгаряне на въглероден оксид във въздуха до голяма степен се определя от наличието и моделите на изгаряне на водород. Окислението на СО чрез реакция (I) зависи от концентрацията на ОН радикали, образувани в реакциите, включващи водород.
Особеността на реакцията на изгаряне на въглероден оксид е в неговото бързо инхибиране, когато малки добавки се въвеждат в реактивната система на вещества с висок афинитет към водородни атоми. Такива вещества, които инхибират изгарянето на СО са халогениди и халопроизводни на въглеводороди. Техният инхибиращ ефект се дължи на прекратяване на реакционните вериги при взаимодействие с водородни атоми от реакцията
2.4. Изгаряне на въглеводороди
Изследването на горивните процеси на водород и въглероден монооксид показва сложността на реакционния механизъм. В случая на Н2 и СО, реакцията протича като верига с участието на много елементарни етапи и междинни продукти. Ето защо е естествено да се очаква, че механизмът на реакциите на горене на по-сложни вещества - въглеводороди - е още по-сложен и ефектите, съпътстващи процесите на запалване и изгаряне на тези съединения са по-разнообразни.
Наличната понастоящем информация за естеството на химическото повишаване на въглеводородите в процеса на тяхното изгаряне ни дава възможност да обясним наблюдаваните ефекти с известно приближение.
Установено е, че в въглеводородните пламъци, заедно с вече известните активни частици, има голям брой междинни продукти с по-сложна структура. В някои случаи те стават източници на появата на нови вериги. Основната роля в процесите на запалване и изгаряне на въглеводороди се играе от следните видове междинни съединения:
Королченко А.Я. Процеси на горене и експлозия
1. Въглеводородни радикали, които са молекули на
леводорода, която отстранява един или повече водородни атоми. тези
остатъци се наричат алкил (СНз-метил; С2Н5-етил; С3Н7-пропил и
и т.н.). Поради високата си реактивност, свободните алкили
не съществуват дълго време. Присъства в пламъци като междинен продукт
ПРАВИТЕЛСТВЕНИ продукти. При взаимодействие с други молекули се държи
като независима структурна група. Въглеводородни радикали
обикновено се представя с буквата R.
2. Пероксиди - съединения с обща формула R-00-R ".
3. Алдехиди - тип съединения
![]()
Най-простите алдехиди са мравчен (формалдехид) и оцетен (ацеталдехид) ![]() , Всички тези вещества са
, Всички тези вещества са
присъстват в продукти на непълно изгаряне на въглеводороди.
Образуването на веригата по време на горенето на въглеводороди може да бъде всяка реакция, при която се образуват въглеводородни радикали. Това може да бъде реакция на разлагане на молекулата етан с образуването на две свободни метилови групи:
![]()
или реакцията на въглеводород с кислород:
![]()
Продължаването на веригите възниква в резултат на реакции на образуване пероксид или хидропероксид:
![]()
Извършва се верижно разклоняване по време на разлагането на хидропероксид:
Глава 2. Химични процеси при горене
Дадената последователност от реакции води до постепенно увеличаване на концентрацията на пероксидни съединения в реагиращата система.
Едновременно с натрупването на пероксиди, радикали и начало
има паралелни реакции:

Тези реакции са екзотермични; когато текат голямо количество топлина.
При повишаване на температурата на реакционната смес ролята на активните центрове преминава от един междинен продукт към друг в следния ред: алкил хидропероксиди, ацил хидропероксиди, формалдехиди.
Експерименталните изследвания на промените в състава на реакционната смес във времето в областта на високите температури (600-800 ° С) показват, че процесът на превръщане на изходните въглеводороди в крайни продукти на горене се разделя на два етапа: първият, който се среща с много висока скорост, окислява въглеводородите до СО. На втория, бавен етап, СО се окислява до. Следва много важно заключение: много от законите на изгаряне на въглеводороди могат да се обяснят с характеристиките на изгарянето на въглероден оксид.
2.5. Горене на въглерод
Изгарянето на въглерода протича по механизма на хетерогенния процес, чиято специфичност се състои в това, че химичният етап не може да бъде разглеждан изолирано от процеса на прехвърляне на газообразен окислител (кислород от въздуха) от околното пространство към повърхността на горящо твърдо вещество. Скоростта на горене зависи както от химичните свойства на въглерода, така и от характеристиките, които определят процеса на подаване на кислород към повърхността на горивото. Подаването на кислород в зоната на горене се извършва чрез дифузия и следователно
Королченко А.Я. Процеси на горене и експлозия
зависи от много фактори: формата и размера на горящото тяло, движението на газообразната среда, коефициентите на дифузия на кислорода и реакционните продукти, както в пространството над повърхността на горивото, така и в пукнатини и пори, съдържащи се в въглища и кокс в значителни количества.
За илюстриране на характеристиките на хетерогенното изгаряне на въглерода, ние разглеждаме поведението на отделно парче въглища, поставено в пещ, загрята до температура от 900 ° С. В началния момент изгарянето на въглища ще се случи за сметка на кислорода, разположен близо до неговата повърхност. След като се използва, се образува слой от продукти на горенето около нагрятата повърхност. Скоростта на изгаряне ще намалее и процесът може да спре, ако няма кислород, идващ от по-отдалечени райони на газовото пространство.
Този поток протича чрез дифузия и скоростта на горене ще се определя от дифузионния поток. Интензивността на дифузията до голяма степен зависи от интензивността и характера на движението на газовата среда в близост до повърхността на изгаряне. Скоростта на химическата реакция се определя главно от температурата. Хетерогенните реакции, както и хомогенните, се подчиняват на закона на Арениус.
При високи температури окислителната реакция на въглерода протича много бързо и общата скорост на процеса ще бъде ограничена от дифузията на кислород към повърхността.
По този начин процесът на изгаряне на въглерода се състои от два процеса от различно естество: процесът на транспортиране на кислород от въздуха от газовото пространство до мястото на неговото потребление и процесът на неговото химично взаимодействие с повърхността на твърдия въглерод. И двата процеса са взаимосвързани, но всеки има свои собствени закони. Най-важният от тези процеси е процесът на консумация на кислород, който се характеризира с различни химични реакции.
Механизмът на комплексната реакция на комбиниране на кислород с въглерод се състои в едновременното образуване на два оксида на СО и С02 чрез междинен физикохимичен комплекс от тип C X 0 Y, който след това се разделя на CO и. Съотношението между тези оксиди зависи от условията на горене. Съответно уравнението за реакцията на изгаряне на въглерод може да бъде записано по следния начин:
Глава 2. Химични процеси при горене
След това протича хомогенна реакция на изгаряне на въглероден оксид:
механизмът на който е разгледан в раздел 2.3.
Тази реакция може да се проведе в близост до въглеродната повърхност, такаи вътре в въглищната маса, в порите и пукнатините.
Друга реакция е хетерогенна реакция между горещ въглерод и въглероден диоксид:
![]()
Тече с забележима скорост на места, където има недостиг на кислород, но където температурата на въглерода е достатъчно висока.
Комбинацията от описаните реакции определя състава на продуктите от горенето на въглерода.
ВЪЗСТАНОВЯВАНЕ НА ПРОЦЕСИ НА ГОРЕНЕ
| D |
поливането в запалими смеси може да настъпи в резултат на тяхното самозапалване, запалване чрез външен източник или спонтанно запалване. Ако процесите на самозапалване и запалване са характерни за вещества, които са в газообразно, течно или твърдо състояние, тогава спонтанно запалване е характерно за твърди материали (особено тези в фино разделено състояние) или висококипящи течности, разпределени по материали с развита повърхност.
3.1. Самозапалване. Стационарна теория
Пожар е неконтролирано изгаряне, което се развива във времето и пространството, опасно за хората и причинява материални щети.
Опасните пожари за хората са открит огън, искри, треска, токсични продукти на горене, дим, намален кислород, срутване на сгради или инсталации.
Горенето е бързо протичаща физико-химична реакция, придружена от отделяне на топлина и дим, поява на пламък или тлеене. При нормални условия, горенето е процес на окисляване или комбиниране на запалимо вещество с атмосферен кислород. Някои вещества (например, сгъстен ацетилен, азотен хлорид, озон) могат да експлодират без кислород, за да образуват топлина и пламък. Следователно, изгарянето може да бъде резултат от реакции не само на съединението, но и на разлагане. Известно е също, че водородът и много метали могат да изгорят в атмосферата на хлор, мед в серни пари, магнезий в въглероден диоксид и др.
Най-опасното изгаряне, което се случва по време на окислението на запалимо вещество с кислород във въздуха. Необходимо е да има източник на запалване, способен да доставя необходимото количество енергия в горивната система. Най-често срещаните източници на запалване са: искри, които се появяват при неизправности в електрическото оборудване, удряне на метални тела, заваряване, коване; топлина, генерирана от триене; технологични отоплителни уреди; противопожарни апарати; топлина на адиабатна компресия; искроизпускане на статично електричество; прегряване на електрически контакти; химични реакции, протичащи с отделянето на топлина.
Температурата на нагряване на тези източници е различна. Така че, искрата, която се появява, когато се удари метално тяло, може да има температура до 1900 ° C, пламъкът на мачката е около. 800 ° С, водещият барабан на лентовия транспортьор по време на приплъзване е до 600 ° С, а в топлината на електрическия разряд температурата достига 10 000 ° С, с почти мигновени химични реакции.
Изгарянето може да бъде пълно и непълно. При пълно изгаряне, което се случва с излишък на кислород, реакционните продукти са въглероден диоксид, вода, азот, серен диоксид. Непълното изгаряне възниква при недостиг на кислород, продуктите от горенето в този случай са токсични и горими вещества - въглероден оксид, алкохоли, кетони, алдехиди и др. За пълното изгаряне на горивното вещество е необходимо определено количество въздух: 1 кг дърво - 4.18, торф - 5 , 8, пропан - 23.8 m3.
Процесът на горене може да бъде представен по следния начин. Нагрява се студена запалителна среда с въвеждане на топлинен импулс, има интензивно окисление на запалителната среда с кислород и допълнително отделяне на топлина. Това, от своя страна, води до нагряване на съседния слой от горими материали, в които също се осъществява интензивна химическа реакция. При такова пластово изгаряне на горивно вещество зоната на горене се движи; Скоростта на това движение определя интензивността на горивния процес и е неговата най-важна характеристика. Процесът на наслояване, окисляване и изгаряне по пласт продължава до изчерпване на целия обем запалим материал.
Тясната зона, в която се нагрява веществото и се осъществява химическата реакция, се нарича фронт на пламъка.
Горимите системи могат да бъдат химически хомогенни и хетерогенни. Химично хомогенните системи са смеси от запалими газове, пари или прах с въздух, в които лесно се смесват горими вещества и въздух. Изгарянето на такива системи се нарича хомогенно. В химически нехомогенни системи, горимият материал и въздухът не са смесени и имат интерфейс. Те често са твърди горивни материали и тяхното изгаряне се нарича хетерогенно.
Общото време на изгаряне на горивната смес Tg е сумата от времето, необходимо за осъществяване на контакт между горивното вещество и кислорода τ к и времето, през което се извършва химическото вещество, окислителната реакция τ x
В зависимост от съотношението на тези два термина се различават дифузионното и кинетичното изгаряне. При изгаряне на твърди горивни вещества времето, необходимо за проникване на кислород (дифузна) към повърхността на веществото, е много по-дълго от времето за химическа реакция, поради което общата скорост на изгаряне се определя изцяло от скоростта на дифузия на кислород към горивното вещество. Изгарянето на такива вещества най-често се среща при пожари и се нарича дифузно. Горенето, чиято скорост се определя от скоростта на химичната реакция, се нарича кинетична. Този тип горене е характерен за хомогенни горивни системи.
Различават калориметричната, теоретичната и действителната температура на горене.
Калориметричната температура на горене се отнася до температурата, в която се нагряват продуктите на пълно изгаряне, ако цялата отделена топлина се изразходва за нагряването им, количеството въздух е теоретично необходимо, веществата са напълно изгорени и началната температура е 0 ° С. Приема се, че топлинните загуби са нула. Ако началната температура на горивото и въздуха е 0 ° C, тогава калориметричната температура на горене
![]()
където Qn е долната топлина на изгаряне на горивното вещество, kcal / kg; V е обемът на продуктите на горенето, m3 / kg; c е средният обемен топлинен капацитет на продуктите на горенето, kcal / m3 · deg.
Следователно, калориметричната температура на горене зависи само от свойствата на горивното вещество и не зависи от неговото количество. Теоретичната температура на изгаряне взема под внимание загубата на топлина по време на горенето, за да се дисоциира. Калориметричната температура на горене е най-висока за запалимо вещество и се използва за качествена оценка. В действителност при изгаряне винаги има топлинни загуби от радиация, нагряване на излишния въздух и околната среда.
Действителната температура на горене е температурата на огъня. Различават температурата на вътрешния и външния огън. Температурата на външния огън е температурата на пламъка, а вътрешната температура е температурата на дима в помещението. Действителни температури, които се развиват в случай на пожар поради загуба на топлина за околната среда, загряване на продукти и структури на горене
винаги по-малко от теоретично с 30 ... 50%. Например, теоретичната температура на горене на бензина е 1730 ° С, а действителната температура е 1400 ° С.
Смес от горими пари и газове с окислител може да гори само с определено съдържание на гориво в него.
Най-ниската концентрация на горими газове, при които горенето вече е възможно, се нарича по-ниска концентрационна граница на запалване (LEL). Най-високата концентрация, при която все още е възможно горене, се нарича горната граница на концентрация на запалване (AIPW). Областта на концентрация, която се намира в тези граници, се нарича област на запалване. Запалването е огън (началото на паренето), придружен от появата на пламък. Това е постоянно продължително изгаряне, което не спира дори и след като източникът на запалване бъде отстранен. Стойностите на долната и горната граница на запалване зависят от свойствата на газа, парата и праха на въздушните смеси, съдържанието на инертни компоненти в горивната смес. Добавянето на инертни газове към горивната смес намалява зоната на запалване и в крайна сметка го прави незапалим. Значително стесни границите на запалване, някои примеси, които забавят реакцията на горене. Най-активни от тях са халогенирани въглеводороди. И двата маркирани свойства се използват за спиране на горенето. Намаляването на налягането на сместа под атмосферното налягане също стеснява зоната на запалване и при определено налягане сместа става незапалима. Увеличаването на налягането на горивната смес разширява зоната на запалване, но като правило леко. Увеличаването на температурата на горивната смес разширява зоната на запалване. Концентрацията на запалване също се влияе от силата на източника на запалване.
Има не само концентрация, но и температурни граници на запалване.
Температурните граници за запалване на парите във въздуха са тези на горимо вещество, при което наситените му пари образуват концентрации, съответстващи на долната или горната граница на концентрация на запалване. Температурата на запалване е най-ниската температура, при която веществото се запалва или започва да тлее и продължава да гори или тлее след отстраняване на източника на запалване. Температурата на запалване характеризира способността на веществото да се самозапали. Ако температурата на запалване на дадено вещество отсъства, тя се нарича бавно изгаряща или негорима.
Ускоряването на окислителната реакция под действието на температурата води до самозапалване. За разлика от процеса на запалване, при който само част от обема - повърхността - се запалва, в целия обем на веществото възниква самозапалване. Температурата на самозапалване се разбира като най-ниската температура, към която веществото трябва да се нагрява, така че да се запали в резултат на по-нататъшно автоокисление. Самозапалването е възможно само ако количеството топлина, отделено по време на процеса на окисляване, надвишава отделянето на топлина в околната среда.
Температурата на самозапалване за дадено вещество не е постоянна, тъй като тя до голяма степен зависи от условията за нейното определяне. За получаване на сравнителни данни, изпитвателната апаратура и методът за определяне на температурата на самозапалване на газове и пари са стандартизирани (ГОСТ 13920-68). Най-ниската температура, определена със стандартния метод, към която сместа от газове и пари с въздух трябва да се нагрява равномерно, за да се запали, без да се въвежда външен източник на запалване в нея, се нарича стандартна температура на самозапалване.
Тип спонтанно запалване е спонтанно запалване, т.е. изгаряне в резултат на самонагряване без въздействието на източник на запалване. Разликата между спонтанно запалване и спонтанно запалване е в големината на температурата. Спонтанното горене възниква при температура на околната среда, а за самозапалване е необходимо да се загрява веществото отвън.

 Получаване на индикации за броячи на топла и студена вода
Получаване на индикации за броячи на топла и студена вода Изчисляване на площта на въздуховодите с различни форми и фитинги
Изчисляване на площта на въздуховодите с различни форми и фитинги Химия на горивните процеси. Енергия от експлозия
Химия на горивните процеси. Енергия от експлозия Какво ще се случи, ако не предавате показанията на измервателните уреди
Какво ще се случи, ако не предавате показанията на измервателните уреди