Yanma deyilir. Yanma zamanı kimyəvi proseslər
Bəzi əsas anlayışlar
Atom və molekulların sayı rahatlıqla ifadə edilir maddə miqdarları ya da maddələrin miqdarı. Maddənin bir moleu 6.023 ∙ 10 23 parçacıqlara (atom və molekullara) cavab verir. N A = 6.023 ∙ 10 23 mol -1 ədədinə Avogadro adı verilir. Mole fraksiyası x ikomponent i mole sayının nisbəti i komponent i ümumi sayına n = Σ n i qarışıqları ( x i = n i / n).
Kütləvi m bir maddənin əsas xüsusiyyətidir (SI sistemində ölçü birliyi kiloqramdır). Wi kütləvi fraksiyası kütlə nisbəti m i komponent i qarışığın ümumi kütləsinə m = Σ m i (Wi = m i / m).
Molekulyar çəki (və ya molekulyar çəki) M i(g / mol) komponentidir Mən - bu komponentin bir mol kütləsi. Beləliklə, atomik karbon, molekulyar hidrogen, oksigen və metan üçün: M = 12 g / mol, Mn 2 = 2 g / mol, Mo2 = 32 g / mol, Mn 4 = 16 g / mol. M (g / mol) qarışığının orta molar kütləsi komponentlərin molar fraksiyaları baxımından ifadə edilə bilər (M = x i M i).
Yanma proseslərinin təyin edilməsi
Yanan - Bu yüksək temperaturun təsirinə məruz qalan yanan maddələr və materialların oksidləşmə vasitəsi (havada oksigen) ilə kimyəvi qarşılıqlı olmasına, yanma məhsullarına çevrilməsinə və sıx istilik və işıq emissiyası ilə müşayiət olunan kompleks fiziki-kimyəvi prosesdir.
Yanma prosesinin baş verməsi üçün zəruri olan şərtlər:
Yanacaq maddəsinin (GV) olması;
Bir oksidləşdirici maddənin (O.) varlığı - hava oksigeni;
Bir qaynaq mənbəyinin olması (I.Z.).
Yanacaq materialları oksidləşmə prosesinin başlanacağı müəyyən bir temperaturda qızdırılmalıdır;
Yanacaq maddəsi müəyyən bir temperaturda qızdırmaq üçün müəyyən bir yanacaq mənbəyi gücü tələb olunur;
Yanma prosesini qorumaq üçün yanacaq və oksidləşmənin bəzi konsentrasiyaları lazımdır.
Ən mühüm yanma prosesləri istilik və kütləvi transferdir. Yanma ən ümumi mülkiyyəti istilik ötürülməsi və ya aktiv hissəciklərin yanma zonasından təzə yanacaqlı bir qarışığa yayılması ilə alovun meydana gəlməsi və yanacaq qarışığı boyunca hərəkət etməsidir.
Flames - Bu, yanan bir görünüşdür. Həm də yanan zona deyilir. Yandırılan qarışıqların tam və natamam yanma məhsullarına çevrilməsinin olduğu sahənin bir hissəsidir.
Yanma aparan və maddi ziyana səbəb olan yanma prosesinin əsas parametrləri aşağıdakılardır:
Böyük miqdarda istilik;
Yüksək temperatur;
Yanma məhsullarının toksik tərkibi.
Yanacaq prosesi qazların molekulyar kinetik nəzəriyyəsi baxımından
Şəkil. 2.1. Aktiv molekulların temperatura nisbəti: T 2\u003e T 1
Qızdırılan qaz yanacaq qarışığı içərisində artıq enerji artır.
Aktiv vəziyyətdə molekulların orta enerji səviyyəsi və qeyri-aktiv vəziyyətin ortalama səviyyəsi arasındakı fərqə aktivasiya enerjisi deyilir. Bu qrafik şəklində təqdim edilə bilər (Şəkil 2).

Şəkil. 2.2. Reaksiya kursunun enerji diagramı G.V. + O. ® PG: E aktivizasiya enerjisi; Q xr - yanma reaksiyasının istilik təsiri
"Birinci" reaksiyaya girən molekulların qarşılıqlı təsirindən azad edilən enerji, qonşu molekullara köçürülür. Onlar həyəcanlandılar, reaksiya göstərən molekulların ətrafında böyük tezlik və intensivliklə proses təkrarlanır. Bütün reaksiya qarışığına (2H 2 + O 2) qarşı özünü təmin edən, özünü sürətləndirən, kimyəvi molekulların formalaşması və ətraf mühitə istilik yayılması və luminescence ilə müşayiət olunan kimyəvi müdaxilə prosesi başlayır, yəni. yanan proseslər yaranır və yayılır.
E hərəkətinin ədədi dəyəri nə qədər yüksək olsa, bu cüt komponentlərin kimyəvi qarşılıqlı təsir göstərməsi daha çətindir. Buna görə, E hərəkətinin dəyəri bu kimyəvi sistemin yanğın təhlükəsizliyinin dərəcəsinin dolayı göstəricisidir.
Yanma növləri və növləri
Yanma aşağıdakı parametrlərə görə təsnif edilə bilər:
1. Qarışıq yanma komponentlərinin vəziyyətinə görə:
a) əvvəlcədən qarışıq qaz və ya buxar hava qarışığının kinetik - yanması. Yanacağın və oksidanın qarışığı yanmağa hazır olduqdan sonra yanma prosesinin ümumi həddi yanma kimyəvi reaksiya dərəcəsindən asılıdır. Belə yanma bir qapalı və ya məhdud həcmdə baş verərsə, partlayış baş verə bilər. Qarışığın yanması zamanı söndürülmüş enerjinin bu həcmdən kənara çıxması üçün vaxt yoxdur, təzyiqi artıraraq, strukturlar məhv edilə bilər;
b) diffuziya, diffuziya yanma yanma adlanır, yanma mühitinin (yanacaq və oksidləşmə qarışığı) yanma zonasından və ya yanma zonasından əvvəl meydana gəldiyi zaman.
2. Kimyəvi reaksiya zonasında yanan komponentlərin alınmasının intensivliyinə görə:
a) laminar, yanma qarışığının tərkibləri isə yanma zonasına nisbətən sakit şəkildə daxil olur. Bu halda, termodinamik rejimi xarakterizə edən Reynolds meyarının ədədi dəyəri kritik olanlardan daha az olacaq (Re<2300).
b) yüksək sürətlə yanma zonasına daxil olan yanan qarışığın tərkibləri ilə turbulent. Bu halda Reynolds sayı 2300-dən çoxdur.
3. Yanacaq qarışığının tərkib hissələrinin birləşməsinin vəziyyətinə görə:
a) homojen yanacaq və oksidləşmə eyni aqreqat vəziyyətdədir (qazlı);
b) heterojen (çox fazlı) - yanacaq və oksidant müxtəlif aqreqat hallarda olur.
4. Yanma kimyəvi reaksiya zonasının yayılması sürəti haqqında:
a) kimyəvi reaksiyanın zonasının deflagrasiyası (yavaş) bölüşdürülməsi (0,5-dən 50 m / s-ə qədər);
b) yanma kimyəvi reaksiya zonası bir şok dalğasının sürətini (saniyədə bir neçə yüz metrdən bir neçə kilometrədək) təbliğ edərkən partlayışa səbəb olur.
Buxarların və ya qazların yandırılacağı yer çağırılır alovla .
Laminar alovlar əvvəlcədən qarışdırılır. Qarışıq qarışıqdan laminar alovlarda yanacaq və oksidan yanma başlamazdan əvvəl qarışdırılır və axın laminar olur.
Əvvəlcədən qarışıq qarışığın alovu adlanır stokiometrik Əgər yanacaq (karbohidrogen) və oksidləşdirici (oksigen - O 2) bir-birini tamamilə istehlak edərsə, karbondioksid (CO 2) və su (H 2 O) təşkil edir. Yanacağın çox olması halında, qarışığın zəngin olduğunu söyləyirlər, oksidantın çox olması isə qarışığın yoxsul olduğunu söyləyirlər.
Ən sadə nümunələri nəzərdən keçirin:
1) 2H 2 + O 2 → 2H 2 O - stokiometrik qarışıq,
2) ZN 2 + O 2 → 2H 2 O + H 2 - zəngin qarışıq (H 2 artıq),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - yağsız qarışıq (çox O 2).
Belə bir kimyəvi reaksiya tənlikində hər bir simvol bir maddənin birinə bərabərdir. Beləliklə, bu tənliklərdən birincisi iki mol H 2 molekulu iki mole H 2 O meydana gətirmək üçün bir mol O 2 ilə reaksiya vermək deməkdir.
Kimyəvi reaksiya tənliyi belə bir şəkildə yazılıb ki, o, yalnız bir mole yanacaq reaksiyasını təsvir edirsə, o zaman stokiyometrik qarışıqdakı yanacaq molekulunun partiyası asanlıqla əlaqədən müəyyən edilə bilər
x dağlar, stokh = 1 / ((1 + v)
Burada vcO 2 və H 2 O formalaşması ilə reaksiyanın bərabərliyində O2 mollərinin sayını nəzərdə tutur. Məsələn, reaksiya
H 2 + 0.5O 2 → H 2 O, v = 0.5, x 2, stoch = 2/3
Oksidləşən hava olduqda, nəzərə alınmalıdır ki, quru havada yalnız 21% oksigen, həmçinin 78% azot və 1% nəcib qazlar var. Beləliklə, hava üçün, X N 2 = 3.762 X O 2. Buradan hava ilə stoikiometrik qarışıq üçün molar fraksiyalar bərabər olacaqdır
x dağlar, stokh = 1 / (((1 + v ∙ 4,762), ![]() ,
,
harada v əvvəllər olduğu kimi, bir mol yanacaqın CO2 və H 2 O-ə qədər tam çevrilməsinin reaksiyanın bərabərində O 2 molekullarının sayı deməkdir. v yanacaq stokiyometrik qarışıqları üçün hava ilə yanacaq molar fraksiyaları Cədvəl 1də göstərilir.
Yanacaq və havanın əvvəlcədən qarışıq qarışıqları (bu halda reaksiya tənliyinə müvafiq miqdarda N 2 əlavə edilməlidir, cədvəl 1-ə baxın) hava üçün ekvivalent nisbəti ilə xarakterizə olunur:
λ = (x w / x dağlar) / (x w, stoch / x dağlar, stoh) = (w w / w dağlar) / (w w, stoch / w dağlar, stoch)
ya da qarşılıqlı - yanacaq üçün ekvivalent nisbəti F (F = 1 / λ). Bu formula, qarışığın molar fraksiyalarının dəyərinə görə müəyyən edilə bilməsi üçün çevrilə bilər F:
x dağlar = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x dağlar,
X çəkisi / 4,762, = ∙ 3,762
V dəyərlərinin nümunələri və yanacağın mole fraksiyaları x dağlar, hava ilə yanacaq stoichiometric qarışıqları üçün stoichi
suvarma hər zaman kimyəvi dəyişikliklərlə müşayiət olunur. Havada yanma - yanacaq maddəsinin oksigenlə qarşılıqlı əlaqəsi. Bununla yanaşı, azotun oksidləri, halolların və ozonun yanma prosesində oxidizatorlar kimi çıxış edə biləcəyini nəzərə almalıdırlar. Məhsulun yalnız bir qaynağının iştirakı ilə baş verən yanma prosesləri - sürətlə ayrışmağa məcbur olan birləşmələr. Belə birləşmələrin nümunələri asetilen və hidrazindir.
Yanma zamanı baş verən kimyəvi proseslər son dərəcə mürəkkəbdir. Sadə halda belə - oksigendə hidrogenin yanması, ümumi tənlikləri forma malikdir
2H 2 + 0 2 = 2H 2 0,
bir neçə düzbucaqlı mərhələlər qurulmuş və tədqiq edilmişdir.
Bu günə qədər hidrogen, karbon monoksit, metan və etan kimi bir neçə maddənin yanması zamanı kimyəvi dəyişiklik mexanizmləri kifayət qədər ətraflı tədqiq edilmişdir. Bu məlumat bir çox maddələrin alovlanma və yanma şərtlərini proqnozlaşdırmaq üçün istifadə olunur.
2.1. Zəncir reaksiyaları
Zəncir reaksiyaları, adi kimyəvi dəyişikliklərdən fərqli olaraq, hər bir elementar hərəkətdə aktiv hissəciklərin görünüşü ilə xarakterizə olunur: bir atomu olmayan bir elektron, azad radikal və ya bir ion. Aktiv hissəciklərin görünüşü başlanğıc materiallarının reaksiya məhsullarına çevrilməsi zəncirinə səbəb olur. Atomlar, sərbəst radikallar və ionlar valent doymuş molekullardan daha reaktivdirlər. Buna görə də, kimyəvi əlaqələrin pozulması və aktiv hissəciklərin formalaşması üçün tələb olunan əhəmiyyətli enerji xərclərinə baxmayaraq, reaksiyanın zəncirinin inkişafı tez-tez moleküllər arasında birbaşa qarşılıqlı təsirdən daha enerjili olur.
Yanma prosesləri əsasən zəncir mexanizmi vasitəsilə baş verir. Zəncir reaksiyaları - bir neçə mərhələdə baş verən kompleks reaksiyalar:
Aktiv hissəciklərin meydana gəldiyi zəncirlərin mənşəyi (başlanğıc);
Aktiv hissəciklərin başlanğıc maddələrlə kimyəvi qarşılıqlı əlaqəyə girdiyi zəncirlərin davamı, bunun nəticəsində yeni aktiv hissəciklər formalaşır;
Aktiv hissəciklərin "ölümü" nün son reaksiya məhsullarının formalaşması ilə baş verən zəncirlərin parçalanması
Zəncirlərin mənşəyi müxtəlif şəraitlərdə baş verə bilər. Məsələn, istilik enerjisi və ya ionlaşdırıcı radiasiya hərəkatı altında molekulyarların ayrışması nəticəsində, elektrik boşalmasında. Aktiv hissəciklərin qatı səthlərlə (heterogen zəif kopma) və ya yanma inhibitorları ilə reaksiyalarının nəticəsi ilə qarşılıqlı olduqda, sərbəst radikalların qarşılıqlı olduqda (homojen zəncir sindromu) rekombinasiya edildikdə meydana gəlir.
Duzsuz və dallı zəncir reaksiyaları var. Zəncirinin davam etdirilməsi reaksiyalarında istifadə olunan hər bir aktiv hissəcik üçün duzsuzluqda təkrar inkişaf etməkdədir. Başlanğıc aktiv hissəcik başına yaranan məhsul molekullarının sayı zəncir uzunluğu adlanır. Yanma reaksiyalarında zəncirlərin uzunluğu yüz minlərlə onilliklər arasında dəyişir. Dəmirsiz zəncirvari reaksiyaların dərəcəsi yanma inhibitorları kimi aktiv partiküllərlə effektiv şəkildə təsir edə bilən maddələrin kiçik qatqılarından təsirlənə bilər.
Bəzi maddələr - təşəbbüskarlar - aktiv hissəciklərin formalaşmasını asanlaşdırır və beləliklə dəmirsiz zəncir reaksiyalarını sürətləndirir.
Zəncirin davamı ilə istehlak edilmiş bir fəal zəncir üçün dallı zəncir reaksiyalarında iki və ya daha çox aktiv hissəcik meydana gəlir. Onlardan biri əsas zənciri davam etdirir, digərləri yeni zəncirlər yaradır və bir dallı yaradırlar (Şəkil 2.1).
"Rekombinasiya nöqtə atomları və ya yüklənmiş hissəciklərdən gələn molekulların formalaşması prosesidir. Rekombinasiya zamanı meydana gələn atomlar və molekullar yerə və həyəcan vəziyyətinə düşə bilər.
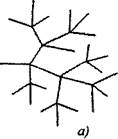
Şəkil. 2.1. Reaksiya zəncirlərinin sxematik təsvirləri:
a) zəncirin hər bir hissəsində dallanma
6) nadir dallanma
Məsələn, zəncirin başlanğıcı reaksiyasında hidrogenin yanması zamanı:
aktiv bir atom meydana gəlir. Zəncir davamlı reaksiya:

yeni zəncirlərin başlanğıcı olan aktiv atomların sayında artım var.
Branched zəncirvari reaksiyalar, dallanmanın sürəti aktiv hissəciklərin ölüm dərəcəsindən az olduğu və qeyri-stasionar vəziyyətdə olan, döllənmədən daha yavaş meydana gələn bir sabit rejimdə davam edə bilər. Sonuncu vəziyyətdə, zəncirvari reaksiya sürəti xeyli artmaqdadır və yalnız başlanğıc materiallarının istehlakı ilə məhdudlaşır. Stansiyadan qeyri-stasionar rejimə keçid reaksiyanın şəraitində yüngül bir dəyişikliklə baş verir: temperatur, təzyiq və ya reaktantlardan birinin konsentrasiyası. Belə sürətli sürətlənmə reaksiya qarışığının və ya bir zəncir partlamasının özünü atəş etməsi hesab olunur.
Dənli zəncirvari reaksiyaların aşkar edilməsi yanma proseslərinin nəzəriyyəsi üçün çox vacibdir. Termal və zəncirvari iki növü vardır ki, sübut edir. Daxil edilən naxışlar
2-ci fəsil yanan
zəncir prosesləri nəzəriyyəsi yanğın zamanı yanma proseslərinin inkişafına və bastırılmasına təsirli təsir göstərə bilər.
Zəncirlərin mənşəyi.Dəyişməmiş zəncir reaksiyaların inkişafında ilkin aktiv mərkəzlərin nüvələşmə prosesi böyük rol oynayır. Zəncirləmə xitam reaksiyaları zamanı aktiv mərkəzlərin itməsini kompensasiya edir. Bu mexanizm aktiv mərkəzlərin toplanmasının ilkin dövründə stasionar rejimin formalaşması üçün şəraitləri müəyyənləşdirir. Kiçik bir başlanğıc dərəcəsi ilə bu dövr əhəmiyyətli ola bilər.
Alovlarda kimyəvi reaksiyaların əksəriyyəti aktiv mərkəzlərin əhəmiyyətli enerji ehtiyatına malikdir. Bu şəraitdə, aktiv mərkəzlərin təşəbbüsü əhəmiyyətli enerji baryerini aradan qaldırmaqla bağlıdır.
Bu vəziyyətdə, aktiv mərkəzlərin meydana gəlməsinin əhəmiyyətli dərəcəsini təmin edən amillər: kimyəvi cəhətdən aktiv additivlər, radiasiya, elektrik boşalması, radioaktiv tərkibli məhsullar mühüm rol oynayır.
Fəal mərkəzlərin yaradılmasına böyük fayda verən amillər arasında heterojen reaksiyalar qeyd edilməlidir. Qatı bir səthdə adsorbsiyan yanan maddələrin molekullarında interatomik bağlar zəiflədilir və onların qırılması az enerji sarf etmək tələb edir. Bu şərtlərdə, aktiv mərkəzlərin yaradılması nisbəti qaz həcminə nisbətən əhəmiyyətli dərəcədə yüksəkdir. Yandırılan qarışıqların tərkib hissələrinin heterojen qarşılıqlı təsirində aktivasiya enerjisi də eyni bir vəziyyətdə olduğundan daha aşağıdır. Həqiqi yanma prosesləri şəraitində aktiv mərkəzlərin istifadəyə verilməməsi qeyri-zəncirli zəncir prosesləri ilə sabit rejimin sürətlə inkişafında mühüm amildir.
Bəzi xüsusiyyətlər atom komponentlərinin iştirakı ilə baş verən duzsuz zəncir reaksiyalarını xarakterizə edir. Yenilənmə olmadan aktiv mərkəzlərlə əlaqəli çirklərin olmaması halında, atomların təkrar üçlü toqquşma və səthlə birləşməsi mümkündür.
Hər hansı bir temperaturda bütün qazlı maddələr qismən ayrışmışdır. Bəzi molekullar atomlara parçalanır. Bu halda, ayrışmanın və atomların birləşməsinin molekullara çevrilməsi prosesi arasında bir tarazlıq var. Dissociasiya dərəcəsi temperaturdan asılıdır.
Zəncirləri pozan yanan qarışıqda heç bir qarışıqlıq yoxdursa, reaksiyanın atom komponentlərinin konsentrasiyası dəyişməz olaraq qalır. Reaksiyaya daxil olan atomlar dərhal eyni şəkildə bərpa edilir
Korolchenko A.Ya. Yanma və partlama prosesləri
lichie. İlkin təşəbbüs reaktiv olmayan sistemdə olduğu kimi eyni reaktiv atomları kompensasiya edir. Stasionar reaksiya bu prosesə təsir göstərmir. Molekülün içərisində atomlar arasında ən az güclü bağı ilə seçilən reaksiyanın tərkib hissələrindən birinin balansı bu rejimin xarakterik xüsusiyyətidir. Bu vəziyyətdə başqa bir atom komponentinin konsentrasiyası kvasistasionar, lakin daha çox tarazlıqdır.
Yanma reaksiyalarının homojen təşəbbüsü ilə, sabit rejim müəyyən bir müddət sonra qurulacaq, çünki ayrışma böyük bir aktivasiya enerjisi tələb edir. Bu müddət ərzində dissociasiya dərəcəsi rekombinasiya dərəcəsini aşır və aktiv mərkəzlər reaksiya sistemində yığılır. Hər iki prosesin dərəcələri yalnız aktiv mərkəzlərin konsentrasiyasını tarazlığa yüksəldikdən sonra müqayisə edilir. Bu dövr induksiya dövrü adlanır.
Reaksiya zonasında katalizator kimi qatı bir səthin olması termodinamik balansın vəziyyətini dəyişmir. Katalizator irəli və əks reaksiyaları bərabər təsir göstərir. Aktiv mərkəzlər yalnız möhkəm bir səthdən deyil, həm də üzərindən qaçırlar. Lakin, bir katalizatorun mövcudluğu bir balans ayrılığı dövlətinin əldə olunmasını sürətləndirir.
Zəncirli qırılma reaksiyalarında iştirak edə bilən yanan qarışıqda aktiv maddələr varsa, aktiv mərkəzlərin konsentrasiyasını azaldır. Bu halda, başlanğıc komponentlərdən birinin balansın ayrılması pozulur, bu reaksiyanı yavaşlatır və onun dayandırılmasına gətirib çıxara bilər.
Eksperimental göstəricilər göstərir ki, bir xarici qaynaq (məsələn, bir işıq mənbəyi) ilə duzsuz zəncirvari reaksiya başladarkən, yanma prosesinin inkişafının başlanğıc mərhələsində aktiv mərkəzlərin konsentrasiyası balansdan əhəmiyyətli dərəcədə artıq ola bilər.
Dallı zəncirvari reaksiyaların gedişi zamanı ilkin başlanmanın şərtləri reaksiyanın inkişafına əhəmiyyətli dərəcədə təsir göstərir. Yavaş hərəkət edən proseslərdə, başlanğıc üçün qisim reaksiya göstərən qarışıqın əlavə olunması induksiya müddətini qısaldır və alov yanma anını sürətləndirir.
Zəncirin davamı.Dəmirsiz zəncirvari reaksiyaların xarakterik xüsusiyyəti aktiv mərkəzlərin konsentrasiyasının qeyri-stationarlığıdır. Açıq dövrə yoxdursa, aktiv hissəciklər meydana gəlir
Fəsil 2. Yanma zamanı kimyəvi proseslər
onlar sərf etdiyi eyni məbləğ. Yeni başlanğıcda yalnız ortaya çıxır. Aktiv mərkəzlərin bərabər dərəcələri və zəncirləmə xəttinin bərpası ilə aktiv mərkəzlərin sabit konsentrasiyası və sabit reaksiya rejimi yaradılır. Əvvəlki komponentlər istehlak edildikcə reaksiya dərəcəsi azalacaq.
Dallı zəncirvari reaksiya halında reaktiv sistemdə aktiv mərkəzlərin konsentrasiyası onların ilkin təşəbbüsün şərtlərinə baxmayaraq artır. Çığın xarakterinə malik olan özünü sürətləndirən reaksiya rejimi tətbiq olundu. Bu halda, reaksiyanın son məhsullarına ilkin komponentlərin tam transformasiyası üçün bir başlanğıc aktiv mərkəz yetərlidir.
Daşlı qiymətli reaksiyanın kinetik tənliyi aşağıdakı kimidir. Zamanla sabit başlanğıc komponentlərinin konsentrasiyalarında dəyişiklik bir ilk təxminlə laqeyd oluna bilər və aktiv mərkəzlərin konsentrasiyasında daha sürətli dəyişikliklər nəzərə alınır. s.Bu sürətdə dəyişikliklər ilkin başlanğıc dərəcəsi və dallanma reaksiyalarının dərəcələrinin nisbəti və zəncirinin sona çatması ilə müəyyən edilir. İlkin başlanğıc dərəcəsi sistemdə mövcud aktiv mərkəzlərin konsentrasiyasından asılı deyil. Dallanma və qırılma proseslərinin dərəcələri aktiv mərkəzlərin konsentrasiyalarına mütənasibdir. Bu şəraitdə, aktiv mərkəzlərin formalaşması və xərclənməsinin ümumi balansı başlama, dalaşma və qırılma proseslərinin dərəcələri ilə müəyyən edilir:
![]() (2.1)
(2.1)
dallanma və qırılma reaksiyalarının dərəcəsi sabitləri olduğu yerlərdir. Denoted, biz alırıq:
![]() (2.2)
(2.2)
Aktiv mərkəzlərin konsentrasiyasının vaxt törəməsi olduqda
müsbətdir. Reaksiya dərəcəsi zamanla artır. Dallı zəncirvari reaksiyaların bu xüsusiyyəti, bu reaksiyaların dərəcəsi zəncirləmə xəttinin reaksiya dərəcəsini aşdıqda belə rejimlərdə aktiv mərkəzlərin çarpılmasına bağlıdır.
Korolchenko A.Ya. Yanma və partlama prosesləri
Reaksiya başlamazdan əvvəl sistemdə aktiv mərkəzlər olmadı, yəni. att= 0, n = 0 tənliklərin inteqrasiyası (2.2) verir:
![]() (2.3)
(2.3)
CO-nun ümumi reaksiya dərəcəsi dallanma prosesinin sürəti ilə müəyyən edilir. Son məhsullar yalnız bu reaksiya zamanı formalaşır. Hər elementar zəncir dallanma hadisəsi üçün son məhsulun molekulları formalaşır. Bunlar aşağıdakılardır:
![]() (2.4)
(2.4)
Zəncirvari reaksiyanın vaxtında inkişafı dallanma reaksiyalarının və zəncirinin sona çatması reaksiyalarının dərəcəsi sabitlərinin nisbəti ilə müəyyən edilir və tənlikdə göstərici (2.4) pozitiv və re-
aksiya məhdudlaşdırılmır. Reaksiyanın inkişafının ilkin mərhələsində aşağıdakı əlaqələr gerçəkləşir:
İlkin başlanğıcın dərəcəsi kiçik olduğundan, ilk dövrdə nəzərəçarpan kimyəvi dəyişiklik yoxdur. Bir müddətdən sonra dəyər birdən çox olur. Bundan sonra, tənlik (2.4) uyğun reaksiya dərəcəsi sürətlə artmağa başlayır və çox böyük dəyərlərə çatır.
Zəncirvari reaksiyanın inkişafı zamanı gecikmə dövrünün (induksiya dövrü) olması reaksiya sistemində bir sıra aktiv mərkəzlərin yığılmasının zəruriliyinə bağlıdır. Yalnız bu kimyəvi transformasiya nəzərəçarpan olur.
Zəncirvari reaksiyalardakı induksiya dövrünün böyüklüyü dalqalma və zəncirləmə xülasəsi proseslərinin nisbətlərini müəyyən edir, ilkin başlanğıc dərəcəsi deyil. Dalğalanma və qırılma reaksiyalarının dərəcələri, öz növbəsində, hər bir reaksiyaya salınan sistemin kimyəvi xüsusiyyətləri ilə əlaqədardır, başlanğıc komponentlərinin temperaturu və konsentrasiyalarına bağlıdır. Zəncirvari reaksiyaların xüsusiyyətləri
dallanma proseslərinin əhəmiyyətli aktivasiya enerjisini tələb etməsi, qırılma prosesinin sabit dərəcəsinin temperaturu isə sıfıra yaxındır. Hər üç növ zəncirinin sona çatması reaksiyalarında: toplu və heterojen rekombinasiyalar halında, radikalların aktiv qatqı ilə qarşılıqlı əlaqədə aktivasiya enerjiləri sıfırdır.
Temperaturun artması, qarışığın ümumi təzyiqi və ya reaksiyaya girən komponentlərin konsentrasiyasında dəyişiklik olarsa, reaksiyanın stasionardan qeyri-stasionar dəyişir olduğu dallanma və qırılma sürət sabitlərinin dəyişməsi mümkündür. Bu prosesin xüsusiyyətləri, bir rejimdən ikisinə kəskin keçiddə, reaksiya dərəcəsini qeyri-məhdud bir dəyərdən qeyri-məhdud artıraraq birinə dəyişir.
Bəzi zəncirvari reaksiyaların axını nisbətən stabil olan ara məhsulların formalaşması ilə müşayiət olunur, amma aktiv mərkəzlərin yaradılmasına imkan verir. Belə reaksiyalar arasında, misal üçün, peroksidlər və aldehidlərin meydana çıxdığı ara maddələr kimi karbohidrogen yanma reaksiyaları daxildir. Bu, zəncirin bir xəttinə gətirib çıxarır. Lakin, aralıq məhsulların nisbi sabitliyinə görə reaksiyanın sürətlənməsi zamanla uzanır. Belə yavaş dallanma zəncirlərinə degenerasiya deyilir.
Radikalların yüksək fəaliyyəti səbəbindən adi radikal dallanma mexanizmi ilə zəncir reaksiyaları olduqca sürətlə davam edir. Nəticədə ortaya çıxan radikallər ya sürətlə sürətləndirən bir reaksiya başlatır, ya da prosesi yenidən birləşdirir və çıxır.
Açıq dövrə Hər hansı bir qaz molekülü kimi aktiv hissəcik, digər molekullarla toqquşan reaksiya sistemində təsadüfi hərəkətlər edir. Eyni zamanda başqa bir aktiv zərif və ya moleküllə qarşılıqlı təsirlərin birləşməsi və əvvəlki yolun davam etdirdiyi yeni bir aktiv hissənin meydana gəlməsində müəyyən bir ehtimal var. Reaksiya zəncirinin inkişafı, aktiv mərkəzlərin köçürülməsi kimyəvi reaksiya ilə müşayiət olunmasına baxmayaraq, qaraciyərin inert molekulların hərəkətinə bənzərdir. Zəncirin inkişaf yolunda iki və ya daha çox növ alternativ aktiv mərkəzlər.
Korolchenko A.Ya. Yanma və partlama prosesləri
Reaksiyaların zənciri aktiv hissəcik bərpası olmadan reaksiya göstərməməyə qədər davam edir. Bu vəziyyətdə sözdə açıq dövrə meydana gəlir. Breakage prosesləri zəncirvari reaksiyaların kinetikasında böyük rol oynayır. Aktiv mərkəzlərin ölümünə səbəb olan iki növ reaksiyalar mövcuddur:
Homojen break (reaksiya qarışığının həcmində ölüm);
Heterogen fasilə (bərk səthdə ölüm) Bir neçə prosesdən biri ilə zəncirlərin birbaşa parçalanması mümkündür:
radikalların yenidən birləşməsi və ya müxtəlif kimyəvi cəhətdən aktiv komponentlər sonuncu rejenerasiya olmadan aktiv mərkəzlərlə qarşılıqlı olduqda.
Heterojen zəncir parçalanması yanma zamanı və ya yanan yanan materialların səthində yaranan hissəciklər üzərində meydana gəlir. Qatı bir səthdə açıq dövrə qaz kəmərindən aktiv səthlərin yox olduqları bu səthə yayılması hesab edilə bilər. Möhkəm bir səthdə rekombinasiya mexanizmi səthdə şişirdilmişdir ki, artan reaktivliyə malik aktiv hissəcikdir. Bu proses üçün heç bir enerji və məkan maneəsi olmadığı üçün, bitişik yerlərdə sorğulanan radikaller bir-biri ilə yenidən birləşir. Rekombinasiya nəticəsində meydana çıxan sabit birləşmələrin molekulları artıq bir zəncirvari reaksiyanın inkişafında iştirak edir.
Buna baxmayaraq, qatı bir səth ilə aktiv hissəciklərin hər birinin toqquşması onun adsorbsiyasına gətirib çıxarır. Yəqin ki, səthdən yansıması. Aktiv bir mərkəzin qatı bir səthlə adsorbsiyası ehtimalı yaşayış katsayısı adlanır. Bu əmsal effektiv hissəciklərin və səthin kimyəvi affinity xüsusiyyətidir. Praktiki olaraq mühüm hallarda, divardan əks olunduqdan sonra aktiv hissəcik onu uzaqlaşmır. Yaşayışına qədər divar ilə yeni toqquşma ehtimalı var. Bu prosesdən ötəri müəyyən şərtlər altında reaksiya dərəcəsi praktik olaraq yaşayış katsayısından asılıdır. Proses Aİ kimi bir şəkildə davam edir
* Şoranlıq - ətraf mühitin bir maddəsinin möhkəm bir orqan (və ya maye) tərəfindən udulması. Soğan orqanına sorbent deyilir, emilir- sorbat. Sorbentin bütün kütlələrinin (absorbsiya) və səth qatının (adsorbsiya) udulmasını ayırd etmə. Bərk sorbent və sorbatın səthi arasında kimya tipinin qarşılıqlı təsirinə görə sorpsiyaya chemisorption deyilir.
__________________________ Fəsil 2. Yanma zamanı kimyəvi proseslər
hər bir toqquşmada bir açıq dövr baş verdi. Səthdə aktiv mərkəzlərin konsentrasiyası sıfıra alınır.
Reaksiyaya girən qarışıqda aktiv qatqıların olmaması halında, zəncirlərin qırılması ya kütləvi radikalların rekombinasiyası yolu ilə ya qatı səthlərdə və ya homojen olaraq baş verə bilər. Real yanğınlarda ikinci yol əsasən həyata keçirilir.
Zəncirvari reaksiyaların kinetikası üzərində müəyyən təsir inert qazların reaksiya verən sistemində aşqarlara malikdir. Inert aşqarlar aktiv hissəciklər ilə toqquşma sayını artırır, zəncir parçalanma ehtimalı artırır və buna görə ümumi reaksiyanı mane olur.
Zəncirvari reaksiyaların daha effektiv inhibisyonu reaktiv aşqarların - inhibitorların reaksiya verən qarışığa daxil edilməsiylə təmin edilir. İnhibitorlar reaksiya aparan, zənciri qıraraq aktiv mərkəzlər ilə qarşılıqlı fəaliyyət göstərirlər. Inhibe edilmiş qarışıqdakı reaksiyanın kinetikası aktiv mərkəzlərlə qarşılıqlı əlaqədə inhibitor və reaksiyanın əsas komponentləri arasında rəqabət şərtləri ilə müəyyən edilir. Inhibitorun yüksək effektivliyi və yeni aktiv mərkəzlərin orta dərəcə istifadəsi ilə, artıq inhibitorun kiçik qatqıları zəncirvari reaksiyanın gedişini tamamilə boğa bilər.
İnhibə prosesi yanğın və partlama təhlükəsizliyi praktikasında böyük əhəmiyyət kəsb edir. Inhibitorların istifadəsi yanma proseslərinə effektiv şəkildə təsir etməyə imkan verir.
2.2. Hidrogen yanma zamanı kimyəvi proseslər
Hidrojen molekulunun bir oksigen molekulası ilə qarşılıqlı olması bir sıra ardıcıl mərhələlər vasitəsilə kompleks bir şəkildə davam edir. İndi güclü şəkildə müəyyənləşdirilmişdir ki, hidrogenin yanması zəncir mexanizmi ilə meydana gəlir və hissəciklər aktiv mərkəzlərin rolu oynayır. Hidrojen yanması zamanı elementar reaksiyaların ardıcıllığı və əhəmiyyəti hidrogen alovlarının meydana gəlməsi və inkişafı üçün müxtəlif şərtlər üçün çox ətraflı təsvir edilmişdir.
Eksperimental və hesablama metodlarından istifadə edərək, avtomatik tənzimləmə rejimində hidrogen yanma prosesinin ən müfəssəl təhlilini professor N.N. Baratov həyata keçirmişdir. O, on dörd əsas elementar reaksiyalar daxil olmaqla prosesin aşağıdakı sxemi təklif etdi:
Korolchenko A.Ya. Yanma və partlama prosesləri
Aktiv mərkəzlərin mənşəyi reaksiya ilə meydana gəlir
![]()
Reaksiyaların zəncirinin davamı
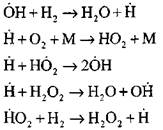
Dalğıc zəncirləri
 |
açıq dövrə
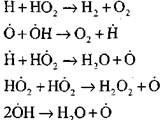 |
Hidrogen atomlarının konsentrasiyası özünü tənzimləmə prosesinin ilkin mərhələsində ilk hidrogen tərkibinin əhəmiyyətsiz bir hissəsidir. Zəncirvari reaksiyanın inkişafı ilə molekulyar hidrogenin çevrilmə dərəcəsi o qədər yüksək olur ki, onu ikinci saniyədə yüzdə biri istehlak edir.
2.3. Karbon monoksidin yanması zamanı kimyəvi reaksiyalar
Karbon monoksitin oksigenlə qarşılıqlı olması yanma prosesləri üçün böyük bir reaksiyadır. Bu reaksiya zamanı
__________________________ Fəsil 2. Kimyəvi prosesyandırmaqdadır
bir çox hallarda karbon tərkibli maddələrin yanma qanunları müəyyən edilir. Reaksiya dallı zəncir mexanizmi ilə xarakterizə olunur. Bir sıra xüsusiyyətlərə malikdir.
Uzun müddətdir ki, CO və 0 2 tamamilə quru bir qarışığı alovlandırmaq və yandırmaq mümkün deyildir. Buna baxmayaraq, kütləvi spektrograf istifadə edərək suyun yoxluğunun monitorinqi aparılmış təcrübələri diqqətlə qurmuşuq ki, quru qarışıq üçün yanma da mümkündür. Qeyd edək ki, sistemdə CO + 0 2 su buxarının və ya hidrogenin olmasını ehtimal olunan aktiv mərkəzlərin sayını artırmaqla yanma və yanma prosesini aktivləşdirir. Suyun sürətləndirici təsiri xüsusilə aşağı konsentrasiyalarda nəzərə çarpır.
Su buxarının mövcudluğunda karbon monoksidin yanması və ya hidrogenin kiçik əlavələri aşağıdakı elementar proseslərin iştirakı ilə baş verir:

Reaksiya (VI) ilə formalaşan H02 radikalləri zəncir davam edə bilər (reaksiya VIII) və ya onun qırılmasına reaksiya (IX-XII) gətirib çıxara bilər.
CO-nun yavaş oksidləşməsinin bir zəncir partlamasına çevrilməsinin şərtlərini qiymətləndirmək üçün radikal H02-də bir zəncir pozulmasının ehtimalını qiymətləndirək; burada zəncirləmə xəttində (X) və (XI) reaksiyaların rolu baxımından əhəmiyyətsiz olacağını nəzərə alırıq.
haqqında 1000K temperaturda prosesləri (IX-XI siniflər) dərəcəsi sabitləri birlikdə yaxın, lakin radikalların konsentrasiyası və hidrogen atomları və radikalların konsentrasiyası xeyli az daha kimyəvi fəaliyyəti var, çünki reaksiya (IX) ilə müqayisədə. Buna görə, radikal H0 2 vasitəsilə açıq dövrə ehtimalı forma yaza bilər:
1000K temperaturda
Buna görə də
![]()
![]()
böyüklük təsiri
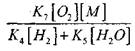
tənliklərin həllində (2.7) zəif olacaqdır.
Fəsil 2. Yanma zamanı kimyəvi proseslər
Vəziyyətdə ![]() və ya
və ya ![]() (nə ilə müşahidə olunur)
(nə ilə müşahidə olunur)
real alovlar), tənlik (2.7) forma çevrilir:
![]() (2.8)
(2.8)
Beləliklə, havada karbonmonoksitin yandırılması vəziyyəti əsasən hidrogen yanmasının mövcudluğu və nümunələri ilə müəyyən edilir. CO ilə oksidləşmə (I) hidrogen ehtiva edən reaksiyalarda meydana gələn OH radikallarının konsentrasiyasına bağlıdır.
Karbon monoksitin yanma reaksiyasının xüsusiyyətləri hidrogen atomlarına yüksək yaxınlıqda olan maddələrin reaktiv sisteminə kiçik additivlər daxil edildikdə, onun sürətli inhibə olunmasında iştirak edir. CO yanmasının qarşısını alan bu cür maddələr hidrokarbonların halojen-törəmələridir. Reaksiyayla hidrogen atomları ilə qarşılıqlı əlaqə qurarkən reaksiyalar zəncirlərinin sona çatması səbəbi onların inhibitor təsiridir
2.4. Karbohidrogen yanması
Hidrojen və karbon monoksidin yanma proseslərinin araşdırılması yanma reaksiya mexanizminin mürəkkəbliyini göstərir. H 2 və CO halında reaksiya bir çox elementar mərhələ və ara məhsulların iştirakı ilə bir zəncir kimi gəlir. Buna görə də, daha mürəkkəb maddələrin - karbohidrogenlərin yanma reaksiyalarının mexanizmi daha da mürəkkəbdir və bu birləşmələrin yanma və yanma proseslərinə müşayiət olunan təsirlər daha fərqlidir.
Halbuki onların yanma prosesində karbohidrogenlərin kimyəvi yüksəlməsinin təbiəti ilə bağlı məlumatlar müşahidə olunan təsiri bəzi yanaşmalarla izah etməyə imkan verir.
Karbohid alovlarında, artıq tanınmış aktiv hissəciklərlə yanaşı, daha mürəkkəb bir strukturun çoxlu aralıq məhsulu olduğu müəyyən edilmişdir. Bəzi hallarda onlar yeni zəncirlərin yaranma mənbəyinə çevrilirlər. Karbohidrogenlərin tutuşma və yanma proseslərində əsas rolu aşağıdakı ara ara birləşmələrlə ifa olunur:
Korolchenko A.Ya. Yanma və partlama prosesləri
1. Bir molekul olan hidrokarbon radikalları
bir və ya daha çox hidrojen atomu çıxaran levodoroda. Bunlar
qalıqları alkil (CH3 - metil, C2H5 - etil, C3H7 - propil və
və s.). Yüksək reaktivliyinə görə, pulsuz alkillər
uzun müddət mövcud deyil. Alovlarda aralıq olaraq təqdim olunur
məhsullar. Digər molekullarla qarşılıqlı davranarkən davranın
müstəqil struktur qrupu kimi. Hidrokarbon radikalları
adətən R hərfi ilə təmsil olunur.
2. Peroksidlər - ümumi formul R-00-R birləşmələri.
3. Aldehidlər - Tərkibi
![]()
Ən sadə aldehidlər formik (formaldehid) və sirkə (asetaldehid) ![]() . Bu maddələr hamısıdır
. Bu maddələr hamısıdır
karbohidrogenlərin tam olmayan yanma məhsullarında mövcuddur.
Karbohidrogenlərin yanması zamanı zəncir meydana gəlməsi karbohidrogen radikallarının meydana gəldiyi reaksiyalar ola bilər. Bu, iki ədəd pulsuz metil qrupunun formalaşması ilə bir etan molekulunun ayrışma reaksiyası ola bilər:
![]()
və ya bir karbohidrogen oksigen ilə reaksiya:
![]()
Zəncirlərin davamı formalaşma reaksiyaları nəticəsində baş verir peroksid və ya hidroperoksid:
![]()
Zincirli dallanma hidroperoksidin ayrılması zamanı aparılır:
Fəsil 2. Yanma zamanı kimyəvi proseslər
Reaksiyaların ardıcıllığı reaksiya sistemində peroksid birləşmələrinin konsentrasiyasının tədricən artmasına gətirib çıxarır.
Peroksidlərin, radikalların və başlanğıcın yığılması ilə eyni vaxtda
paralel reaksiyalar var:

Bu reaksiyalar ekzotermikdir; böyük miqdarda istilik axını olduqda.
Reaksiya qarışığının temperaturu artdıqca, aktiv mərkəzlərin rolu bir aralıq məhsuldan aşağıdakı qaydada keçir: alkil hidroperoksidlər, acil hidroperoksidlər, formaldehidlər.
yüksək temperaturda (600-800 ° C) zaman ilə reaksiya qarışığı tərkibində dəyişikliklər eksperimental tədqiqatlar final yanma məhsulları daxil feed karbohidrogenlərin çevrilməsi prosesi iki mərhələdə irazdelen göstərir ki, ilk, çox yüksək sürətlə axan, CO karbohidrogenlərin oksidləşmə. İkinci, yavaş mərhələdə, CO oksidləşir. Çox əhəmiyyətli bir nəticə belədir: karbonmonoksların yanma qanunlarının çoxu karbon monoksidin yanma xüsusiyyətləri ilə izah edilə bilər.
2.5. Karbon yanması
bir mexanizm heterogen prosesi vasitəsilə karbon vəsaitlərinin yanan xüsusiyyətləri olan kimyəvi addım bərk yanan səthinə ətraf kosmosdan oksidan qaz (hava oksigen) transfer prosesi təcrid hesab edilə bilməz ki. Yanma dərəcəsi həm karbonun kimyəvi xüsusiyyətlərinə, həm də yanacaq səthinə oksigen vermə prosesini müəyyən edən xüsusiyyətlərə bağlıdır. Yanma zonasına oksigen təchizatı diffuziya ilə həyata keçirilir
Korolchenko A.Ya. Yanma və partlama prosesləri
yanan orqanın forma və ölçüsü, qazlı mühitin hərəkəti, oksigenin diffuziya əmsalları və yanacaq səthinin üstündə olan yerlərdə və kömür və koksda olan çatışmazlıqlar və gözeneklərdə əhəmiyyətli miqdarda bir çox amillərdən asılıdır.
Heterojen karbon yanma xüsusiyyətlərini göstərmək üçün 900 ° C temperaturda qızdırılan bir sobada yerləşdirilən ayrı bir kömür parçasının davranışını nəzərdən keçiririk. Başlanğıcda, kömürün yanması onun səthinin yaxınlığında yerləşən oksigen hesabına baş verir. İstifadə edildikdən sonra, yanma məhsullarının bir təbəqəsi qızdırılan səthin ətrafında formalaşır. Yanacaq dərəcəsi azaldılacaq və qaz alanının daha uzaq yerlərindən gələn oksijen olmadığı təqdirdə proses bitərəf ola bilər.
Bu axın diffuziya vasitəsilə baş verir və yanma dərəcəsi diffuziya axını ilə müəyyənləşdirilir. Diffyus intensivliyi əsasən yanan səthə yaxın qaz mühitinin hərəkətinin intensivliyi və təbiətindən asılıdır. Kimyəvi reaksiya dərəcəsi əsasən temperaturla müəyyənləşdirilir. Heterojen reaksiyalar, eyni zamanda homogen, Arrenius qanuna tabe olur.
Yüksək temperaturda karbon oksidləşmə reaksiyası çox tez sürür və prosesin ümumi sürəti oksigenin səthə yayılması ilə məhdudlaşacaq.
Beləliklə, karbon yanma prosesi fərqli təbiətin iki prosesindən ibarətdir: oksigeni təbii qazdan onun istehlak yerinə çatdırılma prosesi və qatı karbon səthi ilə kimyəvi müdaxiləsi prosesi. Hər iki proses bir-biri ilə əlaqəlidir, lakin hər birinin öz qanunları vardır. Bu proseslərin ən vacibi kimyəvi reaksiyalarla xarakterizə edilən oksigen istehlakıdır.
Oxygenin karbonla birləşməsinin kompleks reaksiyasının mexanizmi, CO və C02 iki oksidinin eyni zamanda CX 0 Y tipli ara fizikokimyəvi kompleksi vasitəsilə CO əmələ gətirilməsindən meydana gəlir. Bu oksidlərin nisbəti yanan şərtlərdən asılıdır. Buna görə yanan karbon reaksiyasının tənliyi aşağıdakı kimi yazıla bilər:
Fəsil 2. Yanma zamanı kimyəvi proseslər
Sonra yanan karbon monoksitin homogen reaksiyası davam edir:
onun mexanizmi 2.3 bölməsində müzakirə olunur.
Bu reaksiya karbon səthinin yaxınlığında, beləlikləvə kömür kütləsi içərisində, məsamələri və çatlarında.
Digər reaksiyalar isti karbon və karbondioksid arasında heterojen bir reaksiyadır:
![]()
O, oksigen çatışmazlığı olan yerlərdə nəzərəçarpacaq dərəcədə sürətlə axır, lakin karbon temperaturu kifayət qədər yüksəkdir.
Təsvir edilən reaksiyaların kombinasiyası karbon yanma məhsullarının tərkibini müəyyənləşdirir.
YARANMA PROSESİNİN ƏMƏLİYYATI
| R |
yandırıcı qarışıqlarda sulama onların özünü alovlanması, xarici qaynaq və ya spontan yanma nəticəsində alovlanma nəticəsində baş verə bilər. özünü alovlanma və qaz maye və ya bərk dövlət var maddələrin alovlanma xarakterik proseslər, bərk materialların özünü alovlanma xarakterik (gözəl bölünür dövlət xüsusilə), və ya yüksək qaynama mayelər, bir səthinin sahəsi materialları paylanacaq edin.
3.1. Özünü alovlandırmaq. Stasionar nəzəriyyə
Yanğın insanlara təhlükəli və maddi ziyana səbəb olan zaman və məkanda inkişaf edən nəzarətsiz yanma deməkdir.
Yanğın təhlükəsi insanlar üçün açıq yanğın, kıvılcımlar, ateş, yanma zəhərli məhsullar, tüstü, oksigenin azaldılması, binaların və ya qurğuların dağılmasıdır.
Yanma sürətlə davam edən fiziki-kimyəvi reaksiyadır, istilik və tüstünün sərbəst buraxılması, alovun görünüşü və ya smoldering olması ilə müşayiət olunur. Normal şəraitdə, yanma oksidləşdirici və ya yanan maddələrin atmosfer oksigeni ilə birləşməsi prosesidir. Bununla yanaşı, bəzi maddələr (məsələn, sıxılmış asetilen, azot xlorid, ozon) istilik və alov yaratmaq üçün oksijensiz partlaya bilər. Nəticədə, yanma təkcə mürəkkəbdən deyil, həm də parçalanmadan meydana çıxa bilər. Həm də bilinir ki, hidrogen və bir çox metal xlor atmosferi, kükürd buxarı mis, karbondioksiddə maqnezium və s.
Havada oksigen ilə yanan maddələrin oksidləşməsi zamanı baş verən ən təhlükəli yanma. Eyni zamanda yanacaq sisteminə lazım olan miqdarda enerji təmin edə bilən bir atəş qaynağı olması lazımdır. Ən çox alovlanma qaynaqları bunlardır: elektrik avadanlıqlarının arızalanması, çarpıcı metal gövdələri, qaynaq, dəzgah işləri zamanı görünən qığılcımlar; sürtünmə nəticəsində yaranan istilik; texnoloji isitmə cihazları; yanğın aparatları; adiabatik sıxılma istiliyi; statik elektrik axını; elektrik kontaktlarının aşınması; istilik sərbəstliyi ilə davam edən kimyəvi reaksiyalar.
Bu mənbələrin istilik temperaturu fərqlidir. Beləliklə, bir metal cəsəd vurulduğunda baş verən kıvılcım 1900 ° C-ə qədər bir temperatur ola bilər, bir oyunun alovu haqqında. 800 ° C, kayış konveyörünün qabaqcıl tamburu 600 ° C-ə qədərdir və elektrik boşalmasının istiliyində temperatur 10,000 ° C-ə çatır və dərhal ani kimyəvi reaksiyalar olur.
Yanma tam və tamamlanmamış ola bilər. Tamamilə yanma, oksigenin çox olması ilə baş verən reaksiya məhsulları karbon dioksid, su, azot, kükürd dioksiddir. yanacaq məsələnin tam yanma hava müəyyən bir məbləğ tələb edir və s karbonmonoksit, spirtlər, ketonlar, aldehidlər, - Incomplete yanma, bu halda yanma məhsulları zəhərli və alışqan maddələr oksigen çatışmazlığı ilə yer tutur: - 4.18, torf - ağac 1 kq 5. , 8, propan - 23.8 m3.
Yanma prosesi aşağıdakı kimi təsəvvür edilə bilər. Bir istilik impulsunun tətbiqi ilə soyuq yanan bir vasitə qızdırılır, oksigen və əlavə istilik azad ilə yanma mühitinin sıx oksidləşməsi var. Bu, öz növbəsində sıx bir kimyəvi reaksiyanın baş verdiyi yanacaq materialının qatının istiləşməsinə gətirib çıxarır. Yandırılan bir maddənin qat-qatlı yanması ilə yanma zonası hərəkət edir; Bu hərəkətin sürəti yanma prosesinin intensivliyini müəyyənləşdirir və ən vacib xüsusiyyətidir. Qat-qatlama istiliyi, oksidləşmə və yanma prosesi yanan materialların bütün həcminin tükənməsinə qədər davam edir.
Maddənin qızdırıldığı və kimyəvi reaksiyanın baş verdiyi dar zonaya alov cəbhəsi deyilir.
Yandırılan sistemləri kimyəvi cəhətdən homojen və heterogen ola bilər. Kimyəvi cəhətdən homojen sistemləri yanan qazlar, havalar və tozlar olan yanacaq maddəsi və hava birbaşa qarışıq olan qarışıqlardır. Belə sistemlərin yandırılması birmənalı olaraq adlanır. Kimyəvi cəhətdən birbaşa olmayan sistemlərdə yanacaq maddəsi və hava qarışıq deyil və bir interfeysə malikdir. Bunlar tez-tez yanan yanacaq materiallarıdır və onların yanması heterogendir.
Yanacaq qarışığının Tg-nin yanma müddəti, yanan maddənin və oksigenin τ k ilə təmas üçün lazım olan vaxtı meydana gətirəcəyi vaxtı keçən zaman, kimyəvi oksidləşmə reaksiyası τ x
Bu iki şərtin nisbətindən asılı olaraq diffuziya və kinetik yanma fərqlənir. Qatı yanan maddələr yanarkən, oksigenin maddənin səthinə nüfuz etməsi üçün tələb olunan vaxt kimyəvi reaksiyanın vaxtından daha uzundur, buna görə də ümumi yanma dərəcəsi oksigenin yanma maddəsinə yayılması dərəcəsi ilə tamamilə müəyyən edilir. Bu cür maddələrin yandırılması çox vaxt yanğınlarda aşkar olunur və diffuziv adlanır. Kimyəvi reaksiya dərəcəsi ilə təyin olunan yanma, kinetik deyilir. Bu tip yanma homojen yanacaq sistemlərindən xarakterikdir.
Kalorimetrik, nəzəri və faktiki yanma temperaturunu ayırd edir.
Yanacağın kalorimetrik temperaturu istismar olunan bütün istilik onların istiləşməsinə sərf olunduqda, hava miqdarı nəzəri cəhətdən zəruridir, maddələr tamamilə yandırılır və başlanğıc temperaturu 0 ° C təşkil edir. İstilik itkisi sıfıra bərabərdir. Yanacaq və havanın başlanğıc temperaturu 0 ° C, sonra isə yanma temperaturunun kalorimetrik temperaturu
![]()
burada Qn yanan maddənin dəqiq kalorili dəyəri, kkal / kq; V yanma məhsullarının həcmi, m3 / kq; c yanma məhsullarının orta həcmli istilik gücü, kcal / m3 · deg.
Nəticədə, kalorimetrik yanma temperaturu yalnız yanan maddənin xüsusiyyətlərindən asılıdır və onun miqdarından asılı deyildir. Teorik yanma istiliyi ayrışmaq üçün yanma zamanı istilik itkisini nəzərə alır. Kalorimetrik yanma temperaturu yanan bir maddə üçün ən yüksəkdir və nitel qiymətləndirmə üçün istifadə olunur. Əslində, yanarkən, radiasiya, artıq hava və ətraf mühitin istiləşməsindən asılı olaraq hər zaman istilik itkisi mövcuddur.
Faktiki yanma temperaturu yanğın temperaturu. Daxili və xarici yanğın temperaturu fərqlənir. Xarici yanğın temperaturu alovun temperaturu və daxili istilik otaqdakı tüstünün temperaturudır. Ətrafa istilik itkisi, yanma məhsulları və qurğuların istiləşməsi nəticəsində yanğın zamanı inkişaf edən faktiki temperatur
Teorik olaraq 30% 50% daha az. Məsələn, benzinin nəzəri yanma temperaturu 1730 ° C, faktiki temperatur isə 1400 ° C təşkil edir.
Yanacaq buxarlarının və bir oksidləşdirici maddə olan qazların qarışığı yalnız müəyyən bir yanacaq ehtiyatı ilə yandırıla bilər.
Yanma ehtimalı artıq olan yanan qazın ən aşağı konsentrasiyasına (LEL) daha az konsentrasiya limiti adlanır. Yanma hələ də mümkün olan ən yüksək konsentrasiyaya yüksək konsentrasiya limiti (AIPW) deyilir. Bu sərhədlər içərisində olan konsentrasiya sahəsi atəş bölgəsi adlanır. Atəş tutma alov görünüşü ilə müşayiət olunan yanğındır (yanma başlanğıcı). Bu, davamlı uzun bir yanmadır ki, alovlanma mənbəyi çıxarıldıqdan sonra da dayana bilməz. Aniqliyin alt və yuxarı sərhədlərinin dəyərləri hava, qarışıqların buxar və tozlarının xüsusiyyətlərinə, yanacaq qarışıqdakı inert komponentlərin tərkibinə aiddir. Yanacaq qarışığına təsirsiz qazların əlavə edilməsi alovlanma sahəsini daralır və nəticədə yanmazdır. Yanma reaksiyasını yavaşlatan bəzi tutqunlaşmalar, alovlanma sərhədlərini əhəmiyyətli dərəcədə daraltın. Bunların ən aktiv halojenli hidrokarbonlarıdır. Hər ikisi qeyd olunan xüsusiyyətləri yanan dayandırmaq üçün istifadə olunur. Atmosfer təzyiqi altında qarışıqın təzyiqinin azaldılması da alovlanma sahəsini daralır və müəyyən bir təzyiq altında qarışıq yanmaz olur. Yandırılan qarışıqın təzyiqi artırmaq, alovlanma sahəsini genişləndirir, lakin bir qayda olaraq, bir qədər. Yandırılan qarışıqın temperaturu artdıqca alışma sahəsini genişləndirir. Tutuşmanın konsentrasiyasına da atəş qaynağının gücü təsir göstərir.
Yalnız konsentrasiya deyil, eyni zamanda atəşin temperaturu da məhduddur.
Havadakı buxarların atəşə tutulması üçün temperatur sərhədləri doymuş buxarların alovun aşağı və yuxarı konsentrasiyası limitinə uyğun konsentrasiyalar meydana gətirən yanan bir maddənin temperaturudır. Atəş temperaturu bir maddənin alovlandığı və ya başlamasına səbəb olan ən az temperatur və yanma qaynağını çıxarıldıqdan sonra yanmağa və ya tutmağa davam edir. Atəş temperaturu bir maddənin özünü yanma qabiliyyətini xarakterizə edir. Bir maddənin atəş temperaturu yoxdursa, o, yavaş yanan və ya yanmaz olaraq adlandırılır.
Oksidləşmə reaksiyasının istiliyinin temperaturu altında sürətləndirilməsi özünü alovlandırmaya gətirib çıxarır. Həcmin yalnız məhdud bir hissəsi olan səthin işıqlandırdığı alovlanma prosesindən fərqli olaraq, maddənin bütün həcmində özünü tutma meydana gəlir. Öz-özünə atəş temperaturu maddənin qızdırılması üçün ən aşağı temperatur kimi başa düşülür, belə ki, daha da avtomatik oksidləşmə nəticəsində alovlandıra bilər. Oksidləşmə prosesində sərbəst istilik miqdarı ətraf mühitə istilik azadlığını aşarsa, özünü alovlandırma mümkündür.
Avtomatik alovlanma temperaturu bir maddə üçün sabit deyildir, çünki bu, əsasən, onun müəyyənləşdirilməsinin şərtlərindən asılıdır. Müqayisəli məlumatların alınması üçün test cihazları və qazların və buxarların özünü tutma temperaturu müəyyənləşdirilməsi metodu standartlaşdırılır (GOST 13920-68). Qazı və buxarların hava ilə qarışığı birbaşa qızdırılmalıdır ki, standart metodla təyin olunan ən aşağı temperatura əlavə bir atəş mənbəyi gətirilmədən işıqlandırılmalıdır, standart avtomatik fırlanma temperaturu adlanır.
Spontan atəşin bir növü spontan yanma, yəni atəş qaynaqının təsiri olmadan özünü isitmə nəticəsində yanma deməkdir. Spontan atəşlə spontan yanma arasındakı fərq temperaturun böyüklüyündədir. Spontan yanma ətraf mühitin temperaturunda baş verir və özünü alovlandırmaq üçün maddəni kənardan istiləşdirmək lazımdır.

 İsti və soyuq su təchizatı sayğaclarının göstəricilərinin alınması
İsti və soyuq su təchizatı sayğaclarının göstəricilərinin alınması Müxtəlif formalı və fitinqlərin hava kanallarının sahəsinin hesablanması
Müxtəlif formalı və fitinqlərin hava kanallarının sahəsinin hesablanması Yanma proseslərinin kimyası. Partlayış enerjisi
Yanma proseslərinin kimyası. Partlayış enerjisi Ölçü oxumalarını ötürməzsəniz nə olacaq
Ölçü oxumalarını ötürməzsəniz nə olacaq