ማቃጠል ተጠይቋል. በማቃጠል ጊዜ የኬሚካሎች ሂደት
አንዳንድ መሠረታዊ መግለጫዎች
የአተሞች እና ሞለኪውሎች ቁጥር በችሎቱ ይገለጻል ብዛት ያለው ንጥረ ነገር ወይም የንጥል የሰውነት ቁጥር ብዛት. አንድ ቁራጭ ፍሰት ከ 6.023 ∙ 10 23 እማዎች (አተሞች እና ሞለኪሎች) ጋር አዛምዶታል. N A = 6.023 ∙ 10 23 ሞለ-1 ቁጥር የአቮጋዶ ቁጥር ተብሎ ይጠራል. ሞላ የተቆራረጠ x iክፍል i የ moles ብዛት ጥመርታ ነው i ክፍል i ወደ ጠቅላላው የወሲብ ብዛት n = Σ n i ድብልቅ x i = n i / n).
ቅዳሴ ሜትር የአንድ ንጥረ ነገር መሠረታዊ ገጽታ ነው (በ SI ስርዓት መለኪያ አሃድ ጥንድ ኪሎግራም ነው). የጠቅላላ ስብስብ የጋራ ስብስብ የዩ.ኤፍ. ሚኤ ክፍል i ወደ አጠቃላይ ድብልቅ m = Σ ሜትር i (Wi = m i / m).
ሞለኪዩል ክብደት (ወይም የሞለኪል ክብደት) M i(ግ / ሞል) ክፍል እኔ - የዚህ አካል አንድ ሚዛን ነው. ስለዚህ, ለአቶሚክ ካርበን, ሞለኪውል ሃይድሮጂን, ኦክሲጅን እና ሚቴን አለን: M c = 12 g / mol, Mn 2 = 2 g / ሞል, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. የቅዝቃዜው ሚሜል ሞለ ጥል (M / g / mol) የአካል ክፍሎች ሞለዶች (M = x ሚኤ ሚ).
የፍሳሽ ሂደቶችን መወሰን
የሚቃጠል - ይህ ውስብስብ ቁሳቁሶች እና ቁሳቁሶች ከፍተኛ ሙቀቶች ተፅእኖዎች በኬሚካዊ መስተጋብር ወደ ኦክሲጅን ኤጀንት (በአየር ውስጥ ኦክሲጅን) ወደ ኬሚካል መስተጋብር ውስጥ ሲገቡ, ወደ ከፍተኛ የፍሳሽ ብስባሽነት እና ወደ ከፍተኛ እሳት እና የብርሃን እብጠትን ያካትታል.
የማቃጠያ ሂደቱ ለመከሰቱ የሚያስፈልጉ ሁኔታዎች;
የሚቀጣጠል ንጥረ ነገር (ቫይረስ) መኖር;
አንድ ኦክሳይድ ኦርጋን መኖሩ (ኦው) - የአየር ኦክስጅን;
የማስነሻ ምንጭ መኖሩ (IZ.).
የሚቀጣጠለው ነገር የኦክሳይዱ ሂደት ወደሚጀምርበት የሙቀት መጠን መሞቅ አለበት.
ተቀጣጣይን ንጥረ ነገር ለተወሰነ የሙቀት መጠን ለማቀዝቀሻ የሚሆን የተወሰነ የኃይል ምንጭ ያስፈልጋል.
የማቃጠያ ሂደቱን ለማቆየት የተወሰኑ የነዳጅ እና ኦክሲድ አነሳስቶች አስፈላጊዎች ናቸው.
በጣም አስፈላጊ የሆኑት የማቃጠያ ሂደቶች ሙቀትና ክብደት ማስተላለፍ ናቸው. በጣም የተለመደው የማቃጠል ንብረት የእሳት ነበልባል እና በሙቀቱ ድብልቅ ውስጥ ያለውን ሙቀትን በማስተላለፍ ወይም እንቅስቃሴውን ከቀዝቃዛ ዞን ወደ አዲስ ተቀጣጣይ ቅልቅል በማስተላለፍ.
እሳቶች - ይህ የሚቃጠል መግለጫ ነው. የሚቃጠል ዞን ተብሎም ይጠራል. ተቀጣጣይ ሚዛን ወደ ተሟላ እና ያልተሟጠጡ ብክለቶች ወደ ተለዩበት የሚቀይርበት ክፍል ነው.
ለሞት የሚዳርግ እና ቁስ አካልን የመጉዳት ስራዎች ዋናው የመቆጣጠሪያ ሂደቱ ዋናዎች ናቸው-
ከፍተኛ ሙቀት;
ከፍተኛ ሙቀት
የማቃጠያ ምርቶች አሲሚክ ስብጥር.
የማቃጠያ ሂደቱ በ ሞለኪዩል ኪኔቲክ ሳይንሳዊ ጽንሰ-ሐሳብ ከጉዳዩ ጋር
ምስል 2.1. የነዚህን ሞለኪውሎች መጠን እንደ ቴምብሩ መጠን ይወሰናል: T 2\u003e T 1
በዚያ ውስጥ ሞቃት ፈሳሽ ነዳጅ ሲቀላቀል ትርፍ ኃይሉ ይጨምራል.
በንቃት እንቅስቃሴ ላይ ባሉ ሞለኪዩሎች አማካኝ የኃይል መጠን እና በአገልግሎት ርኩስ አማካኝ ደረጃ መካከል ያለው ልዩነት የእንቅስቃሴ ኃይል ተብሎ ይጠራል. ይህ በምስል ሊወከል ይችላል (ምስል 2).

ምስል 2.2. የፈተናው ኮርፖሬሽን የሃይል ንድፍ GV. + ኤ ፒኤ Œ ፒጂ: E ድርጊት - የማግበር ኃይል, ጥቁር - የቃጠሎው ውጤት መለዋወጥ
"የመጀመሪያው" የተገጠመ ሞለኪውሎች በተገቢው መንገድ የሚፈሩት ኃይል ወደ አጎራባች ሞለኪዩሎች ይተላለፋል. እነሱ በጣም ደስ ይላቸዋል, ሂደቱ በተሰራው ሞለኪውል ዙሪያ በተደጋጋሚ እና ተደጋጋሚነት ይደጋገማል. ለሙሉ ምላሽ (2H 2 + O 2) የኬሚካል መስተጋብር ሂደት ራሱን በራሱ ተዳዳሪነት እና በራስ መሙላት ይጀምራል, የውሃ ሞለኪዩሎችን በማበጀትና ሙቀትን ወደ አካባቢያዊ ሁኔታ በመፍጠር እና የብርሃን ጨረር (ሎሚስቴሽን) ይባላል, ይጀምራል. የሚነሳ እና የሚቃጠል ሂደትን ያሰራጫል.
የእንቅስቃሴው የቁጥር እሴት ሲጨምር, እነዚህ ጥቃቅን ክፍሎች ወደ ኬሚካዊ መስተጋብር እንዲገቡ ለማድረግ በጣም አስቸጋሪ ይሆናል. ስለዚህ የእንቅስቃሴ ድርጊት ዋጋ የዚህ ኬሚካዊ ስርዓት ምን ያህል የእሳት አደጋ ምን እንደሆነ ቀጥተኛ ትንታኔ ነው.
የቃጠሎ አይነቶች እና ስልቶች
መጣር በሚከተሉት ልኬቶች ሊለካ ይችላል.
1. በሚቀጣጠል የመሳሪያዎች ድብልቅ ሁኔታ መሰረት:
ሀ) ካንሰቲክ - የቅድመ-ቅልቅል ጋዝ ወይም የ vapor-air ቅልቅል መደምሰስ. ነዳጅ እና ኦክሳይድ የተባሉት የነዳጅ ቅልቅሎች እስኪቃጠሉ ድረስ ለቃጠሎ ዝግጁ ናቸው ምክንያቱም የፍሳሽ ሂደቱ ጠቅላላ ፍጥነት በኬሚካል የኬሚካል ግጭት መጠን ላይ የተመሰረተ ነው. እንዲህ ያለው ቆዳ በተዘጋ ወይም በተወሰነ መጠን ውስጥ ከሆነ, ፍንዳታ ሊከሰት ይችላል. ድብልቅ በሚፈጠርበት ጊዜ የሚፈሰው ኃይል ከዙህ በሊይ ከዚህ በሊይ ሇማስወጣት ጊዜ አይኖረውም, እኩይቱን በመጨመር, መዋቅሮች ሉጠፉ ይችሊሌ.
(b) ማፈንገጥ እና ማፈንገጥ (ፍሳሽ ማወዛወዝ) የሚቃጠለው መካከለኛ (የነዳጅ እና ኦክሲራይድ ድብልቅ) ከመቃጠያ ዞን ወይንም ከቃጠያ ዞን በፊት ሲፈጠር.
2. በኬሚካል ቅኝት ዞን ውስጥ የሚቀጣጠሉ ነገሮች መቀበላቸው በከፍተኛ መጠን:
a) ሚላሚን, ተቀጣጣይ ድብልቅ አካላት በከባቢ አየር ውስጥ በአንፃራዊነት በተረጋጋ ሁኔታ ውስጥ ይገኛሉ. በዚህ ሁኔታ የሬይንልድስ መስፈርት የቲራዳኒካዊ ስርዓት ተለይቶ የሚታወቀው የሂኖልድስ መስፈርት አኃዛዊው ወሳኝ ከሚለው ወሳኝ ዋጋ በእጅጉ ያነሰ ነው (Re<2300).
ለ) ተለዋዋጭነት ያለው የሙቀት ድብልቅ ከፍታ ዞኖች በፍጥነት በሚጓዙበት ጊዜ. በዚህ ሁኔታ የ Reynolds ቁጥሩ ከ 2300 በላይ ነው.
3. በተለዋዋጭ ቅልቅል ውስጥ የሚገኙትን የተጠቃለለበት ሁኔታ ሁኔታ-
ሀ) ተመሳሳይነት ያለው - ነዳጅ እና ኦክሲጅድ በተመሳሳይ ሁኔታ ውስጥ (ጋሲሚ) ናቸው.
ለ) ተጣጣፊ (ባለብዙ ሓሂብ) - ነዳጅ እና ኦክሳይድ በተለያዩ የተዋሃዱ አገሮች ውስጥ ናቸው.
4. የኬሚካላዊ የኬሚካል ፈጣንና የቃጠሎ ሁኔታ በሰፊው ለማሰራጨት ፍጥነት:
ሀ) የኬሚካል ክምችት ቀጠና (ፍጥነት) መጠን (ከ 0.5 እስከ 50 ሜትር / ሰ) ፍጥነት ያለው የሽግግር ዞን;
ለ) የነፍስ ወከፍ ክምችት በሶሚዮክሳይድ ፍጥነት (በሴኮንድ ብዙ መቶ ሴኮንድ በሰከንድ በሺዎች ኪሎሜትር) ፍንዳታ (ፍንዳታ).
በነፋስ ወይም በጋዞች የሚጠራበት ቦታ ተጠይቋል በእሳት ነበልባል .
የሊማር ነበልባል በቅድሚያ የተቀላቀለ. ቀደም ሲል በተቀላቀለ ድብልቅ እሳቶች ውስጥ ነዳጅ እና ኦክሳይደር ከመቀባቱ በፊት የተቀላቀለ ሲሆን ፍሰት ደግሞ ሚዛን ነው.
ቅመሙ የተቀባው ድብልቅ እጣን ይባላል ስቶይዮሜትሪክ የነዳጅ (ሃይድሮካርቦን) እና ኦክሲጂድ (ኦክስጅን - O 2) እርስ በርስ ይበላጫሉ, ካርቦን ዳይኦክሳይድ (ካርቦንዳዮክሳይድ) እና ውሃ (ኤች 2 ኦ) ይፈጥራሉ. ነዳጅ ብዙ ከሆነ, ድብልቁ ብዙ ሀብታም ነው, እና ከልክ በላይ ኦክስጅን ካለ, ድብልቁ ድብደባ ደካማ ነው ይላሉ.
በጣም ቀላል የሆነውን ምሳሌ ተመልከት.
1) 2 H 2 + O 2 → 2H 2 O - ስቶኪዮሜትሪክ ድብልቅ,
2) ЗН 2 + О 2 → 2 ጂ 2 O + ፪ 2 - ድብልቅ ድብልቅ (፪ 2)
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - የተጣራ ድብልቅ (ኦ 2 በሚበልጥ).
በዚህ ኬሚካዊ ምህዳር ውስጥ ያለው እኩልዮሽ እኩል መጠን ከአንድ እደል አንፃር ጋር ይመሳሰላል. ስለሆነም ከነዚህ ትርጓሜዎች የመጀመሪያው ማለት ሁለት ሞለ ሀ H 2 ከ 2 H ሜ O ከ 2 h ሜል O ፍንጮችን ለመፍጠር ከአንድ ሞር O ኦች ጋር A ሉት.
የኬሚካል የተመጣጠነ እኩልነት የተፃፈ ከሆነ አንድ ሞለድ ነዳጅ መለወጥን የሚገልጽ ከሆነ, ከዚያም በእንደዚህ ያሉ ነገሮች ውስጥ የነዳጅ ሞለ ንትፍሎች ከግንኙነት በቀላሉ በቀላሉ ሊገኙ ይችላሉ.
x ተራሮች, stokh = 1 / ((1 + v)
እዚህ vበኦክስቬይ (CO 2) እና በ H 2 O (ዲ ኤን ኤ) መካከል ያለው የ O 2 ሞለዎችን ቁጥር በመውሰጃ እኩልዮሽ ውስጥ ያሳያል.
H 2 + 0.5O 2 → H 2 O, v = 0.5, x H 2, stoch = 2/3
ኦክሲራይተሩ አየር ከሆነ, ደረቅ አየር የ 21% ኦክሲጅን ብቻ እንዲሁም 78% ናይትሮጅን እና 1% ዘግናኝ ጋዞች ብቻ የያዘ ነው. ስለዚህ ለአየር, X N 2 = 3.762 X O 2. ከዚህ አከባቢ ከፊንቶሜትሪክ ጥራዝ ከፊል ማእከሎች የተጣመሩ ክፍልፋዮች እኩል ናቸው
x ተራሮች, stokh = 1 / (((1 + v ∙ 4,762), ![]() ,
,
የት v ልክ እንደ መጀመሪያው ማለት የ O ኦች ቁጥርን (ሞለዶች) ብዛት የሚያሳይ ሲሆን ይህም ከአንድ ሞለድ የነዳጅ ሞለድ ወደ CO 2 እና H 2 O ሙሉ ለሙሉ መለወጥ ማለት ነው. v እና በነዳጅ ነጠብጣብ አየር ውስጥ ያለው የነዳጅ ውሁድ ክፍል በሰንጠረዥ 1 ውስጥ ይገኛል.
የነዳጅ እና አየር ቅልቅል የተቀላቀሉ ድብልቅ (በዚህ ሁኔታ, ተገቢው የ N 2 መጠንን ወደ ሚስተካከለው እኩል ውስጥ መጨመር አለበት, ሠንጠረዥ 1 ይመልከቱ) በአየር ለተመሳሳይ ተመጣጣኝ መጠን ተለይተዋል.
λ = (x / w ተራሮች) / (x ዋ, stoch / x ተራሮች, stoh) = (w w w w w w w w w w w w w w w w w w w w st w / x mountain, stoch)
ወይም የ \u003cተባይ\u003e - የነዳጅ ተመጣጣኝ ሬሾ ረ (ረ = 1 / λ). የቅየሳውን ሞለ እርከኖች መጠንን ለመለየት ይህ ቀመር ሊለወጥ ይችላል ረ:
x ተራሮች = 1 / ((1+ (4,762 ∙ ቪ) / F), x w = 1 - x ተራሮች,
X ክብደት / 4,762, = ∙ 3,762
የ V ዋጋዎች እና የነዳጅ ክፍልፋዮች ምሳሌዎች x ተራራዎች, በአየር ውስጥ ተመጣጣኝ ነዳጅ ቅልቅል ነጠብጣብ
የመስኖ ሥራ ሁል ጊዜ በኬሚካላዊ ለውጦች አማካኝነት ይታያል. በአየር ውስጥ የሚቀጣጠል - የተቃጠለው ንጥረ ነገር ከኦክስጅን ጋር ያለው ግንኙነት. ይሁን እንጂ የናይትሮጅን, የሃይድድድ እና የኦዞን ኦክሳይዶች በማቃጠያ ሂደት ውስጥ እንደ ኦክሳይድ አሠራር ሊሆኑ እንደሚችሉ ይገነዘባሉ. ከሚታወቁ ምርቶች አንዱ ምንጭ ውስጥ የሚካተቱ የታወቁትን የማቃጠያ ሂደቶች ፈጣን የመበታተን ችሎታ ያላቸው ውህዶች. የነዚህ ውህዶች ምሳሌዎች አሲተሊን እና ሃይድሮይን ናቸው.
በማቃጠል ጊዜ የሚከሰቱ የኬሚካሎች በጣም ውስብስብ ናቸው. በጣም ቀላል በሆነው ጭምር - የኦክስጅን ኦክስጅንን በኦክስጂን ማቃጠል, የአጠቃላይ እኩልዮሽ ቅርፅ
2H 2 + 0 2 = 2H 2 0,
በርካታ ዘጠኝ ደረጃ የአንደኛ ደረጃ ደረጃዎች ተዘጋጅተው ጥናት ተካሂደዋል.
እስካሁን ድረስ እንደ ሃይድሮጂን, የካርቦን ሞኖክሳይድ, ሚቴንና ኤታትን የመሳሰሉ ጥቃቅን ንጥረ ነገሮችን በማቃጠል የኬሚካል ዝውውሮች አሠራር በጥልቀት ተዳሷል. ይህ እውቀት ብዙዎችን ማቃጠል እና የመቀነስ ሁኔታዎችን ለመተንበይ ጥቅም ላይ ይውላል.
2.1. የሰንሠል መለወጫዎች
ሰንሰለቶች በተለመደው የኬሚካላዊ ለውጦች በተቃራኒው በእያንዲንደ ኤሌሜንታሪ ድርጊት ውስጥ የንጥረታዊ ማንነት መገለጫዎች ናቸው. እነርሱም አቶም ባልተለቀለ ኤሌክትሮኖል, ነጻ ዘክሜል ወይም ion. የነርቭ ቅንጣቶች መነሳት የመጀመሪያዎቹ ቁሳቁሶች ወደ ምርት ውጤቶች (ፕሮቲን) መለዋወጥ ያስከትላሉ. አቶሞች, ነፃ አክሲዮኖች እና ionዎች ከቫይነስ-የተደባለቀ ሞለኪውሎች የበለጠ ተለዋዋጭ ናቸው. ስለዚህ, የኬሚካዊ ቁርኝቶችን እና የአርሴኖቹ ቅንጣቶችን ለመግፋት የሚያስፈልገውን ከፍተኛ የኤሌክትሪክ ወጪ ቢወስድም, ብዙውን ጊዜ የብረታ ስርጭት ሰንሰለቶች ፈጠራ ከምናይል ሞለኪውሎች ቀጥተኛ ግንኙነት የበለጠ ጠቃሚ ነው.
የመፍሰስ ሂደቶች በአብዛኛው የሚካሄዱ ሰንሰለት ባለው ዘዴ ነው. ሰንሰለቶች መለወጫዎች - በበርካታ ደረጃዎች የሚካሄዱ ውስብስብ ችግሮች, የሚወክሉ:
ንቁ ሰንሰለቶች (ማነሳሳት), በእንቅስቃሴዎቹ የሚገኙበት ቦታዎች,
ተጣጣፊው ቅንጣቶች ከዋናው ንጥረ ነገሮች ጋር ኬሚካላዊ ትስስር የሚፈጥሩበት ሰንሰለቶች ቀጣይ, በዚህም ምክንያት አዳዲስ ንዑሳት ቅንጣቶች ይዋቀራሉ.
የመጨረሻው ምሰሶ ምርቶች ከመፈጠራቸው በፊት "ገዳይ" የሆኑትን "ሞት" ሰንሰለቶች ይከሰታል
የዚህ ሰንሰለት መነሻ በተለያዩ ሁኔታዎች ውስጥ ሊከሰት ይችላል. ለምሳሌ, በ ኤሌክትሪክ ፍሳሽ ውስጥ ሞለኪዩሎችን በማቀዝቀዣ ኃይል ወይም ionኦት ጨረሮች በማጣታቸው ምክንያት. የነርቭ ቅንጣቶች ሲከሰቱ ሲገናኙ, ነፃ ዘመናዊ ፍጥነቶች (ተመሳሳይነት ያለው ሰንሰለሽ ብልሽት) ሲፈጥሩ, ሲገለጡ, ሲገለገሉ, ተለዋዋጭ ብክሎች ከደረቁ ነገሮች ጋር (ከተቀነጠጠው ሰንሰለታዊ ብልጭታ ጋር) ወይም ከተጋለጡ መከላከያዎች ጋር ሲገናኙ.
ያልተበታተ እና የተከፈለ ሰንሰለት ምላሽ ሰጭዎች አሉ. ሰንሰለቱ በሚቀጥለው ቀውስ ውስጥ በሚሰጡት ለውጦች ውስጥ የሚወሰደው በእያንዳንዱ ንቁ ተጓዳኝ ክፍል ውስጥ አንድ ተፋጥሟል. በእያንዲንደ የነርሲት ብሌች የተሠራሇው የምርት ሞለኪውሎች ብዛት ሰንሰሇቱን ይባሊሌ. በመጋጠሚያዎች ላይ ያሉ ሰንሰለቶች ርዝማኔ ከ መቶ ሺዎች እስከ አስር ሚልዮን ይደርሳል. ያልተቆራረቡ ሰንሰለቶች ፍጥነት በአነስተኛ የሆኑ ጥቃቅን ንጥረነገሮች ለምሳሌ እንደ ፍሳሽ መቆራረጥ የመሳሰሉ ጥቃቅን የተመጣጣኝ መድኃኒቶች ሊነኩ ይችላሉ.
አንዳንድ ንጥረ ነገሮች - አነሳሽዎች - የነቁ ቅንጣቶችን መሥራትን ያመቻቻሉ እና በዚህ ምክንያት ያልተወሳሰለ ሰንሰለትን መለዋወጥ ያፋጥናሉ.
ሰንሰለቱ በሚቀጥለው ሰንሰለቶች ውስጥ በሚጠቀሙበት አንድ ቀዳዳ የሆነ ሰንሰለት ውስጥ በተደጋጋሚ የተሰሩ ሰንሰለቶች ላይ ሁለት ወይም ከዚያ በላይ የሆኑ አክቲቭ ዓይነቶች ይደራጃሉ. አንደኛዋ ዋናው ሰንሰለት ይቀጥላል, ሌሎቹ ደግሞ አዳዲስ ሰንሰለት ይጀምራሉ (ምስል 2.1).
"ድብደባ ማለት የአክቲክ አቶሞች ወይም ሞለኪውሎች ከተለቀቁት ቅንጣቶች ጋር እንዲፈጥሩ ሂደት ነው. እንደገና ሲገናኙ የተፈጠሩ አቶሞች እና ሞለኪውሎች በመሬት ውስጥ ወይም በተፈጥሮ ሁኔታ ውስጥ ሊሆኑ ይችላሉ.
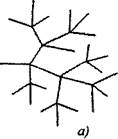
ምስል 2.1. የአመክሮ ሰንሰለቶች ቅደም ተከተል
a) በእያንዳንዱ ሰንሰለት ማቆራረጥ ላይ መሰረዝ
6) ያልተለመደው ቅርንጫፍ
ለምሳሌ ሰንሰለቱ በሚነሳበት ጊዜ ሃይድሮጅን በማቃጠል ጊዜ:
ንቁ አቶም ይሠራል. በሰንሰለት ቀጣይ ምላሽ ውስጥ:

የአዳዲስ ሰንሰለቶች መጀመሪያ የሆኑት የንጥቆች ቁጥር ቁጥር እየጨመረ ነው.
የቅርጽ ሰንሰለቶች (ሪንግሊንግ) ፈጣኖች በቋሚነት ሁነታ የሚጀምሩ ሲሆን ይህም የቅርንጫቡ ፍጥነት ከትክክለኛ ቅንጣቶች ሞት መጠን ያነሰ ነው. በሁለተኛ ደረጃ ደግሞ ሰንሰለቱ ፈጣን በሆነ ሁኔታ እየጨመረ የሚሄድ ሲሆን የመነሻ ቁሳቁሶች ፍጆታ ብቻ ይገደባል. በቋሚነት ወደ ቋት-ነክ ሁነታ የሚደረገው ሽግግር በአስቸኳይ ሁኔታዎች ሁኔታ ላይ ትንሽ ለውጥ ይከሰታል-ከአማራጭ ውስጥ ሙቀት, ግፊት ወይም ትኩረትን. እንዲህ ዓይነቱ ፈጥኖ አፋጣኝ (ኮንቴይነር) ወይም እንደ ሰንሰለት ፍንዳታ (ራዳር) ፍንዳታ (self-ignition) ይባላል.
የሰፈራ ሰንሰለት ግኝቶች መገኘቱ ለካስ ማጥፋት ሂደት የመፍጠር ሂደትን ለመፍጠር ከፍተኛ ጠቀሜታ አለው. ሁለት አይነት እሳት የሚያስከትል መሆኑ ታይቷል. ቅጦች በ
ምዕራፍ 2. በኬሚካሎች ላይ የሚቃጠል
የሠንጠረዥ ሂደቶች ፅንሰ ሀሳብ በእሳት ጊዜ የሚቃጠሉ ሂደቶችን ለማጣራት እና ለማራገፍ ከፍተኛ ተጽዕኖ ያሳድራል.
የዚህ ሰንሰለቶች መነሻ.የመጀመሪያ እንቅስቃሴ የሚያደርጉ ማእከል ሂደቶች ያልተቀነጠቁ ሰንሰለቶች መገንባት ላይ ትልቅ ሚና ይጫወታሉ. በማኅበረሰቡ የማቋረጫ ክውነቶች ወቅት ማዕከላዊ ማዕከሎችን በማጣት ይካሳል. ይህ ዘዴ በመነሻው ማዕከሎች ውስጥ ቋሚ ማዕከላት ለማከማቸት የሚያስፈልጉትን ሁኔታዎች ይወስናል. በአነስተኛ ጅማሬ ጊዜ, ይህ ጊዜ ወሳኝ ሊሆን ይችላል.
በእሳት ነበሮዎች ውስጥ ያሉት አብዛኞቹ የኬሚካኒት እንቅስቃሴዎች ንቁ የሆኑ ማዕከሎች ከፍተኛ ጉልበት አላቸው. በእንደዚህ ዓይነት ሁኔታዎች ውስጥ, ንቁ ማዕከላት መጀመር አንድ ጉልህ የኤነርጂ እንቅፋትን ከማሸነፍ ጋር የተያያዘ ነው.
በዚህ ጉዳይ ላይ ተጨባጭ የሆኑ ማዕከላዊ ደረጃዎች በኬሚካል አክቲቭ, በጨረር, በኤሌክትሪክ መፍጫ, በራዲዮአክቲቭ የመበስ መበስበያ ምርቶች መኖራቸውን የሚያረጋግጡ ምክንያቶች አሉ.
የተግባራዊ ማዕከሎችን ለማመንጨት ከሚያስፈልጉት ነገሮች መካከል የትኩረት ውጤቶች መታየት አለባቸው. በተቃጠሉ ንጥረ ነገሮች ሞለኪውል ውስጥ በንፅፅር ላይ የተንሳፈፉ የብረት-አልባ ቦንዶች እየተዳከሙ ሲሄዱ እና ሲሰነጣጠሉ አነስተኛ የኢነርጂ ወጪ ይጠይቃል. በነዚህ ሁኔታዎች ውስጥ የነቃ የማተሚያ ማእከሎች መጠን በጋዝ መጠን ውስጥ ከፍተኛ ነው. በተቀጣጠለው ቅዝቃዜ ውስጥ በተደረገው የሽምግልና ተጓዳኝ እንቅስቃሴ ውስጥ ያለው የማበረታቻ ኃይልም ተመሳሳይነት ካለው ጋር እኩል ነው. በእውነተኛ የማቃጠያ ሂደቶች ውስጥ ገለልተኛ የሆኑ ማዕከሎችን በማነሳሳት የቋሚ ስርዓት ሂደቶች በአጥጋቂ ስርዓት የተፋጠነ አሠራር ፈጥሯል.
አንዳንድ ገጽታዎች ከአቶሚክ አካላት ጋር በመተባበር ያልተፈጠረ ሰንሰለታዊ ክስተቶች ናቸው. ከንጹህ ማእከሎች ጋር ሳትነፃፅር ከቆሸሸው አሠራር ጋር በማይገናኙበት ጊዜ የዝርጅቱ መቋረጥ ሊከሰቱ የሚቻለው አተሞች በሶስት መንቀጥቀጥ እና በውጭ በሚገኙበት ጊዜ ነው.
በማንኛውም የሙቀት መጠን ሁሉም ያልተሟሉ ንጥረ ነገሮች በከፊል ይጣቀፋሉ. አንዳንዶቹ ሞለኪውሎች ወደ አቶሞች ይከፋፈላሉ. በዚህ ሁኔታ, በማህበረሰቡ ሂደት እና በአቶሞች መካከል ወደ ሞለኪዩሎች መካከል ሚዛናዊነት አለ. የፍላጎቱ መጠን በቋሚነት ሙቀቱ ላይ ነው.
በተቃጠለው ድብልቆሽ ውስጥ ያሉትን ቆርቆሮዎች የማይበጥሱ ከሆነ, የአየሩን አቶሚክ ቅንጣቶች ቅልጥፍናው እስከመጨረሻው አይቀየርም. ወደ ድርጊቱ ውስጥ የገቡት አቶሞች ወዲያውኑ በተመሳሳይ መልኩ እንደገና ይመለሳሉ
ኮርቼንኬ አአአ. የፍሳሽ እና ፍንዳታ ሂደት
lichie. የመጀመሪያ ጅማሬው ለተነሳው አተሞች ለተመልካቾች ምላሽ ባልሆነ ስርዓት መጠን ተመሳሳይ መጠን ይሰጣል. የጣቢያ ፍተሻ በዚህ ሂደት ላይ ተጽዕኖ አያሳርፍም. በሞለኪዩል ውስጥ በሚገኙት አቶሞች መካከል ከሚፈጠረው ጥብቅ ቁርኝት አንጻር በአንዱ የአመክንዮ አካልነት ሚዛናዊነት የዚህ ዓይነታ ባህሪይ ነው. በዚህ ጉዳይ ውስጥ ሌላ የአቶሚክ ተሃድሶ ቅንጅት (ሪአክሲዮሜትር) አዕምሮዊ, ነገር ግን ይበልጥ ሚዛናዊ ነው.
የፍሳሽ ማስወገጃ እርምጃዎችን በአንድ ጊዜ በማነሳሳት, ከተነሱበት ጊዜ በኋላ የቆየ የአገዛዝ ስርዓት የሚመሰረተው ከትላልቅበት ጊዜ በኋላ ነው, ምክንያቱም ክፍተቱ ትልቅ የማንቀሳቀስ ኃይል ይጠይቃል. በዚህ ጊዜ የመነጣጠለው ፍጥነት ከዳግም ማባከን ፍጥነት ይበልጣል, እና ንቁ ማዕከሎች በአመጽ ስርዓቱ ውስጥ ይሰጋሉ. የሁለቱም ሂደቶች ድግምግሞሽ ሚዛን በንፅፅር ማዕከላት ውስጥ የሚገኙትን ማዕከላዊ ማዕከላት ከፍ በማድረግ ብቻ ተመርጠዋል. ይህ ጊዜ የግብአት ወቅት ተብሎ ይጠራል.
በአክሲዮኑ ቀበሌ ውስጥ እንደ ነዳጅ ንጥረ ነገር መኖር የአየር ሙቀት መጨመርን ሁኔታ አይለውጥም. ተለዋዋጭው የፊትና የተገላቢጦሽ ግኝቶች እኩል ነው. ማዕከላዊ ማዕከሎች በጠንካራ ወለል ላይ ብቻ ሳይሆን በመበስበስ ላይ ናቸው. ይሁን እንጂ አንድ ጋይድላይን መኖሩ የ ሚዛን ግጭት መኖሩን ያፋጥናል.
በእንሰት ሰንጥቀሽ ግብረመልሶች ውስጥ ለመሳተፍ የሚችሉ ተሳሳፊ ንጥረ ነገሮች በተቀጣጠለው ቅልቅል ውስጥ የሚገኙ ከሆነ, ንቁ ማዕከሎችን የሙቀት መጠን ይቀንሳሉ. በዚህ ሁኔታ የመነሻ ክፍሉ የክብደት መለዋወጥ ይረብሸዋል, ይህ ደግሞ ውጤቱን ያቀዘቅዘዋል, ወደ ማቋረጡም ሊያመራ ይችላል.
ሙከራዎች እንደሚያሳዩት የውጭ ምንጮችን ከውጭ ምንጮች (ለምሳሌ የብርሃን ምንጭ) ማቅለል ሲጀምሩ, የመቃጠያ ሂደቱ የመነሻ ማእከሎች ትኩረትን ሚዛናዊ በሆነ ደረጃ ላይ ማራዘም ይችላሉ.
በተመሰረቱ ሰንሰለቶች ላይ በሚደረጉበት ወቅት, የመጀመሪያ ጅማሬው ሁኔታዎች በግብረመልስ ሂደት ላይ ከፍተኛ ተፅእኖ አላቸው. በቀስታ የሚንቀሳቀሱ ሂደቶች ውስጥ, በከፊል ተለዋዋጭ የሆነ ድብልቅ ወደ መጀመሪያው መጨመር የመግቢያ ጊዜውን ያሳጥረዋል እናም የእሳት ቃጠሎን ፍጥነት ያፋጥናል.
የ ሰንሰለቶቹ ቀጣይነት.ያልተሰሩ ሰንሰለት ፈሳሽ ባህሪያት የባህላዊ ማዕከሎች ከፍተኛ ደረጃ ላይ ነው. ክፍት ዑደት በሌለበት, ገለልተኛ ቅንጣቶች በውስጣቸው ተገንብተዋል
ምእራፍ 2 በቃጠሎ ጊዜ የኬሚካሎች ሂደት
የሚጠቀሙባቸው ተመሳሳይ መጠን. አዲስ በሚነሳበት ጊዜ ብቻ ይነሳል. በእንቅስቃሴዎች ማዕከላት እና ሰንሰለኪያዎች ማለቂያ አማካይነት በእኩል መጠን የሚያገለግሉ እና ቀጣይነት ያላቸው ማዕከሎች እና ቋሚ ምላስ እንቅስቃሴዎች ይዘጋጃሉ. የመጀመሪያዎቹ ክፍሎች ሲቀሩ የአየሩ ድክመት ይቀንሳል.
በተሰረዘበት ሰንሰለት (ሪች) ሰንሰለት ውስጥ, በተነሳሽነት ስርአት ውስጥ የሚገኙት የማገገሚያ ማዕከሎች በየትኛውም ሁኔታ ላይ ቢሆኑም የጨመረባቸው ናቸው. በአፍንጫው ቁመት ያለው ራስን የመፍጠን ስሜት ሁነታ ተከናውኗል. በዚህ ሁኔታ, የመጀመሪያውን አካላት ሙሉ በሙሉ ወደ ውጤቱ ምርቶች ወደ ሙሉ ለሙሉ እንዲሸጋገር አንድ የመጀመሪያ ንቁ ማእከል በቂ ነው.
የተንዛዙ ወሳኝ ግብረመልሶች የሲኒክስ እኩልነት ቅደም ተከተል ነው. የተረጋጋው የመጀቢያዎች ቅንጅቶች በጊዜ ሂደት ላይ ሲለዋወጡ ለመጀመሪያ ግዜ ሊታወሱ ይችላሉ, እና በስራ ላይ ያሉ ማእከሎች (አህጉራዊ ማዕከሎች) ፈጣን ለውጥ ብቻ ነው ሊወሰዱ የሚችሉት. ገጽበዚህ ፍጥነት የሚደረጉ ለውጦች የሚጀምሩት በመነሻው ጅምር መጠን እና የቅርጫት እና ሰንሰለቶች መዘግየት ምጣኔዎች ጥምርታ ነው. የመጀመሪያው የመነሻ ፍጥነት በሲስተሙ ውስጥ የሚገኙት ንቁ ማዕከሎች ላይ የተመሰረተ አይደለም. የማፈራረስና የማቋረጥ ሂደቶች ከትክክለኛ ማዕከሎች ስብስብ ጋር ተመጣጣኝ ናቸው. በእንደዚህ ዓይነት ሁኔታዎች ውስጥ, የተግባራዊ ማዕከሎች አሠራር እና ወጪ አጠቃቀምን የሚያጠቃልለው በማነሳሳት, በማፈራረስና በማፈራረቅ ሂደቱ ድምር ነው.
![]() (2.1)
(2.1)
የቅርንጫፍ እና የማቋረጥ ምላሾች ብዛታቸው ቋሚዎች. በመጥቀስ, እኛ የሚከተለውን ያገኛሉ:
![]() (2.2)
(2.2)
የገበያ ማእከሎች የሙቀት ደረጃዎች የጊዜ መለያዎች ሲሆኑ
አዎንታዊ ነው. የፈተናው ፍጥነት በጊዜ እየጨመረ ይሄዳል. ይህ የሰንሠለት የስርዓተ-ፆታ ምልከታ ባህሪይ በእንደዚህ ዓይነት አሠራሮች ውስጥ በሚባዙት ማዕከሎች በማባዛት ነው.
ኮርቼንኬ አአአ. የፍሳሽ እና ፍንዳታ ሂደት
ከተገቢው መጀመሪያ በፊት ስርዓቱ ንቁ ማዕከሎች አልያዘም, ማለትም, በt= 0, n = 0 የእኩልነት ማሟያ (2.2) ይሰጣል:
![]() (2.3)
(2.3)
የ CO አጠቃላይ የተጋላጭነት ድግምግሞሽ መጠን በቅርንጫፉ ሂደቱ መጠን ይወሰናል. የመጨረሻዎቹ ምርቶች የሚፈጠሩት በዚህ ምላሽ ወቅት ነው. ለእያንዳንዱ ኤሌሜን ሰንሰለት ቅርንጫፍ ክስተት, የመጨረሻው ሞለኪውል (ሞለኪዩል) ይባላል. የሚከተለው ነው:
![]() (2.4)
(2.4)
የሰንሰለት ክስተት በጊዜ ሂደት መፈጠር የሚቻለው በቅርጫት እና ሰንሰለቶች መቋረጦች መካከል ያሉ ጥረቶች ብዛት እና በእኩል (2.4) ውስጥ ያለው ጠቋሚ አዎንታዊ እና ዳግም-
እርምጃው ያልተገደበ ፈጣን ነው. በቀድሞው የግንኙነት ጊዜ ውስጥ የሚከተለው ግንኙነት እውነት ነው:
የመነሻው ጅምር መጠን አነስተኛ በመሆኑ በመነሻው ወቅት ምንም ግልጽ የሆነ የኬሚካል ለውጥ የለም. ከተወሰነ ጊዜ በኋላ ዋጋው ከአንድ በላይ ይበልጣል. ከዚያ በኋላ በ 2.4 (2.4) መሠረት የተሰጠው የግንኙነት መጠን በፍጥነት መጨመር እና በጣም ትልቅ ትልቅ ዋጋዎችን መጨመር የሚቻል ቢሆንም, ከዚህ በፊት በቀላሉ ሊታይ ይችላል.
የሰንሰለት ክስተት በሚፈጠርበት ጊዜ የመዘግየት ወቅት (የሽምግልና ጊዜ) መገኘት በአመዛኙ ስርዓት የተወሰኑ የነቃ ማእከሎች የማከማቸት አስፈላጊነት ነው. ይህ የኬሚካል ለውጥ በኋላ ብቻ የሚታይ ይሆናል.
በሰንሰለት ግብረመልሶች ውስጥ የመታወቂያ ጊዜው መጠን መጠን የቅርንጫሚን እና የማሳያ ሂደቱን ማቋረጥ ሂደቶች ሬሾውን ይወስናል, መነሻ ጅማሬ ሳይሆን. በተራው ደግሞ የቅርንጫፍ እና የፍሳሽ ክውውቶች በእያንዳንዱ የአስተካክላት ስርዓት ኬሚካሎች ምክንያት የሚከሰቱ ናቸው, በእውቂያዎች ላይ ባለው የሙቀት መጠንና የደም ኙ ክፍሎች ውስጥ ጥገኛዎች ናቸው. የሰንሰዓት ግብረመልሶች ልዩነት
የቅርንጫፍ ሂደቱ አስፈላጊ የጉልበት ኃይል ይጠይቃል, የአከፋፋ ሂደቱ የሙቀት መጠኑ የሙቀት መጠን ግን ዜሮ ሲቃረብ ነው. በሶስቱም ዓይነት ሰንሰለቶች መቋረጡ በሚፈጥሩ ግብረመልሶች በጅምላ እና በተቀነባበረ ውቅዶች ውስጥ, የሬሲሺየቶች እና የንጥቆች እኩይ ምህዳራዊ ግንኙነት በዜሮ ውስጥ ነው.
በሙቀት መጠን መጨመር, የድብደቱ ጠቅላላ ግፊት, ወይም በአመዛኙ አካላት ላይ ለውጥ, የቅርንጫፍ ቋት መለዋወጫዎች እና መለወጫዎች መለወጥ ይቻላል, ይህም ከጽህፈት እስከ ቋት ጸባይ አይቀየርም. የዚህ ሂደት ልዩነት ከአንዴ ሁነታ ወደ ሌላው የግብረ-ገብነት ፍጥነት ከማይነከረው እሴት ወደ የማይለወጥ ከፍተኛ ዕድገት ለመቀየር ነው.
የአንዳንድ ሰንሰለት ግኝቶች ፈሳሽ በአንፃራዊነት የማይነቃቀኑ መካከለኛ ምርቶች ሲፈጠሩ, ታታሪ ማዕከሎች ለማቋቋም ችሎታ አላቸው. እነዚህ ግጭቶች, ለምሳሌ, የሃይድሮካርቦን ኬሚካሎች መለዋወጫዎች, በፔርሞኖች እና በአዴዴይዶች ውስጥ በሚገኙባቸው ማዕከቦች ውስጥ ይካተታሉ. ይህ ደግሞ ወደ ሰንሰለት ቅንጭትን ያስከትላል. ይሁን እንጂ በአመዛኙ መካከለኛ ምርቶች አንጻራዊ መረጋጋት ምክንያት የመረጋጋቱ ሂደት ከጊዜ ወደ ጊዜ እየሰፋ ይሄዳል. እንዲህ ያሉ ዘገምተኛ የፍቅር ሰንሰለቶች ተበላሸዋል ይባላል.
ከተለመደው ሥርያዊ ሥርወ -ተቃያ ስርዓት ጋር ያለው ሰንሰለቶች, በመሠረቱ, በመሠረቱ ከፍተኛ በሆኑት እንቅስቃሴዎች ምክንያት, በፍጥነት ይጓዛሉ. የተፈለገው ተፅዕኖዎች በፍጥነት የሚያፋጥኑ እርምጃዎችን ይጀምራሉ ወይም እንደገና ይሞላሉ እና ከሂደቱ ይወጣሉ.
ዲስክን ክፈት እንደ ማንኛውም የጋዝ ሞለኪውል ገለልተኛ የሆነ ንጥረ ነገር በአመዛኙ ሲስተም ውስጥ የሌላ ሞለኪውሎችን ይገድላል. በተመሳሳይ ጊዜ, ከሌላ ተጓዳኝ ክፍል ወይም ሞለኪውል ጋር ተባብሮ መቆራረጡ እና የቀደመውን ዱካ በቀጣይነት የሚቀጥል አዲስ ሞዴል መፈጠር የተወሰነ ዕድል አለው. የነዋሪ ማዕከሎች ዝውውሩ በኬሚካላዊ ግኝት ተያይዞ ቢሆንም የጥርጣሬ ሰንሰለቱ እድገቱ ግን ከዋናው የቡናያን እንቅስቃሴ የመርከብ ሞለኪውሎች እንቅስቃሴ ጋር ተመሳሳይ ነው. በሁለት ወይም ከዚያ በላይ ዓይነቶች ሰንሰለት ተለዋዋጭ የሙሉ ማዕከሎች እድገት ሂደት ላይ.
ኮርቼንኬ አአአ. የፍሳሽ እና ፍንዳታ ሂደት
ገዳይው ንጥረ ነገር ሳይወሰን እንደገና ምላሽ በማይሰጥበት ጊዜ እስከሚቀጥለው ድረስ የግብረመልስ ሰንሰለቶች ይቀጥላሉ. በዚህ ጊዜ ክፍት ዑደት ይባላል. የማቃጠል ሂደቶች በሰንሰለት ግብረመልሶች የስነ-ንፅፅር ትልቅ ሚና ይጫወታሉ. ለተግባር ማዕከሎች ሞት ምክንያት የሆኑ ሁለት አይነት እርምጃዎች አሉ:
ሆሄኒየማዊ እረፍት (በቅዝቃዜ ድብልቅ ድምጽ ሞት);
ሄትሮጌኔክ መስራት (በጠፈር ላይ መሞት) በአንድ ላይ ከሁለት አንዱ ሂደትን በመጠቀም ሆሄራዊ የብረት ሰንሰለቶችን ማቋረጥ ይቻላል.
መድሃኒቶች እንደገና ሲገናኙ ወይም የተለያዩ የኬሚካል ተግባሮች ከተገቢ ማዕከሎች ጋር ሲገናኙ የኋሊዮሽ ዳግም መመለስ አይኖርባቸውም.
Heterogeneous chain chain breakthrough occurs during the combustion በሚባሉት የሟስ ቅንጣቶች ላይ ወይም ጠንካራ በሆነ የማቃጠል ቁሳቁሶች ላይ ነው. በከባቢ አየር ላይ ክፍት የሆነ ዑደት የነዳጅ ማእከሎች ከጋዝ ቅልቅል ወደተቋረጡበት ይህ ቦታ እንደሚሸጋገሩ ይቆጠራል. በጠንካራማው ገጽ ላይ የአበባው አመላካች ሁኔታ በተቀላጠፈ ሁኔታ ላይ የሚጨመረውን አክቲቭ ሴል በማይታዩበት ሁኔታ ላይ ነው. በዚህ ሂደት ውስጥ ምንም ኃይል እና የመገኛ አካላት አለመኖራቸውን ስለሚያገኙ በአቅራቢያው በሚገኙ ቦታዎች ላይ የሚጣጠሙ ቀውሶች እርስበርሳቸው ይገናኛሉ. በተደጋጋሚ የተፈጠረው የረጋ ተፈጥሯዊ ሞለኪውሎች ሰንሰለትን ፈሳሽ በማስተባበር ሂደት ውስጥ አይካተቱም.
ሆኖም, በእርጥብ ብረት ላይ የሚከሰተው እያንዳንዱን ንጣጭ ግጭት ወደ መሳብ አይመጣም. ምናልባትም ከውጪው ነጸብራቅ ሊሆን ይችላል. በከባድ አሠራሩ በአንድ ማዕከላዊ ማዕከላዊ ቦታ ላይ የማምለጫው የመጠለያ ዋጋ (ኮንቲፊሽ) ተብሎ ይባላል. ይህ የቁጥር አንኳር በንጥሉ እና በንጥሉ ውስጥ የኬሚካል ጥቃቅን ባሕርይ መገለጫ ባህሪ ነው. በጣም ጠቃሚ በሆኑ ጉዳዮች ላይ, ከግድግዳው በኋላ ነቃፊው የእርከን ንጥረ-ነገር ከርቀት አልተንቀሳቀሰም. መኖሪያው እስኪፈርስ ድረስ ከግድግዳው ጋር አዲስ ግጭቶች ሊኖሩ ይችላሉ. በዚህ ሂደት ምክንያት, በተወሰኑ ሁኔታዎች, የአመጋገብ ምጣኔው ከዋናው የመቀየር አኳኋን የተለየ ነው. ሂደቱ እንደ አውሮፓ ህብረት ነው
* ሶስት - በአከባቢው ንጥረ ነገር ውስጥ በተመጣጠኑ አካሎች (ወይም ፈሳሽ) መሳብ. የሚረበሰው ሰው ሰባሪ (ጠጣር) በመባል ይታወቃል- sorbate. የኣካባቢው ጥራጥሬ (ሙቀትን) እና የተንጣለለ ንብርብር (ማነፃፀር) ሚዛን ለመለየት መለየት. በፀረ-ጥፍሩ እና በሸንቢው መካከል ያለው የኬሚካላዊ ቅርጽ ከኬሚራይዘሬቲቭነት ጋር ይስተካከላል.
__________________________ ምእራፍ 2 በቃጠሎ ጊዜ የኬሚካሎች ሂደት
በእያንዳንዱ ግጭት አንድ ክፍት ውዝግብ ከተፈጠረ. ከላይ ያለው ማዕከላዊ ማዕከላት ወደ ዜሮ ሊወሰዱ ይችላሉ.
በተገቢው ድብልቅ ውስጥ ነጠብጣብ ያልሆኑ ነጠብጣቦች በሌሉበት, ሰንሰለቱን ማቃጠል በጠንካራ የፊት ገጽ ላይ ወይም በጅምላ ውስጥ ድብሶችን በማቀላቀል በንፅፅር ላይ ሊከሰት ይችላል. በእውነቱ በእሳት ውስጥ ሁለተኛው መንገድ በመተግበር ላይ ነው.
በተለዋዋጭ ሰንሰለት ግኝቶች ላይ በተወሰነ ተፅእኖ ላይ የሚያሳድረው ተጽዕኖ በአንደኛው የጋዝ ጋዞች መልሶ መቋቋም ላይ ተጨማሪ ተፅዕኖ አለው. የአትክልት ቅይጥሎች ከአንዳንድ ንዑሳን ቅንጣቶች ጋር የመገጣጠሚያዎች ብዛት ይጨምራሉ, የሰንሰለት ብልሽት የመጨመር ሁኔታን ይጨምራሉ, እናም በአጠቃላይ አጠቃላይ ምላሽ ይከላከላል.
የዝንሰንት ግብረመልሶች ይበልጥ ውጤታማ የሆነ መገደብ በንቃተ-ቂጣዎች (አሲዮተርስ) መከላከያዎች (አሲዮተርስ) ውስጥ ወደ ማቀዝቀዣ ድብልቅ ሲገቡ ይደረጋል. ኢሲድ አክቲቪዶች ከዋነኞቹ ማዕከሎች ጋር ግንኙነት ይፈጥራሉ, ይህም ውጤቱን ይመራሉ, ሰንሰለቱን ይሰብራሉ. በተገቢው ድብልቅ ውስጥ የተከሰተው የኪንኖሜትር ቅኝት ከዋና ማዕከላት ጋር በሚገናኝበት ጊዜ ከተቆጣጣሪው ዋና ዋናዎቹ መካከል ባለው የውድድር ሁኔታ የሚወሰነው ነው. በአለፉት የእንተርገተኛ ማዕከሎች ከፍተኛ የእርግብግብታ እና በአዳዲስ መካከለኛ እርከኖች የመተንፈሻ አሠራር አማካኝነት ቀደምት የሰዎች ሰንሰለት ተከላካይ ጥቃቅን ተጓዳኝ ሰንሰለቶች ፈንጂውን ሙሉ በሙሉ ሊያሳድጉ ይችላሉ.
በእሳት እና በፍንዳታ መከሰት ሂደት ውስጥ የእርሾው ሂደቶች ከፍተኛ ጠቀሜታ አላቸው. የማገገሚያዎች አጠቃቀምን የመቦካሾችን ሂደት በተሳካ መንገድ ለመቆጣጠር ያስችልዎታል.
2.2. የኬሚካሎች ሂደት ሃይድሮጅን በማቃጠል ጊዜ
የሃይድሮጂን ሞለኪውል ከአንድ የኦክስጅን ሞለኪውል ጋር ያለው ግንኙነት በተከታታይ ደረጃዎች አማካኝነት ውስብስብ በሆነ መንገድ ይቀጥላል. አሁን የሃይድሮጅን መፈክረሻ ሰንሰለት በተገቢው ሁኔታ የሚንቀሳቀሱ ተዋንያን የሚጫወቱ ማዕከሎች ናቸው. የተለያዩ የሃይድሮጅን ማብጠያዎችን ለማምረት እና ለመገንባት የተለያዩ ሁኔታዎችን በዝርዝር ይዘርዝሩ ስለ ሃይድሮጂን በሚቃጠሉበት ወቅት የአንደኛ ደረጃ ክስተቶች ቅደም ተከተልና አስፈላጊነት በዝርዝር ተገልጸዋል.
በፕሮፌሰር ኤ. ባ. ባራቶቭ የሙከራ እና የግዴታ ዘዴዎችን በመጠቀም በሃይድሮኒን ሞድ ሂደት ውስጥ ስለ ሃይድሮጅን ውስጠኛ ሂደት በጣም ትንታኔ ተካሂዷል. ቀጥሎ የተዘረዘሩትን የአሰራር ሂደቶች ያቀረብነው-
ኮርቼንኬ አአአ. የፍሳሽ እና ፍንዳታ ሂደት
የእነዚህ ንቁ ማዕከላት መነሻ በአጋጣሚ ነው
![]()
የግብረመልስ ሰንሰለትን መቀጠል
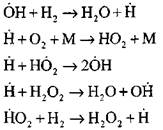
ቅርንጫፍ ሰንሰለቶች
 |
ክፍት ዑደት
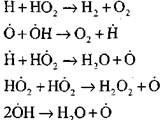 |
በመጀመሪያው የመግቢያ ሂደቱ ውስጥ የሃይድሮጅን አቶሞች ቅልጥፍና የመጀመሪያው ሃይድሮጂን ይዘት አነስተኛ ነው. የሰንሰለት ክስተት በሚፈጠርበት ጊዜ የሞለኪውል ሃይድሮጂን መለወጥ እጅግ በጣም ከፍተኛ በመሆኑ የአንዲት ሴኮንድ መቶ በመቶ ይባላል.
2.3. ካርቦን ሞኖክሳይድ ሲቃጠል የኬሚካሎች ምላሽ
ለካስ ማጥፊያ ሂደቶች ዋነኛው የካርቦን ሞኖክሳይድ ከኦክሲጅን ጋር ያለው ትስስር ነው. በወቅቱ ይህ ምላሽ
__________________________ ምዕራፍ 2. የኬሚካላዊ ሂደትእየፈጠለ ነው
ብዙ ሁኔታዎች የካርቦን-በውስጡ የያዘውን ቁስ ማውጫ የመብቶች ህግ ይወስናል. ምላሹ በአሰቃቂ ሰንሰለት ተለይቶ ይታወቃል. በርካታ ባህሪያት አሉት.
ለረዥም ጊዜ በጣም በከባቢው የ CO እና ጥቁር ኦክሣይ (CO 2) ጥቃቅን እና ማቃጠል እንደማይቻል ያምን ነበር. ሆኖም ግን, በጥንቃቄ የተሞሉ ሙከራዎች በንፅፅር ሳጅግራፍ በመጠቀም ውሃ አለመኖር የተካሄደባቸው ጥቃቅን ድብልቅ ጥቃቅን ድብልቅ ጥራቶች ሊኖሩ እንደሚችሉ አሳይተዋል. በስርዓቱ ውስጥ የ CO + 0 2 በውሃ ወይም በሀይድሮጅን መገኘት የነዳጅ ማደሻዎችን ቁጥር በማሳደግ የማሞቂያና የመቀጣትን ሂደት ያበረታታል. በተለይም የውሃ መጨመር በተለይም በዝቅተኛ ማዕዘናት ውስጥ ሊታወክ ይችላል.
ከዚህ በታች በተዘረዘሩት መሠረታዊ ሂደቶች ውስጥ የካርቦን ሞኖክሳይድ ማስወገዱ በውሃ ትነት ወይም በትንንሽ ሃይድሮጂን መጨመር ላይ ይገኛል.

ሬሺዮዎች, H0 2, በተደጋጋሚ የተፈጠረው (VI), ሰንሰለቱን (ንዝረት VIII) ወይም ሰንጥቆቹ (IX-XII) ሊያስከትል ይችላል.
ሰንሰለትን ፈንጂዎችን ወደ ሰንሰለቶች ፍንዳታ ለመቀየር ሁኔታዎችን ለመለየት, ሰንሰለቱን ማቋረጥ በሂሳብ H0 2 መካከል ያለውን ዕድል እንገምታት. እዚህ ላይ የኛ የግጭት (X) እና (XI) ሚና ሰንጠረዥ ማቋረጫው በጣም ዝቅተኛ ይሆናል
(IX) ጋር ሲነጻጸር, በ 1000 ኪነት ቅደም ተከተል የሙቃተ ቀደሞች (IX-XI) ቅርበት እርስ በርስ ሲቀራረቡ, ነገር ግን አክቲቪስቶች ከፍተኛ የኬሚካላዊ እንቅስቃሴ ስላላቸው የሃይድሮጂንስ ማከማቸት በጣም ዝቅተኛ በመሆኑ ነው. ስለዚህ, ዑደት H0 2 ውስጥ ክፍት ዑደት ምናልባት በፎንት መልክ ሊጻፍ ይችላል:
በ 1000 ኪ.ሜ የሙቀት መጠን
ስለሆነም ያንን
![]()
![]()
መጠኑ ውጤት
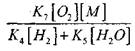
እዚህ ላይ እኩል መሆን (2.7) ደካማ ነው.
ምእራፍ 2 በቃጠሎ ጊዜ የኬሚካሎች ሂደት
በ ![]() ወይም
ወይም ![]() (በ ውስጥ ምን እንደሚከሰት
(በ ውስጥ ምን እንደሚከሰት
በእውነተኛ እሳቶች በ), እኩልታ (2.7) ወደ ቅጽ ይለወጣል:
![]() (2.8)
(2.8)
ስለዚህ, የካርቦን ሞኖክሳይድን በአየር ውስጥ የማቃጠል ሁኔታ በአብዛኛው የሚወሰነው በሃይድሮጂን ማቃጠል በንጥረትም ሆነ በድርጊት ነው. የኬብስተን ኦክሲዮሽን (I) በተመጣጠነ ሁኔታ በኦክስረይ ሓይኖዎች ላይ በሚመሠረቱት የኦ ኤች ሃሮስ ቁጥሮች ላይ የተመሰረተ ነው.
የካርቦን ሞኖኦክሳይድ አመጋገብ ልዩነት በሃይድሮጂን አቶሞች ከፍተኛ ጠቀሜታ ባለው የሂሣብ አቀማመጥ ስርዓት ውስጥ አነስተኛ አሲዶች በተጨመሩበት ጊዜ ፈጣን ተጽእኖ ነው. ካርቦን ማቃጠልን የሚገድሉ እነዚህ ንጥረ ነገሮች h ውርዶች እና የሃይድሮካርቦኖች ሃሎማዎች ናቸው. በሂደቱ ምክንያት ከሃይድሮጅን አተሞች ጋር በሚገናኙበት ጊዜ የውጤታቸው ሰንሰለት መቋረጥ ምክንያት የሚደርስባቸው ተፅዕኖ
2.4. ሃይድሮካርቦን መቃጠል
የሃይድሮጅን እና የካርቦን ሞኖክሳይድ የማቃጠያ ሂደቶችን መመርመር የቃጠሎውን የመለኪያ ስልት ውስብስብነት ያሳያል. በ H 2 እና በኦ.ሲ. ከሆነ ውጤቱ ብዙዎቹ አንደኛ ደረጃ ደረጃዎች እና መካከለኛ ምርቶች ከሚሳተፉበት ሰንሰለት ጋር ይመሳሰላል. ስለዚህ በጣም ውስብስብ የሆኑ ንጥረ ነገሮች - ሃይድሮካርቦኖች የበለጠ ውስብስብ ናቸው ብሎ ማሰቡ ተፈጥሯዊ ነው. ከነዚህም ውስጥ የተቃጠሉ እና የእነዚህን ጥቃቶች ሂደቶች ተከትሎ የሚመጡ ውጤቶች በጣም የተለያየ ናቸው.
በአሁኑ ጊዜ የሚገኙትን የሃይድሮካርቦን ኬሚካሎች በቃጠላቸው ሂደት ላይ የኬሚካዊ ከፍታ መቆጣጠሪያዎች በተወሰነ ደረጃ ላይ ተመስርቶ የተገኙትን ተፅዕኖዎች ለማብራራት ያስችለናል.
በውቅያኖሶች ውስጥ በሚታወቀው የሃይድሮካርቦን ነበልባል ውስጥ, ከተለመዱ ንዑሳን ቅንጣቶች ጋር, እጅግ በጣም ውስብስብ አወቃቀር (ዲዛይኑ) በጣም ብዙ የሆኑ መካከለኛ ምርቶች አሉ. በአንዳንድ ሁኔታዎች, አዳዲስ ሰንሰለቶች ብቅለት ምንጭ ይሆናሉ. በሃይል ማመንጫዎች እና በማቃጠል ሂደቶች ውስጥ ዋና ሚና በሚከተሉት የሚከተሉትን መካከለኛ ድብልቆች ይጫወታል.
ኮርቼንኬ አአአ. የፍሳሽ እና ፍንዳታ ሂደት
1. የሃይድሮካርቦን ራዲስስ, እሱም ሞለኪዩል ነው
አንድ ወይም ከዚያ በላይ የሃይድሮጅን አተሞች የተወገደው ላቮዶዶዶ. እነዚህ
(K 3 - ሜታኒየም; C 2 H 5 - ethyl; C 3 H 7 - propyl እና
ወዘተ ...). በነፃ ከፍተኛ የአነቃቂነት ደረጃዎች, ነፃ አል-አሌክሎች
ለረጂም ጊዜ የለም. እንደ ነጭ መካከለኛ ሆኖ በእሳት ነበልባል ውስጥ
ምርቶች. ከሌሎቹ ሞለኪውሎች ጋር መስተጋብር ሲፈፀም
እንደ ገለልተኛ መዋቅራዊ ቡድን. ሃይድሮካርቦን ራዲካልስ
በአብዛኛው በደብዳቤ የተወከለው.
2. ፐርኦክሳይድ - ጠቅላላው ቀመር R-00-R ".
3. አልዳዪድ - አይነት ሞላጮች
![]()
በጣም ቀላል የሆኑት የአልዲየዝድ ፎቆች (ፎርማልዲድዴ) እና አሲቲክ (አቴለኔይዴ) ![]() . እነዚህ ነገሮች በሙሉ ናቸው
. እነዚህ ነገሮች በሙሉ ናቸው
የሃይድሮካርቦኖች ባልተሟሉ ምርቶች ውስጥ ይገኛሉ.
በሃይድሮካርቦኖች ውስጥ በሚቃጠሉበት ጊዜ ሰንሰለት ፈሳሽ ነው. ይህ ሁለት ነፃ ሜታሊየስ ዓይነቶች ከተፈጠረ ኤነል ሞለኪውል ጋር የተበጠበጠ መበታተን ሊሆን ይችላል.
![]()
ወይም ከኦክሲጅ ጋር አንድ ሃይድሮካርቦን ምላሽ:
![]()
ሰንሰለቱ የሚከሰተው በተከታታይ አሰራሮች ምክንያት ነው ፓርኦክሳይድ ወይም ሃይድሮክሳይድ
![]()
ሃይድሮክሳይድ በሚፈርስበት ጊዜ የሚፈጠሩት ሰንሰለቶች ይካሄዳሉ.
ምእራፍ 2 በቃጠሎ ጊዜ የኬሚካሎች ሂደት
የተሰጠው ቅደም ተከተል ቅደም ተከተል በአመዛኙ ስርዓት ውስጥ የፔሮፊድ ንጥረ ነገር ስብስብ ቀስ በቀስ እንዲጨምር ያደርገዋል.
በተመሳሳይ ጊዜ በቋሚዮክሳይድ ክምችት, ስርጭቶች እና መጀመር
ተመሳሳይ ምላሾች አሉ:

እነዚህ ምላሾች ውስብስብ ናቸው. ብዙ ሙቀትን ሲያወጡት.
የሙቀት ድብልቅ የሙቀት መጠን መጨመር ሲጨምር, የነርሲንግ ማዕከላት ሚና ከአንድ ማዕከላዊ ምርት ወደ ሌላው በሚከተለው ቅደም ተከተል ይከተላል-አኩሊ ሓይድሮክሳይክሎች, አሲሊ ሃይሮፐሮክሳይዶች, ፎርማኔልይድ.
በከፍተኛ የሙቀት መጠን (600-800 ዲግሪ ሴንቲግሬድ) ባለው ጊዜ ውስጥ በቅዝቃዜው ውስጥ የሚፈጠረውን ለውጥ አስመልክቶ የሙከራ ጥናቶች እንደሚያሳዩት የመጀመሪያውን ሃይድሮካርቦንን ወደ ፍሳሽ ማቀነባበሪያዎች መቀየር ሂደት በሁለት ደረጃዎች ይከፈላል. የመጀመሪያው እጅግ በጣም ከፍተኛ በሆነ ሁኔታ የተከሰተውን ውሃ ወደ ካርቦንዳዮክሳይድ ይለውጣል. በሁለተኛ ደረጃ, ቀስ ብሎ, ደረጃው, ኦክስጅን ወደ ኦክስጅን ይለካሉ. በጣም ጠቃሚ ድምዳሜ የሚከተለው ነው-ብዙዎቹ የሃይድሮካርቦን ማስወጫ ህጎች የካርቦን ሞኖክሳይድ ቆዳዎችን መግለፅ ይቻላል.
2.5. የካርቦን ቃጠሎ
የካርቦን ነድ የሚቃጠል በሂጋቡ ሂደት ላይ በመመርኮዝ, የኬሚካዊ ደረጃው ከአካባቢያዊው ቦታ አንስቶ እስከ ነዳድ ጥግ መጋለጥ ከሚገባው ጋዝ ነዳጅ (ኦክስጅን የአየር) ጋር በማዛመድ ብቻ አይወሰድም. የሚቃጠል ፍጥነት በካርቦሚ ኬሚካላዊ ባህሪያት ላይ እና በነዳጅ ዘይት ላይ ኦክሲጅን አቅርቦት ሂደት ላይ በሚወስኑት ባህሪያት ላይ የተመረኮዘ ነው. ለቤት መሞከሪያው የኦክስጂን አቅርቦት የሚከናወነው በማሰራጨት ነው
ኮርቼንኬ አአአ. የፍሳሽ እና ፍንዳታ ሂደት
በበርካታ ምክንያቶች ይወሰናል: የሚቃጠለው የሰውነት ቅርጽ እና መጠን, ጋዘዘኛ ሚዛን, የኦክስጂን ማቀዝቀዣዎች እና የአመዛኙ ውጤቶች ከጣቢያው ወለል በላይ እና በከባድ እና ኮክ ውስጥ የተከማቹ ጥቃቅን እና ጉብታዎች ናቸው.
በሰብል-ስካር (carbonate) የካርቦን ቃጠሎ ገጸ-ባህሪያት ላይ ለመግለጽ, ከ 900 ዲግሪ ሴንቲግሬድ ሙቀት ውስጥ በሚሞቅ ምድጃ ውስጥ ታስቀምጣለን. በመጀመሪያ ላይ, የድንጋይ ማቃጠል የሚከሰተው ከላይ ባለው የኦክስጅን ወጪ ነው. ከተጠቀሙበት በኋላ በተቃጠለው ወለል ላይ የሚቀላቀሉት ምርቶች በከፊል ይታያሉ. የሚቃጠለው ፍጥነት ይቀንሳል እና ከሩቅ ቦታዎች ከሚመጣው ጋዝ የሚመጡ ኦክስጅኖች ከሌሉ ሂደቱ ሊቆም ይችላል.
ይህ ፍሰት በማሰራጨት ይከሰታል, እና የሚነጣው ፍጥነት በዥረት ፍሰት ይወሰናል. የማሰራጨት ጥንካሬ በአብዛኛው የተመካው በተቃጠለው መሬት አቅራቢያ ባለው የነዳጅ ማጓጓዣ መጠን እና ተፈጥሮ ላይ ነው. የኬሚካላዊ ግስጋሴ ፍጥነት በዋነኝነት የሚወሰነው በሙቀት መጠን ነው. ከተለያዩ ባህሪያዊ ግብረመልሶች እንዲሁም ተመሳሳይነት ያለው የአርነኒስ ህግን ይታዘዛል.
ከፍተኛ ሙቀት በሚገኝበት ጊዜ የካርቦን ኦክሳይድ ውጤት በጣም በፍጥነት ይጠናቀቃል, እናም አጠቃላይ ሂደቱ በኦክስጅን ወደ ውስጡ በማሰራጨቱ ብቻ የተወሰነ ይሆናል.
ስለሆነም የሚቃጠለው የካርቦን ሂደት ሁለት ዓይነት ሂደቶችን ያካትታል የአየር ኦክስጅን ከጋዝ እፅ ወደ ፍጆታው አመክንዮ እና ከከካው የካርቦን ውስጣዊ ኬሚካላዊ ሂደት ጋር በማጓጓዝ ሂደት ነው. ሁለቱም ሂደቶች እርስ በርሳቸው የተያያዙ ቢሆኑም እያንዳንዳቸው የራሳቸው ሕጎች አሏቸው. ከእነዚህ ሂደቶች ውስጥ በጣም አስፈላጊው የኦክስጅን ፍጆታ ሂደቶች የተለያዩ ኬሚካዊ ምላሾች ናቸው.
ኦክሲጅንን በካርቦን በማዋሃድ የተወሳሰበው ግብረ-መልስ ሁለት የኦክስ ኦክሳይድ እና የ CO 2 ን ኦክሲጅኖችን በ CO X 0 ኤ መካከል መካከለኛ የፊዚክኬሚካዊ ቅንጅት በአንድ ጊዜ እንዲፈጠሩ ያደርጋል. በእነዚህ ኦክሳይዶች መካከል ያለው ጥመር የሚከሰተው በተቃውሞ ሁኔታዎች ላይ ነው. ስለሆነም ለሚቃጠለው የካርበን ልውውጥ ሚዛን (equation) እንደሚከተለው ሊጻፍ ይችላል.
ምእራፍ 2 በቃጠሎ ጊዜ የኬሚካሎች ሂደት
ከዚያም የሚነካው የካርቦን ሞኖክሳይድ ዓይነት ተመሳሳይነት ይጀምራል:
በዚህ ክፍል ውስጥ በክፍል 2.3 ውስጥ ተብራርቷል.
ይህ ሁኔታ በካርቦን ጠርዝ አካባቢ, ስለዚህእና በከባድ ውስጠኛ ክፍል ውስጥ, በግራና በቀዳዳዎቹ ውስጥ.
ሌላው ግጭት በካርቦን እና በካርቦን ዳይኦክሳይድ መካከል በተደጋጋሚ የሚከሰተውን ለውጥ ነው.
![]()
የኦክስጂን እጥረት ባለበት ቦታዎች በሚታወቅ ፍጥነት ይለቃቃል, ነገር ግን የካርቦን የሙቀት መጠን ከፍተኛ በሆነበት ቦታ ነው.
የተብራሩት ምላሾች አንድ ላይ ተጣምረው የካርቦን ነዳጅ ምርቶች ስብስብ ይወስናል.
የአመጋገብ ሂደት የአሠራር ምልክቶች
| አር |
በቀላሉ የሚቀለበስ ድብደባ የሚመስለው በውጫዊ ምንጭ ወይም በራስ ተሞካሽነት ምክንያት የሚከሰተውን የመቀላቀያ መሳሪያዎች ማቀነባበር ነው. የራስ-ቃጠሎ እና የእሳት ማጥፊያ ሂደቶች በጋዝ, በፈሳሽ ወይንም በጠንካራ ሁኔታ ውስጥ የሚገኙ ንጥረ ነገሮችን ባህሪያት ካሳዩ የቃላት መለዋወጫ ጥሬ እቃዎች (በተለይም በክፍል በተከፋፈለ ሁኔታ ውስጥ ያሉ) ወይም የተፋፋሙ ፈሳሽ ነገሮች በከፍተኛ ደረጃ ፈሳሽ ፈሳሽ ባህሪያት ናቸው.
3.1. እራስን ማጥፋት. የፀጉር ጽንሰ-ሐሳብ
እሳትን በሰከነ-ጊዜ እና በቦታ መገንባት, ለሰዎች አደገኛ እና ጉዳት የሚያስከትል ነው.
ለሰዎች የእሳት አደጋዎች ክፍት እሳት, የእሳት ብልጭታዎች, ትኩሳት, የመርዝ ብክለት, ጭስ, የኦክስጅን ዝቅተኛነት, ሕንፃዎች ወይም መትከያዎች መውደቅ ናቸው.
የሚፈነዳበት ፍንዳታ በፍጥነት በሚቀጥለው ፊዚካዊ ኬሚካዊ ምጣኔ ነው, ከሙቀት እና ጭስ ማገዶ ጋር, የእሳት ነበልባል ወይም ማቃጠል. በተለመደው ሁኔታ ውስጥ የፍሳሽ ማስወገጃ (የተቃጠለው ንጥረ ነገር) በከባቢ አየር ውስጥ ኦክሲጂን (ኦክሲጅን) በኦክሳይድ (ኦክሲጅን) እና በኦርጂን (ኦክሲጅን) ውስጥ መቀላቀል ነው ይሁን እንጂ አንዳንድ ንጥረ ነገሮች (ለምሳሌ, የተጨመቀ አሲኢሊን, ናይትሮጅ ክሎራይድ, ኦዞን) ሙቀትን እና ነበልባትን ሳይለቁ ኦክስጅንን ይፈጥራሉ. በውጤቱም, የቃጠሎ ሁኔታ ውጤቱ ከግድግዳሽ ብቻ ሳይሆን ከዳግማዊነትም ያስከትላል. በተጨማሪም የሃይድሮጅን እና ብዙ ብረቶች በክሎሪን በከባቢ አየር ውስጥ, በሰልፈር ውስጥ በሚገኝ ናስ, በካርቦን ዳይኦክሳይድ ወዘተ.
በአየር ውስጥ ኦክሲጅን ውስጥ በሚቀጣጠል ንጥረ ነገር ኦክሲዴሽን ኦክሳይድ ውስጥ በጣም አደገኛ የሆነ አመሳስል. በተመሳሳይም የነዳጅ ስርዓቱን የሚያስፈልገውን የኃይል መጠን ለማቅረብ የሚያስችላት የማሞቂያ ምንጭ መኖር አስፈላጊ ነው. በጣም የተለመዱ የማሳሳቻዎች ምንጮች: የኤሌክትሪክ መሳሪያዎች በእሳት ብልጭታ, በሚረጭ የብረት መያዣዎች, በእቃ ማጓጓዝ, በማንጠባጠብ ስራዎች ሲከሰቱ የሚወጣ ብልጭታ; በግጭት አማካይነት የተፈጠረ ሙቀት; የቴክኖሎጂ ማሞቂያ መሳሪያዎች; የእሳት ተከላካዮች; የአቲያባቲ ጭስ ስቲስታዊ የኤሌክትሪክ መፍሰስ; የኤሌክትሪክ ግንኙነቶችን ማሞቅ; የሙቀት መለዋወጫዎች በኬሚካላዊ ግብረመልሶች ይከናወናሉ.
የእነዚህ ምንጮች ሙቀት የተለየ ነው. ስለዚህ, የብረት ቅርፊት ሲነድ የሚከሰተው ብጥብጥ እስከ 1900 ዲግሪ ሴንቲ ግሬድ ድረስ ሙቀት ሊኖረው ይችላል, የግጥሚያ ነበልባቡ ሊጠፋ ነው. 800 ዲግሪ ሴንቲግሬድ በሚፈጠርበት ጊዜ ቀበቶው የሚሸከበው ቀበቶ በርሜል እስከ 600 ° ሴ ድረስ ነው, እና በኤሌክትሪክ ፍሳሽ ሙቀቱ የሙቀት መጠኑ 10,000 ዲግሪ ሴንቲግሬድ ደርሷል.
የመብላት ሙሉ እና ያልተሟላ ሊሆን ይችላል. በኦክስጅን ከፍተኛ መጠን ያለው ሙቀት በመውሰጃው ውስጥ, የካርቦን ዳዮክሳይድ, ውሃ, ናይትሮጅ, ሰልፈር ዳይኦክሳይድ ይገኙበታል. ያልተሟሉ ጥገኛዎች በኦክስጅን አለመኖር ምክንያት ሲሆኑ, በዚህ ምክንያት የተቃጠሉ ምርቶች መርዛማ እና ተጓጉዘው የሚመጡ ንጥረ ነገሮች ናቸው - ካርቦን ሞኖክሳይድ, አልኮሆሎች, ኪቲኖዎች, አልዲኢዲዎች, ወዘተ. የተቃጠለው ንጥረ ነገር ሙሉ በሙሉ ለማቃለል የተወሰነ መጠን ያለው አየር ያስፈልጋል. 1 ኪሎ ግራም እንጨት - 4.18, አተር - 5 , 8, propane - 23.8 ሜ.
የማቃጠል ሂደቱ እንደሚከተለው እንደሚከተለው ሊታሰብ ይችላል. ሙቀት አምቆ የሚነሳ ሙቀትን ያቀዘቅዝ ቀዝቃዛ መካከለኛ ይሟገታል, ተቀጣጣይ ሚዲያንን ከኦክስጂን እና ተጨማሪ ሙቀትን ለመለቀቅ ያስችላል. ይህ ደግሞ በተቃራኒው የሚቀጣጠሉ የንጽጽር ንብርብሮች ማሞቂያ ያስገኛል, ይህም ከፍተኛ የሆነ የኬሚካላዊ ግፊት ይከሰታል. የሚቀጣጠል ንጥረ ነገር እንዲህ አይነት ንብርብ በተፈጠረ ንብርብር ሲቃጠል, የሚቀጣጠለው ዞን ያንቀሳቅሳል, ይህ የእንቅስቃሴ ፍጥነት የቃጠሎው ሂደት ከፍተኛ መጠን ያለው እና እጅግ አስፈላጊ ባህሪው ነው. በንጽሕና የሚሞሉ ማሞቂያዎች, ኦክሳይዴ እና ፍሳሽ ሂደት የሚቀጥል የሚቀጣጠለው ነገር በሙሉ ይሟላል.
ይህ ንጥረ ነገር የሚያሞቅበት ጠባብ አካባቢ እና የኬሚካላዊ ግስጋሴ የተከሰተው የእሳት ነበልባል ፊት ነው.
የሚቀጣጠሉ ስርዓቶች በኬሚካዊነት እርስ በርስ የሚቀራረቡ እና እንደየተለይ ናቸው. በኬሚካዊ አሠራር ዘዴዎች ውስጥ የሚቀጣጠሉ የጋዝ ጋዞች, የአየር ወይም የአቧራ ቅንጣቶች ድብልቅ ናቸው. የእነዚህን ሥርዓቶች መቃጠል ተመሳሳይነት ይባላል. በኬሚካዊ አተነተ አመላካች ስርዓቶች ውስጥ, ተለዋዋጭ ቁስ አካልና አየር ያልተቀላመጠ እና በይነገጽ (ኢንኬቲቭ) ኣይደለም. እነዚህ በአብዛኛው ጠንካራ ተለዋዋጭ ቁሳቁሶች ናቸው እና የእነሱ ፍንዳታ ደግሞ ሄር-ሞ (ሄር-ሁሴን) ይባላል.
የሚቀጣጠለው ድብልቅ ንኪኪ ጠቅላላ ጊዜ Tg ከሚባሉት ተጓጓኝ ንጥረ ነገሮች እና ከኦክስጅን τ ጋር የሚጣጣሙበት ጊዜ እና በኬሚካሉ እራሱ የሚከሰትበት ጊዜ, የኦክሳይሬት ግኝት τ x
በነዚህ ሁለት ቃላት ጥምርታ መሠረት የሽብልቅ እና የስነ-ንፅዋትን መጣበጥ ተለይቷል. ረቂቅ ተጣጣሚ ንጥረ ነገሮችን በማቃጠል ጊዜ ለኦክሲጅን አስፈላጊውን (የፀረ-ተባይ) ወደ ንጥረ ገፅ ውስጡ ለማስገባት የሚፈጀው ጊዜ ከኬሚካዊ ግፈኛ ጊዜ በጣም ረዘም ያለ ነው, ስለዚህ አጠቃላይ የመነሻ መጠን በኦክሲጅን ወደ ተቀጣጣይ ንጥረ ነገሮች በማሰራጨቱ መጠን ሙሉ በሙሉ ይወሰናል. የእነዚህ ንጥረ ነገሮች ቁሳቁሶች አብዛኛውን ጊዜ በእሳት ላይ ተገኝተዋል እናም በብዛት ይባላል. የሚቀጣጠለው የኬሚካላዊ ግኝት መጠን የሚወሰነው በኬሚካላዊ ግፊት መጠን ነው. ይህ ዓይነቱ የቃጠሎ ሁኔታ ተመሳሳይ ቧንቧዎች ስርዓት ነው.
የካልሞሜትሪክ, የቲዎሬቲክ እና ትክክለኛው የመቃጠል ሙቀት ለይቶ ማወቅ.
የካሎሪሜትሪክ ቅዝቃዜ ሙቀትን ለማሞቅ የሚጠቀሙበት ሙቀትን በሙከራ ደረጃ ቢያሞቁ, የሙቀት መጠኑ በጣም አስፈላጊ ነው, ነዳጁ ሙሉ በሙሉ ይቃጠላል እና የመጀመሪያው መነሻ ሙቀት 0 ዲግሪ ነው. የሙቀት መጠኑ ዜሮ እንደሆነ ይገመታል. የነዳጅ እና አየር መነሻ ሙቀት 0 ዲግሪ ሴንቲግሬድ ከሆነ, የካሎሪሜትሪክ የቅዝቃዜ ሙቀት
![]()
የኩንት ንጥረ ነገር ጥሬ እቃ (ካረን) / ካሬ / k V የቃጠላቸው ምርቶች መጠን, m3 / ኪ.ግ; c የመብለጭ ቆጣቢ ምድጃዎች አማካይ የሙቀት መጠን, kcal / m3 ዲግ.
በዚህም ምክንያት የካሎሪሜትሪክ ቅዝቃዜ የሙቀት መጠን የሚቀሰው በሚቀሳቀሰው ንጥረ ነገር ባህሪያት ላይ ብቻ እና በጥቅሉ ላይ አይደለም. የቲዎሬቲክ የመብሳት ሙቀት በአመዛኙ ጊዜ ውስጥ የሚከሰት ሙቀት መጠን ይለያያል. የካሎሪሜትሪክ ቅዝቃዜ ሙቀት ለቀጣይ ንጥረ ነገር ከፍተኛ ሲሆን ለአካላዊ ግምገማ ጥቅም ላይ ይውላል. በእውነቱ, በሚነድበት ጊዜ, በጨረር ምክንያት, ከአየርና ከአካባቢው ማሞቂያ ምክንያት ሁልጊዜም የሙቀት መጠን ይኖራል.
እውነተኛው በእሳት የሚወጣው ሙቀት የእሳት ሙቀት ነው. ውስጣዊና ውጫዊ የእሳት አደጋን መለየት. የእሳት ቃጠሎው የሙቀት መጠን የእሳት ነበልባል ሲሆን ውስጣዊው ሙቀት በክፍሉ ውስጥ ያለው የኩሱ ሙቀት ነው. በእሳት አደጋ ምክንያት ለአካባቢ ጥበቃ, ለማቃጠያ ምርቶችና ለንብረቶች ማሞቂያ ምክንያት በእሳት ምክንያት የሚከሰቱ የሙቀት መጠኖች ናቸው
ሁልጊዜ ከ 30% ... 30%. ሇምሳላ የነዋሪው የነዋሪነት ሙቀት 1630 ° ሴ ነው እና ትክክሇኛ የሙቀት መጠን 1400 ° ሴ ነው.
የሚቀጣጠል ቫይተር እና ጋዞች ድብልቅ ኦክሲጅን በመሙላት በውስጡ በነዳጅ የተወሰነ ይዘት ብቻ ሊቃጠል ይችላል.
በቃጠሎ ላይ የሚፈጠረውን ተለዋዋጭ ጋዝ ዝቅተኛ የውኃ ማጠራቀሚያ አነስተኛ የሙቀት መጠን ገደብ (LEL) ተብሎ ይጠራል. አሁንም ቢሆን የሚቃጠለው ፍሳሽ እስከሚቻልበት ከፍተኛው ከፍተኛው የሙቀት መጠን ገደብ (AIPW) ተብሎ ይጠራል. በነዚህ ድንበሮች ውስጥ ያለው የኩላቲ ክልል ክልል መበራከት ተብሎ ይጠራል. ነጠብጣብ ከእሳት ጋር አብሮ የሚመጣው የእሳት (የእሳት መጀመር) እሳት ነው. ይህ የማያቋርጥ ብርሀን ሲሆን ይህም የማምጫው ምንጭ ከተነሳ በኋላም እንኳ አይቆምም. የመብራት የታችኛው እና ከፍተኛ ገደቦች እሴቶች በአየር, በጋዝ እና በአቧራ ቅንጣቶች ባህሪያት ላይ የተመሰረቱ ናቸው. በተለዋዋጭ ጥቃቅን ያልተለቀቁ ጋዞች መጨመር የፍላጩን አካባቢ ይቀንሳል እና በመጨረሻም የማይቀጣጠል ያደርገዋል. አንዳንድ ጠጣር ጉልህ የሆነ ጠጣር ጠቋሚዎችን የሚያስወግድ ሲሆን አንዳንድ ቆሻሻዎች የቃጠሎውን ፍጥነት ይቀንሳሉ. ከእነዚህ ውስጥ በጣም ንቁ የሆኑት እነዚህ ናቸው ባርኔጣ ሃይድሮካርቦኖች ናቸው. ሁለቱም የተያዩ ባህሪያት ማቃጠል ለማቆም ጥቅም ላይ ይውላሉ. የውቅ ድብታውን በከባቢ አየር ግፊት ዝቅ ማድረግ የጠቋሚውን አካባቢ ይቀንሳል, እና በተወሰነ ግፊት ድብልቁ እንዳይቀዘቅዝ ይደረጋል. የሚቀጣጠለው ድብልቅን ጫና መጨመር የእሳት ማጥፊያ አካባቢን ያሰፋዋል, ነገር ግን እንደ ደንብ, በትንሹ. የሚቀጣጠለው ድብልቅ የሙቀት መጠን መጨመር የፍላጩን አካባቢ ያርጋግሳል. የማሞቂያው ምንጭ ኃይለኛ ተጽዕኖም ይነፈነቃል.
ትኩረትን ብቻ ሳይሆን የሙቀት መጠን ገደብም አለ.
በአየር ውስጥ የአየር ሙቀት መጨመር የሙቀት መጠን ነው, በእነዚህ ፍሳሽ ንጥረ ነገሮች ውስጥ የሚገኙት የሳምባ ነጠብጣቦች (የሙቀት መጠን) ከከሳሹ ዝቅተኛ ወይም ከከፍተኛ ከፍታ የሙቀት መጠን ጋር የሚጣጣም ናቸው. የማሞቂያው ሙቀት የአየር ሙቀት መጠኑ አነስተኛ ከሆነ ወይም ማቃጠል የሚጀምርበት እና የሙቀቱ ምንጭ ካስወገደ በኋላ ማቃጠል ወይም ማቃጠል ይቀጥላል. የማሞቂያው ሙቀት የራስ-ሙለ-ፈሳሽ ንጥረ-ቁሳቁሶችን ብቃት ይለያል. የአንድ ንጥረ ነገር ማሞቂያ ሙቀት ከሌለ, ዘግይቶ የሚቃጠል ወይም የማይቀጣጠል ይባላል.
በአየር ሙቀት እንቅስቃሴ ስር የሚሆነው የኦ ኤድዲክት ለውጥ በፍጥነት ወደ ራስ-ማቃጠል ያመራል. የድምፅ መጠን የተወሰነ ክፍል - ውስጠ-ጥቁር ቃጠሎ, እራስ-ቃጠሎ በጠቅላላው ንጥረ-ነገር ውስጥ ይከሰታል. የራስ-ማመቻቸት ሙቀቱ እንደ ሙቀቱ እንደ ሙቀት መጠን ሊታሰብበት ይገባል, ይህም ንጥረ ነገሩ እንዲሞቀው ይደረጋል, ስለዚህም ተጨማሪ የራስ-ኦክሳይድ ውጤት ስለሚያስከትል. የራስ-ማጥቃቱ ሊገኝ የሚችለው በኦክሳይድ ሂደት ውስጥ የሚወጣው ሙቀት ከከባቢ አየር ወደ አከባቢው ከተለቀቀ ብቻ ነው.
የራስ-ማመሳከሪያ ሙቀት ለአንድ ንጥረ ነገር ቋሚ አይደለም, ምክንያቱም በአብዛኛው የሚወሰነው በሚወሰነው ሁኔታ ነው. ተመጣጣኝ ውሂብን ለማግኘት, የሙከራ መሳሪያው እና የራስ-ቃጠሎዎችን የጋዝ እና ነዳጅ የሙቀት መጠን ለመወሰን ዘዴ (GOST 13920-68). በአጠቃላይ ሲታይ በአየር ውስጥ ያለው ጋዞች እና ነዳጅ ድብልቅ ቅይጥ ውጫዊ የሙቀት-አማቂ ብርሃን ሳያካትት እንዲፈነጥቅ ከተደረገ መደበኛ የሙቀት መጠን የተቀመጠው አነስተኛ የሙቀት መጠን, ደረጃውን የጠበቀ የሙቀት መጠን ይባላል.
ያልተፈነጠጣ እሳት ዓይነት በድንገት የሚከሰት ነው, ማለትም, ከኃይለኛ ምንጭ ምንጭ ውጭ የራስ-ሙቀት (ብረትን) በማቃጠል, ስለማስገባት. በቃለ መኃላ እና በራስ ተነሳሽነት መካከል ያለው ልዩነት በአየሩ ሙቀት መጠን ውስጥ ነው. ያልተለመዱ ብክነቶች በአካባቢው የሙቀት መጠን ይከሰታሉ, እናም እራስ ማጥቃትን ከውጭ ለማስወጣት አስፈላጊ ነው.

 የጋዝ እና ቀዝቃዛ የውሃ አቅርቦቶች መቆጣጠሪያዎች
የጋዝ እና ቀዝቃዛ የውሃ አቅርቦቶች መቆጣጠሪያዎች የተለያየ ቅርፅ ያላቸው እና የአየር ዝርጋታ የአየር መጫዎቻ ክፍሎችን መለካት
የተለያየ ቅርፅ ያላቸው እና የአየር ዝርጋታ የአየር መጫዎቻ ክፍሎችን መለካት የማቃጠያ ሂደቶች ኬሚስትሪ. የፍነት ኃይል
የማቃጠያ ሂደቶች ኬሚስትሪ. የፍነት ኃይል የቆጣሪ ንባቦችን የማያስተላልፉ ከሆነ ምን ይከሰታል
የቆጣሪ ንባቦችን የማያስተላልፉ ከሆነ ምን ይከሰታል