Yonish deyiladi. Yonish vaqtidagi kimyoviy jarayonlar
Ba'zi asosiy tushunchalar
Atomlar va molekulalarning soni mos ravishda ifodalanadi moddalar miqdori ham moddaning mol soni. Bir mol moddasi 6,023 ∙ 10 23 zarraga (atom va molekulalarga) mos keladi. N a soni = 6.023 ∙ 10 23 mol -1 Avogadro raqami deb nomlanadi. Mol fraktsiyasi x ikomponenti i mol soni n ning nisbati i komponenti i mollarning umumiy soniga n = 2 n i Aralashmalar ( x i = n i / n).
Mass m (SI sistemasidagi o'lchov birligi kilogramm) moddasining asosiy xususiyati hisoblanadi. Massiv fraksiyonu Wi - massa nisbati m i komponenti i m = 2 aralashmaning umumiy massasiga to'g'ri keladi m i (Wi = m i / m).
Molekula og'irligi (yoki molekulyar og'irligi) M i(g / mol) komponenti Men - bu komponentning bir mol massasi. Masalan, atomik uglerod, molekulyar vodorod, kislorod va metan uchun: M = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. M (g / mol) aralashmaning o'rtacha molyar massasi tarkibiy qismlarning molar fraktsiyalari (M = x i M i).
Yonish jarayonlarini aniqlash
Yonmoqda - Bu yuqori haroratlar ta'siri ostida yonuvchi moddalar va materiallar oksidlovchi razvedka (havoda kislorod) bilan kimyoviy shov-shuvga kiradigan, yonish mahsulotlariga aylanadigan va kuchli issiqlik va yorug'lik emissiyasi bilan birga bo'lgan murakkab fizik-kimyoviy jarayon.
Yonish jarayonining paydo bo'lishi uchun zarur bo'lgan shartlar:
Yonuvchan moddalar (GV) mavjudligi;
Oksidlovchi moddalar (O.) - havo kislorodi mavjudligi;
Aniqlanish manbasi (I.Z.).
Yonuvchan materialni oksidlanish jarayonining boshlanishi ma'lum bir temperaturgacha qizdirilishi kerak;
Yonuvchan moddalarni muayyan haroratda isitish uchun ma'lum bir ateşleme manbai kuchi kerak;
Yonish jarayonini ta'minlash uchun yoqilg'ining va oksidlovchi konsentratsiyasi zarur.
Eng muhim yonish jarayoni issiqlik va massa uzatishdir. Yonishning eng keng tarqalgan xususiyati - olov paydo bo'lishi va uni yonish hududida issiqlikni uzatish yoki faol zarralarni yonish hududidan yangi yoqiladigan aralashga tarqatish yo'li bilan yondirish.
Olovlar - Bu yonib ketishning aniq namoyonidir. Bundan tashqari, yonish hududi ham deyiladi. Yonuvchan qorishmaning to'liq va to'liq bo'lmagan yonish mahsulotiga aylanishi sodir bo'lgan maydonning bir qismi.
Yonish jarayonining asosiy parametrlari o'limga olib keladigan va moddiy zararga sabab bo'lgan:
Katta miqdorda issiqlik;
Yuqori harorat;
Yonuvchan mahsulotlarning toksik tarkibi.
Gazlarning molekulyar kinetik nazariyasi nuqtai nazaridan yonish jarayoni
Shakl. 2.1. Haroratga qarab faol molekulalarning nisbati: T 2\u003e T 1
Issiq gaz yonuvchan aralashmasi ortiqcha energiyani oshiradi.
Faol holatdagi molekulalarning o'rtacha energiya darajasi va inaktiv holatning o'rtacha darajasi o'rtasidagi farq, aktivizatsiya energiyasi deb ataladi. Bu grafik jihatdan ifodalanishi mumkin (2-rasm).

Shakl. 2.2. Reaktsiya kursining energetik diagrammasi G.V. + O. ® PG: E faollashtirilgan energiya; Q xr - yonish reaktsiyasining termal ta'siri
"Birinchi" reaksiyaga kirishgan molekulalarning o'zaro ta'siri natijasida chiqarilgan energiya qo'shni molekulalarga o'tkaziladi. Ular hayajonli, jarayon juda katta chastota va intensivlik bilan ta'sirlangan molekulalar atrofida takrorlanadi. Barcha reaktsiya aralashmasiga (2H 2 + O 2) o'z-o'zidan mustahkamlovchi, o'z-o'zidan tezlashib boradigan kimyoviy ta'sir o'tkazish jarayoni suv molekulalarining hosil bo'lishi va atrof-muhitga issiqlikning tarqalishi va luminesans bilan birga davom etishi bilan boshlanadi. paydo bo'ladi va yondirish jarayonini yoyadi.
E harakatining soni kattaroq bo'lsa, bu juftlikni kimyoviy o'zaro ta'sirga kiritish qiyinroq bo'ladi. Shuning uchun E aktsiyasi qiymati ushbu kimyoviy tizimning yong'in xavfi darajasining bevosita ko'rsatkichidir.
Yonish turlari va turlari
Yonish quyidagi parametrlar bo'yicha tasniflanishi mumkin:
1. Yonuvchan tarkibiy qismlarni aralashtirish holatiga ko'ra:
a) oldindan aralashtirilgan gaz yoki bug '-havo aralashmalari kinetik-yonishi. Yoqilg'i va oksidant aralashmasi yoqilgunga qadar yonish uchun tayyor bo'lgani uchun yonish jarayonining umumiy darajasi nafaqat yonish kimyoviy reaktsiyasiga bog'liq. Bunday yonish yopiq yoki cheklangan hajmda bo'lsa, portlash sodir bo'lishi mumkin. Aralashmaning yonishi vaqtida chiqarilgan energiyaning bu hajmdan ortiqcha tashqariga chiqishi uchun vaqt yo'qligi sababli, bosimni oshirib, tuzilmalarni yo'q qilish mumkin;
b) diffuziya, diffuzion yonish yonish deb ataladi, yonish zonasi yoki yonish zonasi oldida yonadigan muhit (yoqilg'i va oksidlovchi aralashmasi) shakllanishi paydo bo'lganda.
2. Kimyoviy reaksiya zonasida yonuvchi komponentlarni olish intensivligiga ko'ra:
a) laminar, yonuvchan aralashmaning tarkibiy qismlari yonish hududiga nisbatan xotirjamlik bilan kiradi. Bunday holda, termodinamik rejimni tavsiflovchi Reynolds kriterining soni qiymati kritik darajadan ancha past bo'ladi (Re<2300).
b) yonish zonasi yuqori tezlikda kiruvchi yonuvchi aralashmaning komponentlari bilan turbulent. Bu holda Reynoldsning soni 2300 dan oshgan.
3. Yonuvchan aralashmaning tarkibiy qismlarini agregatlash holatiga ko'ra:
a) bir hil - yoqilg'i va oksidlovchi bir xil agregat holatida (gazsimon);
b) heterojen (ko'p fazali) - yoqilg'i va oksidant turli agregatli holatlarda.
4. Yonish kimyoviy reaktsiyasi zonasining tarqalishi tezligi to'g'risida:
a) kimyoviy reaksiya zonasining deflagratsiyasi (sekin) taqsimlanishi (tezlik 0,5 dan 50 m / s gacha);
b) yonish kimyoviy reaktsiyasi zilzila to'lqinining tezligi (sekundiga bir necha metrdan bir soniyada bir necha kilometrgacha) tarqalganda portlovchi moddalar (portlovchi).
Bug 'va gazlar yoqilgan joy nomlanadi otash tomonidan .
Laminar olov oldindan aralashtirilgan. Oldindan aralashtirilgan aralashmaning laminar alangasida yoqilg'i va oksidlanish yonish jarayoni boshlanishidan oldin aralashtiriladi va oqim laminar bo'ladi.
Oldindan aralashtirilgan aralashmaning olovi deyiladi stokiyometrik agar yoqilg'i (uglevodorod) va oksidlovchi (kislorod - O 2) bir-birini to'liq iste'mol qilsa, u holda karbonat angidrid (CO 2) va suv (H 2 O) hosil bo'ladi. Agar yoqilg'ining ko'pligi bo'lsa, aralashmaning boyligi va oksidant ortiq bo'lsa, ular aralashmasining kambag'al ekanligini aytadilar.
Eng oddiy misollarni ko'rib chiqing:
1) 2H 2 + O 2 → 2H 2 O - stokiyometrik aralashmasi,
2) ZN 2 + O 2 → 2H 2 O + H 2 - boy aralashmasi (ortiqcha H 2),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - yomg'ir aralashmasi (ortiqcha O 2).
Bunday kimyoviy reaksiya tenglamasidagi har bir belgi bir molga to'g'ri keladi. Shunday qilib, bu tenglamalarning birinchi soni H 2 molekulyaridan 2 mol H2O ni hosil qilish uchun bir mol O2 bilan reaksiyaga kirishadi degan ma'noni anglatadi.
Kimyoviy reaksiya tenglamasi faqat bitta olov yoqilg'ining reaktsiyasini ta'riflaydigan tarzda yozilsa, stoikiometrik aralashmada yoqilg'ining molekulyar ulushi osonlik bilan aniqlanadi
x tog'lar, stokh = 1 / ((1 + v)
Bu erda vreaksiya tenglamasida O2 ning mollarini CO 2 va H 2 O hosil bo'lishi bilan ifodalaydi. Masalan, reaktsiya
H 2 + 0,5O 2 → H 2 O, v = 0,5, x 2, stoch = 2/3
Agar oksidlovchi havo bo'lsa, u holda quruq havo faqatgina 21% kislorod, shuningdek, 78% azot va 1% nobud gazlarni o'z ichiga olishi kerak. Shunday qilib, havo uchun, X N 2 = 3.762 X O 2. Bu yerda havo bilan stoikiometrik aralashmaning molar fraktsiyalari teng bo'ladi
x tog'lar, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
qaerda v oldingi kabi, bir mol yoqilg'ini CO2 va H2O ga to'liq konversiyalash reaktsiyasi tenglamasida O 2 ning mollarini bildiradi. v va stoikiyometrik yoqilg'ining havo bilan aralashmalari uchun yoqilg'ining molar fraktsiyalari 1-jadvalda keltirilgan.
Yoqilg'i va havo aralashmalari oldindan aralashtirilgan (bu holda reaktsiya tenglamasiga N 2 tegishli miqdorda qo'shilishi kerak, 1-jadvalga qarang) havoning ekvivalent nisbati bilan tavsiflanadi:
l = (x w / x tog'lar) / (x w, stoch / x tog'lar, stoh) = (tog'lar)
yoki yonilg'i uchun mos keladigan nisbati F. (F. = 1 / l). Ushbu formula qiymatning aralashmaning molar fraktsiyalarining kattaligini aniqlash uchun o'zgartirilishi mumkin F.:
x tog'lar = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x tog'lar,
X og'irligi / 4,762, = ∙ 3 762
V qiymatlari va yoqilg'ining mol fraktsiyalari x tog'lar, havo bilan havo yoqilg'i stoikometrik aralashmalari uchun stoichi
sug'orish har doim kimyoviy o'zgarishlarga hamroh bo'ladi. Havoda yonish - yonuvchan moddalarning kislorod bilan o'zaro ta'siri. Shunga qaramay, azot, halid va ozon oksidlari yonish jarayonida oksidlovchi sifatida harakat qilishi mumkinligini yodda tutish kerak. Mahsulotning faqat bir manbai ishtirokida ma'lum yonish jarayoni - tez ajralishga ega bo'lgan aralashmalar. Bunday birikmalarga misollar asetilen va hidrazin hisoblanadi.
Yonish vaqtida yuz beradigan kimyoviy jarayonlar juda murakkab. Hatto eng oddiy narsa uchun - vodorodning kislorodda yonishi, umumiy ta'rifi shaklga ega
2H 2 + 0 2 = 2H 2 0,
bir necha o'nlab boshlang'ich bosqichlar yaratildi va o'rganildi.
Bugungi kunga kelib, vodorod, karbon monoksit, metan va etan singari bir necha moddalarning yonishi paytida kimyoviy transformatsiyalar mexanizmi etarlicha batafsil o'rganildi. Ushbu ma'lumot ko'p moddalarning yonish va yonish sharoitlarini oldindan aniqlash uchun ishlatiladi.
2.1. Chinak reaktsiyalari
Zanjir reaktsiyalari oddiy kimyoviy transformatsiyalardan farqli o'laroq, har bir elementar harakatda faol zarrachaning ko'rinishi bilan ajralib turadi: to'ldirilmagan elektronli, erkin radikal yoki ionli atom. Faol zarralarning paydo bo'lishi boshlang'ich materiallarning reaktsiya mahsulotlariga aylantirilishini zanjiriga olib keladi. Atomlar, erkin radikallar va ionlar valent-to'yingan molekulalardan ko'ra ko'proq reaktivdir. Shu sababli, kimyoviy bog'lanishni va faol zarrachalarni shakllantirish uchun zarur bo'lgan sezilarli energiya sarf-xarajatlariga qaramasdan, reaksiya zanjirining rivojlanishi ko'pincha molekulalar orasidagi to'g'ridan-to'g'ri shovqinga qaraganda energetik jihatdan foydali bo'ladi.
Yonish jarayoni asosan zanjirli mexanizm orqali sodir bo'ladi. Zanjir reaktsiyalari - bir necha bosqichda yuzaga keladigan murakkab reaktsiyalar:
Faol zarralar shakllanadigan zanjirlarning kelib chiqishi (boshlash);
Faol zarralar boshlang'ich materiallari bilan kimyoviy shovqinga kiradigan zanjirlarning davomi, buning natijasida yangi faol zarralar paydo bo'ladi;
Faol zarrachalar "o'lim" ning yakuniy reaktsiya mahsuloti shakllanishi bilan sodir bo'lgan zanjirlarning yuqishi
Zanjirlarning kelib chiqishi turli xil sharoitlarda paydo bo'lishi mumkin. Masalan, issiqlik energiyasi yoki ionlashtiruvchi nurlanish ta'siri ostida molekulalarning dissotsiatsiyasi oqibatida elektr oqimi natijasida. Faol zarralar o'limini faol zaharli moddalar qattiq yuzalar (gektar zanjir sinishi) bilan yoki ular bilan yonish inhibitörleri bilan reaktsiya natijasida ta'sir qilganda, erkin radikallar o'zaro ta'sir qilganda (bir hil zanjir sinishi) rekombinasyon paytida paydo bo'ladi.
Dengizsiz va tarvaqaylab zanjirli reaktsiyalar mavjud. Zanjirning davom etishi haqidagi reaktsiyalarda iste'mol qilingan har bir faol zarrachaga duch kelmagan holda, yana bir bor paydo bo'ladi. Boshlang'ich faol zarraga nisbatan hosil qilingan mahsulot molekulalarining soni zanjir uzunligi deb ataladi. Yonish reaksiyalarida zanjirlar uzunligi yuz mingdan o'n milliongacha o'zgarib turadi. Dengizsiz zanjir reaktsiyalarining nisbati yonish inhibitörleri kabi samarali zarralar bilan samarali ta'sir qilishi mumkin bo'lgan moddalar kichik hissa moddalardan ta'sir qilishi mumkin.
Ba'zi moddalar - tashabbuskorlar - faol zarrachalarni shakllantirishni osonlashtiradi va shu bilan zanjirsiz zanjir reaktsiyalarini tezlashtiradi.
Zanjirning davomi bilan iste'mol qilingan bir faol zarrachaga tarvaqaylab zanjirli reaktsiyalarda ikki yoki undan ortiq faol zarrachalar hosil bo'ladi. Ularning biri asosiy zanjirni davom ettirsa, boshqalari esa yangi zanjirlarni boshlaydilar (2.1-rasm).
"Rekombinatsiya - zararli zarrachalardan neytral atomlar yoki molekulalarning shakllanish jarayoni, rekombinatsiya jarayonida hosil bo'lgan atomlar va molekulalar yerda yoki qo'zg'aluvchan holda bo'lishi mumkin.
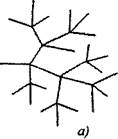
Shakl. 2.1. Reaktsiya zanjirlarining sxematik ifodasi:
a) zanjirning har bir qismida dallanadi
6) noyob dallanma
Masalan, zanjirning boshlang'ich reaktsiyasida vodorod yonishi paytida:
faol atom hosil bo'ladi. Zanjirni davom ettirishda:

yangi zanjirlarning boshlanishi bo'lgan faol atomlar sonining ko'payishi kuzatiladi.
Tarqalgan zanjir reaktsiyalari statsionar rejimda davom etishi mumkin, unda tarmoq sathining tezligi faol zarrachalarning o'lim tezligidan kam, va o'lim dallanmasdan ko'ra asta-sekin sodir bo'lmaydigan statsionarda. Ikkinchi holda, zanjir reaktsiyasining tezligi chidamli ravishda oshib boradi va faqat boshlang'ich materiallarini iste'mol qilish bilan cheklanadi. Statsionar holatdan statsionar rejimga o'tish keskin ravishda reaksiya sharoitida engil o'zgarib turadi: harorat, bosim yoki reaktivlardan birining konsentratsiyasi. Bunday tez tezlashuv reaktsiya aralashmasidan yoki zanjir portlashidan o'z-o'zidan yonish deb hisoblanadi.
Yonish jarayonlari nazariyasini yaratish uchun tarvaqaylab zanjirli reaktsiyalarni kashf qilish katta ahamiyatga ega edi. Issiqlik va zanjirning ikki turi mavjudligi isbotlangan. O'rnatilgan naqshlar
2-bob yonish
zanjirli jarayonlarning nazariyasi yong'in paytida yonish jarayonlarining rivojlanishiga va to'xtatilishiga samarali ta'sir ko'rsatishi mumkin.
Zanjirlarning kelib chiqishi.Dastlabki faol markazlarning yadrolanish jarayoni dallanmagan zanjir reaktsiyalarini rivojlantirishda katta rol o'ynaydi. Zanjir tugatish reaktsiyalarida faol markazlarning yo'qolishini qoplaydi. Ushbu mexanizm faol markazlarni to'plashning dastlabki davrida statsionar rejim yaratish uchun sharoitlarni belgilaydi. Boshlashning past darajasi bilan ushbu davr ahamiyatli bo'lishi mumkin.
Olovdagi kimyoviy reaktsiyalarning aksariyati faol markazlarning muhim energiya rezerviga ega. Bunday sharoitlarda faol markazlarning ishga tushirilishi muhim energiya to'siqlarini bartaraf etish bilan bog'liq.
Bunday holatda faol markazlarning paydo bo'lishining sezilarli tezligini ta'minlaydigan omillar: kimyoviy faol moddalar, radiatsiya, elektr deşarjlari, radioaktiv parchalanish mahsulotlari muhim ahamiyatga ega.
Faol markazlarni shakllantirishga yordam beradigan omillar orasida heterojen reaktsiyalar qayd qilinishi kerak. Yuzaki qatlamda so'rilgan yonuvchi moddalarning molekulalarida interatomik aloqalar zaiflashadi va ularning buzilishi kamroq energiya sarfi talab qiladi. Bunday sharoitda faol markazlarning ishlab chiqarish tezligi gaz hajmiga nisbatan ancha yuqori. Yonuvchan aralashmaning tarkibiy qismlarining heterojen ta'sirida faollashtiruvchi energiya bir hil bo'lgan holatda ham past. Haqiqiy yonish jarayonlari sharoitida faol markazlarning gektogial ishga tushirilishi zanjirsiz zanjirli statsionar rejimga tezkor erishishning muhim omilidir.
Ba'zi xususiyatlar atom qismlarini ishtirokida yuzaga keladigan zanjirsiz zanjir reaktsiyalarini tavsiflaydi. Rejeneratsiyaning faol markazlari bilan o'zaro ta'sirlashmagan holda, zanjirni bekor qilish atomlarni uch marta to'qnashuvlar va yuzada rekombinatsiya qilishda mumkin bo'ladi.
Har qanday haroratda gazsimon moddalar qisman ajraladi. Ba'zi molekulalar atomlarga bo'linadi. Bu holatda ajralish jarayonlari va atomlar birligi molekulalariga muvozanat bor. Dissociatsiya darajasi haroratga bog'liq.
Yonuvchan aralashmasida zanjirlarni buzadigan narsa yo'q bo'lsa, reaktsiyaning atom qismlarini kontsentratsiyasi amalda o'zgarmagan qoladi. Reaksiyaga kirgan atomlar darhol bir xilda yangilanadi
Korolchenko A.Ya. Yonish va portlash jarayonlari
lichie. Dastlabki ishga tushirish reaktiv bo'lmagan tizimda bo'lgani kabi reaktiv atomlarni bir xil miqdorda qoplaydi. Ruxsat etilgan reaktsiya bu jarayonga ta'sir qilmaydi. Bu molekulada atomlar orasidagi eng kam kuchli aloqalar bilan ajralib turadigan reaktsiyaning tarkibiy qismlaridan biri muvozanati bu rejimning xarakterli xususiyati hisoblanadi. Bu holatda boshqa atom komponentlari kontsentratsiyasi kvazistatsion, ammo ko'proq muvozanat.
Yonish reaktsiyalarini bir hil boshlash bilan statsionar rejim ma'lum vaqtdan keyin o'rnatiladi, chunki ayrilish katta faollik energiyasini talab qiladi. Ushbu davr mobaynida disosiyasyon darajasi rekombinatsiya tezligini oshiradi va faol markazlar reaktsiya tizimida to'planadi. Har ikkala jarayonning nisbati ham faol markazlarning muvozanatga kelishini ko'paytirgandan keyin solishtiriladi. Bu vaqt oralig'i indüksiyon davri deb nomlanadi.
Reaktsiya zonasida katalizator sifatida qattiq sirt mavjudligi terodinamik muvozanatni o'zgartirmaydi. Katalizator oldinga va teskari reaktsiyalarga teng ta'sir ko'rsatadi. Faol markazlar nafaqat qattiq yuzaga kelibgina qolmasdan, balki uni to'xtatadi. Ammo, katalizatorning mavjudligi muvozanatning ayrilish holatiga erishishni tezlashtiradi.
Agar zanjirli sinishi reaktsiyalarida ishtirok eta oladigan yonish aralashmasida faol moddalar mavjud bo'lsa, ular faol markazlarning konsentratsiyasini kamaytiradi. Bunday holda, dastlabki tarkibiy qismlardan birining muvozanat ajralishi buziladi, bu reaksiya susayadi va uning tugatilishiga olib kelishi mumkin.
Tajribalar shuni ko'rsatadiki, tashqi manbalar (masalan, yorug'lik manbai) tomonidan taqqoslanmagan zanjir reaktsiyasini boshlashda yonish jarayonining boshlang'ich bosqichida faol markazlarning kontsentratsiyasi muvozanat darajasini sezilarli darajada oshirishi mumkin.
Dallanadigan zanjirli reaktsiyalar jarayonida dastlabki boshlash shartlari reaksiya rivojlanishiga sezilarli ta'sir ko'rsatadi. Sekinlashuvchi jarayonlarda qisman reaksiyaga kirishgan aralashmaning boshlang'ichga qo'shilishi indüksiyon davrini qisqartiradi va otash yonish momentini tezlashtiradi.
Zanjirlarning davomi.Dengizsiz zanjir reaktsiyalarining xarakterli xususiyati faol markazlarning kontsentratsiyasining vaqtinchalik holati. Ochiq elektron bo'lmasa, faol zarrachalar hosil bo'ladi
2-bob. Yonish vaqtida kimyoviy jarayonlar
ular sarflanadigan miqdorda. Faqat yangi boshlanishda paydo bo'ladi. Faol markazlarning teng taqsimlanishi va zanjirni bekor qilish bilan faol markazlarning doimiy konsentratsiyasi va statsionar reaktsiya rejimi o'rnatiladi. Reaktiv darajasi dastlabki tarkibiy qismlar iste'mol qilinganligi bilan kamayadi.
Tarqalgan zanjirli reaksiya holatida, reaktiv tizimidagi faol markazlarning kontsentratsiyasi ularning dastlabki boshlanish shartlaridan qat'iy nazar ortadi. Ko'chki xarakteriga ega bo'lgan o'z-o'zini tezlatuvchi reaktsiya rejimi amalga oshirildi. Bunday holda, dastlabki tarkibiy qismlarning reaktsiyaning yakuniy mahsulotlariga aylantirilishi uchun bir boshlang'ich faol markaz etarli bo'ladi.
Tarqalgan qimmatli reaksiya kinetik tenglamasi quyidagicha. Vaqti-vaqti bilan barqaror boshlang'ich tarkibiy qismlarining kontsentratsiyasining o'zgarishi birinchi taxminan e'tiborsiz qolishi mumkin va faqat faol markazlarning kontsentratsiyasida tez o'zgarishlarni hisobga olish mumkin. s.Ushbu tezlikdagi o'zgarishlar dastlabki ishga tushirish darajasi va dallanma reaktsiyalarining stavkalarining nisbati va zanjirni tugatish bilan belgilanadi. Dastlabki ishga tushirish darajasi tizimda mavjud faol markazlarning konsentratsiyasiga bog'liq emas. Dallanish va sinishi jarayonlari stavkalari faol markazlarning kontsentratsiyasi bilan mutanosib. Bunday sharoitda faol markazlarning shakllanishi va sarflanishining umumiy muvozanati boshlang'ich, tarmoqli va sinishi jarayonlarining stavkalarining summasi bilan belgilanadi:
![]() (2.1)
(2.1)
qaerda va qaysi yo'nalish va sinishi reaktsiyalarining nisbati sobit bo'lgan. Aytaylik, biz quyidagilarni olamiz:
![]() (2.2)
(2.2)
Faol markazlarning kontsentratsiyasining vaqt hosil bo'lganda
ijobiy. Reaktsiya tezligi vaqt bilan ortadi. Dallanadigan zanjirli reaktsiyalarning bu xususiyati bunday reaktsiyalarning tezligi zanjirning tugatish reaktsiyasini oshirib yuboradigan rejimlarda faol markazlarning ko'payishi bilan bog'liq.
Korolchenko A.Ya. Yonish va portlash jarayonlari
Agar reaksiya boshlanishidan oldin tizimda faol markazlar bo'lmasa, ya'ni. att= 0, n = 0 tenglamaning integratsiyasi (2.2) quyidagilarni beradi:
![]() (2.3)
(2.3)
CO ning umumiy reaktsiya tezligi dallanma jarayonining tezligi bilan aniqlanadi. Oxirgi mahsulotlar faqat ushbu reaktsiya vaqtida shakllanadi. Har bir elementar zanjirning dallanishi uchun yakuniy mahsulot molekulalari hosil bo'ladi. Bunga quyidagilar kiradi:
![]() (2.4)
(2.4)
Zanjirli reaksiya vaqtida rivojlanish dallanma reaktsiyalari va zanjirni tugatish reaktsiyalarining stavkalari nisbati bilan belgilanadi va (2.4) tenglamasi ijobiy bo'lsa,
aksiya cheksiz tezlashdi. Reaksiyaning rivojlanishining boshlang'ich davrida quyidagi munosabatlar haqiqiydir:
Dastlabki boshlanishning tezligi kichik bo'lgani sababli, dastlabki davrda sezilarli kimyoviy o'zgarish mavjud emas. Biroz vaqt o'tgach, bu qiymat birdan katta bo'ladi. Shundan keyin (2.4) tenglamaga muvofiq reaksiya tezligi oshib boradi va juda katta qadriyatlarga etadi, garchi u ilgari deyarli sezilmaydigan bo'lsa.
Zanjirli reaksiya rivojlanishida kechikish davrining (indüksiya davri) mavjudligi reaktsiya tizimida ma'lum miqdordagi faol markazlarni to'plash zarurati bilan bog'liq. Faqat bu kimyoviy transformatsiyalar sezilarli bo'ladi.
Zanjir reaktsiyalarida indüksiya davrining kattaligi dastlabki ishga tushirish tezligi emas, balki tarmoqlarni va zanjirni tugatish jarayonlarining nisbatlarini belgilaydi. O'z navbatida, dallanma va sinishi reaktsiyalarining stavkalari har bir reaktsiyali tizimning kimyoviy xususiyatlariga bog'liq bo'lib, ular harorat va kontsentratsiyaga bog'liqligi bilan belgilanadi. Zanjirli reaktsiyalarning o'ziga xosligi
filiallash jarayonlari sezilarli faollashuv energiyasini talab qilsa, sinishi jarayoni tezligi sobit bo'lgan harorat koeffitsienti nolga yaqin. Har uch turdagi zanjirlarning tugashi reaktsiyalarida: ommaviy va heterogen rekombinatsiyalarda, faol aralashmalar bilan radikallarning o'zaro ta'sirida aktivizatsiya energiyasi nolga teng.
Haroratning oshishi bilan aralashmaning umumiy bosimi yoki reaksiyaga kirishgan tarkibiy qismlarning kontsentratsiyasida o'zgarish bo'lishi mumkin, bu reaktsiya statsionardan statsionargacha o'zgaradi. Ushbu jarayonning o'ziga xos xususiyati reaktsiya stavkasini o'zgarmas qiymatdan tortib tobora kuchayib borayotgan darajagacha o'zgarganda, bir rejimdan ikkinchisiga keskin o'tishda yotadi.
Ba'zi zanjirli reaktsiyalar oqimlari nisbiy barqaror bo'lgan, ammo faol markazlarni yaratish qobiliyatiga ega bo'lgan oraliq mahsulotlarning shakllanishi bilan birga keladi. Bunday reaktsiyalar, masalan, peroksidlar va aldegidlar hosil qiluvchi oraliq moddalar sifatida, uglevodorod yonish reaktsiyalarini o'z ichiga oladi. Bu zanjirning dallanishiga olib keladi. Biroq, oraliq mahsulotlarning nisbatan barqarorligi tufayli reaksiya tezlashishi vaqt o'tishi bilan cho'ziladi. Bunday asta-sekin zanjirlar degenerat deb ataladi.
Odatdagidek radikal dallanma mexanizmi bilan zanjir reaktsiyalari, odatda, radikallarning yuqori faolligi tufayli juda tez davom etadi. Olingan radikallar tezda tezlashtiradigan reaktsiyani boshlashadi, yoki bu jarayonni birlashtiradi va chiqaradi.
On elektron Har qanday gaz molekulasi kabi faol zaharli modda boshqa molekulalar bilan to'qnashib, reaktsiya tizimida tasodifiy harakatlar qiladi. Shu bilan birga, yana bir faol zarra yoki molekula bilan ta'sir o'tkazish va oldingi yo'lni davom ettiradigan yangi faol zaharli moddalar shakllanishi bilan bog'liq bo'lgan to'qnashuvlarda ma'lum bir ehtimollik mavjud. Reaksiya zanjirining rivojlanishi, harakatsiz markazlarning klubi kimyoviy reaktsiyaga ega bo'lsa-da, inovatsion molekulalarning Brownian harakatlariga o'xshaydi. Zanjirning rivojlanish yo'lida ikki yoki undan ortiq turdagi alternativ faol markazlar.
Korolchenko A.Ya. Yonish va portlash jarayonlari
Reaktsiyalar zanjiri faol zarrachaning yangilanmasdan reaktsiyaga tushmaguniga qadar davom etadi. Bu holda, ochiq-oydin o'chirib deyiladi. Zanjir reaktsiyalarining kinetikasida ajralish jarayonlari katta rol o'ynaydi. Faol markazlarning o'limiga olib keladigan ikki turdagi reaktsiyalar mavjud:
Homogen oraliq (reaktsiya aralashuvining miqdori bo'yicha o'lim);
Heterogen oraliq (qattiq sirt ustida o'lim) Ikki jarayondan biri bilan bir qator zanjirlar uzilishi mumkin:
radikallar rekombinatsiya qilishda yoki turli kimyoviy jihatdan faol moddalar ikkilamchi qayta tiklanmasdan faol markazlar bilan o'zaro ta'sirlashganda.
Yonish vaqtida yoki qattiq yonish materiallari yuzasida hosil qilingan kichkina zarralar bo'yicha heterojen zanjir buzilishi sodir bo'ladi. Sog'lom yuza ustida ochiq elektron gaz aralashmasidan faol siqilish nuqtasi bu sirtga yo'qolishi mumkin. Qattiq sirtdagi rekombinatsiya mexanizmi, reaktivlikni oshiruvchi faol zaharli modda sirtda so'riladi *. Bu jarayonda energiya va makon to'siqlari bo'lmaganligi sababli, qo'shni uchastkalarda so'roq qilingan radikallar bir-biri bilan qayta ishlanadi. Rekombinatsiya natijasida hosil bo'lgan barqaror birikmalar molekulalari endi zanjirli reaksiya rivojlanishiga aralashmaydi.
Biroq, faol zarrachaning qattiq sirt bilan to'qnashuvi uning adsorbsiyasiga olib kelmaydi. Ehtimol, uning sirtidan aks etishi. Faol markazni qattiq sirt bilan adsorptsiya qilish ehtimoli turar joy koeffitsienti deb ataladi. Ushbu koeffitsient faol zarrachaning va yuzaning kimyoviy yaqinligiga xosdir. Deyarli muhim holatlarda, faol zarrachalar devordan aks ettirilganidan keyin uzoqqa ketmaydi. Devorda turar joy paydo bo'lmaguncha yangi to'qnashuvlar yuzaga kelishi ehtimoli mavjud. Ushbu jarayon tufayli ma'lum sharoitlarda reaksiya darajasi turar-joy koeffitsientidan deyarli mustaqil. Bu jarayon Yevropa Ittifoqi kabi davom etadi
* Tortib olish - atrof-muhitga ta'sir qiluvchi modda moddasining qattiq tanasi (yoki suyuqligi) tomonidan emdirilishi. Sovutadigan tanaga sorbent deyiladi, so'riladi- sorbatlar. Sovutgichning barcha massasini (assimilyatsiya) va sirt qatlamini (adsorbsiyasini) ajratib turadi. Kimyoviy turdagi qattiq sorbent va sorbat yuzasi o'rtasidagi o'zaro ta'sirga bog'liq bo'lgan so'ralganda chemisorptsiya deyiladi.
__________________________ 2-bob. Yonish vaqtida kimyoviy jarayonlar
har bir to'qnashuvda ochiq-oydin o'chirib sodir bo'lsa. Sirtdagi faol markazlarning kontsentratsiyasi nolga teng bo'lishi mumkin.
Reaksiya aralashmasida faol aralashmalar bo'lmasa, zanjirlar buzilishi qattiq yuzalar yoki massa tarkibidagi radikallarni rekombinatsiya qilish yo'li bilan bir xil tarzda sodir bo'lishi mumkin. Haqiqiy yong'inlarda ikkinchi yo'l asosan amalga oshiriladi.
Zanjir reaktsiyalarining kinetikasiga ma'lum ta'sirlar inert gazlar bilan reaksiyaga kirish tizimida hissa moddalariga ega. Inert qo'shimchalar faol zarralar bilan to'qnashuvlar sonini ko'paytiradi, zanjir buzilish ehtimolini oshiradi va shunga muvofiq umumiy reaktsiyani inhibe qiladi.
Reaksiyaga kirishayotgan aralashmaning reaktiv qo'shimchalari - inhibitorlar kiritilishi bilan zanjir reaktsiyalarini yanada samarali tarzda inhibe qilish mumkin. Inhibitorlar reaktsiyaga etaklovchi, zanjirni buzadigan faol markazlar bilan o'zaro ta'sir o'tkazadi. Inhibe qilingan aralashmaning reaksiya kinetikasi faol markazlar bilan o'zaro aloqada inhibitör va reaksiyaning asosiy komponentlari o'rtasidagi raqobat sharoitlari bilan aniqlanadi. Inhibitorning yuqori samaradorligi va yangi faol markazlarning mo'tadil tezligi bilan, allaqachon inhibitordagi kichik hissa moddalar zanjir reaksiya jarayonini to'liq bostirishi mumkin.
Yong'in va portlash xavfsizligi amaliyotida inhibisyon jarayonlari katta ahamiyatga ega. Inhibitorlarni qo'llash yonish jarayonlariga samarali ta'sir o'tkazishga imkon beradi.
2.2. Vodorodning yonishi paytida kimyoviy jarayonlar
Bir vodorod molekulasining kislorod molekulasi bilan o'zaro ta'siri ketma-ket ketma-ketliklar ketma-ketligi bilan murakkab tarzda davom etadi. Hozir vodorodning yonishi zanjir mexanizmi orqali sodir bo'ladi, zarralar faol markazlarning rolini o'ynaydi. Vodorod yonishi paytida elementar reaktsiyalarning ketma-ketligi va ahamiyatliligi vodorod olovining paydo bo'lishi va rivojlanishi uchun turli sharoitlarda juda batafsil bayon etilgan.
Eksperimental va hisoblash uslublarini qo'llagan holda vodorodni yoqish jarayonini o'z-o'zini aniqlash rejimida batafsil tahlil qilish professor A.N. Baratov tomonidan amalga oshirildi. U o'n to'rt asosiy elementar reaksiyalar, jumladan, jarayonning quyidagi sxemasini taklif qildi:
Korolchenko A.Ya. Yonish va portlash jarayonlari
Faol markazlarning kelib chiqishi reaktsiya orqali sodir bo'ladi
![]()
Reaksiyalar zanjirining davomi
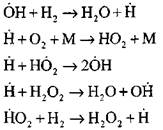
Dallanuvchi zanjirlar
 |
ochiq elektron
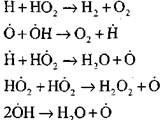 |
Vodorod atomlarining konsentratsiyasi o'z-o'zini aniqlash jarayonining dastlabki bosqichida dastlabki vodorod tarkibining ahamiyatsiz qismi hisoblanadi. Zanjirli reaksiya rivojlanishi bilan molekulyar vodorodning konversiyalash darajasi u qadar yuqori bo'lib, u soniyaning yuzinchi qismida iste'mol qilinadi.
2.3. Karbon monoksitni yoqish paytida kimyoviy reaktsiyalar
Karbon monoksit kislorod bilan o'zaro ta'siri yoqish jarayonlari uchun muhim reaktsiya hisoblanadi. Ushbu reaktsiyaning davomiyligi
__________________________ 2-bob. Kimyoviy jarayonlaryonib turadi
ko'pgina holatlar uglerod o'z ichiga olgan moddalarni yonish qonunlarini belgilaydi. Reaksiya tarvaqaylab zanjirli mexanizm bilan tavsiflanadi. Bir qator xususiyatlarga ega.
Uzoq vaqt davomida CO va O2 ning butunlay quruq qorishmasini yoqish va yoqish mumkin emasligiga ishonch bor edi. Shu bilan birga, massa spektrogrami yordamida suvning yo'qligi nazorat qilinadigan eksperimentlar diqqat bilan aniqlandi, shuning uchun quruq aralashman uchun ham tutash mumkin. Ta'kidlash joizki, tizimda CO + 0 2 suv bug'ining yoki vodorodning mavjudligi mumkin bo'lgan faol markazlarning sonini ko'paytirish orqali tutash va yonish jarayonini faollashtiradi. Suvning tezlashtiruvchi ta'siri past konsentratsiyalarda ayniqsa seziladi.
Suv bug'idagi yoki vodorodning kichik qo'shimchalari borligida uglerod oksidini yoqish quyidagi asosiy jarayonlarning ishtiroki bilan sodir bo'ladi:

Reaksiya (VI) bilan hosil qilingan H0 2 radikalleri zanjirni davom ettirishi mumkin (reaktsiya VIII) yoki uning sinishi (IX-XII) bilan parchalanishiga olib kelishi mumkin.
CO ning sekin oksidlanishini zanjirli portlashga o'tish shartlarini baholash uchun, H02 radikalida bir zanjir uzilish ehtimolini baholashimiz mumkin; bu erda (X) va (XI) zanjirni tugatishdagi reaktsiyalarning ahamiyatini hisobga olamiz.
(IX-XI) protseduralari (IX-XI) 1000 K tartibli haroratlarda bir-biriga yaqin bo'lgani uchun, reaktsiyaga (IX) solishtiradigan bo'lsak, radikallar konsentratsiyasi vodorod atomlarining kontsentratsiyasidan ancha past, chunki radikallar kimyoviy faolligini yuqori deb hisoblaydi. Shuning uchun, radikal H02 orqali ochiq-oydin elektron mumkinligi quyidagi tarzda yozilishi mumkin:
1000K haroratda
Shuning uchun, agar shunday bo'lsa
![]()
![]()
magnit effekti
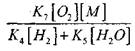
(2.7) tenglamani echish bo'yicha zaiflashadi.
2-bob. Yonish vaqtida kimyoviy jarayonlar
Bunday holda ![]() yoki
yoki ![]() (nima sodir bo'ladi?
(nima sodir bo'ladi?
haqiqiy olovlar bilan), tenglama (2.7) quyidagi shaklga aylanadi:
![]() (2.8)
(2.8)
Shunday qilib, atmosferada uglerod oksidini yondirish holati vodorod yonishi mavjudligi va naqshlari bilan ko'p jihatdan aniqlanadi. Reaksiya bo'yicha CO ning oksidlanishi (v) vodorodni o'z ichiga olgan reaktsiyalarda hosil bo'lgan OH radikallerinin konsentratsiyasiga bog'liq.
Uglerod oksidi uchun yonish reaktsiyasining o'ziga xos xususiyati, kichik qo'shimchalar vodorod atomlariga yuqori ta'sirga ega bo'lgan moddalarning reaktiv tizimiga kiritilganda uning tez inhibasiyasida yotadi. CO ning yonishini oldini olgan bunday moddalar uglevodorodlarning halol-türevleridir. Reaksiya natijasida vodorod atomlari bilan o'zaro ta'sirlashganda reaksiya zanjirlarining to'xtab qolishi natijasida ularning inhibitor ta'siri
2.4. Uglevodorod yonishi
Vodorod va karbon monoksitning yonish jarayonlarini tekshirish yonish reaktsiyasi mexanizmining murakkabligini ko'rsatadi. H 2 va CO ga nisbatan reaksiya juda ko'p elementar bosqichlar va oraliq mahsulotlar ishtirokidagi zanjir bo'lib qoladi. Shuning uchun ham murakkab moddalar - uglevodorodlarning yonish reaktsiyalari mexanizmi yanada murakkablashishi va bu birikmalarning yonishi va yonishi jarayonlari bilan birgalikda olib boriladigan ta'sirlar yanada ko'proq bo'lishini kutish tabiiydir.
Hozirgi vaqtda uglevodorodlarning kimyoviy yuksalishning tabiiy xususiyati haqidagi ma'lumotlar ularning yonish jarayonida kuzatiladigan ta'sirlarni ba'zi bir taxminlar bilan tushuntirishga imkon beradi.
Uglevodorod olovida, ma'lum bo'lgan faol zarralar bilan bir qatorda, ancha murakkab strukturaning oraliq mahsuloti ko'pligi aniqlangan. Ba'zi hollarda ular yangi zanjirlarning paydo bo'lishiga aylanadi. Uglevodorodlarni yoqish va yoqish jarayonlarida asosiy o'rin quyidagi oraliq birikmalar bilan ifodalanadi:
Korolchenko A.Ya. Yonish va portlash jarayonlari
1. Uglevodorod radikallari - bu molekula
bir yoki bir necha vodorod atomi chiqaradigan levodorodalar. Ular
Qoldiqlar alkil (CH3 - metil, C2H5 - etil, C3H7 - propil va
va hokazo). Uning yuqori reaktivligi tufayli erkin alkillar mavjud
uzoq vaqt mavjud emas. Olovda oraliqda bo'lish
mahsulotlar. Boshqa molekulalar bilan o'zaro aloqada bo'lganda
mustaqil tuzilmaviy guruh sifatida. Uglevodorod radikallalari
odatda R harfi bilan ifodalanadi.
2. Peroxidlar - umumiy formulalar R-00-R "birikmalari.
3. Aldehidlar - toifa birikmalari
![]()
Eng oddiy aldegid formik (formaldegid) va asatik (asetaldegid) ![]() . Bu moddalar hammasi
. Bu moddalar hammasi
uglevodorodlarning to'liq yonish mahsulotlarida mavjud.
Uglevodorodlarning yonishi paytida zanjir shakllanishi uglevodorod radikallarini hosil qiluvchi har qanday reaktsiya bo'lishi mumkin. Bu ikki erkin metil guruhi tashkil etilgandagi bir etan molekulasining ajralib chiqishi reaktsiyasi bo'lishi mumkin:
![]()
yoki uglevodorod kislorod bilan reaktsiyasi:
![]()
Zanjirlarning davomi shakllanish reaktsiyalari natijasida sodir bo'ladi periks yoki gidroksid oksidi:
![]()
Cho'yinish dallanishi gidroksidning parchalanishi vaqtida amalga oshiriladi:
2-bob. Yonish vaqtida kimyoviy jarayonlar
Reaktsiyalarning ushbu ketma-ketligi reaktsiya tizimida periks birikmalari kontsentratsiyasining bosqichma-bosqich oshirilishiga olib keladi.
Perikslar, radikallar va boshlang'ich birikmalar bilan bir vaqtda
parallel reaktsiyalar mavjud:

Ushbu reaktsiyalar ekzotermik; ular katta miqdorda issiqlik oqishi bilan.
Reaktsiya aralashmasining harorati oshishi bilan faol markazlarning o'rni bir oraliq mahsulotdan ikkinchisiga quyidagi tartibda o'tadi: alkil gidroksidi oksidlari, och gidroksidlar, formaldegidlar.
Yuqori haroratli hududlarda (600-800 ° C) vaqt davomida reaktsiya aralashmasining tarkibidagi o'zgarishlarning eksperimental tekshiruvlari dastlabki uglevodorodlarni yakuniy yonish mahsulotlariga aylantirish jarayoni ikki bosqichga bo'linganligini ko'rsatmoqda: birinchi, juda yuqori nisbatda yuzaga keladi, uglevodorodlarni CO ga oksidlaydi. Ikkinchi, sekin, bosqichda CO oksidlanadi. Juda muhim bir xulosa quyidagicha: uglevodorodlarning yonish qonunlarining ko'pchiligi uglerod monoksid yonishi xususiyatlariga ko'ra tushuntirilishi mumkin.
2.5. Karbon yonishi
Karbonli yonish jarayoni heterogen jarayonning mexanizmiga qarab davom etadi, uning o'ziga xosligi kimyoviy bosqichni atrofdagi kosmosdan yonib turgan qattiq yuzasiga gazli oksidantni (havo kislorodi) o'tkazish jarayonidan ajratish mumkin emasligi sababli yotadi. Yonish darajasi uglerodning kimyoviy xususiyatlariga va yonilg'i yuzasiga kislorod etkazib berish jarayonini belgilovchi xususiyatlarga bog'liq. Yonish zonasiga kislorod etkazilishi diffuziya va shuning uchun amalga oshiriladi
Korolchenko A.Ya. Yonish va portlash jarayonlari
yoqilg'i yuzasi ustidagi fazada va ko'mir va koks moddalarida mavjud bo'lgan yoriqlar va ko'zgularda juda ko'p miqdordagi omillarga bog'liq: yonayotgan tananing shakli va hajmi, gazli muhitning harakatlanishi, kislorodning diffuziya koeffitsientlari va reaksiya mahsulotlari.
Heterogen bo'lmagan uglerod yonish xususiyatlarini namoyish qilish uchun biz 900 ° S haroratgacha qizdirilgan o'choqqa qo'yilgan alohida ko'mir ishini ko'rib chiqamiz. Dastlabki vaqtda ko'mir yoqilishi yuzasiga yaqin joylashgan kislorod hisobidan yuz beradi. Ishlatilgandan so'ng, isitish sirtini yonish mahsulotlari hosil qiladi. Yonish tezligi kamayadi va gaz uzayining boshqa uzoq joylaridan kislorod bo'lmaganida jarayoni to'xtatishi mumkin.
Ushbu oqim diffuziya orqali sodir bo'ladi va yonish darajasi diffuziya oqimi bilan aniqlanadi. Difüzyon zichligi katta darajada gaz dunyosining yonayotgan sirt yaqinidagi harakatining zichligi va tabiatiga bog'liq. Kimyoviy reaksiya tezligi asosan harorat bilan aniqlanadi. Heterojen reaktsiyalar, shuningdek bir hil, Arreni qonuniga bo'ysunadi.
Yuqori haroratlarda uglerod oksidlanish reaktsiyasi juda tez sodir bo'ladi va jarayonning umumiy tezligi kislorodning yuzaga tarqalishi bilan cheklanadi.
Shunday qilib, uglerodni yoqish jarayoni turli xil tabiatdagi ikkita jarayondan iborat: gaz kosmikidan havo oqimidan tortib o'tadigan joygacha transportirovka qilish jarayonlari va uglerod qatlami bilan kimyoviy shovqin jarayoni. Har ikkala jarayon ham bir-biri bilan bog'liq, biroq ularning har biri o'z qonunlariga ega. Bu jarayonlarning eng muhimi kislorod iste'mol qilish jarayoni bo'lib, u turli kimyoviy reaktsiyalar bilan tavsiflanadi.
Kislorodni uglerod bilan birlashtirishning kompleks reaktsiyasi mexanizmi C va C02 ning oksidlarini bir vaqtda shakllantiradigan, keyinchalik CX0Y tipidagi qidiruv fizikokimyoviy kompleks orqali hosil bo'ladi va keyinchalik CO ga bo'linadi. Ushbu oksidlarning nisbati yonish shartlariga bog'liq. Shunga mos ravishda, yonuvchi uglerod reaksiya uchun tenglama quyidagi kabi yozilishi mumkin:
2-bob. Yonish vaqtida kimyoviy jarayonlar
Keyin yonayotgan uglerod monoxidining bir hil reaktsiyasi davom etadi:
uning mexanizmi 2.3-bo'limda muhokama qilinadi.
Ushbu reaksiya uglerod yuzasi yaqinida sodir bo'lishi mumkin, shundayva ko'mirning massasi, uning ko'zlaridagi va yoriqlarida.
Yana bir reaktsiya - issiq uglerod va karbonat angidrid o'rtasida heterojen reaktsiya:
![]()
U kislorod etishmasligi bo'lgan joylarda sezilarli tezlikda oqadi, lekin u erda uglerod harorati etarli darajada yuqori.
Ta'riflangan reaksiyalarning kombinatsiyasi uglerod yonishi mahsulotlarining tarkibini aniqlaydi.
Chiqib ketish jarayonining chuqurlashishi
| R. |
yonuvchan aralashmalarda sug'orish o'z-o'zidan yoqish, tashqi manba yoki o'z-o'zidan yonish natijasida olov natijasida sodir bo'lishi mumkin. O'z-o'zidan otash va tutash jarayonlari gazli, suyuq yoki qattiq holatda bo'lgan moddalarga xos bo'lsa, u holda o'z-o'zidan yonish qattiq materiallar (ayniqsa nozik bo'lingan holatda) yoki rivojlangan yuzaga ega bo'lgan materiallarga tarqalgan qaynoq suyuqliklarga xosdir.
3.1. O'z-o'zini yoqish. Ruxsat etilgan nazariya
Yong'in - odamlarga xavf soladigan va moddiy zarar etkazadigan vaqt va makonda rivojlanayotgan nazoratsiz yonish.
Odamlarga yong'in xavfi ochiq olov, uchqunlar, isitma, yonishning toksik moddalari, tutun, kislorodning kamayishi, bino yoki inshootlarning qulashi.
Yonish - issiqlik va tutunning chiqishi, olovning paydo bo'lishi yoki tebranishi bilan birga tezda davom etadigan fizik-kimyoviy reaktsiya. Oddiy sharoitlarda yonish jarayoni yonuvchan moddalarni oksidlovchi yoki atmosferadagi kislorod bilan birlashtiruvchi jarayondir. Biroq, ayrim moddalar (masalan, siqilgan asetilen, azot xlorid, ozon) kislorodsiz portlashi mumkin, bu esa issiqlik va olovni hosil qiladi. Natijada, yonish faqatgina birikma emas, balki parchalanish reaksiyalaridan kelib chiqadi. Bundan tashqari, vodorod va ko'plab metallar xlor atmosferasida, oltingugurt bug'laridan mis, karbon dioksidda magnezium va hk.
Havodagi kislorod bilan yonadigan modda oksidlanish jarayonida yuzaga keladigan eng xavfli yonish. Shu bilan birga, yoqilg'i tizimiga kerakli miqdorda energiya etkazib beradigan olov manbasi bo'lishi kerak. Og'irlikning eng keng tarqalgan manbalari quyidagilardan iborat: elektr jihozlari ishlamay qolganda, yorqin metall korpuslari, payvandlash, zarb qilish ishlari paytida paydo bo'ladigan uchqunlar; ishqalanish natijasida hosil bo'ladigan issiqlik; texnologik isitish asboblari; yong'inga qarshi qurilmalar; adiyabatik siqilish issiqligi; statik elektr tokini uchirish; elektr kontaktlarini haddan ziyod qizdirish; kimyoviy reaktsiyalar, issiqlikning chiqishi bilan boshlanadi.
Ushbu manbalarning isitish harorati boshqacha. Shunday qilib, metall tananing urishi natijasida paydo bo'ladigan uchqun 1900 ° S gacha bo'lgan haroratga ega bo'lishi mumkin, o'yinning alangasi taxminan. 800 ° S, kayış paytida kamar konveyörünün etakchi tamburu 600 ° C'ye qadar va elektr deşarjının issiqligida harorat 10.000 ° S ga etadi va deyarli bir zumda kimyoviy reaktsiyalarga ega.
Yonish to'liq va to'liq bo'lmasligi mumkin. To'liq yonish natijasida, kisloroddan ortiq bo'lgan reaktsiya mahsulotlari karbonat angidrid, suv, azot, oltingugurt dioksidi hisoblanadi. Yonuvchan kislorod kislorod etishmovchiligi bilan yuzaga keladi, bu holda yonish mahsulotlari toksik va yonuvchi moddalar - uglerod oksidi, spirtli ichimliklarni, keton, aldegid va boshqalar. Yonuvchan moddalarni to'liq yoqish uchun ma'lum miqdorda havo kerak bo'ladi: 1 kg yog'och - 4.18, torf - 5 , 8, propan - 23,8 m3.
Yonish jarayonini quyidagicha tasavvur qilish mumkin. Issiqlik impulsini kiritish bilan sovuq yonuvchi vosita isitiladi, yonuvchan vositani kislorod va qo'shimcha issiqlik bilan ajralib turadigan zich oksidlanish mavjud. Bu, o'z navbatida, yonuvchi materialning qatlamini isitishga olib keladi, bu erda kuchli kimyoviy reaktsiya ham sodir bo'ladi. Yonuvchan moddalarning bunday yonma qatlam yonishi bilan yonish zonasi harakatlanadi; Bu harakatning tezligi yonish jarayonining intensivligini belgilaydi va uning eng muhim xususiyati hisoblanadi. Yonuvchan issiqlik, oksidlanish va yonish jarayoni yonuvchan materiallarning to'liq hajmini to'kmasdan davom etadi.
Moddaning qizib ketgan va kimyoviy reaksiyaga kirishgan tor hududiga olov old tomoni deyiladi.
Yonuvchan tizimlar kimyoviy jihatdan bir hil va heterojen bo'lishi mumkin. Kimyoviy bir hil tizimlar yonuvchan moddalar, havo va bug'lari yoki havo bilan qoplangan changlar aralashmasi bo'lib, unda yonadigan moddalar va havo bir xil tarzda aralashadi. Bunday tizimlarning yonishi bir hil deb ataladi. Kimyoviy birlamchi bo'lmagan tizimlarda yonuvchi modda va havo aralash bo'lmaydi va interfeysga ega. Ular ko'pincha qat'iy yonuvchan materiallar va ularning yonishi heterojen deb nomlanadi.
Yonuvchan aralashmaning Tg yonishining umumiy vaqti yonuvchan moddalar bilan kislorodning t k aloqasi uchun zarur bo'lgan vaqtning yig'indisi va kimyoviy o'zi sodir bo'ladigan vaqt, Oksidlanish reaktsiyasi t x
Ushbu ikki atamaning nisbatiga qarab diffuziya va kinetik yonish farqlanadi. Qattiq yonuvchan moddalarni yondirganda, moddalarning sirtiga kislorod kirishi uchun zarur bo'lgan vaqt kimyoviy reaktsiya vaqtidan ancha uzoqroq bo'ladi, shuning uchun umumiy yonish darajasi kislorodning yonuvchan moddaga tarqalishi tezligi bilan aniqlanadi. Bunday moddalarni yondirish odatda yong'inlarda uchraydi va diffuziv deb nomlanadi. Kimyoviy reaksiya tezligi bilan belgilanadigan yonish, kinetik deb ataladi. Bu turdagi yonish bir hil yonuvchi tizimlarga xosdir.
Kuyishning kalorimetrik, nazariy va haqiqiy haroratini ajratib ko'rsatish.
Yonuvchanlikning kalorimetrik harorati, to'liq yonish mahsuloti qizib ketadigan haroratni ifodalaydi, agar chiqarilgan barcha issiqlik ularni isitish uchun sarflansa, havo miqdori nazariy jihatdan zarur, moddalar butunlay yondiriladi va dastlabki harorat 0 ° S. Issiqlik yo'qotishlari nolga teng deb hisoblanadi. Yoqilg'i va havoning dastlabki harorati 0 ° C bo'lsa, u holda yonishning kalorimetrik harorati
![]()
bu erda Qn yonuvchan moddalarning aniq kalorifik qiymati, kkal / kg; V - yonish mahsulotlarining hajmi, m3 / kg; c - yonish mahsulotlarining o'rtacha hajmli issiqlik quvvati, kkal / m3 · deg.
Natijada, kalorimetrik yonish harorati faqat yonuvchan moddalarning xususiyatlariga bog'liq va uning miqdoriga bog'liq emas. Nazariy yonish harorati dispersiyani yoqish paytida issiqlik yo'qolishini hisobga oladi. Kalorimetrik yonish harorati yonuvchan moddalar uchun eng yuqori va sifatli baholash uchun ishlatiladi. Aslida, yoqilganda, nurlanish, ortiqcha havo va atrof-muhitni isituvchi issiqlik tufayli har doim issiqlik yo'qolishi mumkin.
Haqiqiy yonish harorati yong'in harorati. Ichki va tashqi olovning haroratini farqlash. Tashqi olovning harorati olov harorati va ichki harorat xonadagi tutunning harorati. Atrof muhitga issiqlik yo'qotilishi, yonish mahsuloti va inshootlarni isitish tufayli yong'in holatlarida yuzaga kelgan haqiqiy haroratlar
har doim 30% dan 50% gacha nazariyroqdir. Misol uchun, benzinning nazariy yonish harorati 1730 ° C va haqiqiy harorat 1400 ° S ni tashkil qiladi.
Yonuvchan bug'lar va oksidlovchi moddalarni o'z ichiga olgan gazlar aralashmasi faqat undagi ma'lum miqdorda yoqilg'i bilan yonishi mumkin.
Yonishini ta'minlash mumkin bo'lgan yonuvchan gazning eng past kontsentratsiyasi (LEL) pastroq kontsentratsiya chegarasi deb ataladi. Yonishini davom ettirish mumkin bo'lgan eng yuqori kontsentratsiyaga ateşleme yuqori konsantrasyon chegarasi (AIPW), deyiladi. Ushbu chegaralarda joylashgan kontsentratsiya hududi olov hududi deb ataladi. Ateşleme olov paydo bo'lishi bilan birga olov (yoqish boshlanishi). Bu uzoq vaqt davomida yonib turadi, bu hatto olov manbasini olib tashlaganidan keyin ham to'xtamaydi. Aniqlanishning pastki va yuqori chegaralaridagi qiymatlar gaz aralashmasi, havo aralashmalarining bug'lari va changlari, yonuvchan aralashmaning ta'sirsiz qismlarining tarkibi bilan bog'liq. Yonuvchan qorishmalarga inert gazlar qo'shilishi ateşleme maydonini toraytiradi va oxir-oqibatda yonmaydilar. Yonish chegaralarini sezilarli darajada kamaytiring, yonish reaktsiyasini susaytiradigan ayrim aralashmalar. Ulardan eng faoli halogenlashgan uglevodorodlardir. Ham belgilanadigan xususiyatlar yonib ketishni to'xtatish uchun ishlatiladi. Aralashmaning bosimini atmosfera bosimidan pastga tushirish ham ateşleme maydonini toraytiradi va ma'lum bir bosim davomida aralash yonmaydi. Yonuvchan qorishmaning bosimini kuchaytirmoq odatdagi maydonni kengaytiradi, biroq, odatda, bir oz. Yonuvchan qorishmaning harorati ko'tarilishi olov maydonini kengaytiradi. Tutuşmanın konsantrasyonu, shuningdek, ateşleme manbasini kuchiga ham ta'sir qiladi.
Faqat kontsentratsiya emas, balki olovning harorat chegaralari ham mavjud.
Havodagi bug'lar ateşlenmesi uchun harorat chegaralari, uning to'yingan bug'lari ateşleme pastki yoki yuqori kontsentrasyon chegarasiga to'g'ri keladigan konsantrasyonlar tashkil etgan, yonadigan moddalar haroratidir. Ateşleme harorati, bir modda tutuşturur yoki tutunmaya boshlagan eng kam harorat va ateşleme manbai çıkartıldıktan keyin yoqish yoki tutun davom etmoqda. Ateşleme harorati moddalarning o'zini yonish qobiliyatini ifodalaydi. Agar moddaning ateşleme harorati bo'lmasa, u yonib-yoqish yoki yonmaydilar deb nomlanadi.
Oksidlanish reaktsiyasining harorat ta'sirida tezlashishi o'z-o'zidan yoqilishga olib keladi. Ateşleme jarayoni farqli o'laroq, bu erda faqat miqyosi cheklangan qismi - sirt - tutuşur, o'z-o'zidan tutuşma modda miqyosida paydo bo'ladi. O'z-o'zini yoqish haroratini eng kam harorat deb tushunishadi, bu moddaga qizdirilishi kerak, bu esa keyingi avto-oksidlanish natijasida yonadi. O'z-o'zini yoqish faqatgina Oksidlanish jarayonida chiqarilgan issiqlik miqdori atrof-muhitga issiqlik chiqarilishini oshirishi mumkin.
Avtomatik ateşleme harorati bir modda uchun sobit emas, chunki u katta darajada aniqlash shartlariga bog'liq. Qiyosiy ma'lumotlar olish uchun sinov qurilmasi va gazlar va bug'larning o'z-o'zini yoqish haroratini aniqlash usuli standartlashtirilgan (GOST 13920-68). Oddiy usul bilan belgilanadigan eng past harorat, unga gazlar va bug'lari aralashmasi havoga bir tekisda qizdirilishi kerak, chunki u tashqi ateşleme manbai kiritilmasdan tutuşturmak uchun standart avtomatik ateşleme harorati deb nomlanadi.
Spontan ateşleme turi, o'z-o'zidan yanmasıdır, ya'ni ateşleme manbai ta'siri holda o'z-o'zidan isitish natijasida yonishi. Spontan ateşleme va o'z-o'zidan yanma o'rtasidagi farq, harorat katta. O'z-o'zidan yonish atrof-muhit haroratida sodir bo'ladi va o'z-o'zidan yoqish uchun moddani tashqi tomondan isitish kerak.

 Issiq va sovuq suv bilan ta'minlovchi hisoblagichlarni qabul qilish
Issiq va sovuq suv bilan ta'minlovchi hisoblagichlarni qabul qilish Turli shakldagi va aloqa qismlari havodagi kanallari maydonini hisoblash
Turli shakldagi va aloqa qismlari havodagi kanallari maydonini hisoblash Yonish jarayonlari kimyosi. Portlash energiyasi
Yonish jarayonlari kimyosi. Portlash energiyasi Agar siz hisoblagichlarni o'qimasangiz, nima bo'ladi
Agar siz hisoblagichlarni o'qimasangiz, nima bo'ladi