การเผาไหม้เรียกว่า กระบวนการทางเคมีระหว่างการเผาไหม้
คำจำกัดความพื้นฐานบางประการ
จำนวนอะตอมและโมเลกุลจะแสดงออกอย่างสะดวกในแง่ของ ปริมาณของสาร หรือ จำนวนโมลของสาร. หนึ่งโมลของสสารสอดคล้องกับ 6.023 ∙ 10 23 23 (อะตอมและโมเลกุล) หมายเลข N A = 6.023 ∙ 10 23 mol -1 เรียกว่าหมายเลข Avogadro โมลเศษส่วน x ฉันส่วนประกอบ ผม คืออัตราส่วนของจำนวนโมล n ผม ส่วนประกอบ ผม ถึงจำนวนโมลทั้งหมด n = ∑ n ผม ส่วนผสม ( x i = n ฉัน / n).
น้ำหนัก ม. เป็นคุณสมบัติพื้นฐานของสาร (หน่วยการวัดในระบบ SI คือกิโลกรัม) ส่วนของมวล Wi คืออัตราส่วนของมวล ม ส่วนประกอบ ผม ถึงมวลรวมของส่วนผสม m = ∑ ม. ฉัน (Wi = m ฉัน / ม).
น้ำหนักโมเลกุล (หรือน้ำหนักโมเลกุล) M ผม(g / mol) ส่วนประกอบ ผม - คือมวลของหนึ่งโมลขององค์ประกอบนี้ ดังนั้นสำหรับคาร์บอนอะตอมอะตอมไฮโดรเจนออกซิเจนและมีเธนเรามี: M c = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol มวลโมลเฉลี่ยของส่วนผสม M (g / mol) สามารถแสดงในรูปของเศษส่วนกรามของส่วนประกอบ (M = x i M i).
การกำหนดกระบวนการเผาไหม้
ร้อน - เป็นกระบวนการทางเคมีและฟิสิกส์ที่ซับซ้อนซึ่งสารและวัสดุที่ติดไฟได้ภายใต้อิทธิพลของอุณหภูมิที่สูงเข้าสู่ปฏิกิริยาทางเคมีกับสารออกซิไดซ์ (ออกซิเจนในอากาศ) เปลี่ยนเป็นผลิตภัณฑ์จากการเผาไหม้และมีการแผ่รังสีความร้อนและแสง
เงื่อนไขที่จำเป็นสำหรับการเกิดขึ้นของกระบวนการเผาไหม้:
การปรากฏตัวของสารติดไฟ (GV);
การปรากฏตัวของสารออกซิไดซ์ (O. ) - ออกซิเจนในอากาศ
การปรากฏตัวของแหล่งกำเนิดประกายไฟ (I.Z)
วัสดุที่ติดไฟได้จะต้องได้รับความร้อนจนถึงอุณหภูมิที่จะเกิดกระบวนการออกซิเดชั่น
ในการให้ความร้อนกับสารที่ติดไฟได้ในอุณหภูมิหนึ่ง ๆ จำเป็นต้องใช้แหล่งกำเนิดประกายไฟบางอย่าง
เพื่อรักษากระบวนการเผาไหม้จำเป็นต้องมีความเข้มข้นของเชื้อเพลิงและออกซิไดเซอร์บางอย่าง
กระบวนการเผาไหม้ที่สำคัญที่สุดคือความร้อนและการถ่ายเทมวล คุณสมบัติที่พบบ่อยที่สุดของการเผาไหม้คือการเกิดขึ้นของเปลวไฟและเคลื่อนย้ายไปทั่วส่วนผสมที่ติดไฟได้โดยการถ่ายโอนความร้อนหรือกระจายอนุภาคที่ใช้งานจากโซนการเผาไหม้ไปยังส่วนผสมที่ติดไฟได้สด
ไฟไหม้ - นี่เป็นอาการที่มองเห็นได้ของการเผาไหม้ มันจะเรียกว่าเขตการเผาไหม้ นี่เป็นส่วนหนึ่งของพื้นที่ที่มีการเปลี่ยนแปลงของส่วนผสมที่ติดไฟได้เป็นผลิตภัณฑ์ที่เกิดจากการเผาไหม้ที่สมบูรณ์และไม่สมบูรณ์
ตัวแปรหลักของกระบวนการเผาไหม้ที่นำไปสู่ความตายและก่อให้เกิดความเสียหายต่อวัสดุคือ:
ความร้อนจำนวนมาก
อุณหภูมิสูง
องค์ประกอบที่เป็นพิษของผลิตภัณฑ์เผาไหม้
กระบวนการเผาไหม้จากมุมมองของทฤษฎีจลศาสตร์ของโมเลกุลของก๊าซ
มะเดื่อ 2.1 สัดส่วนของโมเลกุลที่ใช้งานขึ้นอยู่กับอุณหภูมิ: T 2\u003e T 1
เมื่อก๊าซร้อนผสมติดไฟในมันเพิ่มพลังงานส่วนเกิน
ความแตกต่างระหว่างระดับพลังงานเฉลี่ยของโมเลกุลในสถานะใช้งานและระดับเฉลี่ยของสถานะไม่ได้ใช้งานเรียกว่าพลังงานกระตุ้น สิ่งนี้สามารถแทนด้วยภาพกราฟิก (รูปที่ 2)

มะเดื่อ 2.2 แผนภาพพลังงานของปฏิกิริยาแน่นอน G.V. + O. ® PG: E การกระทำ - พลังงานกระตุ้น; Q xr. - ผลกระทบความร้อนจากปฏิกิริยาการเผาไหม้
พลังงานที่ถูกปล่อยออกมาจากปฏิกิริยาของ "ปฏิกิริยาแรก" ของโมเลกุลที่ถูกทำปฏิกิริยาจะถูกถ่ายโอนไปยังโมเลกุลข้างเคียง พวกเขาตื่นเต้นกระบวนการนี้ทำซ้ำรอบ ๆ โมเลกุลที่ตอบสนองด้วยความถี่และความเข้มข้นที่ยอดเยี่ยม กระบวนการเร่งปฏิกิริยาด้วยตนเองการเร่งความเร็วให้กับส่วนผสมของปฏิกิริยาทั้งหมด (2H 2 + O 2) เริ่มต้นจากปฏิกิริยาทางเคมีพร้อมกับการก่อตัวของโมเลกุลของน้ำและการปล่อยความร้อนออกสู่สิ่งแวดล้อมพร้อมกับการเรืองแสงเช่น เกิดขึ้นและแพร่กระจายกระบวนการเผาไหม้
ยิ่งค่าตัวเลขของการกระทำของ E สูงขึ้นเท่าไหร่ก็ยิ่งเป็นการยากที่จะทำให้ส่วนประกอบของคู่นี้เข้าสู่ปฏิกิริยาทางเคมี ดังนั้นค่าของ E act จึงเป็นตัวบ่งชี้ทางอ้อมของระดับอันตรายจากไฟไหม้ของระบบเคมีนี้
ประเภทและโหมดของการเผาไหม้
การเผาไหม้สามารถจำแนกตามพารามิเตอร์ต่อไปนี้:
1. ตามเงื่อนไขของส่วนประกอบที่ติดไฟได้ผสม:
a) kinetic - การเผาไหม้ของก๊าซผสมหรือไอระเหยของอากาศ เนื่องจากส่วนผสมของเชื้อเพลิงและสารออกซิแดนท์พร้อมสำหรับการเผาไหม้จนกว่าจะจุดประกายอัตราการรวมของกระบวนการเผาไหม้จะขึ้นอยู่กับอัตราของปฏิกิริยาทางเคมีของการเผาไหม้เท่านั้น หากการเผาไหม้ดังกล่าวเกิดขึ้นในปริมาณที่ปิดหรือ จำกัด อาจเกิดการระเบิดได้ เนื่องจากพลังงานที่ปล่อยออกมาในระหว่างการเผาไหม้ของส่วนผสมไม่ได้มีเวลาที่จะปล่อยออกมาเกินปริมาณนี้โดยการเพิ่มความดันโครงสร้างอาจถูกทำลาย;
b) การแพร่การเผาไหม้แบบแพร่เรียกว่าการเผาไหม้เมื่อการก่อตัวของตัวกลางที่ติดไฟได้ (ส่วนผสมของเชื้อเพลิงและออกซิไดเซอร์) เกิดขึ้นก่อนที่โซนการเผาไหม้หรือในเขตการเผาไหม้
2. ตามความเข้มของการรับส่วนประกอบที่ติดไฟได้ในโซนปฏิกิริยาเคมี:
a) laminar ในขณะที่ส่วนประกอบของส่วนผสมที่ติดไฟได้เข้าสู่โซนการเผาไหม้ค่อนข้างสงบ ในกรณีนี้ค่าตัวเลขของเกณฑ์ Reynolds ซึ่งเป็นลักษณะของระบอบการปกครองทางอุณหพลศาสตร์จะน้อยกว่าค่าวิกฤต (นัยสำคัญ)<2300).
b) ความปั่นป่วนกับส่วนประกอบของส่วนผสมที่ติดไฟได้เข้าสู่โซนการเผาไหม้ที่ความเร็วสูง หมายเลข Reynolds ในกรณีนี้มากกว่า 2300
3. ตามสถานะของการรวมตัวของส่วนประกอบของส่วนผสมที่ติดไฟได้:
a) เชื้อเพลิงที่เป็นเนื้อเดียวกันและออกซิไดเซอร์อยู่ในสถานะรวมตัวเดียวกัน (ก๊าซ);
b) ต่างกัน (หลายเฟส) - เชื้อเพลิงและสารออกซิแดนท์อยู่ในสถานะรวมต่างกัน
4. ความเร็วของการแพร่กระจายของโซนปฏิกิริยาทางเคมีของการเผาไหม้:
a) deflagration (ช้า) การกระจายตัวของโซนปฏิกิริยาเคมี (ความเร็วจาก 0.5 ถึง 50 m / s);
b) การระเบิด (ระเบิด) เมื่อโซนของปฏิกิริยาทางเคมีของการเผาไหม้แพร่กระจายด้วยความเร็วของคลื่นกระแทก (จากหลายร้อยเมตรต่อวินาทีถึงหลายกิโลเมตรต่อวินาที)
พื้นที่ที่ไอระเหยหรือก๊าซเผาไหม้ถูกเรียกว่า โดยเปลวไฟ .
เปลวไฟ Laminar ผสมล่วงหน้า ในเปลวไฟแบบราบเรียบของส่วนผสมที่ผสมล่วงหน้าเชื้อเพลิงและสารออกซิแดนท์จะถูกผสมก่อนที่จะเริ่มการเผาไหม้และการไหลจะเป็นแบบราบเรียบ
เปลวไฟของส่วนผสมที่ผสมล่วงหน้าเรียกว่า stoichiometric ถ้าเชื้อเพลิง (ไฮโดรคาร์บอน) และออกซิไดเซอร์ (ออกซิเจน - O 2) กินซึ่งกันและกันอย่างสมบูรณ์ก่อให้เกิดก๊าซคาร์บอนไดออกไซด์ (CO 2) และน้ำ (H 2 O) หากมีน้ำมันเชื้อเพลิงมากเกินไปพวกเขาก็บอกว่าส่วนผสมนั้นอุดมไปด้วยและถ้ามีอนุมูลอิสระมากเกินไปพวกเขาก็บอกว่าส่วนผสมนั้นไม่ดี
พิจารณาตัวอย่างที่ง่ายที่สุด:
1) 2H 2 + O 2 → 2H 2 O - ส่วนผสม stoichiometric
2) ЗН 2 + О 2 → 2H 2 O + Н 2 - ส่วนผสมที่เข้มข้น (เกิน 2 ครั้ง),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - ส่วนผสมแบบลีน (O 2 มากเกินไป)
สัญลักษณ์แต่ละตัวในสมการปฏิกิริยาเคมีนั้นตรงกับหนึ่งโมลของสาร ดังนั้นสมการแรกนี้หมายความว่าสองโมลของ H 2 ทำปฏิกิริยากับหนึ่งโมลของ O 2 ในการสร้างสองโมลของ H 2 O
หากเขียนสมการปฏิกิริยาทางเคมีในลักษณะที่อธิบายปฏิกิริยาของน้ำมันเชื้อเพลิงเพียงหนึ่งโมลแล้วเศษโมลของเชื้อเพลิงในส่วนผสมของสโตอิชิโอเมตริกสามารถถูกกำหนดได้ง่ายจากความสัมพันธ์
x mountains, stokh = 1 / ((1 + v)
ที่นี่ โวลต์หมายถึงจำนวนโมลของ O 2 ในสมการปฏิกิริยากับการก่อตัวของ CO 2 และ H 2 O ตัวอย่างคือปฏิกิริยา
H 2 + 0.5O 2 → H 2 O, v = 0.5, x H 2, stoch = 2/3
หากออกซิไดเซอร์คืออากาศก็ควรคำนึงถึงว่าอากาศแห้งมีออกซิเจนเพียง 21% เช่นเดียวกับไนโตรเจน 78% และก๊าซมีตระกูล 1% ดังนั้นสำหรับอากาศ X N 2 = 3.762 X O 2 จากที่นี่ฟันกรามซี่สำหรับส่วนผสม stoichiometric กับอากาศจะเท่ากัน
x ภูเขา, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
ที่ไหน โวลต์ ดังเดิมหมายถึงจำนวนโมลของ O 2 ในสมการปฏิกิริยาของการแปลงที่สมบูรณ์ของหนึ่งโมลของเชื้อเพลิงเป็น CO 2 และ H 2 O ตัวอย่างของค่า โวลต์ และเศษส่วนของโมลาร์ของเชื้อเพลิงสำหรับสารผสม stoichiometric กับอากาศแสดงในตารางที่ 1
น้ำมันเชื้อเพลิงและอากาศผสมแบบผสมล่วงหน้า (ในกรณีนี้จะต้องเติม N 2 ในปริมาณที่เหมาะสมลงในสมการปฏิกิริยาดูตารางที่ 1) โดยมีอัตราส่วนเทียบเท่ากับอากาศ:
λ = (x w / x ภูเขา) / (x w, stoch / x ภูเขา, stoh) = (w w / w ภูเขา) / (w w, stoch / w ภูเขา, stoch)
หรือส่วนกลับของ - อัตราส่วนที่เท่ากันสำหรับน้ำมันเชื้อเพลิง F (F = 1 / λ) สูตรนี้สามารถเปลี่ยนได้เพื่อให้สามารถกำหนดขนาดของเศษส่วนกรามของส่วนผสมตามค่า F:
x mountains = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x ภูเขา
น้ำหนัก X / 4,762, = ∙ 3,762
ตัวอย่างของค่า v และโมลเศษส่วนของเชื้อเพลิง x ภูเขา stoichi สำหรับผสม stoichiometric ของเชื้อเพลิงกับอากาศ
การชลประทานมักมาพร้อมกับการเปลี่ยนรูปทางเคมี การเผาไหม้ในอากาศ - ปฏิกิริยาของสารที่ติดไฟได้กับออกซิเจน อย่างไรก็ตามควรระลึกไว้เสมอว่าออกไซด์ของไนโตรเจนเฮไลด์และโอโซนสามารถทำหน้าที่เป็นตัวออกซิไดเซอร์ในกระบวนการเผาไหม้ กระบวนการเผาไหม้ที่รู้จักที่เกิดขึ้นกับการมีส่วนร่วมของแหล่งผลิตภัณฑ์เดียว - สารประกอบที่สามารถสลายตัวได้อย่างรวดเร็ว ตัวอย่างของสารดังกล่าว ได้แก่ อะเซทิลีนและไฮดราซีน
กระบวนการทางเคมีที่เกิดขึ้นระหว่างการเผาไหม้มีความซับซ้อนมาก แม้แต่กรณีที่ง่ายที่สุด - การเผาไหม้ของไฮโดรเจนในออกซิเจนสมการทั่วไปที่มีรูปแบบ
2H 2 + 0 2 = 2H 2 0,
ขั้นตอนเบื้องต้นได้รับการจัดตั้งและศึกษามาแล้วหลายสิบครั้ง
จนถึงปัจจุบันได้มีการศึกษากลไกการเปลี่ยนรูปทางเคมีระหว่างการเผาไหม้ของสารเพียงไม่กี่ชนิดเช่นไฮโดรเจน, คาร์บอนมอนอกไซด์, มีเธนและอีเทน ความรู้นี้ใช้เพื่อทำนายสภาวะของการจุดระเบิดและการเผาไหม้ของสารหลายชนิด
2.1 ปฏิกิริยาลูกโซ่
ปฏิกิริยาลูกโซ่ในทางตรงกันข้ามกับการเปลี่ยนแปลงทางเคมีทั่วไปมีลักษณะที่ปรากฏในการกระทำเบื้องต้นของแต่ละอนุภาคที่ใช้งาน: อะตอมที่มีอิเล็กตรอน unpaired, อนุมูลอิสระหรือไอออน การปรากฏตัวของอนุภาคแอคทีฟทำให้เกิดการเปลี่ยนแปลงของวัสดุเริ่มต้นในผลิตภัณฑ์ปฏิกิริยา อะตอมอนุมูลอิสระและไอออนจะทำปฏิกิริยาได้มากกว่าโมเลกุลที่มีความอิ่มตัว ดังนั้นแม้จะมีค่าใช้จ่ายพลังงานจำนวนมากที่จำเป็นในการทำลายพันธะเคมีและการก่อตัวของอนุภาคที่ใช้งานการพัฒนาห่วงโซ่ของปฏิกิริยามักจะกลายเป็นพลังอย่างมีพลังมากกว่าปฏิสัมพันธ์โดยตรงระหว่างโมเลกุล
กระบวนการเผาไหม้ส่วนใหญ่เกิดขึ้นผ่านกลไกลูกโซ่ ปฏิกิริยาลูกโซ่ - ปฏิกิริยาที่ซับซ้อนที่เกิดขึ้นในหลายขั้นตอนแทน:
ที่มาของโซ่ (การเริ่มต้น) ซึ่งเป็นอนุภาคที่ใช้งานจะเกิดขึ้น;
ความต่อเนื่องของโซ่ซึ่งอนุภาคแอกทีฟเข้าสู่ปฏิกิริยาทางเคมีกับวัสดุเริ่มต้นซึ่งเป็นผลมาจากการเกิดอนุภาคใหม่
การแตกของโซ่ที่ "ความตาย" ของอนุภาคที่ใช้งานเกิดขึ้นกับการก่อตัวของผลิตภัณฑ์ปฏิกิริยาสุดท้าย
ต้นกำเนิดของโซ่สามารถเกิดขึ้นได้ภายใต้เงื่อนไขต่าง ๆ ตัวอย่างเช่นเป็นผลมาจากการแยกตัวของโมเลกุลภายใต้การกระทำของพลังงานความร้อนหรือรังสีในการปล่อยไฟฟ้า การตายของอนุภาคที่แอคทีฟเกิดขึ้นเมื่อพวกเขารวมตัวกันอีกครั้ง * เมื่ออนุมูลอิสระเกิดปฏิกิริยา (การแตกของโซ่ที่เป็นเนื้อเดียวกัน) เมื่ออนุภาคแอคทีฟมีปฏิกิริยากับพื้นผิวของแข็ง (การแตกของโซ่
มีปฏิกิริยาลูกโซ่ที่ไม่ผ่านการย่อยและแยกเป็น ใน unbranched สำหรับแต่ละอนุภาคที่ใช้งานอยู่ในปฏิกิริยาของความต่อเนื่องของห่วงโซ่มีหนึ่งเกิดขึ้นใหม่ จำนวนโมเลกุลของผลิตภัณฑ์ที่เกิดขึ้นต่ออนุภาคเริ่มต้นเรียกว่าความยาวโซ่ ความยาวของสายโซ่ในปฏิกิริยาการเผาไหม้มีตั้งแต่หลายแสนจนถึงหลายสิบล้าน อัตราการเกิดปฏิกิริยาลูกโซ่ที่ไม่ได้ผ่านการแบรนช์อาจได้รับผลกระทบจากสารผสมเล็กน้อยที่สามารถโต้ตอบกับอนุภาคที่มีประสิทธิภาพเช่นสารยับยั้งการเผาไหม้
สารบางอย่าง - ผู้ริเริ่ม - ช่วยในการก่อตัวของอนุภาคที่ใช้งานอยู่และจึงเร่งปฏิกิริยาลูกโซ่ที่ไม่ได้ทำการดัดแปลง
ในปฏิกิริยาลูกโซ่แบบแยกส่วนกับอนุภาคที่ใช้งานอยู่หนึ่งตัวซึ่งถูกบริโภคโดยความต่อเนื่องของห่วงโซ่ หนึ่งในนั้นยังคงอยู่ในห่วงโซ่หลักในขณะที่คนอื่น ๆ เริ่มต้นโซ่ใหม่สร้างกิ่ง (รูปที่ 2.1)
"การคืนสภาพเป็นกระบวนการของการก่อตัวของอะตอมที่เป็นกลางหรือโมเลกุลจากอนุภาคที่มีประจุอะตอมและโมเลกุลที่เกิดขึ้นในระหว่างการรวมตัวกันอีกครั้งอาจอยู่ในพื้นดินหรือในสถานะที่ตื่นเต้น
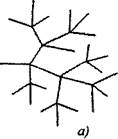
มะเดื่อ 2.1 แผนผังแสดงปฏิกิริยาลูกโซ่:
ก) การแตกแขนงในแต่ละลิงก์ของโซ่
6) การแตกแขนงที่หายาก
ตัวอย่างเช่นระหว่างการเผาไหม้ของไฮโดรเจนในปฏิกิริยาการเริ่มต้นลูกโซ่:
อะตอมที่ใช้งานจะเกิดขึ้น ในปฏิกิริยาต่อเนื่องของโซ่:

มีจำนวนอะตอมที่ใช้งานเพิ่มขึ้นซึ่งเป็นจุดเริ่มต้นของโซ่ใหม่เพิ่มขึ้น
ปฏิกิริยาลูกโซ่แบบแยกได้สามารถดำเนินการในโหมดนิ่งซึ่งความเร็วของการแตกแขนงนั้นน้อยกว่าอัตราการตายของอนุภาคที่มีการเคลื่อนไหวและไม่หยุดนิ่งซึ่งการตายเกิดขึ้นช้ากว่าการแตกแขนง ในกรณีหลังความเร็วของปฏิกิริยาลูกโซ่เพิ่มขึ้นแบบทวีคูณและถูก จำกัด โดยการใช้วัสดุเริ่มต้นเท่านั้น การเปลี่ยนจากโหมดที่อยู่กับที่ไม่หยุดนิ่งเกิดขึ้นทันทีกับการเปลี่ยนแปลงเล็กน้อยในเงื่อนไขของปฏิกิริยา: อุณหภูมิความดันหรือความเข้มข้นของหนึ่งในสารตั้งต้น การเร่งความเร็วอย่างรวดเร็วเช่นนี้ถือเป็นการจุดระเบิดของปฏิกิริยาผสมหรือการระเบิดโซ่
การค้นพบปฏิกิริยาลูกโซ่แบบแยกสาขามีความสำคัญอย่างยิ่งสำหรับการสร้างทฤษฎีของกระบวนการเผาไหม้ มันพิสูจน์แล้วว่ามีการจุดระเบิดสองประเภท: ความร้อนและโซ่ รูปแบบที่กำหนดไว้
บทที่ 2 กระบวนการทางเคมีที่ ร้อน
ทฤษฎีของกระบวนการลูกโซ่สามารถมีอิทธิพลต่อการพัฒนาและปราบปรามกระบวนการเผาไหม้ในระหว่างเกิดเพลิงไหม้ได้อย่างมีประสิทธิภาพ
ต้นกำเนิดของโซ่กระบวนการของนิวเคลียสของศูนย์แอคทีฟเริ่มต้นมีบทบาทอย่างมากในการพัฒนาปฏิกิริยาลูกโซ่ที่ไม่ผ่านการดัดแปลง มันชดเชยการสูญเสียของศูนย์ที่ใช้งานอยู่ในระหว่างปฏิกิริยาการเลิกจ้างโซ่ กลไกนี้กำหนดเงื่อนไขสำหรับการก่อตัวของระบอบการปกครองแบบคงที่ในช่วงเริ่มต้นของการสะสมของศูนย์ที่ใช้งานอยู่ ด้วยอัตราการเริ่มต้นที่น้อยช่วงเวลานี้จึงมีความสำคัญ
ปฏิกิริยาทางเคมีส่วนใหญ่ในเปลวไฟมีพลังงานสำรองที่สำคัญของศูนย์ที่ใช้งานอยู่ ภายใต้เงื่อนไขเหล่านี้การเริ่มต้นของศูนย์ที่ใช้งานจะเกี่ยวข้องกับการเอาชนะอุปสรรคด้านพลังงานที่สำคัญ
ในกรณีนี้มีบทบาทสำคัญโดยปัจจัยที่สร้างความมั่นใจว่าอัตราการเกิดขึ้นของศูนย์ที่มีนัยสำคัญ: สารเติมแต่งที่ใช้งานทางเคมี, รังสี, การปล่อยไฟฟ้า, ผลิตภัณฑ์การสลายกัมมันตรังสี
ในบรรดาปัจจัยที่ช่วยอำนวยความสะดวกในการสร้างศูนย์ปฏิบัติการปฏิกิริยาต่าง ๆ ควรสังเกต ในโมเลกุลของสารที่ติดไฟได้ซึ่งถูกดูดซับบนพื้นผิวแข็งพันธะระหว่างโมเลกุลจะอ่อนตัวลงและการแตกหักของพวกมันต้องการการใช้พลังงานน้อยลง ภายใต้เงื่อนไขเหล่านี้อัตราการสร้างของศูนย์ที่ใช้งานอยู่สูงกว่าปริมาณก๊าซอย่างมีนัยสำคัญ พลังงานกระตุ้นในการทำงานร่วมกันที่แตกต่างกันขององค์ประกอบของส่วนผสมที่ติดไฟได้ก็ยังต่ำกว่าในกรณีที่เป็นเนื้อเดียวกัน การเริ่มต้นที่แตกต่างกันของศูนย์ที่ใช้งานอยู่ภายใต้เงื่อนไขของกระบวนการเผาไหม้ที่เกิดขึ้นจริงเป็นปัจจัยสำคัญในการบรรลุผลสำเร็จของระบอบการปกครองแบบอยู่กับที่ด้วยกระบวนการลูกโซ่ที่ไม่มีการดัดแปลง
คุณสมบัติบางอย่างเป็นลักษณะของปฏิกิริยาลูกโซ่ที่ไม่ได้ทำการแบรนช์ที่เกิดขึ้นกับการมีส่วนร่วมของส่วนประกอบอะตอม ในกรณีที่ไม่มีสิ่งเจือปนที่มีปฏิสัมพันธ์กับศูนย์ที่ใช้งานอยู่โดยไม่มีการฟื้นฟูการเลิกโซ่จะเกิดขึ้นได้ก็ต่อเมื่ออะตอมรวมตัวกันใหม่โดยการชนสามครั้งและบนพื้นผิว
ที่อุณหภูมิใด ๆ สารก๊าซทั้งหมดจะถูกแยกออกจากกันบางส่วน โมเลกุลบางส่วนแตกตัวเป็นอะตอม ในกรณีนี้มีความสมดุลระหว่างกระบวนการแยกตัวออกจากกันและการรวมตัวกันของอะตอมเป็นโมเลกุล ระดับของความร้าวฉานชี้แจงขึ้นอยู่กับอุณหภูมิ
หากไม่มีสิ่งเจือปนในส่วนผสมที่ติดไฟได้จะทำลายโซ่ความเข้มข้นของส่วนประกอบอะตอมของปฏิกิริยายังคงไม่เปลี่ยนแปลง อะตอมที่ทำปฏิกิริยาจะถูกสร้างใหม่ในทันที
Korolchenko A.Ya. กระบวนการเผาไหม้และการระเบิด
lichestve การเริ่มต้นจะชดเชยอะตอมที่มีปฏิกิริยาในปริมาณเดียวกันกับในระบบที่ไม่เกิดปฏิกิริยา ปฏิกิริยาคงที่ไม่ส่งผลกระทบต่อกระบวนการนี้ ความสมดุลของหนึ่งในองค์ประกอบของปฏิกิริยาซึ่งมีความแตกต่างจากพันธะที่แข็งแรงน้อยที่สุดระหว่างอะตอมในโมเลกุลเป็นคุณสมบัติที่โดดเด่นของโหมดนี้ ความเข้มข้นของส่วนประกอบอะตอมอื่นในกรณีนี้คือ quasistationary แต่มีความสมดุลมากกว่า
ด้วยการเริ่มต้นที่เป็นเนื้อเดียวกันของปฏิกิริยาการเผาไหม้ระบอบการปกครองแบบคงที่จะถูกจัดตั้งขึ้นหลังจากช่วงระยะเวลาหนึ่งเนื่องจากความร้าวฉานต้องการพลังงานกระตุ้นขนาดใหญ่ ในระหว่างช่วงเวลานี้อัตราการแยกตัวเกินอัตราการรวมตัวกันใหม่และศูนย์ที่ใช้งานสะสมในระบบปฏิกิริยา อัตราของกระบวนการทั้งสองจะถูกนำมาเปรียบเทียบเฉพาะหลังจากการเพิ่มความเข้มข้นของศูนย์ที่ใช้งานเพื่อความสมดุล ช่วงเวลานี้เรียกว่าช่วงเวลาการเหนี่ยวนำ
การปรากฏตัวของพื้นผิวของแข็งเป็นตัวเร่งปฏิกิริยาในโซนปฏิกิริยาไม่เปลี่ยนสถานะของสมดุลทางอุณหพลศาสตร์ ตัวเร่งปฏิกิริยามีผลต่อปฏิกิริยาไปข้างหน้าและย้อนกลับอย่างเท่าเทียมกัน ศูนย์ที่ใช้งานไม่เพียง แต่กำเนิดบนพื้นผิวที่เป็นของแข็ง แต่ยังทำลายมัน อย่างไรก็ตามการปรากฏตัวของตัวเร่งปฏิกิริยาเร่งความสำเร็จของสถานะการแยกตัวของความสมดุล
หากสารออกฤทธิ์อยู่ในส่วนผสมที่ติดไฟได้ซึ่งสามารถมีส่วนร่วมในปฏิกิริยาการแตกของโซ่ได้พวกเขาจะลดความเข้มข้นของศูนย์ที่ใช้งานอยู่ ในกรณีนี้การแยกความสมดุลของหนึ่งในองค์ประกอบเริ่มต้นจะถูกรบกวนซึ่งจะทำให้ปฏิกิริยาช้าลงและอาจนำไปสู่การสิ้นสุดของมัน
การทดลองแสดงให้เห็นว่าเมื่อเริ่มต้นปฏิกิริยาลูกโซ่ที่ไม่ได้เติมแบรนช์โดยแหล่งภายนอก (ตัวอย่างเช่นแหล่งกำเนิดแสง) ความเข้มข้นของศูนย์แอคทีฟในระยะเริ่มแรกของการพัฒนากระบวนการเผาไหม้อาจเกินความสมดุลอย่างมีนัยสำคัญ
ในระหว่างการเกิดปฏิกิริยาลูกโซ่แบบแยกย่อยเงื่อนไขของการเริ่มต้นมีผลกระทบอย่างมีนัยสำคัญต่อการพัฒนาของปฏิกิริยา ในกระบวนการที่เคลื่อนไหวช้าการเติมส่วนผสมที่มีปฏิกิริยาบางส่วนไปยังส่วนเริ่มต้นจะทำให้ระยะเวลาการเหนี่ยวนำสั้นลงและเร่งความเร็วของการเผาไหม้ของเปลวไฟ
ความต่อเนื่องของโซ่คุณลักษณะเฉพาะของปฏิกิริยาลูกโซ่ที่ไม่ผ่านการดัดแปลงคือความเสมือนจริงของความเข้มข้นของศูนย์ที่ใช้งานอยู่ ในกรณีที่ไม่มีวงจรเปิดอนุภาคที่ใช้งานจะเกิดขึ้น
บทที่ 2 กระบวนการทางเคมีระหว่างการเผาไหม้
จำนวนเดียวกันกับที่ใช้ไป ใหม่เกิดขึ้นเมื่อเริ่มต้นเท่านั้น ด้วยอัตราที่เท่ากันของการสร้างศูนย์แอคทีฟและการเลิกโซ่ทำให้มีความเข้มข้นคงที่ของแอคทีฟเซ็นเตอร์และโหมดตอบสนองแบบนิ่ง อัตราการเกิดปฏิกิริยาจะลดลงเมื่อมีการใช้ส่วนประกอบเริ่มต้น
ในกรณีของปฏิกิริยาลูกโซ่แบบแยกสาขาความเข้มข้นของศูนย์แบบแอคทีฟในระบบปฏิกิริยาจะเพิ่มขึ้นโดยไม่คำนึงถึงเงื่อนไขของการเริ่มต้นครั้งแรก ปรับใช้โหมดตอบโต้การเร่งตนเองซึ่งมีตัวละครหิมะถล่ม ในกรณีนี้สำหรับการเปลี่ยนแปลงที่สมบูรณ์ของส่วนประกอบเริ่มต้นเป็นผลิตภัณฑ์สุดท้ายของการเกิดปฏิกิริยาหนึ่งศูนย์ปฏิบัติการเริ่มต้นหนึ่งก็เพียงพอแล้ว
สมการจลนศาสตร์ของปฏิกิริยาที่มีค่าแตกแขนงมีดังนี้ การเปลี่ยนแปลงในระดับความเข้มข้นของส่วนประกอบเริ่มต้นที่เสถียรในช่วงเวลาหนึ่งอาจถูกเพิกเฉยต่อการประมาณครั้งแรกและจะต้องคำนึงถึงการเปลี่ยนแปลงที่รวดเร็วกว่าในความเข้มข้นของศูนย์ที่ใช้งานอยู่เท่านั้น nการเปลี่ยนแปลงความเร็วนี้ถูกกำหนดโดยอัตราการเริ่มต้นและอัตราส่วนของอัตราการเกิดปฏิกิริยาของการแตกแขนงและการเลิกโซ่ อัตราการเริ่มต้นไม่ได้ขึ้นอยู่กับความเข้มข้นของศูนย์ที่ใช้งานอยู่ในระบบ อัตราของการแตกแขนงและกระบวนการแตกเป็นสัดส่วนกับความเข้มข้นของศูนย์ที่ใช้งานอยู่ ภายใต้เงื่อนไขเหล่านี้ความสมดุลโดยรวมของการก่อตัวและการใช้จ่ายของศูนย์ที่ใช้งานจะถูกกำหนดโดยผลรวมของอัตราของกระบวนการของการเริ่มต้นการแตกแขนงและการแตกหัก:
![]() (2.1)
(2.1)
โดยที่และเป็นค่าคงที่อัตราของปฏิกิริยาการแตกแขนงและการแตกหัก แสดงว่าเราได้:
![]() (2.2)
(2.2)
เมื่ออนุพันธ์ของเวลาของความเข้มข้นของศูนย์ที่ใช้งานอยู่
เป็นบวก อัตราการเกิดปฏิกิริยาเพิ่มขึ้นตามเวลา คุณสมบัติของปฏิกิริยาลูกโซ่แบบแยกย่อยนี้เกิดจากการเพิ่มจำนวนของศูนย์แบบแอคทีฟในระบบดังกล่าวเมื่ออัตราการเกิดปฏิกิริยาการแตกกิ่งนั้นสูงกว่าอัตราการเกิดปฏิกิริยาการสิ้นสุดแบบลูกโซ่
Korolchenko A.Ya. กระบวนการเผาไหม้และการระเบิด
หากก่อนที่จะเริ่มปฏิกิริยาระบบจะไม่มีศูนย์ที่ใช้งานอยู่เช่น ที่เสื้อ= 0, n = 0 การรวมของสมการ (2.2) ให้:
![]() (2.3)
(2.3)
อัตราการเกิดปฏิกิริยารวมของ CO จะถูกกำหนดโดยอัตราของกระบวนการแตกแขนง ผลิตภัณฑ์ขั้นสุดท้ายจะเกิดขึ้นเฉพาะในช่วงปฏิกิริยานี้ สำหรับเหตุการณ์การแตกแขนงโซ่พื้นฐานแต่ละโมเลกุลของผลิตภัณฑ์ขั้นสุดท้ายจะเกิดขึ้น มันดังต่อไปนี้:
![]() (2.4)
(2.4)
การพัฒนาปฏิกิริยาลูกโซ่ในเวลาถูกกำหนดโดยอัตราส่วนของค่าคงที่อัตราของปฏิกิริยาของการแตกแขนงและการเลิกโซ่และ เมื่อเลขชี้กำลังในสมการ (2.4) เป็นค่าบวกและอีกครั้ง
การดำเนินการจะเร่งอย่างไม่ จำกัด ในช่วงแรกของการพัฒนาปฏิกิริยาความสัมพันธ์ต่อไปนี้จะเป็นจริง:
เนื่องจากความจริงที่ว่าอัตราการเริ่มต้นครั้งแรกมีขนาดเล็กจึงไม่มีการเปลี่ยนแปลงทางเคมีที่เห็นได้ชัดเจนในช่วงเริ่มต้น หลังจากเวลาผ่านไปค่าจะยิ่งใหญ่กว่าหนึ่ง หลังจากนั้นอัตราการเกิดปฏิกิริยาตามสมการ (2.4) จะเริ่มเพิ่มขึ้นอย่างรวดเร็วและมีค่ามากถึงแม้ว่าจะไม่สามารถมองเห็นได้ในทางปฏิบัติมาก่อน
การปรากฏตัวของระยะเวลาล่าช้า (ช่วงเหนี่ยวนำ) ในระหว่างการพัฒนาปฏิกิริยาลูกโซ่เกิดจากความจำเป็นในการสะสมจำนวนศูนย์ปฏิบัติการที่ใช้งานจำนวนหนึ่งในระบบการทำปฏิกิริยา หลังจากการเปลี่ยนแปลงทางเคมีนี้จะเห็นได้ชัดเจน
ขนาดของระยะเวลาการเหนี่ยวนำในปฏิกิริยาลูกโซ่กำหนดอัตราส่วนของอัตราการแยกย่อยและกระบวนการเลิกโซ่ไม่ใช่อัตราการเริ่มต้น ในทางกลับกันอัตราการแตกแขนงและปฏิกิริยาแตกหักเกิดขึ้นเนื่องจากคุณสมบัติทางเคมีของแต่ละระบบทำปฏิกิริยาโดยจะขึ้นอยู่กับอุณหภูมิและความเข้มข้นของส่วนประกอบเริ่มต้น ความผิดปกติของปฏิกิริยาลูกโซ่สำหรับ
คือกระบวนการแตกแขนงต้องการพลังงานกระตุ้นสำคัญขณะที่ค่าสัมประสิทธิ์อุณหภูมิของค่าคงที่อัตราของกระบวนการแตกอยู่ใกล้กับศูนย์ ในปฏิกิริยาของการสิ้นสุดของโซ่ทั้งสามประเภท: ในกรณีของการรวมตัวกันจำนวนมากและการรวมตัวที่แตกต่างกันในการทำงานร่วมกันของอนุมูลอิสระที่มีสิ่งสกปรกที่ใช้งานพลังงานการเปิดใช้งานเป็นศูนย์
ด้วยการเพิ่มอุณหภูมิความดันรวมของส่วนผสมหรือการเปลี่ยนแปลงความเข้มข้นของส่วนประกอบทำปฏิกิริยาการเปลี่ยนแปลงของค่าคงที่อัตราของการแตกแขนงและการแตกหักเป็นไปได้ที่ปฏิกิริยาเปลี่ยนจากไม่ขยับเขยื้อนเป็นไม่อยู่นิ่ง ความผิดปกติของกระบวนการนี้อยู่ในช่วงการเปลี่ยนภาพอย่างกะทันหันจากโหมดหนึ่งไปเป็นโหมดอื่นในการเปลี่ยนอัตราการตอบสนองจากค่าเล็กน้อยไปเป็นค่าที่เพิ่มขึ้นอย่างไม่ จำกัด
การไหลของปฏิกิริยาลูกโซ่บางอย่างมาพร้อมกับการก่อตัวของผลิตภัณฑ์ระดับกลางที่ค่อนข้างเสถียร แต่มีความสามารถในการสร้างศูนย์ที่ใช้งานอยู่ ตัวอย่างเช่นปฏิกิริยาดังกล่าวรวมถึงปฏิกิริยาการเผาไหม้ของไฮโดรคาร์บอนเนื่องจากสารตัวกลางที่สารเปอร์ออกไซด์และอัลดีไฮด์เกิดขึ้น สิ่งนี้นำไปสู่การแตกแขนงของโซ่ อย่างไรก็ตามเนื่องจากความเสถียรของผลิตภัณฑ์ระดับกลางการเร่งปฏิกิริยาจะยืดออกไปตามกาลเวลา โซ่กิ่งที่ช้าเช่นนี้เรียกว่าการเสื่อมสภาพ
ปฏิกิริยาลูกโซ่ที่มีกลไกการแตกแขนงปกติตามกฎเนื่องจากกิจกรรมของอนุมูลสูงดำเนินไปอย่างรวดเร็ว อนุมูลที่เกิดขึ้นอาจเริ่มต้นปฏิกิริยาการเร่งอย่างรวดเร็วหรือรวมตัวกันอีกครั้งและออกจากกระบวนการ
เปิดวงจร อนุภาคแอคทีฟเช่นโมเลกุลก๊าซใด ๆ ทำให้เกิดการเคลื่อนที่แบบสุ่มภายในระบบปฏิกิริยาทำปฏิกิริยากับโมเลกุลอื่น ๆ ในเวลาเดียวกันมีความเป็นไปได้ที่จะเกิดการปะทะกันกับอนุภาคหรือโมเลกุลอื่นและการก่อตัวของอนุภาคใหม่ การพัฒนาของปฏิกิริยาลูกโซ่มีความคล้ายคลึงกับการเคลื่อนที่แบบบราวเนียนของโมเลกุลเฉื่อยแม้ว่าการถ่ายโอนของศูนย์ที่ใช้งานจะมาพร้อมกับปฏิกิริยาทางเคมี บนเส้นทางของการพัฒนาของศูนย์ที่ใช้งานสลับห่วงโซ่ของสองประเภทหรือมากกว่า
Korolchenko A.Ya. กระบวนการเผาไหม้และการระเบิด
ห่วงโซ่ของปฏิกิริยายังคงดำเนินต่อไปจนกระทั่งช่วงเวลาที่อนุภาคที่ใช้งานไม่ตอบสนองโดยไม่มีการฟื้นฟู ในกรณีนี้วงจรเปิดเรียกว่าเกิดขึ้น กระบวนการแตกมีบทบาทสำคัญในจลนพลศาสตร์ของปฏิกิริยาลูกโซ่ ปฏิกิริยามีสองประเภทที่นำไปสู่การตายของศูนย์ที่ใช้งานอยู่:
การแตกตัวเป็นเนื้อเดียวกัน (ตายในปริมาณของส่วนผสมปฏิกิริยา);
การสลายแบบ Heterogeneous (การตายบนพื้นผิวที่เป็นของแข็ง) การแตกของโซ่ที่เป็นเนื้อเดียวกันเป็นไปได้ด้วยหนึ่งในสองกระบวนการ:
เมื่ออนุมูลรวมตัวกันอีกครั้งหรือเมื่อส่วนประกอบทางเคมีที่ทำปฏิกิริยากับศูนย์ที่ทำงานอยู่โดยไม่เกิดการงอกใหม่
การแตกของโซ่ที่แตกต่างกันเกิดขึ้นกับอนุภาคเขม่าที่เกิดขึ้นในระหว่างการเผาไหม้หรือบนพื้นผิวของวัสดุเผาไหม้ที่เป็นของแข็ง วงจรเปิดบนพื้นผิวที่แข็งถือได้ว่าเป็นการแพร่กระจายของศูนย์ที่ใช้งานอยู่จากส่วนผสมของก๊าซไปยังพื้นผิวที่พวกเขาหายไป กลไกของการรวมตัวกันอีกครั้งบนพื้นผิวที่เป็นของแข็งคืออนุภาคที่แอคทีฟซึ่งมีปฏิกิริยาเพิ่มขึ้นจะถูกดูดซับไว้บนพื้นผิว อนุมูลที่ถูกดูดซับไว้ในพื้นที่ใกล้เคียงจะรวมตัวกันอีกครั้งเนื่องจากไม่มีพลังงานและอุปสรรคเชิงพื้นที่สำหรับกระบวนการนี้ โมเลกุลของสารประกอบที่เสถียรเกิดขึ้นจากการรวมตัวกันอีกครั้งไม่เกี่ยวข้องกับการพัฒนาปฏิกิริยาลูกโซ่
อย่างไรก็ตามการชนกันของอนุภาคที่แอคทีฟที่มีพื้นผิวที่เป็นของแข็งนั้นนำไปสู่การดูดซับ บางทีมันสะท้อนจากพื้นผิว ความน่าจะเป็นของการดูดซับของศูนย์ที่ใช้งานโดยพื้นผิวที่แข็งเรียกว่าสัมประสิทธิ์ความสะดวก สัมประสิทธิ์นี้เป็นลักษณะของความสัมพันธ์ทางเคมีของอนุภาคที่ใช้งานและพื้นผิว ในกรณีที่สำคัญจริง ๆ แล้วอนุภาคที่แอคทีฟหลังจากการสะท้อนจากผนังไม่ได้เคลื่อนที่ไปไกล มีความเป็นไปได้ที่จะเกิดการชนกับกำแพงใหม่จนกว่าที่พักจะเกิดขึ้น เนื่องจากกระบวนการนี้ภายใต้เงื่อนไขบางประการอัตราการเกิดปฏิกิริยาจึงไม่ขึ้นอยู่กับสัมประสิทธิ์ของที่พัก กระบวนการดำเนินการในลักษณะที่เป็นสหภาพยุโรป
* Sorption - การดูดซึมโดยร่างกายที่เป็นของแข็ง (หรือของเหลว) ของสารฮ่าของสิ่งแวดล้อม ร่างกายดูดซับเรียกว่าดูดซับดูดซับ- ซอร์เบต แยกแยะการดูดซับของมวลทั้งหมดของตัวดูดซับ (การดูดซึม) และชั้นผิว (การดูดซับ) Sorption เนื่องจากปฏิกิริยาระหว่างชนิดของสารเคมีระหว่างพื้นผิวของตัวดูดซับที่เป็นของแข็งและตัวดูดซับเรียกว่า chemisorption
__________________________ บทที่ 2 กระบวนการทางเคมีระหว่างการเผาไหม้
หากเกิดวงจรเปิดที่การชนกันทุกครั้ง ความเข้มข้นของศูนย์ที่ใช้งานอยู่ที่พื้นผิวสามารถนำมาเป็นศูนย์
ในกรณีที่ไม่มีสิ่งเจือปนอยู่ในส่วนผสมที่ทำปฏิกิริยาการแตกของโซ่อาจเกิดขึ้นได้ทั้งบนพื้นผิวที่เป็นของแข็งหรือเป็นเนื้อเดียวกันโดยการรวมตัวกันของอนุมูลในกลุ่ม ในการยิงจริงทางที่สองจะถูกนำมาใช้เป็นหลัก
อิทธิพลบางประการต่อจลนพลศาสตร์ของปฏิกิริยาลูกโซ่มีสารเติมแต่งในระบบการทำปฏิกิริยาของก๊าซเฉื่อย สารเติมแต่งเฉื่อยเพิ่มจำนวนของการชนกับอนุภาคที่ใช้งานเพิ่มโอกาสในการแตกโซ่และตามยับยั้งปฏิกิริยาโดยรวม
การยับยั้งปฏิกิริยาลูกโซ่ที่มีประสิทธิภาพมากขึ้นนั้นเกิดขึ้นได้ด้วยการแนะนำของสารเติมแต่งปฏิกิริยา - สารยับยั้งเข้าไปในส่วนผสมของปฏิกิริยา สารยับยั้งมีปฏิกิริยากับศูนย์ที่ใช้งานอยู่นำปฏิกิริยาออกมาทำลายโซ่ จลนพลศาสตร์ของปฏิกิริยาในส่วนผสมที่ถูกยับยั้งจะถูกกำหนดโดยเงื่อนไขของการแข่งขันระหว่างตัวยับยั้งและองค์ประกอบหลักของปฏิกิริยาเมื่อมีปฏิสัมพันธ์กับศูนย์ที่ใช้งานอยู่ ด้วยประสิทธิภาพของตัวยับยั้งและอัตราการสร้างศูนย์แอคทีฟใหม่ในระดับปานกลางสารเติมแต่งขนาดเล็กของตัวยับยั้งสามารถยับยั้งกระบวนการปฏิกิริยาลูกโซ่ได้อย่างสมบูรณ์
กระบวนการของการยับยั้งมีความสำคัญอย่างยิ่งในการปฏิบัติงานของความปลอดภัยจากอัคคีภัยและการระเบิด การใช้สารยับยั้งช่วยให้คุณมีอิทธิพลต่อกระบวนการเผาไหม้ได้อย่างมีประสิทธิภาพ
2.2 กระบวนการทางเคมีระหว่างการเผาไหม้ของไฮโดรเจน
การทำงานร่วมกันของโมเลกุลไฮโดรเจนกับโมเลกุลออกซิเจนดำเนินไปอย่างซับซ้อนผ่านชุดของขั้นตอนต่อเนื่อง ตอนนี้ได้รับการยอมรับอย่างมั่นคงว่าการเผาไหม้ของไฮโดรเจนเกิดจากกลไกลูกโซ่โดยมีอนุภาคที่ทำหน้าที่เป็นศูนย์กลางการเคลื่อนไหว ลำดับและความสำคัญของปฏิกิริยาขั้นต้นในระหว่างการเผาไหม้ของไฮโดรเจนอธิบายไว้ในรายละเอียดที่ดีสำหรับเงื่อนไขต่าง ๆ สำหรับการเกิดขึ้นและการพัฒนาของเปลวไฟไฮโดรเจน
การวิเคราะห์อย่างละเอียดที่สุดของกระบวนการเผาไหม้ไฮโดรเจนในโหมดอัตโนมัติโดยใช้วิธีการทดลองและการคำนวณดำเนินการโดยศาสตราจารย์ A. N. Baratov เขาเสนอรูปแบบของกระบวนการดังต่อไปนี้รวมถึงปฏิกิริยาระดับประถมสี่ขั้นพื้นฐาน:
Korolchenko A.Ya. กระบวนการเผาไหม้และการระเบิด
ต้นกำเนิดของศูนย์ที่ใช้งานเกิดขึ้นจากปฏิกิริยา
![]()
ความต่อเนื่องของปฏิกิริยาลูกโซ่
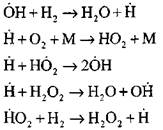
โซ่กิ่ง
 |
วงจรเปิด
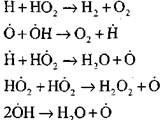 |
ความเข้มข้นของอะตอมไฮโดรเจนในระยะเริ่มต้นของกระบวนการ autoignition นั้นเป็นส่วนที่ไม่มีนัยสำคัญของปริมาณไฮโดรเจนเริ่มต้น ด้วยการพัฒนาปฏิกิริยาลูกโซ่อัตราการแปลงไฮโดรเจนโมเลกุลจะสูงมากจนถูกใช้ไปในร้อยวินาที
2.3 ปฏิกิริยาทางเคมีเมื่อเผาไหม้คาร์บอนมอนอกไซด์
ปฏิกิริยาของคาร์บอนมอนอกไซด์กับออกซิเจนเป็นปฏิกิริยาสำคัญสำหรับกระบวนการเผาไหม้ หลักสูตรของปฏิกิริยานี้ในช่วง
__________________________ บทที่ 2 กระบวนการทางเคมีที่เผา
หลายกรณีกำหนดกฎหมายของการเผาไหม้ของสารที่ประกอบด้วยคาร์บอน ปฏิกิริยานี้มีลักษณะโดยกลไกลูกโซ่ที่แยกเป็นส่วน ๆ มันมีคุณสมบัติหลายอย่าง
เป็นเวลานานมีความเชื่อว่าส่วนผสมที่แห้งสนิทของ CO และ 0 2 ไม่สามารถลุกไหม้และเผาไหม้ได้ อย่างไรก็ตามการตั้งค่าการทดลองอย่างระมัดระวังโดยที่ไม่มีน้ำถูกตรวจสอบโดยใช้สเปคโตรกราฟจำนวนมากแสดงให้เห็นว่าการจุดระเบิดนั้นเป็นไปได้สำหรับส่วนผสมที่แห้ง ควรสังเกตว่าการมีอยู่ของ CO + 0 2 ไอน้ำหรือไฮโดรเจนในระบบเปิดใช้งานกระบวนการของการจุดระเบิดและการเผาไหม้โดยการเพิ่มจำนวนของศูนย์การใช้งานที่เป็นไปได้ ผลของการเร่งความเร็วของน้ำสามารถสังเกตได้โดยเฉพาะอย่างยิ่งที่ความเข้มข้นต่ำ
การเผาไหม้ของคาร์บอนมอนนอกไซด์ต่อหน้าไอน้ำหรือเติมไฮโดรเจนเล็กน้อยเกิดขึ้นจากการมีส่วนร่วมของกระบวนการเบื้องต้นดังต่อไปนี้:

อนุมูลอิสระ H0 2 ซึ่งเกิดจากปฏิกิริยา (VI) สามารถดำเนินการต่อห่วงโซ่ (ปฏิกิริยา VIII) หรือนำไปสู่การแตกของมันโดยปฏิกิริยา (IX-XII)
ในการประเมินเงื่อนไขสำหรับการเปลี่ยนสถานะของการออกซิเดชั่นช้าลงในการระเบิดโซ่ให้เราประเมินความน่าจะเป็นของการทำลายโซ่ผ่านอนุมูลอิสระ H0 2; ที่นี่เราคำนึงถึงว่าบทบาทของปฏิกิริยา (X) และ (XI) ในการยุติลูกโซ่จะไม่มีนัยสำคัญในแง่ของ
เมื่อเทียบกับปฏิกิริยา (IX) เนื่องจากอัตราคงที่ของกระบวนการ (IX-XI) ที่อุณหภูมิ 1000 K อยู่ใกล้กัน แต่ความเข้มข้นของอนุมูลต่ำกว่าความเข้มข้นของอะตอมไฮโดรเจนเนื่องจากอนุมูลมีกิจกรรมทางเคมีที่สูงกว่า ดังนั้นความน่าจะเป็นของวงจรเปิดผ่านอนุมูลอิสระ H0 2 สามารถเขียนในรูปแบบ:
ที่อุณหภูมิ 1,000K
ดังนั้นโดยมีเงื่อนไขว่า
![]()
![]()
ผลกระทบขนาด
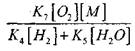
ในการแก้สมการ (2.7) จะอ่อนแอ
บทที่ 2 กระบวนการทางเคมีระหว่างการเผาไหม้
ในกรณีของ ![]() หรือ
หรือ ![]() สิ่งที่สังเกตเห็นใน
สิ่งที่สังเกตเห็นใน
เปลวไฟจริงด้วย) สมการ (2.7) ถูกแปลงเป็นรูปแบบ:
![]() (2.8)
(2.8)
ดังนั้นเงื่อนไขของการเผาไหม้คาร์บอนมอนนอกไซด์ในอากาศจะถูกกำหนดโดยส่วนใหญ่จากการปรากฏตัวและรูปแบบของการเผาไหม้ไฮโดรเจน ออกซิเดชันของ CO โดยปฏิกิริยา (I) ขึ้นอยู่กับความเข้มข้นของอนุมูล OH ที่เกิดขึ้นในปฏิกิริยาที่เกี่ยวข้องกับไฮโดรเจน
ความผิดปกติของปฏิกิริยาการเผาไหม้ของคาร์บอนมอนอกไซด์อยู่ในการยับยั้งอย่างรวดเร็วเมื่อสารเติมแต่งขนาดเล็กถูกนำเข้าสู่ระบบปฏิกิริยาของสารที่มีความสัมพันธ์สูงสำหรับอะตอมไฮโดรเจน สารดังกล่าวที่ยับยั้งการเผาไหม้ของ CO คือเฮไลด์และฮาโล - อนุพันธ์ของไฮโดรคาร์บอน ผลยับยั้งของพวกเขาเนื่องจากการสิ้นสุดของปฏิกิริยาลูกโซ่เมื่อมีปฏิสัมพันธ์กับอะตอมไฮโดรเจนโดยปฏิกิริยา
2.4 การเผาไหม้ของไฮโดรคาร์บอน
การตรวจสอบกระบวนการเผาไหม้ของไฮโดรเจนและคาร์บอนมอนอกไซด์แสดงให้เห็นถึงความซับซ้อนของกลไกการเกิดปฏิกิริยาการเผาไหม้ ในกรณีของ H 2 และ CO ปฏิกิริยาจะเกิดขึ้นเป็นสายโซ่โดยมีส่วนร่วมในขั้นตอนพื้นฐานและผลิตภัณฑ์ขั้นกลางมากมาย ดังนั้นจึงเป็นเรื่องธรรมดาที่จะคาดหวังว่ากลไกการเกิดปฏิกิริยาการเผาไหม้ของสารที่ซับซ้อนมากขึ้น - ไฮโดรคาร์บอน - มีความซับซ้อนมากขึ้นและผลกระทบที่มาพร้อมกับกระบวนการจุดระเบิดและการเผาไหม้ของสารเหล่านี้มีความหลากหลายมากขึ้น
ข้อมูลที่มีอยู่ในปัจจุบันเกี่ยวกับธรรมชาติของการยกระดับสารเคมีของไฮโดรคาร์บอนในกระบวนการเผาไหม้ช่วยให้เราสามารถอธิบายผลที่สังเกตได้ด้วยการประมาณ
เป็นที่ยอมรับว่าในเปลวไฟไฮโดรคาร์บอนพร้อมกับอนุภาคที่มีการใช้งานแล้วมีผลิตภัณฑ์ระดับกลางจำนวนมากที่มีโครงสร้างที่ซับซ้อนมากขึ้น ในบางกรณีพวกเขากลายเป็นแหล่งกำเนิดของโซ่ใหม่ บทบาทหลักในกระบวนการของการเผาไหม้และการเผาไหม้ของไฮโดรคาร์บอนมีการเล่นโดยสารประกอบกลางดังต่อไปนี้:
Korolchenko A.Ya. กระบวนการเผาไหม้และการระเบิด
1. อนุมูลไฮโดรคาร์บอนซึ่งเป็นโมเลกุลของ
levodoroda ซึ่งเอาไฮโดรเจนอะตอมหนึ่งอะตอมขึ้นไป เหล่านี้
สารตกค้างจะเรียกว่าอัลคิล (CH 3 - เมธิล; C 2 H 5 - เอทิล; C 3 H 7 - โพรพิลและ
ฯลฯ ) เนื่องจากมีปฏิกิริยาสูงจึงทำให้แอลคิลฟรี
ไม่ได้มีอยู่เป็นเวลานาน มีเปลวไฟเป็นสื่อกลาง
ผลิตภัณฑ์ภาครัฐ เมื่อทำปฏิกิริยากับโมเลกุลอื่น ๆ จะมีพฤติกรรม
เป็นกลุ่มโครงสร้างอิสระ อนุมูลของไฮโดรคาร์บอน
มักจะแสดงด้วยตัวอักษร R
2. เปอร์ออกไซด์ - สารประกอบของสูตรทั่วไป R-00-R "
3. อัลดีไฮด์ - สารประกอบประเภท
![]()
อัลดีไฮด์ที่ง่ายที่สุดคือฟอร์มิค (ฟอร์มาลดีไฮด์) และอะซิติก (อะซีตัลดีไฮด์) ![]() . สารเหล่านี้ล้วนแล้วแต่
. สารเหล่านี้ล้วนแล้วแต่
มีอยู่ในผลิตภัณฑ์ของการเผาไหม้ที่ไม่สมบูรณ์ของไฮโดรคาร์บอน
การก่อโซ่ในระหว่างการเผาไหม้ของไฮโดรคาร์บอนสามารถเป็นปฏิกิริยาใด ๆ ที่เกิดขึ้นจากสารอนุมูลไฮโดรคาร์บอน นี่อาจเป็นปฏิกิริยาการสลายตัวของโมเลกุลอีเทนด้วยการก่อตัวของกลุ่มเมทิลอิสระสองกลุ่ม:
![]()
หรือปฏิกิริยาของไฮโดรคาร์บอนกับออกซิเจน:
![]()
ความต่อเนื่องของโซ่เกิดขึ้นจากปฏิกิริยาการก่อตัว เปอร์ออกไซด์หรือไฮโดรเปอร์ออกไซด์:
![]()
กิ่งก้านผูกมัดจะดำเนินการในระหว่างการสลายตัวของไฮโดรเปอร์ออกไซด์:
บทที่ 2 กระบวนการทางเคมีระหว่างการเผาไหม้
ลำดับของปฏิกิริยาที่ได้รับจะนำไปสู่การเพิ่มความเข้มข้นของสารประกอบเปอร์ออกไซด์ในระบบปฏิกิริยา
พร้อมกันกับการสะสมของเปอร์ออกไซด์อนุมูลและการเริ่มต้น
มีปฏิกิริยาแบบขนาน:

ปฏิกิริยาเหล่านี้เป็นปฏิกิริยาคายความร้อน เมื่อพวกเขาไหลความร้อนจำนวนมาก
ด้วยการเพิ่มขึ้นของอุณหภูมิของส่วนผสมปฏิกิริยาบทบาทของศูนย์ที่ใช้งานส่งผ่านจากผลิตภัณฑ์ระดับกลางหนึ่งไปยังอีกในลำดับต่อไปนี้: อัลคิลไฮโดรเพอร์ออกไซด์, acyl hydroperoxides, ฟอร์มาลดีไฮด์
การศึกษาเชิงทดลองเกี่ยวกับการเปลี่ยนแปลงองค์ประกอบของส่วนผสมที่เกิดปฏิกิริยาเมื่อเวลาผ่านไปในภูมิภาคที่มีอุณหภูมิสูง (600-800 ° C) แสดงให้เห็นว่ากระบวนการของการเปลี่ยนแปลงของไฮโดรคาร์บอนเริ่มต้นเป็นผลิตภัณฑ์การเผาไหม้ขั้นสุดท้ายแบ่งออกเป็นสองขั้นตอนคือขั้นแรกเกิดขึ้นในอัตราที่สูงมาก ในขั้นที่สองช้าระยะ CO จะถูกออกซิไดซ์ ข้อสรุปที่สำคัญมากดังต่อไปนี้: กฎหลายข้อของการเผาไหม้ของไฮโดรคาร์บอนสามารถอธิบายได้ด้วยคุณสมบัติของการเผาไหม้ของคาร์บอนมอนอกไซด์
2.5 การเผาไหม้คาร์บอน
การเผาไหม้ของคาร์บอนดำเนินไปตามกลไกของกระบวนการที่แตกต่างกันความจำเพาะที่อยู่ในความจริงที่ว่าขั้นตอนทางเคมีไม่สามารถพิจารณาแยกออกจากกระบวนการถ่ายโอนสารออกซิแดนท์ (ออกซิเจนของอากาศ) จากพื้นที่โดยรอบไปยังพื้นผิวของของแข็ง อัตราการเผาไหม้ขึ้นอยู่กับคุณสมบัติทางเคมีของคาร์บอนและคุณสมบัติที่กำหนดกระบวนการส่งออกซิเจนไปยังพื้นผิวเชื้อเพลิง การจ่ายออกซิเจนให้กับเขตการเผาไหม้จะดำเนินการโดยการแพร่กระจายดังนั้น
Korolchenko A.Ya. กระบวนการเผาไหม้และการระเบิด
ขึ้นอยู่กับปัจจัยหลายประการ: รูปร่างและขนาดของวัตถุที่เผาไหม้การเคลื่อนที่ของตัวกลางก๊าซค่าสัมประสิทธิ์การแพร่ของออกซิเจนและผลิตภัณฑ์ปฏิกิริยาทั้งในพื้นที่เหนือพื้นผิวเชื้อเพลิงและในรอยแตกและรูขุมขนที่มีอยู่ในถ่านหินและโค้กในปริมาณมาก
เพื่อแสดงให้เห็นถึงคุณสมบัติของการเผาไหม้คาร์บอนที่แตกต่างกันเราพิจารณาพฤติกรรมของชิ้นส่วนของถ่านหินที่แยกจากกันในเตาที่ให้ความร้อนถึงอุณหภูมิ 900 ° C ในช่วงแรกการเผาไหม้ของถ่านหินจะเกิดขึ้นโดยที่ออกซิเจนอยู่ใกล้กับพื้นผิวของมัน หลังจากใช้หมดแล้วผลิตภัณฑ์การเผาไหม้จะเกิดขึ้นรอบ ๆ พื้นผิวที่ร้อน อัตราการเผาไหม้จะลดลงและกระบวนการอาจหยุดลงหากไม่มีออกซิเจนมาจากพื้นที่ที่ห่างไกลมากขึ้นของพื้นที่ก๊าซ
การไหลนี้เกิดขึ้นจากการแพร่และอัตราการเผาไหม้จะถูกกำหนดโดยฟลักซ์การแพร่ ความเข้มการแพร่กระจายส่วนใหญ่ขึ้นอยู่กับความเข้มและธรรมชาติของการเคลื่อนที่ของตัวกลางก๊าซใกล้กับพื้นผิวการเผาไหม้ อัตราการเกิดปฏิกิริยาเคมีขึ้นอยู่กับอุณหภูมิเป็นหลัก ปฏิกิริยาที่ต่างกันเช่นเดียวกับที่เป็นเนื้อเดียวกันเชื่อฟังกฎหมาย Arre-nius
ที่อุณหภูมิสูงปฏิกิริยาออกซิเดชันของคาร์บอนจะดำเนินไปอย่างรวดเร็วและความเร็วรวมของกระบวนการจะถูก จำกัด โดยการกระจายของออกซิเจนไปที่พื้นผิว
ดังนั้นกระบวนการเผาไหม้คาร์บอนประกอบด้วยสองกระบวนการในลักษณะที่แตกต่างกัน: กระบวนการขนส่งออกซิเจนในอากาศจากพื้นที่ก๊าซไปยังสถานที่ที่บริโภคและกระบวนการปฏิสัมพันธ์ทางเคมีกับพื้นผิวของของแข็งคาร์บอน กระบวนการทั้งสองนี้มีความสัมพันธ์กัน แต่แต่ละกระบวนการมีกฎหมายของตัวเอง ที่สำคัญที่สุดของกระบวนการเหล่านี้คือกระบวนการของการใช้ออกซิเจนซึ่งโดดเด่นด้วยปฏิกิริยาทางเคมีที่หลากหลาย
กลไกการเกิดปฏิกิริยาเชิงซ้อนของการรวมออกซิเจนกับคาร์บอนประกอบด้วยการก่อตัวของออกไซด์สองอันของ CO และ C0 2 ผ่านทางเคมีเชิงฟิสิกส์ขั้นกลางของชนิด C X 0 Y ซึ่งจะแบ่งออกเป็น CO และ อัตราส่วนระหว่างออกไซด์เหล่านี้ขึ้นอยู่กับเงื่อนไขการเผาไหม้ ดังนั้นสมการสำหรับปฏิกิริยาของการเผาไหม้คาร์บอนสามารถเขียนได้ดังนี้:
บทที่ 2 กระบวนการทางเคมีระหว่างการเผาไหม้
จากนั้นปฏิกิริยาที่เป็นเนื้อเดียวกันของการเผาไหม้คาร์บอนมอนอกไซด์จะดำเนินต่อไป:
กลไกที่กล่าวถึงในหัวข้อ 2.3
ปฏิกิริยานี้สามารถเกิดขึ้นใกล้กับพื้นผิวคาร์บอน ดังนั้นและภายในมวลถ่านหินในรูขุมขนและรอยแตก
ปฏิกิริยาอีกอย่างคือปฏิกิริยาต่างกันระหว่างคาร์บอนร้อนกับคาร์บอนไดออกไซด์:
![]()
มันไหลด้วยความเร็วที่เห็นได้ชัดเจนในสถานที่ที่ไม่มีออกซิเจน แต่อุณหภูมิของคาร์บอนสูงพอ
การรวมกันของปฏิกิริยาที่อธิบายจะกำหนดองค์ประกอบของผลิตภัณฑ์จากการเผาไหม้ของคาร์บอน
ภาวะฉุกเฉินของกระบวนการเผาไหม้
| D |
การชลประทานในสารผสมที่ติดไฟได้อาจเกิดขึ้นเนื่องจากการลุกติดไฟด้วยตนเองการจุดติดไฟจากแหล่งภายนอกหรือการเผาไหม้เอง หากกระบวนการเผาไหม้ด้วยตนเองและการเผาไหม้เป็นลักษณะของสารที่อยู่ในสถานะของก๊าซของเหลวหรือของแข็งการเผาไหม้ที่เกิดขึ้นเองเป็นลักษณะของวัสดุที่เป็นของแข็ง (โดยเฉพาะอย่างยิ่งในสถานะที่แบ่งอย่างละเอียด) หรือของเหลวที่เดือดจัดกระจายบนวัสดุ
3.1 การเผาไหม้ตัวเอง ทฤษฎีเครื่องเขียน
ไฟคือการเผาไหม้ที่ไม่มีการควบคุมที่พัฒนาขึ้นในเวลาและสถานที่เป็นอันตรายต่อผู้คนและก่อให้เกิดความเสียหายต่อวัสดุ
อันตรายจากไฟไหม้ต่อมนุษย์ ได้แก่ ไฟเปิดประกายไฟไข้ผลิตภัณฑ์ที่เป็นพิษจากการเผาไหม้ควันออกซิเจนที่ลดลงการพังทลายของอาคารหรือสถานที่ปฏิบัติงานนอกชายฝั่ง
การเผาไหม้เป็นปฏิกิริยาทางเคมีและฟิสิกส์ที่ดำเนินไปอย่างรวดเร็วพร้อมกับการปล่อยความร้อนและควัน, การปรากฏตัวของเปลวไฟหรือการระอุ ภายใต้สภาวะปกติการเผาไหม้เป็นกระบวนการของการออกซิไดซ์หรือการรวมสารที่ติดไฟได้กับออกซิเจนในบรรยากาศ อย่างไรก็ตามสารบางชนิด (เช่นอะเซทิลีนอัดไนโตรเจนคลอไรด์โอโซน) สามารถระเบิดได้โดยไม่ต้องใช้ออกซิเจนในการสร้างความร้อนและเปลวไฟ ดังนั้นการเผาไหม้อาจเกิดจากปฏิกิริยาไม่เพียง แต่ของสารประกอบ แต่ยังเกิดจากการสลายตัว เป็นที่ทราบกันดีว่าไฮโดรเจนและโลหะหลายชนิดสามารถเผาไหม้ในบรรยากาศของคลอรีนทองแดงในไอกำมะถันแมกนีเซียมในคาร์บอนไดออกไซด์เป็นต้น
การเผาไหม้ที่อันตรายที่สุดที่เกิดขึ้นระหว่างการออกซิเดชั่นของสารที่ติดไฟได้กับออกซิเจนในอากาศ ในขณะเดียวกันก็จำเป็นที่จะต้องมีแหล่งกำเนิดประกายไฟที่สามารถจ่ายพลังงานตามจำนวนที่ต้องการให้กับระบบเชื้อเพลิง แหล่งกำเนิดการจุดติดไฟที่พบมากที่สุดคือ: ประกายไฟที่ปรากฏขึ้นเมื่ออุปกรณ์ไฟฟ้าทำงานผิดปกติ, ตัวโลหะที่โดดเด่น, การเชื่อม, การปลอมแปลงงาน ความร้อนที่เกิดจากแรงเสียดทาน อุปกรณ์ให้ความร้อนเทคโนโลยี อุปกรณ์ดับเพลิง ความร้อนของการบีบอัดอะเดียแบติก ประกายปล่อยของไฟฟ้าสถิต ความร้อนสูงเกินไปของหน้าสัมผัสทางไฟฟ้า ปฏิกิริยาเคมีที่เกิดขึ้นจากการปล่อยความร้อน
อุณหภูมิความร้อนของแหล่งกำเนิดเหล่านี้แตกต่างกัน ดังนั้นประกายไฟที่เกิดขึ้นเมื่อตัวโลหะถูกกระทบอาจมีอุณหภูมิสูงถึง 1900 ° C เปลวไฟของการแข่งขันจะใกล้เคียง 800 ° C, ดรัมชั้นนำของสายพานลำเลียงในระหว่างการลื่นไถลสูงถึง 600 ° C และในความร้อนของการปล่อยไฟฟ้าอุณหภูมิสูงถึง 10,000 ° C ด้วยปฏิกิริยาทางเคมีเกือบทันที
การเผาไหม้อาจสมบูรณ์และไม่สมบูรณ์ ด้วยการเผาไหม้ที่สมบูรณ์เกิดขึ้นกับออกซิเจนส่วนเกินผลิตภัณฑ์ปฏิกิริยาคือคาร์บอนไดออกไซด์น้ำไนโตรเจนซัลเฟอร์ไดออกไซด์ การเผาไหม้ที่ไม่สมบูรณ์เกิดขึ้นเนื่องจากการขาดออกซิเจนผลิตภัณฑ์การเผาไหม้ในกรณีนี้เป็นสารพิษและติดไฟได้ - คาร์บอนมอนอกไซด์แอลกอฮอล์แอลกอฮอล์คีโตนอัลดีไฮด์ ฯลฯ อากาศจำนวนหนึ่งจำเป็นสำหรับการเผาไหม้ที่สมบูรณ์ของสารที่ติดไฟได้: 1 กิโลกรัมจากไม้ - 4.18, พีท - 5 , 8, โพรเพน - 23.8 m3
กระบวนการเผาไหม้สามารถจินตนาการได้ดังนี้ สื่อที่ติดไฟได้เย็นกับการแนะนำของแรงกระตุ้นความร้อนความร้อนมีการเกิดออกซิเดชันอย่างเข้มข้นของสื่อที่ติดไฟได้ด้วยออกซิเจนและปล่อยความร้อนเพิ่มเติม ในทางกลับกันสิ่งนี้นำไปสู่การให้ความร้อนของชั้นที่อยู่ติดกันของวัสดุซึ่งติดไฟได้ซึ่งเกิดปฏิกิริยาทางเคมีอย่างรุนแรง ด้วยการเผาไหม้เป็นชั้น ๆ ของสารที่เผาไหม้ได้โซนการเผาไหม้จะเคลื่อนที่ ความเร็วของการเคลื่อนที่นี้เป็นตัวกำหนดความเข้มของกระบวนการเผาไหม้และเป็นคุณลักษณะที่สำคัญที่สุด กระบวนการให้ความร้อนแบบชั้นต่อชั้นการเกิดออกซิเดชันและการเผาไหม้จะดำเนินต่อไปจนกว่าจะหมดปริมาณของวัสดุที่ติดไฟได้ทั้งหมด
เขตแคบ ๆ ซึ่งสารให้ความร้อนและปฏิกิริยาทางเคมีเกิดขึ้นเรียกว่าด้านหน้าของเปลวไฟ
ระบบที่ติดไฟได้นั้นสามารถเป็นเนื้อเดียวกันและแตกต่างกันทางเคมี ระบบที่เป็นเนื้อเดียวกันทางเคมีนั้นเป็นส่วนผสมของก๊าซที่ติดไฟได้ไอระเหยหรือฝุ่นกับอากาศซึ่งสสารที่ติดไฟได้และอากาศจะผสมกันอย่างสม่ำเสมอ การเผาไหม้ของระบบดังกล่าวเรียกว่าเป็นเนื้อเดียวกัน ในระบบที่ไม่ใช้สารเคมีสารที่ติดไฟได้และอากาศไม่ได้ผสมและมีส่วนต่อประสาน เหล่านี้มักเป็นวัสดุติดไฟได้ยากและการเผาไหม้เรียกว่าต่างกัน
เวลารวมของการเผาไหม้ของส่วนผสมที่ติดไฟได้ Tg คือผลรวมของเวลาที่ต้องใช้สำหรับการติดต่อระหว่างสารติดไฟและออกซิเจนτкที่จะเกิดขึ้นและเวลาที่สารเคมีเกิดขึ้นปฏิกิริยาออกซิเดชันτ x
ทั้งนี้ขึ้นอยู่กับอัตราส่วนของคำสองคำนี้การแพร่กระจายและการเผาไหม้ของจลนศาสตร์นั้นแตกต่างกัน เมื่อเผาสารที่ติดไฟได้ของแข็งเวลาที่ใช้ในการแทรกซึม (กระจาย) ไปยังพื้นผิวของสารนั้นนานกว่าเวลาที่เกิดปฏิกิริยาเคมีดังนั้นอัตราการเผาไหม้ทั้งหมดจะถูกกำหนดโดยสมบูรณ์โดยอัตราการแพร่ของออกซิเจนไปยังสารที่ติดไฟได้ การเผาไหม้ของสารดังกล่าวมักพบในไฟและเรียกว่ากระจาย อัตราการเผาไหม้จะถูกกำหนดโดยอัตราการเกิดปฏิกิริยาเคมีเรียกว่าการเคลื่อนไหว การเผาไหม้ประเภทนี้เป็นลักษณะของระบบที่ติดไฟได้เป็นเนื้อเดียวกัน
แยกแยะความร้อนอุณหภูมิทฤษฎีและอุณหภูมิจริงของการเผาไหม้
อุณหภูมิ Calorimetric ของการเผาไหม้หมายถึงอุณหภูมิที่ผลิตภัณฑ์ของการเผาไหม้เสร็จสมบูรณ์จะถูกให้ความร้อนหากความร้อนทั้งหมดถูกปล่อยออกไปในการทำความร้อนปริมาณอากาศเป็นสิ่งจำเป็นในทางทฤษฎีสารจะถูกเผาไหม้อย่างสมบูรณ์และอุณหภูมิเริ่มต้นคือ 0 °С การสูญเสียความร้อนจะถือว่าเป็นศูนย์ หากอุณหภูมิเริ่มต้นของเชื้อเพลิงและอากาศเท่ากับ 0 ° C แสดงว่าอุณหภูมิความร้อนของการเผาไหม้
![]()
ที่ Qn คือค่าความร้อนสุทธิของสารที่ติดไฟได้ kcal / kg; V คือปริมาตรของผลิตภัณฑ์การเผาไหม้, m3 / kg; c คือความจุปริมาตรความร้อนโดยเฉลี่ยของผลิตภัณฑ์การเผาไหม้ kcal / m3 ·องศา
ดังนั้นอุณหภูมิการเผาไหม้ของพลังงานความร้อนขึ้นอยู่กับคุณสมบัติของสารที่ติดไฟได้เท่านั้นและไม่ได้ขึ้นอยู่กับปริมาณของมัน อุณหภูมิการเผาไหม้ทางทฤษฎีคำนึงถึงการสูญเสียความร้อนในระหว่างการเผาไหม้เพื่อแยกตัว อุณหภูมิการเผาไหม้ Calorimetric นั้นสูงที่สุดสำหรับสารที่ไหม้ไฟได้และใช้สำหรับการประเมินเชิงคุณภาพ ในความเป็นจริงเมื่อการเผาไหม้มีการสูญเสียความร้อนเนื่องจากรังสีความร้อนของอากาศส่วนเกินและสิ่งแวดล้อม
อุณหภูมิการเผาไหม้ที่เกิดขึ้นจริงคืออุณหภูมิไฟ แยกแยะอุณหภูมิของไฟภายในและภายนอก อุณหภูมิของไฟภายนอกคืออุณหภูมิของเปลวไฟและอุณหภูมิภายในคืออุณหภูมิของควันในห้อง อุณหภูมิที่เกิดขึ้นจริงในกรณีเกิดไฟไหม้เนื่องจากการสูญเสียความร้อนต่อสิ่งแวดล้อมความร้อนของผลิตภัณฑ์และโครงสร้างการเผาไหม้
น้อยกว่าตามทฤษฎีเสมอ 30 ... 50% ตัวอย่างเช่นอุณหภูมิการเผาไหม้ในทางทฤษฎีของน้ำมันเบนซินคือ 1730 ° C และอุณหภูมิที่แท้จริงคือ 1,400 ° C
ส่วนผสมของไอระเหยและแก๊สที่ติดไฟได้ด้วยสารออกซิไดซ์สามารถเผาไหม้ได้ด้วยเชื้อเพลิงในปริมาณที่แน่นอนเท่านั้น
ความเข้มข้นต่ำสุดของก๊าซที่ติดไฟได้ซึ่งการเผาไหม้มีอยู่แล้วเรียกว่าขีดจำกัดความเข้มข้นของการจุดติดไฟ (LEL) ที่ต่ำกว่า ความเข้มข้นสูงสุดที่การเผาไหม้ยังเป็นไปได้เรียกว่าขีดจำกัดความเข้มข้นของการจุดติดไฟ (AIPW) ขอบเขตของความเข้มข้นที่อยู่ภายในขอบเขตเหล่านี้เรียกว่าบริเวณจุดติดไฟ การเผาไหม้เป็นไฟ (จุดเริ่มต้นของการเผาไหม้) พร้อมกับลักษณะของเปลวไฟ นี่คือการเผาไหม้ที่ยาวนานและมั่นคงซึ่งไม่หยุดแม้หลังจากที่แหล่งกำเนิดประกายไฟถูกเอาออกไปแล้ว ค่าของขีด จำกัด ล่างและบนของการจุดระเบิดขึ้นอยู่กับคุณสมบัติของก๊าซไอและฝุ่นของเครื่องผสมอากาศเนื้อหาของส่วนประกอบเฉื่อยในส่วนผสมที่ติดไฟได้ การเติมก๊าซเฉื่อยลงในส่วนผสมที่ติดไฟได้จะทำให้พื้นที่การเผาไหม้แคบลงและในที่สุดก็ทำให้ไม่ติดไฟ จำกัด ขอบเขตการจุดระเบิดให้แคบลงอย่างมีนัยสำคัญสิ่งสกปรกบางอย่างที่ทำให้ปฏิกิริยาการเผาไหม้ช้าลง ที่ใช้งานมากที่สุดของเหล่านี้คือไฮโดรคาร์บอนฮาโลเจน คุณสมบัติที่ทำเครื่องหมายไว้ทั้งสองถูกใช้เพื่อหยุดเขียน การลดความดันของส่วนผสมที่ต่ำกว่าความดันบรรยากาศก็ทำให้พื้นที่การเผาไหม้แคบลงและด้วยความดันที่แน่นอน การเพิ่มความดันของสารผสมที่ติดไฟได้จะขยายบริเวณจุดติดไฟ แต่ตามกฎเล็กน้อย การเพิ่มอุณหภูมิของสารผสมที่ติดไฟได้จะขยายพื้นที่การจุดติดไฟ ความเข้มข้นของการจุดระเบิดยังได้รับผลกระทบจากพลังของแหล่งกำเนิดประกายไฟ
มีความเข้มข้นไม่เพียง แต่ยัง จำกัด อุณหภูมิของการเผาไหม้
ขีด จำกัด อุณหภูมิสำหรับการจุดติดไฟของไอระเหยในอากาศคืออุณหภูมิของสารที่ติดไฟได้ซึ่งไอระเหยของมันอิ่มตัวจะสร้างความเข้มข้นที่สอดคล้องกับขีดจำกัดความเข้มข้นต่ำหรือสูงกว่าของการจุดติดไฟ อุณหภูมิการจุดติดไฟคืออุณหภูมิต่ำสุดที่สารติดไฟหรือเริ่มที่จะทำให้มีขนาดเล็กลงและยังคงเผาไหม้หรือดีขึ้นหลังจากนำแหล่งกำเนิดประกายไฟออก อุณหภูมิการเผาไหม้เป็นลักษณะความสามารถของสารในการเผาไหม้ตัวเอง หากอุณหภูมิการจุดติดไฟของสารไม่มีอยู่จะเรียกว่าการเผาไหม้ช้าหรือไม่ติดไฟ
การเร่งปฏิกิริยาออกซิเดชันภายใต้การกระทำของอุณหภูมินำไปสู่การจุดระเบิดด้วยตนเอง แตกต่างจากกระบวนการจุดระเบิดซึ่งมีเพียงส่วน จำกัด ของปริมาณ - พื้นผิว - จุดติดไฟการจุดระเบิดด้วยตนเองเกิดขึ้นในปริมาณทั้งหมดของสาร อุณหภูมิจุดติดไฟด้วยตนเองนั้นเป็นอุณหภูมิต่ำสุดซึ่งสารจะต้องได้รับความร้อนเพื่อที่จะติดไฟเนื่องจากการเกิดออกซิเดชันอัตโนมัติเพิ่มเติม การลุกติดไฟได้ด้วยตนเองจะเกิดขึ้นได้ก็ต่อเมื่อปริมาณความร้อนที่ปล่อยออกมาในระหว่างกระบวนการออกซิเดชั่นนั้นสูงกว่าการปล่อยความร้อนสู่สิ่งแวดล้อม
อุณหภูมิการจุดติดไฟอัตโนมัตินั้นไม่คงที่สำหรับสารเนื่องจากส่วนใหญ่ขึ้นอยู่กับเงื่อนไขของการตัดสินใจ สำหรับการรับข้อมูลเปรียบเทียบเครื่องมือทดสอบและวิธีการกำหนดอุณหภูมิการเผาไหม้ด้วยตนเองของก๊าซและไอระเหยนั้นเป็นมาตรฐาน (GOST 13920-68) อุณหภูมิต่ำสุดที่กำหนดโดยวิธีมาตรฐานซึ่งส่วนผสมของก๊าซและไอระเหยกับอากาศจะต้องได้รับความร้อนอย่างสม่ำเสมอเพื่อให้ติดไฟได้โดยไม่ต้องนำแหล่งกำเนิดประกายไฟภายนอกมาเรียกว่าอุณหภูมิจุดติดไฟมาตรฐาน
ประเภทของการเผาไหม้ที่เกิดขึ้นเองคือการเผาไหม้ที่เกิดขึ้นเองเช่นการเผาไหม้เนื่องจากความร้อนในตัวเองโดยไม่ได้รับอิทธิพลจากแหล่งกำเนิดประกายไฟ ความแตกต่างระหว่างการเผาไหม้ที่เกิดขึ้นเองและการเผาไหม้ที่เกิดขึ้นเองนั้นอยู่ที่ขนาดของอุณหภูมิ การเผาไหม้ที่เกิดขึ้นเองเกิดขึ้นที่อุณหภูมิห้องและสำหรับการเผาไหม้ด้วยตนเองมีความจำเป็นต้องให้ความร้อนสารจากภายนอก

 การรับสัญญาณบ่งชี้เคาน์เตอร์น้ำร้อนและน้ำเย็น
การรับสัญญาณบ่งชี้เคาน์เตอร์น้ำร้อนและน้ำเย็น การคำนวณพื้นที่ของท่ออากาศที่มีรูปร่างและอุปกรณ์ต่าง ๆ
การคำนวณพื้นที่ของท่ออากาศที่มีรูปร่างและอุปกรณ์ต่าง ๆ เคมีของกระบวนการเผาไหม้ พลังงานระเบิด
เคมีของกระบวนการเผาไหม้ พลังงานระเบิด จะเกิดอะไรขึ้นถ้าคุณไม่ส่งการอ่านมิเตอร์
จะเกิดอะไรขึ้นถ้าคุณไม่ส่งการอ่านมิเตอร์