Djegia quhet. Proceset kimike gjatë djegies
Disa përkufizime themelore
Numri i atomeve dhe molekulave është i shprehur në mënyrë të përshtatshme në terma të sasi të substancës ose numri i moleve të substancës. Një molë e materies korrespondon me 6.023 ∙ 10 23 grimca (atome dhe molekula). Numri N A = 6.023 ∙ 10 23 mol -1 quhet numri Avogadro. Fraksion Mole x ikomponent unë është raporti i numrit të moleve n unë komponent unë në numrin total të moles n = Σ n unë pėrzierje ( x i = n i / n).
peshë m është një pronë themelore e një substance (njësia e matjes në sistemin SI është kilogram). Pjesa masive Wi është raporti i masës m i komponent unë në masën totale të përzierjes m = Σ m i (Wi = m i / m).
Pesha molekulare (ose pesha molekulare) M unë(g / mol) komponenti unë - është masa e një mole të këtij komponenti. Kështu, për karbonin atomik, hidrogjenin molekular, oksigjenin dhe metanin, kemi: M c = 12 g / mol, Mn 2 = 2 g / mol, Mo2 = 32 g / mol, Mn 4 = 16 g / mol. Mesatarja e molarit të përzierjes M (g / mol) mund të shprehet në terma të fraksioneve molare të përbërësve (M = x i M i).
Përcaktimi i proceseve të djegies
përvëlues - Ky është një proces kompleks fiziko-kimik në të cilin substancat dhe materialet e djegshme nën ndikimin e temperaturës së lartë hyjnë në ndërveprim kimik me një agjent oksidues (oksigjen në ajër), duke u shndërruar në produkte të djegies dhe i cili shoqërohet me nxehtësi intensive dhe emetim të dritës.
Kushtet e nevojshme për shfaqjen e procesit të djegies:
Prania e një substance të djegshme (GV);
Prania e një agjenti oksidues (O.) - oksigjeni i ajrit;
Prania e një burimi të ndezjes (I.Z.).
Materiali i djegshëm duhet të nxehet në një temperaturë të caktuar në të cilën do të fillojë procesi i oksidimit;
Për të ngrohur një lëndë të djegshme në një temperaturë të caktuar, kërkohet një burim i caktuar i burimit të ndezjes;
Për të ruajtur procesin e djegies, nevojiten përqëndrime të caktuara të karburantit dhe oksiduesit.
Proceset më të rëndësishme të djegies janë transferimi i nxehtësisë dhe masës. Pronë më e zakonshme e djegies është shfaqja e një flake dhe lëvizja e tij në të gjithë ndezjen e djegshme duke transferuar nxehtësinë ose shpërndarjen e grimcave aktive nga zona e djegies në një përzierje të re të djegshme.
zjarr - Ky është një manifestim i dukshëm i djegies. Ajo quhet edhe zona e djegies. Kjo është pjesa e hapësirës ku ndodh transformimi i përzierjes së djegshme në produkte të djegies së plotë dhe të paplotë.
Parametrat kryesorë të procesit të djegies, që çojnë në vdekje dhe që shkaktojnë dëme materiale, janë:
Shuma e madhe e nxehtësisë;
Temperatura e lartë;
Përbërja toksike e produkteve të djegies.
Procesi i djegies nga pikëpamja e teorisë kinetike molekulare të gazeve
Fig. 2.1. Proporcioni i molekulave aktive në varësi të temperaturës: T 2\u003e T 1
Kur përzierje e nxehtë e gazuar në të rritet energjia e tepërt.
Dallimi midis nivelit mesatar të energjisë së molekulave në gjendjen aktive dhe nivelit mesatar të gjendjes jo aktive quhet energjia e aktivizimit. Kjo mund të paraqitet në mënyrë grafike (Fig. 2).

Fig. 2.2. Diagrami i energjisë i kursit të reagimit G.V. + O. ® PG: E akt - energjia e aktivizimit; Q xr - efekt termik i reagimit të djegies
Energjia e lëshuar si rezultat i ndërveprimit të molekulave "të para" të reaguara transferohet në molekulat fqinje. Ata janë të ngazëllyer, procesi përsëritet rreth molekulave të reaguara me frekuencë dhe intensitet të madh. Fillon procesi i ndërveprimit kimik, i vetë-mbështetur, i vetë-përshpejtuar në të gjithë reagimin e reagimit (2H 2 + O 2), i shoqëruar nga formimi i molekulave të ujit dhe lirimi i nxehtësisë në mjedis dhe i shoqëruar nga luminescenca, dmth. lind dhe përhap procesin e djegies.
Sa më e lartë vlera numerike e aktit E, aq më e vështirë është që ky palë përbërës të futet në ndërveprim kimik. Prandaj, vlera e aktit E është një tregues indirekt i shkallës së rrezikut të zjarrit të këtij sistemi kimik.
Llojet dhe mënyrat e djegies
Djegija mund të klasifikohet sipas parametrave të mëposhtëm:
1. Sipas kushtit të përzierjes së komponentëve të djegshëm:
a) kinetike - djegia e gazrave para-përzier ose përzierjet e avullit-ajrit. Meqë përzierja e karburantit dhe oksiduesit është e gatshme për djegie derisa të ndizet, shkalla totale e procesit të djegies varet vetëm nga shkalla e reaksionit kimik të djegies. Nëse një djegie e tillë ndodh në një vëllim të mbyllur ose të kufizuar, atëherë mund të ndodhë një shpërthim. Meqenëse energjia e lëshuar gjatë djegies së përzierjes nuk ka kohë për t'u shkarkuar përtej këtij vëllimi, duke rritur presionin, strukturat mund të shkatërrohen;
b) difuzioni, djegja e difuzionit quhet djegie, kur formimi i një mjedisi të djegshëm (një përzierje e karburantit dhe oksiduesit) ndodh para zonës së djegies ose në zonën e djegies.
2. Sipas intensitetit të pranimit të komponentëve të djegshëm në zonën e reagimit kimik:
a) laminar, ndërkohë që përbërësit e përzierjes së djegshme hyn në zonën e djegies relativisht qetë. Në këtë rast, vlera numerike e kriterit Reynolds, që karakterizon regjimin termodinamik, do të jetë dukshëm më i vogël se ai kritik (Re<2300).
b) i turbullt, me komponentët e përzierjes së djegshme që hyjnë në zonën e djegies me shpejtësi të lartë. Numri Reynolds në këtë rast është më shumë se 2300.
3. Sipas gjendjes së grumbullimit të përbërësve të përzierjes së djegshme:
a) karburant dhe oksidues homogjen - janë në të njëjtin gjendje agregate (gazore);
b) karboni dhe oksidanti heterogjen (multifaz) janë në gjendje të ndryshme agregate.
4. Sipas shpejtësisë së përhapjes së zonës së reaksionit kimik të djegies:
a) shpërndarjen e deflagrimit (të ngadaltë) të zonës së reaksionit kimik (shpejtësia nga 0,5 deri në 50 m / s);
b) shpërthimi (eksploziv), kur zona e reaksionit kimik të djegies përhapet me shpejtësinë e valës së goditjes (nga disa qindra metra për sekondë në disa kilometra në sekondë).
Hapësira në të cilën avujt ose gazi digjen është quajtur nga flaka .
Flakët laminare para-përziera. Në flakët laminare të një përzierjeje të para-përzier, karboni dhe oksidanti janë të përziera para fillimit të djegies dhe rrjedha është laminare.
Flaka e përzierjes së para-përzierjes quhet stoichiometric nëse karburanti (hidrokarbur) dhe oksiduesi (oksigjeni - O 2) konsumojnë plotësisht njëra tjetrën, duke formuar dioksid karboni (CO 2) dhe ujë (H 2 O). Nëse ka një tepricë të karburantit, ata thonë se përzierja është e pasur, dhe nëse ekziston një oksidues i tepërt, ata thonë se përzierja është e dobët.
Shqyrtoni shembujt më të thjeshtë:
1) 2H 2 + O 2 → 2H 2 O - përzierje stoikiometrike,
2) Н 2 + О 2 → 2H 2 O + Н 2 - përzierje e pasur (Н 2 e tepërt),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - përzierje ligët (O2 në tepërt).
Çdo simbol në një ekuacion të tillë të reagimit kimik korrespondon me një mol të një substance. Kështu, e para nga këto ekuacione do të thotë që dy mol të H2 reagojnë me një mol të O2 për të formuar dy mol të H20.
Nëse ekuacioni i reagimit kimik është shkruar në mënyrë të tillë që të përshkruajë reagimin e vetëm një molë karburanti, atëherë pjesa e molës së karburantit në një përzierje stoikiometrike mund të përcaktohet lehtë nga relacioni
x malet, stokh = 1 / ((1 + v)
këtu vnënkupton numrin e moleve të O2 në ekuacionin e reagimit me formimin e CO 2 dhe H 2 O. Një shembull është reagimi
H2 + 0.5O2 → H2O, v = 0.5, xH2, stoch = 2/3
Nëse oksiduesi është ajër, atëherë duhet të merret parasysh se ajri i thatë përmban vetëm 21% oksigjen, si dhe 78% azot dhe 1% gazra fisnike. Kështu, për ajrin, X N 2 = 3.762 X O 2. Nga këtu fraksionet molare për përzierje stoikiometrike me ajër do të jenë të barabarta
x malet, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
ku v si më parë do të thotë numri i moleve të O 2 në ekuacionin e reaksionit të konvertimit të plotë të një molë karburanti në CO 2 dhe H 2 O. Disa shembuj të vlerave v dhe fraksionet molare të karburantit për përzierjet stoikiometrike të karburantit me ajër janë paraqitur në Tabelën 1.
Përzierjet e para të përziera të karburantit dhe ajrit (në këtë rast, duhet të shtohet një sasi e përshtatshme e N2 në ekuacionin e reaksionit, shih Tabelën 1) karakterizohen nga raporti ekuivalent për ajrin:
λ = (x w / x malet) / (x w, stoch / x malet, stoh) = (w w / w malet) / (w w, stoch / w malet, stoch)
ose reciproke të - raporti ekuivalent për karburant F (F = 1 / λ). Kjo formulë mund të transformohet në mënyrë që të jetë në gjendje të përcaktojë madhësinë e fraksioneve molare të përzierjes me vlerë F:
x malet = 1 / ((1 + (4,762 ∙ v) / F), x w = 1 - x malet,
Pesha X / 4,762, = ∙ 3,762
Shembuj të vlerave v dhe fraksioneve të naftës x male, stoichi për përzierjet stoikiometrike të karburantit me ajër
ujitja shoqërohet gjithmonë me transformime kimike. Djegija në ajër - bashkëveprimi i një substance të djegshme me oksigjenin. Megjithatë, duhet të kihet parasysh se oksidet e azotit, halideve dhe ozonit mund të veprojnë si oksidues në procesin e djegies. Proceset e njohura të djegies që ndodhin me pjesëmarrjen e vetëm një burimi të produktit - komponimet e aftë për dekompozim të shpejtë. Shembuj të përbërjeve të tilla janë acetileni dhe hidrazina.
Proceset kimike që ndodhin gjatë djegies janë jashtëzakonisht komplekse. Edhe për rastin më të thjeshtë - djegia e hidrogjenit në oksigjen, ekuacioni i përgjithësuar i së cilës ka formën
2H 2 + 0 2 = 2H 2 O,
janë krijuar dhe studiuar disa faza fillestare.
Deri më sot, mekanizmat e transformimeve kimike gjatë djegies së vetëm disa substancave, si hidrogjeni, monoksidi i karbonit, metani dhe etani, janë studiuar në detaje të mjaftueshme. Kjo njohuri përdoret për të parashikuar kushtet e ndezjes dhe djegien e shumë substancave.
2.1. Reaksionet e zinxhirit
Reaksionet e zinxhirit, në dallim nga transformimet e zakonshme kimike, karakterizohen nga paraqitja në çdo akt elementar të një grimce aktive: një atom me një elektron të palëvizur, një radikal të lirë ose një jon. Shfaqja e grimcave aktive shkakton një zinxhir transformimesh të materialeve fillestare në produkte reagimi. Atomet, radikalet e lira dhe jonet jane me reaktive sesa molekulat e mbushura me valencë. Prandaj, përkundër kostove të konsiderueshme të energjisë që kërkohen për të thyer lidhjet kimike dhe formimin e grimcave aktive, zhvillimi i zinxhirit të një reaksioni shpesh rezulton të jetë energjikisht më e dobishme sesa ndërveprimi i drejtpërdrejtë midis molekulave.
Proceset e djegies kryesisht ndodhin nëpërmjet një mekanizmi të zinxhirit. Reaksionet e zinxhirit - reaksione komplekse që ndodhin në disa faza, që përfaqësojnë:
Origjina e zinxhirëve (fillimi), në të cilën formohen grimcat aktive;
Vazhdimi i zinxhirëve, në të cilën grimcat aktive hyjnë në ndërveprim kimik me materialet fillestare, si rezultat i të cilave formohen grimca të reja aktive;
Thyerja e zinxhirëve në të cilët ndodh "vdekja" e grimcave aktive me formimin e produkteve të reagimit përfundimtar
Origjina e zinxhirëve mund të ndodhë nën kushte të ndryshme. Për shembull, si rezultat i shkëputjes së molekulave nën veprimin e energjisë termike, ose rrezatimit jonizues, në një shkarkesë elektrike. Vdekja e grimcave aktive ndodh kur ato rekombinohen kur radikalet e lira ndërveprojnë (thyerja e zinxhirit homogjen), kur grimcat aktive bashkëveprojnë me sipërfaqe të ngurta (thyerje heterogjene zinxhiri) ose si rezultat i reagimit të tyre me frenuesit e djegies.
Ka reaksione zinxhirore të pandryshuara dhe të degëzuara. Në unbranched për çdo grimcë aktive të konsumuar në reagimet e vazhdimit të zinxhirit, ka një ri-dalin. Numri i molekulave të produktit të formuar sipas grimcave fillestare aktive quhet gjatësia e zinxhirit. Gjatësia e zinxhirëve në reaksionet e djegies varion nga qindra mijëra në dhjetëra miliona. Shkalla e reaksioneve të zinxhirit të palidhur mund të ndikohet nga shtesa të vogla të substancave që mund të bashkëveprojnë në mënyrë efektive me grimca aktive, siç janë frenuesit e djegies.
Disa substanca - iniciatorë - lehtësojnë formimin e grimcave aktive dhe në këtë mënyrë përshpejtojnë reaksionet zinxhirore të pangopura.
Në reaksionet e zinxhirit të degëzuar në një grimcë aktive, të konsumuar me vazhdimin e zinxhirit, formohen dy ose më shumë grimca aktive. Njëri prej tyre vazhdon zinxhirin kryesor, ndërsa të tjerët fillojnë zinxhirë të rinj, duke formuar një degëzim (Figura 2.1).
"Rekombinimi është procesi i formimit të atomeve ose molekulave neutrale nga grimcat e ngarkuara. Atomet dhe molekulat e formuara gjatë rekombinimit mund të jenë në tokë ose në gjendje të ngazëllyer.
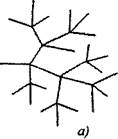
Fig. 2.1. Përfaqësimi skematik i zinxhirëve të reagimit:
a) degëzimi në secilën lidhje të zinxhirit
6) bronkial i rrallë
Për shembull, gjatë djegies së hidrogjenit në reaksionin e fillimit të zinxhirit:
formohet një atom aktiv. Në reagimin e vazhdimit të zinxhirit:

ka një rritje të numrit të atomeve aktivë që janë fillimi i zinxhirëve të rinj.
Reaksionet e zinxhirëve të degëzuar mund të vazhdojnë në një mënyrë stacionare, në të cilën shpejtësia e degëzimit është më e vogël se norma e vdekjes së grimcave aktive dhe jo-stacionare, në të cilën vdekja ndodh më ngadalë se degëzimi. Në rastin e fundit, shpejtësia e reaksionit zinxhir rritet në mënyrë eksponenciale dhe kufizohet vetëm nga konsumi i materialeve fillestare. Kalimi nga mënyra stacionare në jo stacionare ndodh papritmas me një ndryshim të lehtë në kushtet e reagimit: temperatura, presioni ose përqendrimi i një prej reagentëve. Një përshpejtim i tillë i shpejtë konsiderohet si vetë-ndezja e përzierjes së reagimit ose shpërthimit të një zinxhiri.
Zbulimi i reaksioneve të zinxhirit të degëzuar ishte i një rëndësie të madhe për krijimin e një teorie të proceseve të djegies. Është vërtetuar se ka dy lloje të ndezjes: termike dhe zinxhir. Modelet e vendosura në
Kapitulli 2. Proceset kimike në përvëlues
teoria e proceseve të zinxhirit, mund të ndikojë në mënyrë efektive në zhvillimin dhe shtypjen e proceseve të djegies gjatë zjarreve.
Origjina e zinxhirëve.Procesi i bërthamëzimit të qendrave fillestare aktive luan një rol të madh në zhvillimin e reaksioneve zinxhirore të pangopura. Ai kompenson humbjen e qendrave aktive gjatë reagimeve të ndërprerjes së zinxhirit. Ky mekanizëm përcakton kushtet për formimin e një regjimi stacionar në periudhën fillestare të akumulimit të qendrave aktive. Me një shkallë të vogël fillimi, kjo periudhë mund të jetë e rëndësishme.
Shumica e reagimeve kimike në flakë kanë një rezervë të konsiderueshme energjie të qendrave aktive. Nën këto kushte, fillimi i qendrave aktive shoqërohet me tejkalimin e një pengese të konsiderueshme të energjisë.
Në këtë rast, një rol të rëndësishëm luajnë faktorët që sigurojnë një shkallë të konsiderueshme të shfaqjes së qendrave aktive: aditivëve kimikisht aktivë, rrezatimit, shkarkimit elektrik, produkteve të prishjes radioaktive.
Ndër faktorët që lehtësojnë shumë gjenerimin e qendrave aktive, duhet të vërehen reagime heterogjene. Në molekulat e substancave të djegshme të adsorbuara në një sipërfaqe solide, lidhjet ndëratomike dobësohen dhe thyerja e tyre kërkon më pak shpenzime të energjisë. Nën këto kushte, norma e gjenerimit të qendrave aktive është dukshëm më e lartë se në vëllimin e gazit. Energjia e aktivizimit për ndërveprimin heterogjen të komponentëve të përzierjes së djegshme është gjithashtu më e ulët se sa për homogjen. Inicimi heterogjen i qendrave aktive nën kushtet e proceseve aktuale të djegies është një faktor i rëndësishëm në arritjen e përshpejtuar të një regjimi stacionar me proceset e zinxhirit të pandarë.
Disa karakteristika karakterizojnë reaksione zinxhirore të pandryshuara që ndodhin me pjesëmarrjen e komponentëve atomikë. Në mungesë të papastërtive që bashkëveprojnë me qendrat aktive pa rigjenerim, ndërprerja e zinxhirit bëhet e mundur vetëm kur atomet rekombinohet nga goditjet e trefishta dhe në sipërfaqe.
Në çdo temperaturë, të gjitha substancat e gazta dissociohen pjesërisht. Disa nga molekulat shpërthejnë në atome. Në këtë rast, ekziston një ekuilibër mes proceseve të shkëputjes dhe bashkimit të atomeve në molekula. Shkalla e dissociimit në mënyrë eksponenciale varet nga temperatura.
Nëse nuk ka papastërti në përzierjen e djegshme që thyen zinxhirët, përqendrimi i komponentëve atomikë të reagimit mbetet praktikisht e pandryshuar. Atomet që hynë në reaksion rigjenerohen menjëherë në të njëjtën
Korolchenko A.Ya. Proceset e djegies dhe shpërthimit
lichestve. Nisja fillestare kompenson atomet e reaguar në të njëjtën sasi si në sistemin jo reaktiv. Reagimi stacionar nuk ndikon në këtë proces. Bilanci i një prej përbërësve të reagimit, i cili dallohet nga lidhja më e fortë midis atomeve në molekulë, është një tipar karakteristik i kësaj mode. Përqendrimi i një komponenti tjetër atomik në këtë rast është quasistationary, por më shumë ekuilibrit.
Me fillimin homogjen të reaksioneve të djegies, regjimi stacionar do të krijohet vetëm pas një periudhe të caktuar kohe, pasi dissociimi kërkon një energji të madhe aktivizimi. Gjatë kësaj periudhe shkalla e disociimit tejkalon normën e rekombinimit dhe qendrat aktive grumbullohen në sistemin e reaksionit. Shkalla e të dy proceseve krahasohet vetëm pasi rritet përqendrimi i qendrave aktive në ekuilibër. Kjo periudhë kohore quhet periudha e induksionit.
Prania e një sipërfaqe solide si një katalizator në zonën e reaksionit nuk ndryshon gjendjen e ekuilibrit termodinamik. Katalizori ndikon në mënyrë të barabartë reagimet përpara dhe të kundërta. Qendrat aktive jo vetëm që kanë origjinën në një sipërfaqe të fortë, por gjithashtu thyejnë në të. Megjithatë, prania e një katalizatori përshpejton arritjen e një shteti të dissociimit të ekuilibrit.
Nëse substancat aktive janë të pranishme në përzierjen e djegshme, të cilat janë në gjendje të marrin pjesë në reagimet e thyerjes së zinxhirit, ato pakësojnë përqendrimin e qendrave aktive. Në këtë rast, dissociimi i ekuilibrit të një prej përbërësve fillestar është i shqetësuar, gjë që ngadalëson reagimin dhe mund të çojë në përfundimin e saj.
Eksperimentet tregojnë se kur fillon një reaksion zinxhir i pangopur nga një burim i jashtëm (për shembull, një burim drite), përqendrimi i qendrave aktive në fazën fillestare të zhvillimit të procesit të djegies mund të tejkalojë dukshëm ekuilibrin.
Gjatë rrjedhës së reagimeve të zinxhirit të degëzuar, kushtet e fillimit fillestar kanë një ndikim të rëndësishëm në zhvillimin e reagimit. Në proceset me lëvizje të ngadaltë, shtimi i një përzierjeje pjesërisht të reaguar ndaj fillestarit shkurton periudhën e induksionit dhe përshpejton momentin e djegies së flakës.
Vazhdimi i zinxhirëve.Një karakteristikë karakteristike e reaksioneve zinxhirore të pangopura është kuazi-stacionari i përqendrimit të qendrave aktive. Në mungesë të një qarku të hapur, formohen grimca aktive
Kapitulli 2. Proceset kimike gjatë djegies
shumën e njëjtë në të cilën janë shpenzuar. Të reja dalin vetëm në fillimin fillestar. Me norma të barabarta të gjenerimit të qendrave aktive dhe ndërprerjes së zinxhirit, krijohen një përqendrim konstant i qendrave aktive dhe një regjimi stacionar reagimi. Shkalla e reaksionit do të ulet pasi komponentët fillestarë do të konsumohen.
Në rastin e një reaksioni zinxhir të degëzuar, përqendrimi i qendrave aktive në sistemin reagues rritet pavarësisht nga kushtet e fillimit të tyre fillestar. Zbatohet modaliteti i vetë-përshpejtimit të reagimit, i cili ka një karakter ortek. Në këtë rast, për transformimin e plotë të komponentëve fillestar në produktet finale të reagimit, një qendër fillestare aktive është e mjaftueshme.
Ekuacioni kinetik i një reagimi të degëzuar me vlerë është si më poshtë. Ndryshimi në përqendrimet e komponentëve të qëndrueshëm të fillimit me kalimin e kohës mund të neglizhohet në një përafrim të parë dhe vetëm ndryshimet më të shpejta në përqendrimin e qendrave aktive mund të merren parasysh. n.Ndryshimet në këtë shpejtësi përcaktohen nga shkalla e fillimit fillestar dhe raporti i shkallëve të reagimeve të degëzimit dhe përfundimit të zinxhirit. Shkalla fillestare e fillimit nuk varet nga përqendrimi i qendrave aktive të pranishme në sistem. Normat e proceseve të degëzimit dhe thyerjes janë proporcionale me përqendrimet e qendrave aktive. Në këto kushte, bilanci i përgjithshëm i formimit dhe shpenzimit të qendrave aktive përcaktohet nga shuma e përqindjeve të proceseve të fillimit, degëzimit dhe thyerjes:
![]() (2.1)
(2.1)
ku dhe janë konstante të normave të reagimeve të degëzimit dhe thyerjes. Duke treguar, ne marrim:
![]() (2.2)
(2.2)
Kur rrjedh koha e përqendrimit të qendrave aktive
është pozitiv. Shkalla e reagimit rritet me kalimin e kohës. Kjo karakteristikë e reaksioneve të zinxhirit të degëzuar është për shkak të shumëzimit të qendrave aktive në regjime të tilla kur shkalla e reagimit të degëzimit tejkalon shkallën e reagimit të ndërprerjes së zinxhirit.
Korolchenko A.Ya. Proceset e djegies dhe shpërthimit
Nëse para fillimit të reagimit sistemi nuk përmbante qendra aktive, dmth. nët= 0, n = 0 integrimi i ekuacionit (2.2) jep:
![]() (2.3)
(2.3)
Shkalla totale e reaksionit të CO përcaktohet nga shkalla e procesit të degëzimit. Produktet përfundimtare formohen vetëm gjatë këtij reagimi. Për secilën ngjarje bronkiale të zinxhirit elementar, formohen molekulat e produktit përfundimtar. Ai vijon:
![]() (2.4)
(2.4)
Zhvillimi i një reaksioni zinxhir në kohë përcaktohet nga raporti i normave të normës së reaksioneve të degëzimit dhe përfundimit të zinxhirit dhe kur eksponenti në ekuacion (2.4) është pozitiv dhe ri-
veprimi pafundësisht përshpejton. Në periudhën fillestare të zhvillimit të reagimit, marrëdhënia e mëposhtme është e vërtetë:
Për shkak të faktit se shkalla e fillimit fillestar është e vogël, nuk ka transformim të dukshëm kimik në periudhën fillestare. Pas disa kohësh, vlera bëhet shumë më e madhe se një. Pas kësaj, shkalla e reagimit në përputhje me ekuacionin (2.4) fillon të rritet me shpejtësi dhe arrin vlera shumë të mëdha, edhe pse kjo ishte praktikisht e padukshme më parë.
Prania e një periudhe vonese (periudha e induksionit) gjatë zhvillimit të një reaksioni zinxhir është për shkak të nevojës për grumbullimin e një numri të caktuar të qendrave aktive në sistemin reagues. Vetëm pas kësaj transformimi kimik bëhet i dukshëm.
Madhësia e periudhës së induksionit në reaksionet zinxhir përcakton raportet e normave të proceseve të degëzimit dhe përfundimit të zinxhirit, jo shkallën e fillimit fillestar. Nga ana tjetër, normat e reagimeve të degëzimit dhe thyerjes janë për shkak të karakteristikave kimike të secilit sistem reagues, ato përcaktohen nga varësitë nga temperatura dhe përqendrimet e komponentëve fillestarë. Veçori e reagimeve të zinxhirit për
është se proceset degëzuese kërkojnë energji të rëndësishme të aktivizimit, ndërsa koeficienti i temperaturës i konstancës së normës së procesit të thyerjes është afër zeros. Në reagimet e ndërprerjes së zinxhirëve të të tri llojeve: në rastin e rekombinimit të pjesëve të mëdha dhe heterogjene, në ndërveprimin e radikalëve me papastërtitë aktive, energjitë e aktivizimit janë zero.
Me një rritje të temperaturës, presioni total i përzierjes, ose një ndryshim në përqendrimin e komponentëve të reaguar, është e mundur një ndryshim në normat e normës së degëzimit dhe thyerjes, në të cilin reagimi ndryshon nga stacioni në jo stacionar. Veçori e këtij procesi qëndron në kalimin e menjëhershëm nga një mënyrë në tjetrën, në ndryshimin e shkallës së reagimit nga një vlerë e papërfillshme në një rritje të pakufizuar.
Fluksi i disa reaksioneve zinxhir shoqërohet me formimin e produkteve të ndërmjetme që janë relativisht të qëndrueshme, por me aftësinë për të gjeneruar qendra aktive. Reaksione të tilla përfshijnë, për shembull, reaksionet e djegies së hidrokarbureve, si ndërmjetëse në të cilat formohen peroksidet dhe aldehidet. Kjo çon në një degëzim të zinxhirit. Megjithatë, për shkak të stabilitetit relativ të produkteve të ndërmjetme, përshpejtimi i reagimit shtrihet me kalimin e kohës. Zinxhirët e ngadalshëm të degëzimit quhen të degjeneruar.
Reaksionet e zinxhirit me mekanizmin e zakonshëm të degëzimit radikal, si rregull, për shkak të aktivitetit të lartë të radikalëve, vazhdojnë shumë shpejt. Radikalët rezultues ose iniciojnë një reagim të përshpejtuar, ose rekombino dhe dalin nga procesi.
Qarku i hapur Grimca aktive, si çdo molekulë e gazit, bën lëvizje të rastit brenda sistemit të reagimit, duke u përplasur me molekula të tjera. Në të njëjtën kohë, ekziston një probabilitet i caktuar në ndonjë përplasje të ndërveprimit me një tjetër grimcë ose molekulë aktive dhe formimin e një grimce të re aktive, duke vazhduar rrugën e një të mëparshmi. Zhvillimi i zinxhirit të reagimit është i ngjashëm me lëvizjen Brownian të molekulave inerte, edhe pse transferimi i qendrave aktive shoqërohet nga një reaksion kimik. Në rrugën e zhvillimit të zinxhirit alternuar qendrat aktive të dy ose më shumë lloje.
Korolchenko A.Ya. Proceset e djegies dhe shpërthimit
Zinxhiri i reagimeve vazhdon deri në momentin kur grimca aktive nuk reagon pa rigjenerim. Në këtë rast ndodh e ashtuquajtura qark i hapur. Proceset e thyerjes luajnë një rol të madh në kinetikën e reaksioneve zinxhirore. Ka dy lloje të reagimeve që çojnë në vdekjen e qendrave aktive:
Thyerje homogjene (vdekje në vëllimin e përzierjes së reagimit);
Pushim heterogjen (vdekje në një sipërfaqe të fortë) Ndërprerja homogjene e zinxhirëve është e mundur me një nga dy proceset:
kur radikalët rekombinohen ose kur komponente të ndryshme kimikisht aktive bashkëveprojnë me qendrat aktive pa rigjenerimin e kësaj të fundit.
Prishja heterogjene e zinxhirit ndodh në grimcat e blozës së formuar gjatë djegijes, ose në sipërfaqen e materialeve të djegura të forta. Një qark i hapur në një sipërfaqe të fortë mund të konsiderohet si përhapja e qendrave aktive nga përzierja e gazit në këtë sipërfaqe në të cilën ato zhduken. Mekanizmi i rekombinimit në një sipërfaqe të ngurtë është që grimca aktive, e cila ka një reaktivitet të rritur, është ngjitur * në sipërfaqe. Radikalët që janë të lidhur në faqet e afërta rekombinojnë me njëri-tjetrin, pasi nuk ka pengesa për energji dhe hapësirë për këtë proces. Molekulat e komponimeve të qëndrueshme të krijuara si rezultat i rekombinimit nuk janë më të përfshirë në zhvillimin e një reaksioni zinxhir.
Megjithatë, jo çdo përplasje e një grimce aktive me një sipërfaqe solide çon në adsorpimin e saj. Ndoshta reflektimi i saj nga sipërfaqja. Mundësia e adsorpimit të një qendre aktive nga një sipërfaqe solide quhet koeficienti i akomodimit. Ky koeficient është një karakteristikë e afinitetit kimik të grimcave aktive dhe të sipërfaqes. Në raste praktike të rëndësishme, grimca aktive pas reflektimit nga muri nuk largohet nga ajo larg. Ekziston mundësia e përplasjeve të reja me murin derisa të ndodhë akomodimi i tij. Për shkak të këtij procesi, në kushte të caktuara, shkalla e reagimit është praktikisht e pavarur nga koeficienti i akomodimit. Procesi vazhdon në një mënyrë të tillë si BE
* Sorption - thithjen nga një trup i ngurtë (ose lëng) i një substance ha të mjedisit. Trupi thithës quhet sorbent, i zhytur- sorbate. Dalloj thithjen e të gjithë masës së absorbimit (sorbentit) dhe shtresës sipërfaqësore (adsorption). Sorption për shkak të ndërveprimit të tipit kimik në mes të sipërfaqes së sorbentit të ngurtë dhe sorbatit quhet chemisorption.
__________________________ Kapitulli 2. Proceset kimike gjatë djegies
nëse një qark i hapur ndodhi në çdo përplasje. Përqendrimi i qendrave aktive në sipërfaqe mund të merret zero.
Në mungesë të papastërtive aktive në përzierjen reaguese, thyerja e zinxhirëve mund të ndodhë ose në sipërfaqe të ngurta ose në mënyrë homogjene nga rekombinimi i radikalëve në masë. Në zjarret e vërteta, mënyra e dytë kryesisht zbatohet.
Ndikimi i caktuar në kinetikë të reaksioneve zinxhirore ka aditivë në sistemin reagues të gazeve inerte. Aditivët inertë rrisin numrin e goditjeve me grimca aktive, rrisin gjasat e thyerjes së zinxhirit dhe, në përputhje me rrethanat, pengojnë reagimin e përgjithshëm.
Ndalimi më efektiv i reaksioneve zinxhirore arrihet me futjen e shtesave reaktive - frenues në përzierjen reaguese. Frenuesit ndërveprojnë me qendrat aktive, duke udhëhequr reagimin, duke thyer zinxhirin. Kinetika e reaksionit në përzierjen e frenuar përcaktohet nga kushtet e konkurrencës ndërmjet inhibitorit dhe komponentëve kryesorë të reagimit kur ndërveprojnë me qendrat aktive. Me efikasitetin e lartë të inhibitorit dhe shkallën e moderuar të gjenerimit të qendrave të reja aktive, aditivët tashmë të vegjël të inhibitorit mund të shtypin plotësisht rrjedhën e reaksionit zinxhir.
Proceset e ndalimit janë të një rëndësie të madhe në praktikën e sigurisë së zjarrit dhe shpërthimit. Përdorimi i frenuesve ju lejon që të ndikoni në mënyrë efektive në proceset e djegies.
2.2. Proceset kimike gjatë djegies së hidrogjenit
Ndërveprimi i molekulës së hidrogjenit me një molekulë oksigjeni vazhdon në një mënyrë komplekse përmes një sërë fazash të njëpasnjëshme. Tani është vendosur në mënyrë të vendosur se djegia e hidrogjenit ndodh përmes një mekanizmi zinxhir, me grimca që luajnë rolin e qendrave aktive. Sekuenca dhe rëndësia e reaksioneve elementare gjatë djegies së hidrogjenit janë përshkruar në hollësi të hollësishme për kushte të ndryshme për shfaqjen dhe zhvillimin e flakëve të hidrogjenit.
Analiza më e hollësishme e procesit të djegies së hidrogjenit në mënyrën e vetëshpalljes duke përdorur metoda eksperimentale dhe kompjuterike u krye nga Profesor A. N. Baratov. Ai propozoi skemën e mëposhtme të procesit, duke përfshirë katërmbëdhjetë reaksione themelore elementare:
Korolchenko A.Ya. Proceset e djegies dhe shpërthimit
Origjina e qendrave aktive ndodh nëpërmjet reagimit
![]()
Vazhdimi i zinxhirit të reagimeve
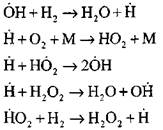
Zinxhirët e degëzimit
 |
qark i hapur
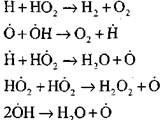 |
Përqendrimi i atomet e hidrogjenit në fazën fillestare të procesit të vetë-lindjes është një pjesë e parëndësishme e përmbajtjes fillestare të hidrogjenit. Me zhvillimin e një reaksioni zinxhir, shkalla e konvertimit të hidrogjenit molekulare bëhet aq e lartë sa që konsumohet në qindra sekonda.
2.3. Reaksionet kimike kur djegin monoksidin e karbonit
Ndërveprimi i monoksidit të karbonit me oksigjenin është një reagim i madh për proceset e djegies. Rruga e këtij reagimi gjatë
__________________________ Kapitulli 2. Procesi kimiks në djegie
shumë raste përcaktojnë ligjet e djegies së substancave që përmbajnë karbon. Reagimi karakterizohet nga një mekanizëm i zinxhirit të degëzuar. Ajo ka një numër karakteristikash.
Për një kohë të gjatë ka pasur një besim se një përzierje tërësisht e thatë e CO dhe 0 2 nuk mund të ndez dhe të digjen. Sidoqoftë, eksperimente të përcaktuara me kujdes në të cilat monitorimi i mungesës së ujit duke përdorur një spektrograf masiv tregoi se ndezja është gjithashtu e mundur për një përzierje të thatë. Duhet të theksohet se prania e CO + 0 2 avuj uji ose hidrogjeni në sistem aktivizon procesin e ndezjes dhe djegie duke rritur numrin e qendrave të mundshme aktive. Efekti përshpejtues i ujit është veçanërisht i dukshëm në përqëndrime të ulëta.
Djegia e monoksidit të karbonit në prani të avullit të ujit ose shtesave të vogla të hidrogjenit ndodh me pjesëmarrjen e proceseve elementare në vijim:

Radikalët, H0 2, të formuar nga reagimi (VI), mund të vazhdojnë zinxhirin (reaksioni VIII) ose të çojnë në thyerjen e tij nga reaksioni (IX-XII).
Për të vlerësuar kushtet për kalimin e oksidimit të ngadaltë të CO në një shpërthim zinxhiri, le të vlerësojmë probabilitetin e prishjes së një zinxhiri nëpërmjet radikal H0 2; këtu marrim parasysh se roli i reagimeve (X) dhe (XI) në përfundimin e zinxhirit do të jetë i parëndësishëm në aspektin e
krahasuar me reagimin (IX), meqenëse konstantet e normës së proceseve (IX-XI) në temperaturat e rendit prej 1000 K janë afër njëri-tjetrit, por përqendrimi i radikalëve është shumë më i ulët se përqendrimi i atomeve të hidrogjenit, meqë radikalët kanë një aktivitet më të lartë kimik. Prandaj, probabiliteti i një qark të hapur nëpërmjet radikal H0 2 mund të shkruhet në formën:
Në një temperaturë prej 1000K
Prandaj, me kusht që
![]()
![]()
efekt të madhësisë
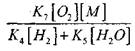
në zgjidhjen e ekuacionit (2.7) do të jetë i dobët.
Kapitulli 2. Proceset kimike gjatë djegies
Në rastin e ![]() ose
ose ![]() (çfarë është vërejtur në
(çfarë është vërejtur në
flaka e vërtetë ME), ekuacioni (2.7) konvertohet në formën:
![]() (2.8)
(2.8)
Kështu, gjendja e djegies së monoksidit të karbonit në ajër është përcaktuar kryesisht nga prania dhe modelet e djegies së hidrogjenit. Oksidimi i CO nga reaksioni (I) varet nga përqendrimi i radikalëve OH të formuar në reagimet që përfshijnë hidrogjenin.
Veçori e reaksionit të djegies së monoksidit të karbonit qëndron në ndalimin e saj të shpejtë kur aditivët e vegjël futen në sistemin reaktiv të substancave me afinitet të lartë për atomet e hidrogjenit. Substancat e tilla që frenojnë djegien e CO janë halidet dhe halo-derivatet e hidrokarbureve. Efekti i tyre frenues për shkak të ndërprerjes së zinxhirëve të reagimit kur bashkëveprojnë me atomet e hidrogjenit nga reagimi
2.4. Djegia e hidrokarbureve
Një ekzaminim i proceseve të djegies së hidrogjenit dhe monoksidit të karbonit tregon kompleksitetin e mekanizmit të reagimit të djegies. Në rastin e H2 dhe CO, reagimi vazhdon si një zinxhir me pjesëmarrjen e shumë fazave elementare dhe produkteve të ndërmjetme. Prandaj, është e natyrshme të pritet që mekanizmi i reaksioneve të djegies të substancave më komplekse - hidrokarburet - është edhe më kompleks dhe efektet që shoqërojnë proceset e ndezjes dhe djegie të këtyre komponimeve janë më të ndryshme.
Aktualisht informacionet në dispozicion mbi natyrën e ngritjeve kimike të hidrokarbureve në procesin e djegies së tyre na lejojnë të shpjegojmë efektet e vrojtuara me disa përafrime.
U konstatua se në flakët e hidrokarbureve, së bashku me grimcat aktive tashmë të njohura, ekziston një numër i madh i produkteve të ndërmjetme të një strukture më komplekse. Në disa raste, ato bëhen burime të shfaqjes së zinxhirëve të rinj. Roli kryesor në proceset e ndezjes dhe djegia e hidrokarbureve luhet nga llojet e mëposhtme të përbërjeve të ndërmjetme:
Korolchenko A.Ya. Proceset e djegies dhe shpërthimit
1. Radikalët e hidrokarbureve, që është një molekulë e
levodoroda, e cila hoqi një ose më shumë atome hidrogjen. këto
mbetjet quhen alkil (CH3-metil; C2H5-etil; C3H7-propil dhe
etj). Për shkak të reagimit të saj të lartë, alkile të lira
nuk ekzistojnë për një kohë të gjatë. I pranishëm në flakë si ndërmjetëse
Produktet qeveritare. Kur bashkëveprojmë me molekulat e tjera sillen
si një grup strukturor i pavarur. Hidrokarbureve Radikale
zakonisht përfaqësuar nga shkronja R.
2. Peroksidet - komponimet e formulës së përgjithshme R-00-R ".
3. Aldehidet - komponimet e tipit
![]()
Aldehidet më të thjeshta janë formic (formaldehid) dhe acetik (acetaldehid) ![]() . Këto substanca janë të gjitha
. Këto substanca janë të gjitha
janë të pranishme në produktet e djegies së paplotë të hidrokarbureve.
Formimi i zinxhirit gjatë djegies së hidrokarbureve mund të jetë çdo reaksion në të cilin formohen radikalet hidrokarbur. Kjo mund të jetë një reagim dekompozimi i një molekule ethane me formimin e dy grupeve të lira metil:
![]()
ose reagimi i një hidrokarboni me oksigjen:
![]()
Vazhdimi i zinxhirëve ndodh si rezultat i reagimeve të formimit peroksid ose hidroperoksid:
![]()
Zinxhirët e degëzimit kryhen me dekompozimin e hidroperoksidit:
Kapitulli 2. Proceset kimike gjatë djegies
Sekuenca e dhënë e reaksioneve çon në një rritje graduale të përqendrimit të peroksideve në sistemin reagues.
Njëkohësisht me akumulimin e peroksideve, radikalëve dhe fillimit
ka reagime paralele:

Këto reagime janë ekzotermike; kur ata rrjedhin një sasi të madhe të ngrohjes.
Me një rritje në temperaturën e përzierjes së reaksionit, roli i qendrave aktive kalon nga një produkt i ndërmjetëm në tjetrin në rendin e mëposhtëm: hidroperoksidet alkil, hidroperoksidet acil, formaldehidet.
Studimet eksperimentale të ndryshimeve në përbërjen e përzierjes së reagimit me kalimin e kohës në rajonin e temperaturës së lartë (600-800 ° C) tregojnë se procesi i transformimit të hidrokarbureve fillestare në produktet finale të djegies ndahet në dy faza: i pari, që ndodh në një shkallë shumë të lartë, oksidizon hidrokarburet në CO. Në fazën e dytë, të ngadaltë, CO është oksiduar. Një konkluzion shumë i rëndësishëm vijon: shumë nga ligjet e djegies së hidrokarbureve mund të shpjegohet me karakteristikat e djegies së monoksidit të karbonit.
2.5. Djegia e karbonit
Djegia e karbonit vazhdon sipas mekanizmit të një procesi heterogjen, specifikimi i të cilit qëndron në faktin se faza kimike nuk mund të konsiderohet veç e veç nga procesi i transferimit të një oksidanti të gaztë (oksigjen i ajrit) nga hapësira përreth deri në sipërfaqen e një ngurtësie të djegur. Shkalla e djegies varet nga të dy vetitë kimike të karbonit dhe nga karakteristikat që përcaktojnë procesin e furnizimit të oksigjenit me sipërfaqen e karburantit. Furnizimi me oksigjen në zonën e djegies kryhet me përhapje dhe për këtë arsye
Korolchenko A.Ya. Proceset e djegies dhe shpërthimit
varet nga shumë faktorë: forma dhe madhësia e trupit të djegies, lëvizja e mesme e gaztë, koeficientët e difuzionit të oksigjenit dhe produktet e reagimit si në hapësirën mbi sipërfaqen e karburantit, ashtu edhe në çara dhe poret që gjenden në qymyr dhe koks në sasi të konsiderueshme.
Për të ilustruar karakteristikat e djegies heterogjene të karbonit, ne e konsiderojmë sjelljen e një pjese të veçantë të thëngjillit të vendosur në një furre të nxehtë në një temperaturë prej 900 ° C. Në momentin fillestar, djegia e qymyrit do të ndodhë në kurriz të oksigjenit që ndodhet afër sipërfaqes së saj. Pasi të përdoret, formohet një shtresë e produkteve të djegies rreth sipërfaqes së nxehtë. Shkalla e djegies do të ulet dhe procesi mund të pushojë nëse nuk ka oksigjen që vjen nga zona më të largëta të hapësirës së gazit.
Ky rrjedhë ndodh përmes difuzionit dhe shkalla e djegies do të përcaktohet nga fluksi i difuzionit. Intensiteti i difuzionit në masë të madhe varet nga intensiteti dhe natyra e lëvizjes së mesme të gazit pranë sipërfaqes së djegies. Shkalla e reagimit kimik është përcaktuar kryesisht nga temperatura. Reagimet heterogjene, si dhe homogjene, respektojnë ligjin Arreon.
Në temperatura të larta, reagimi i oksidimit të karbonit vazhdon shumë shpejt dhe shpejtësia totale e procesit do të kufizohet nga difuzioni i oksigjenit në sipërfaqe.
Kështu, procesi i djegies së karbonit përbëhet nga dy procese të natyrës së ndryshme: procesi i transportimit të oksigjenit të ajrit nga hapësira e gazit në vendin e konsumit të tij dhe procesi i ndërveprimit të tij kimik me sipërfaqen e karbonit të ngurtë. Të dyja këto procese janë të ndërlidhura, por secili ka ligjet e veta. Më e rëndësishmja nga këto procese është procesi i konsumit të oksigjenit, i cili karakterizohet nga një sërë reagimesh kimike.
Mekanizmi i reagimit kompleks të kombinimit të oksigjenit me karbon përbëhet nga formimi i njëkohshëm i dy oksideve të CO dhe CO2 nëpërmjet një kompleksi fiziko-kimik të ndërmjetëm të tipit C X 0 Y, i cili pastaj ndahet në CO dhe. Raporti midis këtyre oksideve varet nga kushtet e djegies. Prandaj, ekuacioni për reagimin e karbonit të djegur mund të shkruhet si më poshtë:
Kapitulli 2. Proceset kimike gjatë djegies
Pastaj një reagim homogjen i ndezjes së monoksidit të karbonit vazhdon:
mekanizmi i të cilit diskutohet në seksionin 2.3.
Ky reagim mund të ndodhë pranë sipërfaqes së karbonit, kështudhe brenda masës së qymyrit, në poret dhe çarje të saj.
Një tjetër reagim është një reagim heterogjen midis karbonit të nxehtë dhe dioksidit të karbonit:
![]()
Rrjedh me një shpejtësi të dukshme në vende ku mungon oksigjeni, por ku temperatura e karbonit është mjaft e lartë.
Kombinimi i reagimeve të përshkruara përcakton përbërjen e produkteve të djegies së karbonit.
EMERGJENTJA E PROCESIT TË FUZUAR
| D |
ujitja në përzierjet e ndezshme mund të ndodhë si pasojë e vetë ndezjes së tyre, ndezjes nga një burim i jashtëm ose djegie spontane. Nëse proceset e vetë-ndezjes dhe ndezjes janë karakteristike për substancat që janë në gjendje të gaztë, të lëngët ose të ngurtë, atëherë djegia spontane është karakteristikë e materialeve të ngurta (sidomos ato të ndara në formë të imët) ose lëngjeve me valë të lartë të shpërndarë në materiale me sipërfaqe të zhvilluar.
3.1. Vetë-ndezjen. Teoria stacionare
Një zjarr është një djegie e pakontrolluar që zhvillohet në kohë dhe hapësirë, e rrezikshme për njerëzit dhe duke shkaktuar dëme materiale.
Rreziqet nga zjarri për njerëzit janë zjarri i hapur, ndezja, ethet, produktet toksike të djegies, tymi, oksigjeni i reduktuar, kolapsi i ndërtesave ose instalimeve.
Djegija është një reagim fiziko-kimik i shpejtë, i shoqëruar nga lirimi i nxehtësisë dhe tymit, shfaqja e një flakë ose thithja e zjarrit. Nën kushte normale, djegia është procesi i oksidimit ose i kombinimit të një substance të djegshme me oksigjen atmosferik. Megjithatë, disa substanca (për shembull, acetileni i ngjeshur, klorur azoti, ozoni) mund të shpërthejnë pa oksigjen për të formuar nxehtësi dhe flakë. Rrjedhimisht, djegia mund të rezultojë nga reagimet jo vetëm të përbërjes, por edhe të dekompozimit. Gjithashtu dihet se hidrogjeni dhe shumë metale mund të digjen në atmosferën e klorit, bakrit në avujt e squfurit, magnezit në dioksid karboni etj.
Djegia më e rrezikshme që ndodh gjatë oksidimit të një substance të djegshme me oksigjen në ajër. Në të njëjtën kohë, është e nevojshme që të ketë një burim të ndezjes i aftë për të furnizuar sasinë e kërkuar të energjisë në sistemin e karburantit. Burimet më të zakonshme të ndezjes janë: ndezjet që shfaqen kur keqbërjet e pajisjeve elektrike, goditjet e trupave metalikë, saldimi, punimet e falsifikimit; nxehtësia e krijuar nga fërkimi; pajisjet teknologjike të ngrohjes; aparatet e zjarrit; nxehtësia e compression adiabatic; shkarkimi i shkëndijë i elektricitetit statik; mbinxehja e kontakteve elektrike; reagimet kimike që vazhdojnë me lëshimin e nxehtësisë.
Temperatura e ngrohjes e këtyre burimeve është e ndryshme. Pra, shkëndija që ndodh kur një trup metalik është goditur mund të ketë një temperaturë deri në 1900 ° C, flaka e një ndeshje është rreth. 800 ° C, daulle kryesore e transportuesit të rripit gjatë rrëshqitjes është deri në 600 ° C, dhe në nxehtësinë e shkarkimit elektrik temperatura arrin 10.000 ° C, me reaksione kimike pothuajse të menjëhershme.
Djegia mund të jetë e plotë dhe e paplotë. Me djegie të plotë, që ndodhin me një oksigjen të tepërt, produktet e reaksionit janë dioksidi i karbonit, uji, azoti, dioksidi i squfurit. Djegja e paplotësuar ndodh me një mungesë oksigjeni, produktet e djegies në këtë rast janë lëndë toksike dhe të djegshme - monoksidi i karbonit, alkoolet, ketonet, aldehidet etj. Një sasi e caktuar e ajrit është e nevojshme për djegien e plotë të lëndës së djegshme: 1 kg dru - 4.18, , 8, propan - 23,8 m3.
Procesi i djegies mund të imagjinohet si më poshtë. Një mjedis i ftohtë i ftohtë me futjen e impulsit të nxehtësisë nxehet, ka një oksidim intensiv të mesme të djegshme me oksigjen dhe lirimin e nxehtësisë shtesë. Kjo, nga ana tjetër, çon në ngrohjen e shtresës ngjitur të materialit të djegshëm, në të cilin ndodh edhe një reagim intensiv kimik. Me një djegje të tillë të shtresës për shtresë të një substance të djegshme, zona e djegies lëviz; Shpejtësia e kësaj lëvizje përcakton intensitetin e procesit të djegies dhe është karakteristika e tij më e rëndësishme. Procesi i shtresës për shtresë për ngrohje, oksidim dhe djegie vazhdon derisa vëllimi i tërë i materialit të djegshëm është i rraskapitur.
Zona e ngushtë në të cilën substanca është e nxehtë dhe reagimi kimik ndodh quhet front flaka.
Sistemet e djegshme mund të jenë kimikisht homogjene dhe heterogjene. Sistemet kimikisht homogjene janë përzierjet e gazeve, avujve ose pluhurave të djegshme me ajër, në të cilat materia të ndezshme dhe ajri janë të përziera në mënyrë uniforme. Djegia e sistemeve të tilla quhet homogjene. Në sistemet kimikisht inhomogjene, lënda e djegshme dhe ajri nuk janë të përziera dhe kanë një ndërfaqe. Këto janë shpesh materiale të forta të djegshme dhe djegia e tyre quhet heterogjene.
Koha totale e djegies së përzierjes së djegshme Tg është shuma e kohës së nevojshme për kontaktin ndërmjet substancës së djegshme dhe oksigjenit τ к që ndodh, dhe kohës gjatë së cilës ndodh vetë kimia, reaksioni i oksidimit τ x
Varësisht nga raporti i këtyre dy termave, difuzioni dhe djegja kinetike dallohen. Kur djegen substanca të ngurta të djegshme, koha e nevojshme për depërtimin e oksigjenit (shpërndarë) në sipërfaqen e substancës është shumë më e gjatë se koha e reagimit kimik, prandaj shkalla totale e djegies përcaktohet plotësisht nga shkalla e përhapjes së oksigjenit tek substanca e djegshme. Djegia e këtyre substancave më së shpeshti gjendet në zjarr dhe quhet difuzive. Djegia, shkalla e së cilës përcaktohet nga shkalla e reagimit kimik, quhet kinetik. Ky lloj i djegies është karakteristik i sistemeve homogjene të djegshme.
Dalloni temperaturën kalorimetrike, teorike dhe aktuale të djegies.
Temperatura kalorimetrike e djegies i referohet temperaturës në të cilën produktet e djegies së plotë janë të nxehtë, nëse të gjitha nxehtësitë e lëshuara janë shpenzuar për ngrohjen e tyre, sasia e ajrit është teorikisht e nevojshme, substancat janë djegur plotësisht dhe temperatura fillestare është 0 ° С. Humbjet e nxehtësisë supozohet të jenë zero. Nëse temperatura fillestare e karburantit dhe ajrit është 0 ° C, atëherë temperatura kalorimetrike e djegies
![]()
ku Qn është vlera neto kalorifike e substancës së djegshme, kcal / kg; V është vëllimi i produkteve të djegies, m3 / kg; c është kapaciteti mesatar i ngrohjes volumetrike të produkteve të djegies, kcal / m3 · deg.
Rrjedhimisht, temperatura e djegies kalorimetrike varet vetëm nga vetitë e substancës së djegshme dhe nuk varet nga sasia e saj. Temperatura teorike e djegies merr parasysh humbjen e nxehtësisë gjatë djegies për t'u shkëputur. Temperatura e djegies kalorimetrike është më e lartë për një substancë të djegshme dhe përdoret për vlerësim cilësor. Në të vërtetë, kur digjen, gjithmonë ka humbje të nxehtësisë për shkak të rrezatimit, ngrohjes së ajrit të tepërt dhe mjedisit.
Temperatura aktuale e djegies është temperatura e zjarrit. Dalloni temperaturën e zjarrit të brendshëm dhe të jashtëm. Temperatura e zjarrit të jashtëm është temperatura e flakës, dhe temperatura e brendshme është temperatura e tymit në dhomë. Temperaturat aktuale në zhvillim në rast të zjarrit për shkak të humbjes së nxehtësisë në mjedis, ngrohjes së produkteve të djegies dhe strukturave
gjithmonë më pak se teorik prej 30 ... 50%. Për shembull, temperatura e djegie teorike e benzinës është 1730 ° C dhe temperatura aktuale është 1400 ° C.
Një përzierje e avujve dhe gazrave të djegshëm me një agjent oksidues mund të digjet vetëm me një përmbajtje të caktuar të karburantit në të.
Përqendrimi më i ulët i gazit të djegshëm në të cilin djegia është tashmë e mundur quhet kufiri i përqendrimit më të ulët të ndezjes (LEL). Përqendrimi më i lartë në të cilin djegja është ende e mundshme quhet kufiri i sipërm i koncentrimit të ndezjes (AIPW). Rajoni i përqendrimit që qëndron brenda këtyre kufijve quhet rajoni i ndezjes. Ignition është një zjarr (fillimi i djegies), i shoqëruar nga shfaqja e një flakë. Kjo është një djegie e vazhdueshme e gjatë, e cila nuk ndalet edhe pas largimit të burimit të ndezjes. Vlerat e kufijve të poshtëm dhe të sipërm të ndezjes varen nga vetitë e gazit, avullit dhe pluhurit të përzierjeve të ajrit, përmbajtja e përbërësve inerte në përzierjen e djegshme. Shtimi i gazrave inerte në përzierjen e djegshme ngushton zonën e ndezjes dhe përfundimisht e bën atë të padjegshëm. Zvogëlojnë ndjeshëm kufijtë e ndezjes, disa papastërti që ngadalësojnë reagimin e djegies. Më aktive nga këto janë hidrokarburet e halogjenizuara. Të dy pronat e shënuara përdoren për të ndaluar djegien. Ulja e presionit të përzierjes nën trysninë atmosferike gjithashtu ngushton zonën e ndezjes dhe në një presion të caktuar përzierja bëhet e padjegshme. Rritja e presionit të përzierjes së djegshme zgjeron zonën e ndezjes, por, si rregull, pak. Rritja e temperaturës së përzierjes së djegshme zgjeron zonën e ndezjes. Përqendrimi i ndezjes ndikohet edhe nga fuqia e burimit të ndezjes.
Nuk ka vetëm koncentrim, por edhe kufijtë e temperaturës së ndezjes.
Kufijtë e temperaturës për ndezjen e avujve në ajër janë ato temperature të një substance të djegshme në të cilën vaporët e saj të ngopur formojnë përqendrime që korrespondojnë me kufirin e përqëndrimit të ulët ose të sipërm të ndezjes. Temperatura e ndezjes është temperatura më e ulët në të cilën një substancë ndez ose fillon të qetësohet dhe vazhdon të digjet ose të digjet pas heqjes së burimit të ndezjes. Temperatura e ndezjes karakterizon aftësinë e një substance të vetë-djegies. Nëse mungesa e temperaturës së ndezjes së një substance, atëherë referohet si djegia e ngadaltë ose jo e ndezshme.
Përshpejtimi i reaksionit të oksidimit nën veprimin e temperaturës çon në vetë-ndezjen. Ndryshe nga procesi i ndezjes, në të cilin vetëm një pjesë e kufizuar e vëllimit - sipërfaqja - ndez, vetë-ndezja ndodh në vëllimin e tërë të substancës. Temperatura e vetë-ndezjes kuptohet si temperatura më e ulët, në të cilën substanca duhet të nxehet, në mënyrë që ajo të ndizet si pasojë e auto-oksidimit të mëtejshëm. Vetëçlirimi është i mundur vetëm nëse sasia e nxehtësisë e lëshuar gjatë procesit të oksidimit tejkalon lirimin e nxehtësisë në mjedis.
Temperatura e ndezjes automatike nuk është konstante për një substancë, pasi ajo kryesisht varet nga kushtet e përcaktimit të saj. Për marrjen e të dhënave krahasuese, aparatura e provës dhe metoda për përcaktimin e temperaturës së ndezjes së gazeve dhe avujve janë të standardizuara (GOST 13920-68). Temperatura më e ulët e përcaktuar me metodën standarde, në të cilën përzierja e gazrave dhe avujve me ajër duhet të nxehet në mënyrë uniforme në mënyrë që ajo të ndizet pa futur një burim të jashtëm të ndezjes në të, quhet temperatura automatike e ndezjes automatike.
Një lloj i ndezjes spontane është djegia spontane, dmth. Djegia si pasojë e vetë-ngrohjes pa ndikimin e burimit të ndezjes. Dallimi midis ndezjes spontane dhe djegies spontane është në madhësinë e temperaturës. Djegija spontane ndodh në temperaturën e ambientit, dhe për vetë-ndezjen është e nevojshme të nxehet substanca nga jashtë.

 Marrja e shenjave të sporteleve të furnizimit me ujë të nxehtë dhe të ftohtë
Marrja e shenjave të sporteleve të furnizimit me ujë të nxehtë dhe të ftohtë Llogaritja e zonës së kanaleve të ajrit me forma dhe pajisje të ndryshme
Llogaritja e zonës së kanaleve të ajrit me forma dhe pajisje të ndryshme Kimi i proceseve të djegies. Energji shpërthyese
Kimi i proceseve të djegies. Energji shpërthyese Çfarë do të ndodhë nëse nuk i transmetoni leximet e njehsorëve
Çfarë do të ndodhë nëse nuk i transmetoni leximet e njehsorëve