Burning se imenuje. Kemični procesi med izgorevanjem
Nekaj osnovnih definicij
Število atomov in molekul je primerno izraženo v smislu snovi prav tako število molov snovi. En mol snovi ustreza 6.023 23 10 23 delcem (atomom in molekulam). Število N A = 6,023 23 10 23 mol -1 se imenuje Avogadro številka. Molska frakcija x ikomponento i je razmerje števila molov n i komponento i na skupno število molov n =. n i mešanice ( x i = n i / n).
Masa m je temeljna lastnost snovi (merska enota v sistemu SI je kilogram). Masni delež Wi je razmerje mase m i komponento i do skupne mase mešanice m = ∑ m i (Wi = m i / m).
Molekulska masa (ali molekulska masa) M i(g / mol) komponento I - masa enega mola te komponente. Za atomski ogljik, molekularni vodik, kisik in metan imamo torej: M c = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. Povprečna molska masa zmesi M (g / mol) se lahko izrazi kot molarne dele sestavin (M = x i M i).
Določanje procesov zgorevanja
Burning - To je zapleten fizikalno-kemijski proces, pri katerem vnetljive snovi in materiali pod vplivom visokih temperatur vstopajo v kemično interakcijo z oksidacijskim sredstvom (kisikom v zraku), ki se spreminjajo v produkte zgorevanja, ki jih spremlja intenzivna emisija toplote in svetlobe.
Pogoji, potrebni za pojav procesa zgorevanja: \\ t
Prisotnost gorljive snovi (GV);
Prisotnost oksidacijskega sredstva (O.) - kisika v zraku;
Prisotnost vira vžiga (I.Z.).
Gorljivi material je treba segreti na določeno temperaturo, pri kateri se začne proces oksidacije;
Za segrevanje gorljive snovi do določene temperature je potrebna določena moč vira vžiga;
Za vzdrževanje procesa zgorevanja so potrebne določene koncentracije goriva in oksidanta.
Najpomembnejši procesi zgorevanja so prenos toplote in snovi. Najpogostejša lastnost gorenja je pojav plamena in premikanje po vsej gorljivi mešanici s prenosom toplote ali razpršitvijo aktivnih delcev iz območja izgorevanja v svežo gorljivo mešanico.
Plamen - To je vidna manifestacija gorenja. Imenuje se tudi goreče območje. To je del prostora, kjer pride do pretvorbe gorljive zmesi v produkte popolnega in nepopolnega zgorevanja.
Glavni parametri procesa zgorevanja, ki povzročajo smrt in povzročajo materialno škodo, so:
Velika količina toplote;
Visoka temperatura;
Toksična sestava produktov izgorevanja.
Proces zgorevanja s stališča molekularne kinetične teorije plinov
Sl. 2.1. Delež aktivnih molekul, odvisno od temperature: T 2\u003e T 1
Pri segrevanju plina vnetljivo mešanico v njej povečuje odvečno energijo.
Razlika med povprečno energetsko ravnjo molekul v aktivnem stanju in povprečno stopnjo neaktivnega stanja se imenuje aktivacijska energija. To lahko predstavimo grafično (slika 2).

Sl. 2.2. Energetski diagram reakcijskega toka G.V. + O. ® PG: E akt - aktivacijska energija; Q xr - toplotni učinek reakcije zgorevanja
Energija, ki se sprosti zaradi interakcije "prvih" reagiranih molekul, se prenese na sosednje molekule. Navdušeni so, proces se ponavlja okoli reagiranih molekul z veliko frekvenco in intenzivnostjo. Začne se samozadosten, samozaposlitveni do celotne reakcijske zmesi (2H 2 + 2) proces kemične interakcije, ki ga spremlja tvorba vodnih molekul in sproščanje toplote v okolje ter luminiscenca, tj. nastane in širi proces gorenja.
Višja kot je numerična vrednost E-akta, težje je, da ta par komponent vstopi v kemično interakcijo. Zato je vrednost E-akta posredni pokazatelj stopnje požarne nevarnosti tega kemičnega sistema.
Vrste in načini zgorevanja
Zgorevanje lahko razvrstimo po naslednjih parametrih:
1. Glede na stanje mešanja gorljivih komponent:
a) kinetika - zgorevanje mešanih mešanic plinov ali hlapov z zrakom. Ker je mešanica goriva in oksidanta pripravljena za zgorevanje, dokler se ne vname, je skupna hitrost procesa zgorevanja odvisna samo od hitrosti kemične reakcije zgorevanja. Če pride do zgorevanja v zaprtem ali omejenem volumnu, lahko pride do eksplozije. Ker energija, ki se sprosti med zgorevanjem mešanice, nima časa, da bi se izločila preko tega volumna, se lahko s povečanjem tlaka strukture uničijo;
b) difuzija, difuzijsko zgorevanje se imenuje zgorevanje, ko nastane gorljivi medij (mešanica goriva in oksidanta) pred območjem zgorevanja ali v območju izgorevanja.
2. Glede na intenzivnost prevzema gorljivih sestavin v coni kemične reakcije: \\ t
a) laminarno, medtem ko komponente gorljive zmesi relativno mirno vstopijo v območje zgorevanja. V tem primeru bo numerična vrednost Reynoldsovega merila, ki je značilna za termodinamični režim, bistveno manjša od kritične (Re<2300).
b) turbulentno, pri čemer komponente gorljive zmesi vstopajo v območje zgorevanja pri visoki hitrosti. Reynoldsovo število je v tem primeru več kot 2300.
3. Glede na agregatno stanje sestavin gorljive zmesi: \\ t
a) homogeno and gorivo in oksidant sta v istem agregatnem stanju (plinasto);
b) heterogeno (večfazno) - gorivo in oksidant sta v različnih agregatnih stanjih.
4. O hitrosti širjenja območja kemijske reakcije zgorevanja:
a) deflagracija (počasna) porazdelitev območja kemijske reakcije (hitrost od 0,5 do 50 m / s);
b) detonacija (eksploziv), ko se območje kemične reakcije zgorevanja širi s hitrostjo udarnega vala (od več sto metrov na sekundo do nekaj kilometrov na sekundo).
Prostor, v katerem gorijo hlapi ali plini, se imenuje s plamenom .
Laminarni plameni so bili premešani. Pri laminarnih plamenih predhodno mešane zmesi se gorivo in oksidant premešata pred začetkom zgorevanja in je pretok laminarni.
Plamen predhodno mešane zmesi se imenuje stehiometrično če se gorivo (ogljikovodik) in oksidant (kisik - O 2) popolnoma zaužita, tvorita ogljikov dioksid (CO 2) in vodo (H 2 O). Če je presežek goriva, pravijo, da je mešanica bogata, in če je presežek oksidanta, pravijo, da je mešanica slaba.
Razmislite o najpreprostejših primerih:
1) 2H 2 + O 2 → 2H 2 O - stehiometrična zmes,
2) ZN 2 + О 2 → 2H 2 O + N 2 - bogata zmes (N 2 v prebitku), \\ t
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - suha zmes (O 2 v prebitku).
Vsak simbol v takšni enačbi kemijske reakcije ustreza enemu molu snovi. Tako prva od teh enačb pomeni, da dva mola H2 reagirata z enim molom O2, da tvorita dva mola H20.
Če je enačba kemijske reakcije napisana tako, da opisuje reakcijo samo enega mol goriva, potem se lahko molski delež goriva v stehiometrični zmesi zlahka določi iz razmerja.
x gora, stokh = 1 / ((1 + v)
Tukaj voznačuje število molov O 2 v reakcijski enačbi z tvorbo CO 2 in H 2 O. Primer je reakcija
H2 + 0.5O2 → H20, v = 0.5, xH2, stoh = 2/3
Če je oksidant zrak, je treba upoštevati, da suhi zrak vsebuje le 21% kisika, pa tudi 78% dušika in 1% plemenitih plinov. Tako je za zrak X N2 = 3,762 X 2. Od tukaj bodo molarne frakcije za stehiometrično mešanico z zrakom enake
x gora, stokh = 1 / (((1 + v 76 4.762), ![]() ,
,
kjer v kot prej pomeni število molov O 2 v reakcijski enačbi popolne pretvorbe enega mol goriva v CO 2 in H 2 O. Nekateri primeri vrednosti v in molarne frakcije goriva za stehiometrične mešanice goriva z zrakom so prikazane v tabeli 1.
Predmešane mešanice goriva in zraka (v tem primeru je treba reakcijski enačbi dodati ustrezno količino N 2, glej tabelo 1), za katero je značilno ekvivalentno razmerje:
λ = (x w / x gora) / (x w, stoch / x gora, stoh) = (w w / w gora) / (w w, stoch / w gora, stoch)
ali vzajemnost - ekvivalentno razmerje za gorivo F (F = 1 / λ). To formulo lahko pretvorimo, da lahko določimo velikost molarne frakcije zmesi po vrednosti F:
x gora = 1 / ((1+ (4,762) v) / F), x w = 1 - x gora,
X teža / 4,762, = 3,762
Primeri vrednosti v in molskih deležev goriva x gore, stoichi za stehiometrične mešanice goriva z zrakom
namakanje vedno spremljajo kemijske transformacije. Izgorevanje v zraku - interakcija gorljive snovi s kisikom. Vendar pa je treba upoštevati, da dušikovi oksidi, halogenidi in ozon lahko delujejo kot oksidanti v procesu zgorevanja. Znani procesi zgorevanja, ki se odvijajo ob sodelovanju samo enega vira proizvoda - spojin, ki se lahko hitro razgradijo. Primeri takih spojin so acetilen in hidrazin.
Kemični procesi, ki se pojavijo med izgorevanjem, so izredno kompleksni. Tudi za najpreprostejši primer - izgorevanje vodika v kisiku, katerega posplošena enačba ima obliko
2H 2 + 2 2 = 2H 2 0,
vzpostavljenih in preučenih je bilo več ducat elementarnih faz.
Mehanizmi kemijskih transformacij med zgorevanjem le nekaj snovi, kot so vodik, ogljikov monoksid, metan in etan, so bili do sedaj podrobno proučeni. To znanje se uporablja za napovedovanje pogojev vžiga in izgorevanja mnogih snovi.
2.1. Verižne reakcije
Za verižne reakcije, v nasprotju z običajnimi kemijskimi transformacijami, je značilno, da je v vsakem elementarnem aktu aktiven delček: atom z neparnim elektronom, prosti radikal ali ion. Pojav aktivnih delcev povzroči verigo transformacij vhodnih snovi v reakcijske produkte. Atomi, prosti radikali in ioni so bolj reaktivni kot valenčno zasičene molekule. Zato se kljub znatnim stroškom energije, ki so potrebni za prekinitev kemijskih vezi in nastajanju aktivnih delcev, razvoj verige reakcije pogosto izkaže za energetsko bolj koristen kot neposredna interakcija med molekulami.
Procesi zgorevanja se večinoma odvijajo skozi verižni mehanizem. Verižne reakcije - kompleksne reakcije, ki se odvijajo v več fazah, kar predstavlja:
Izvor verig (iniciacija), v katerem nastanejo aktivni delci;
Nadaljevanje verig, v katerih aktivni delci vstopajo v kemično interakcijo z izhodnimi snovmi, zaradi česar nastajajo novi aktivni delci;
Lomljenje verig, pri katerih pride do "smrti" aktivnih delcev z nastajanjem končnih reakcijskih produktov
Izvor verig lahko nastopi pod različnimi pogoji. Na primer, kot posledica disociacije molekul pod vplivom toplotne energije ali ionizirajočega sevanja v električni razelektritvi. Smrt aktivnih delcev nastopi, ko se rekombinirajo *, ko medsebojno delujejo prosti radikali (homogeni lom verige), ko aktivni delci medsebojno delujejo s trdnimi površinami (heterogeni razpad verige) ali kot posledica njihove reakcije z inhibitorji izgorevanja.
Obstajajo nerazvejane in razvejane verižne reakcije. V nerazvejanem za vsak aktivni delec, ki se porabi v reakcijah nadaljevanja verige, se pojavlja ena. Število nastalih molekul produkta na začetni aktivni delec se imenuje dolžina verige. Dolžina verig v reakcijah izgorevanja sega od stotisoč do več deset milijonov. Na hitrost nerazvejanih verižnih reakcij lahko vplivajo manjše primesi snovi, ki lahko učinkovito vplivajo na aktivne delce, kot so inhibitorji izgorevanja.
Nekatere snovi - iniciatorji - olajšajo nastajanje aktivnih delcev in s tem pospešijo nerazvejene verižne reakcije.
V razvejanih verižnih reakcijah na en aktivni delček, porabljen z nadaljevanjem verige, nastanejo dva ali več aktivnih delcev. Eden od njih nadaljuje s primarno verigo, drugi pa z novimi verigami, ki tvorijo vejo (slika 2.1).
"Rekombinacija je proces nastajanja nevtralnih atomov ali molekul iz nabitih delcev. Atomi in molekule, ki nastanejo med rekombinacijo, so lahko v zemeljskem ali vzbujenem stanju.
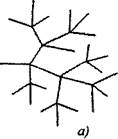
Sl. 2.1. Shematski prikaz reakcijskih verig:
a) razvejanost v vsaki povezavi verige
6) redke razvejanosti
Na primer med izgorevanjem vodika v reakciji uvajanja verige:
nastane aktivni atom. V reakciji nadaljevanja verige:

povečuje se število aktivnih atomov, ki so začetek novih verig.
Razvejane verižne reakcije lahko potekajo v stacionarnem načinu, v katerem je hitrost razvejanosti manjša od hitrosti smrti aktivnih delcev in v nestacionarnem, v katerem se smrt zgodi počasneje od razvejanja. V zadnjem primeru se hitrost verižne reakcije eksponentno poveča in je omejena le s porabo izhodnih materialov. Prehod iz stacionarnega v nestacionarni način se nenadoma pojavi z rahlo spremembo pogojev reakcije: temperature, tlaka ali koncentracije enega od reaktantov. Tako hitro pospeševanje se šteje kot samovžig reakcijske zmesi ali verižnega eksplozije.
Odkritje razvejanih verižnih reakcij je bilo zelo pomembno za oblikovanje teorije procesov zgorevanja. Dokazano je, da obstajata dve vrsti vžiga: toplotna in verižna. Vzorci v
Poglavje 2. Kemijski procesi pri gori
teorija verižnih procesov lahko učinkovito vpliva na razvoj in zatiranje procesov zgorevanja med požari.
Izvor verig.Proces nukleacije začetnih aktivnih središč ima pomembno vlogo pri razvoju nerazvejanih verižnih reakcij. Kompenzira izgubo aktivnih središč med reakcijami prekinitve verige. Ta mehanizem določa pogoje za nastanek stacionarnega režima v začetnem obdobju akumulacije aktivnih središč. Ob nizki stopnji začetka je to obdobje lahko pomembno.
Večina kemičnih reakcij v plamenih ima pomembno energijsko zalogo aktivnih središč. V teh pogojih je začetek aktivnih centrov povezan s premagovanjem pomembne energetske pregrade.
V tem primeru imajo pomembno vlogo dejavniki, ki zagotavljajo pomembno stopnjo pojavljanja aktivnih središč: kemično aktivni aditivi, sevanje, električni izpusti, radioaktivni razpadni produkti.
Med dejavniki, ki močno olajšujejo nastanek aktivnih središč, je treba omeniti heterogene reakcije. V molekulah gorljivih snovi, adsorbiranih na trdni površini, so medatomske vezi oslabljene in njihova prekinitev zahteva manj energije. V teh pogojih je stopnja nastajanja aktivnih središč bistveno višja kot v prostornini plina. Aktivacijska energija v heterogeni interakciji komponent gorljive zmesi je tudi nižja kot pri homogeni. Heterogena iniciacija aktivnih središč v pogojih dejanskih procesov zgorevanja je pomemben dejavnik pri pospešenem doseganju stacionarnega režima z nepovezanimi verižnimi procesi.
Nekatere značilnosti so značilne za nerazvejane verižne reakcije, ki se pojavljajo ob sodelovanju atomskih komponent. V odsotnosti nečistoč, ki medsebojno delujejo z aktivnimi središči brez regeneracije, postane prekinitev verige možna le, ko se atomi rekombinirajo s trojnimi trki in na površini.
Pri vsaki temperaturi so vse plinaste snovi delno disocirane. Nekatere molekule se razgradijo v atome. V tem primeru obstaja ravnotežje med procesi disociacije in združitvijo atomov v molekule. Stopnja disociacije je eksponentno odvisna od temperature.
Če v gorljivi mešanici ni nečistoč, ki bi raztrgale verige, ostane koncentracija atomskih komponent reakcije praktično nespremenjena. Atomi, ki so vstopili v reakcijo, se takoj regenerirajo v isti
Korolchenko A.Ya. Procesi zgorevanja in eksplozije
lichie. Začetna inicializacija kompenzira reagirane atome v enaki količini kot v nereaktivnem sistemu. Stacionarna reakcija ne vpliva na ta proces. Za ta način je značilno ravnovesje ene od komponent reakcije, ki se odlikuje z najmanj močno vezjo med atomi v molekuli. Koncentracija druge atomske komponente je v tem primeru kvazistacionarna, vendar bolj ravnotežna.
S homogeno iniciacijo zgorevalnih reakcij bo stacionarni režim vzpostavljen šele po določenem časovnem obdobju, saj disociacija zahteva veliko aktivacijsko energijo. V tem obdobju hitrost disociacije presega hitrost rekombinacije in se aktivni centri kopičijo v reakcijskem sistemu. Stopnje obeh procesov se primerjajo šele po povečanju koncentracije aktivnih središč v ravnotežje. To obdobje se imenuje indukcijsko obdobje.
Prisotnost trdne površine kot katalizatorja v reakcijskem območju ne spremeni stanja termodinamičnega ravnovesja. Katalizator enako vpliva na prednje in povratne reakcije. Aktivni centri ne izvirajo le na trdni površini, temveč se tudi raztrgajo. Vendar pa prisotnost katalizatorja pospešuje doseganje ravnotežnega disociacijskega stanja.
Če so v gorljivi zmesi prisotne aktivne snovi, ki lahko sodelujejo pri reakcijah razgradnje verige, zmanjšajo koncentracijo aktivnih središč. V tem primeru je motena ravnotežna disociacija ene od začetnih komponent, kar upočasni reakcijo in lahko privede do njene prekinitve.
Eksperimenti kažejo, da lahko koncentracija aktivnih središč v začetni fazi razvoja zgorevalnega procesa bistveno preseže ravnotežno koncentracijo aktivnih središč v začetni fazi razvoja procesa zgorevanja, ko se sproži verižna verižna reakcija.
Med razvejanimi verigami imajo pogoji začetne iniciacije pomemben vpliv na razvoj reakcije. Pri postopkih s počasnim gibanjem dodajanje delno odzivene zmesi na začetno skrajša indukcijsko obdobje in pospeši trenutek zgorevanja plamena.
Nadaljevanje verig.Značilna značilnost nerazvejanih verižnih reakcij je kvazistacionarnost koncentracije aktivnih središč. V odsotnosti odprtega kroga se tvorijo aktivni delci
Poglavje 2. Kemični procesi med zgorevanjem
enak znesek, v katerem so porabljeni. Novo se pojavi šele na začetku. Pri enakih stopnjah nastajanja aktivnih središč in prekinitve verige se vzpostavi konstantna koncentracija aktivnih središč in stacionarni reakcijski način. Hitrost reakcije se bo zmanjšala, ko bodo prvotne komponente porabljene.
V primeru razvejane verižne reakcije se koncentracija aktivnih središč v reakcijskem sistemu poveča ne glede na pogoje njihove začetne iniciacije. Izveden je samozapiralni reakcijski način, ki ima plazovit značaj. V tem primeru je za popolno transformacijo začetnih komponent v končne produkte reakcije zadostno eno začetno aktivno središče.
Kinetična enačba razvejane dragocene reakcije je naslednja. Spremembo koncentracij stabilnih zagonskih komponent v daljšem časovnem obdobju lahko zanemarimo v prvem približku in upoštevamo le hitrejše spremembe koncentracije aktivnih središč. str.Spremembe te hitrosti so določene s hitrostjo začetne iniciacije in razmerjem med stopnjami reakcij razvejanja in prekinitve verige. Začetna hitrost iniciacije ni odvisna od koncentracije aktivnih središč v sistemu. Procesi razvejanosti in loma so sorazmerni s koncentracijami aktivnih središč. V teh pogojih se celotna bilanca oblikovanja in porabe aktivnih središč določi s seštevkom stopenj procesov iniciacije, razvejanja in loma:
![]() (2.1)
(2.1)
kjer in so konstante hitrosti razvejanih in prelomnih reakcij. Označujemo, dobimo:
![]() (2.2)
(2.2)
Ko čas izvedene koncentracije aktivnih središč
je pozitiven. Hitrost reakcije se sčasoma poveča. Ta značilnost razvejanih verižnih reakcij je posledica množenja aktivnih središč v takih režimih, kadar je hitrost reakcije razvejanja večja od hitrosti reakcije prekinitve verige.
Korolchenko A.Ya. Procesi zgorevanja in eksplozije
Če pred začetkom reakcije sistem ni vseboval aktivnih centrov, t.j. nat= 0, n = 0 integracija enačbe (2.2) daje:
![]() (2.3)
(2.3)
Skupna hitrost reakcije CO je določena s hitrostjo procesa razvejanja. Končni produkti nastanejo samo med to reakcijo. Za vsak elementarni vejniški dogodek se tvorijo molekule končnega produkta. Sledi:
![]() (2.4)
(2.4)
Razvoj verižne reakcije v času se določi z razmerjem konstant hitrosti reakcij razvejitve in prekinitve verige, in ko je eksponent v enačbi (2.4) pozitiven in ponovno
dejanje je neomejeno pospešeno. V začetnem obdobju razvoja reakcije velja naslednje:
Ker je stopnja začetne iniciacije majhna, v začetnem obdobju ni opazne kemijske transformacije. Po določenem času postane vrednost bistveno večja od ene. Po tem se hitrost reakcije v skladu z enačbo (2.4) začne hitro povečevati in doseči zelo velike vrednosti, čeprav je bila prej praktično neopazna.
Prisotnost zakasnitve (indukcijskega obdobja) med razvojem verižne reakcije je posledica potrebe po akumulaciji določenega števila aktivnih središč v reakcijskem sistemu. Šele po tem kemijska transformacija postane opazna.
Velikost indukcijskega obdobja v verižnih reakcijah določa razmerja med stopnjami procesov razvejanja in prekinitve verige, ne hitrost začetne iniciacije. Stopnje reakcij razvejenosti in loma pa so posledica kemijskih lastnosti vsakega reaktorskega sistema, ki jih določajo odvisnosti od temperature in koncentracij izhodnih komponent. Posebnost verižnih reakcij za
je, da procesi razvejanja zahtevajo veliko energijo aktiviranja, medtem ko je temperaturni koeficient konstante hitrosti procesa loma blizu ničle. V reakcijah prekinitve verig vseh treh tipov: pri večinskih in heterogenih rekombinacijah, pri interakciji radikalov z aktivnimi nečistočami, so aktivacijske energije enake nič.
S povečanjem temperature, skupnim tlakom mešanice ali spremembo koncentracije reagirajočih komponent je možna sprememba konstant hitrosti razvejanja in loma, pri čemer se reakcija spremeni iz stacionarnega v nestacionarno. Posebnost tega procesa je v nenadnem prehodu iz enega načina v drugega, pri spreminjanju hitrosti reakcije iz zanemarljive vrednosti v neomejeno naraščajočo.
Pretok nekaterih verižnih reakcij spremlja nastanek vmesnih produktov, ki so sorazmerno stabilni, vendar z zmožnostjo ustvarjanja aktivnih središč. Takšne reakcije vključujejo, na primer, reakcije zgorevanja ogljikovodikov, kot vmesne produkte, v katerih nastanejo peroksidi in aldehidi. To vodi do razvejanosti verige. Vendar pa je zaradi relativne stabilnosti vmesnih produktov pospešek reakcije raztegnjen skozi čas. Takšne počasi razvejane verige se imenujejo degenerirane.
Verižne reakcije z običajnim radikalnim vejnim mehanizmom, praviloma zaradi visoke aktivnosti radikalov, potekajo zelo hitro. Nastali radikali bodisi sprožijo hitro pospešeno reakcijo bodisi rekombinirajo in zapustijo postopek.
Odprite krog Aktivni delci, tako kot katera koli plinska molekula, naredi reakcije naključnih gibov v reakcijskem sistemu in trči z drugimi molekulami. Hkrati obstaja določena verjetnost pri nekem trku interakcije z drugim aktivnim delcem ali molekulo in nastajanjem novega aktivnega delca, ki nadaljuje pot prejšnjega. Razvoj reakcijske verige je podoben Brownovem gibanju inertnih molekul, čeprav je prenos aktivnih središč spremljal kemična reakcija. Na poti razvoja verige izmenično aktivni centri dveh ali več vrst.
Korolchenko A.Ya. Procesi zgorevanja in eksplozije
Veriga reakcij se nadaljuje do trenutka, ko aktivni delci ne reagirajo brez regeneracije. V tem primeru pride do tako imenovanega odprtega kroga. Procesi loma imajo pomembno vlogo pri kinetiki verižnih reakcij. Obstajata dve vrsti reakcij, ki vodijo do smrti aktivnih centrov:
Homogena prekinitev (smrt v volumnu reakcijske zmesi);
Heterogeni lom (smrt na trdni površini) Homogeni lom verige je možen z enim od dveh procesov:
ko se radikali rekombinirajo ali ko različne kemično aktivne komponente medsebojno delujejo z aktivnimi središči brez regeneracije slednjih.
Heterogeni razpad verige se pojavi na delcih saj, ki nastanejo med zgorevanjem, ali na površini trdnih gorilnih materialov. Odprt tokokrog na trdni površini lahko štejemo za difuzijo aktivnih središč iz plinske mešanice na to površino, na kateri izginejo. Mehanizem rekombinacije na trdni površini je, da se aktivni delci, ki imajo povečano reaktivnost, sorbirajo * na površini. Radikali, ki se sorbirajo na sosednjih mestih, se medsebojno združujejo, saj za ta proces ni energetskih in prostorskih ovir. Molekule stabilnih spojin, ki nastanejo zaradi rekombinacije, niso več vključene v razvoj verižne reakcije.
Vendar pa ne vsak trk aktivnega delca s trdno površino vodi do njegove adsorpcije. Morda njen odsev od površine. Verjetnost adsorpcije aktivnega središča s trdno površino se imenuje namestitveni koeficient. Ta koeficient je značilnost kemične afinitete aktivnega delca in površine. V praktično pomembnih primerih se aktivni delci po odboju od stene ne oddaljujejo daleč od njega. Obstaja verjetnost novih trkov s steno do njegove namestitve. Zaradi tega procesa je pod določenimi pogoji hitrost reakcije praktično neodvisna od namestitvenega koeficienta. Postopek poteka tako, kot EU
* Sorpcija - absorpcija s trdnim telesom (ali tekočino) snovi v okolju. Vpojno telo se imenuje sorbent, ki se absorbira- sorbat. Razlikujemo absorpcijo celotne mase sorbenta (absorpcije) in površinske plasti (adsorpcijo). Sorpcija zaradi interakcije kemijske vrste med površino trdnega sorbenta in sorbata se imenuje kemosorpcija.
__________________________ Poglavje 2. Kemični procesi med zgorevanjem
če je pri vsakem trku prišlo do odprtega kroga. Koncentracija aktivnih središč na površini je enaka nič.
V odsotnosti aktivnih nečistoč v reakcijski zmesi lahko pride do preloma verig na trdnih površinah ali homogeno z rekombinacijo radikalov v razsutem stanju. V resničnih požarih se drugi način večinoma izvaja.
Določen vpliv na kinetiko verižnih reakcij imajo aditivi v reakcijskem sistemu inertnih plinov. Inertni aditivi povečajo število trkov z aktivnimi delci, povečajo verjetnost loma verige in s tem zavirajo celotno reakcijo.
Učinkovitejšo inhibicijo verižnih reakcij dosežemo z uvajanjem reaktivnih aditivov - inhibitorjev v reakcijsko zmes. Inhibitorji medsebojno delujejo z aktivnimi centri, ki vodijo reakcijo in razbijajo verigo. Kinetika reakcije v inhibirani zmesi je določena s pogoji konkurence med inhibitorjem in glavnimi komponentami reakcije pri interakciji z aktivnimi centri. Z visoko učinkovitostjo inhibitorja in zmerno hitrostjo nastajanja novih aktivnih središč lahko že majhni aditivi inhibitorja popolnoma zavrejo potek verižne reakcije.
Procesi zaviranja so zelo pomembni v praksi požarne in eksplozijske varnosti. Uporaba inhibitorjev omogoča učinkovito vplivanje na procese zgorevanja.
2.2. Kemijski procesi pri izgorevanju vodika
Interakcija molekule vodika z molekulami kisika poteka na kompleksen način skozi vrsto zaporednih faz. Zdaj je trdno ugotovljeno, da se zgorevanje vodika dogaja z verižnim mehanizmom, pri čemer delci igrajo vlogo aktivnih središč. Zaporedje in pomen elementarnih reakcij pri izgorevanju vodika so podrobno opisani za različne pogoje za nastanek in razvoj vodikovih plamenov.
Najbolj podrobno analizo procesa izgorevanja vodika v načinu samovžiga z eksperimentalnimi in računalniškimi metodami je opravil profesor A. N. Baratov. Predlagal je naslednjo shemo procesa, vključno s štirinajstimi osnovnimi osnovnimi reakcijami:
Korolchenko A.Ya. Procesi zgorevanja in eksplozije
Izvor aktivnih središč se pojavi z reakcijo
![]()
Nadaljevanje verige reakcij
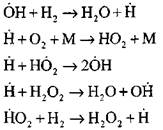
Razvejane verige
 |
odprt tokokrog
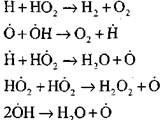 |
Koncentracija atomov vodika v začetni fazi postopka samovžiga je neznaten del začetne vsebnosti vodika. Z razvojem verižne reakcije hitrost pretvorbe molekularnega vodika postane tako visoka, da se porabi v stotinkah sekunde.
2.3. Kemične reakcije pri sežiganju ogljikovega monoksida
Interakcija ogljikovega monoksida s kisikom je glavna reakcija pri procesih zgorevanja. Med potekom te reakcije
__________________________ Poglavje 2. Kemijski process pri gorenju
v številnih primerih določa zakone izgorevanja snovi, ki vsebujejo ogljik. Reakcijo karakterizira mehanizem z razvejeno verigo. Ima številne funkcije.
Dolgo časa je obstajalo prepričanje, da se popolnoma suha mešanica CO in 0 2 ne more vžgati in sežgati. Vendar pa so skrbno določeni poskusi, v katerih je bila odsotnost vode nadzorovana z masnim spektrografom, pokazala, da je možen tudi vžig za suho mešanico. Treba je opozoriti, da prisotnost CO + 0 2 vodne pare ali vodika v sistemu aktivira proces vžiga in zgorevanja s povečanjem števila možnih aktivnih središč. Pospešitveni učinek vode je še posebej opazen pri nizkih koncentracijah.
Izgorevanje ogljikovega monoksida v prisotnosti vodne pare ali majhnih dodatkov vodika poteka ob sodelovanju naslednjih osnovnih procesov:

Radikali, H02, ki nastanejo z reakcijo (VI), lahko nadaljujejo verigo (reakcija VIII) ali povzročijo njeno razbitje z reakcijo (IX-XII).
Za oceno pogojev za prehod počasne oksidacije CO v verižno eksplozijo ocenimo verjetnost preboja verige skozi radikal H0 2; tu upoštevamo, da bo vloga reakcij (X) in (XI) v prenehanju verige neznatna glede na
v primerjavi z reakcijo (IX), saj sta konstanti hitrosti procesov (IX-XI) pri temperaturah okoli 1000 K blizu drug drugemu, vendar je koncentracija radikalov veliko nižja od koncentracije atomov vodika, saj imajo radikali večjo kemijsko aktivnost. Zato je verjetnost odprtega kroga skozi radikal H0 2 lahko zapisana v obliki:
Pri temperaturi 1000 K
Zato pod pogojem, da
![]()
![]()
učinek velikosti
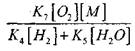
pri reševanju enačbe (2.7) bo šibka.
Poglavje 2. Kemični procesi med zgorevanjem
V primeru. \\ T ![]() ali
ali ![]() (kar opazimo v. \\ t
(kar opazimo v. \\ t
prave plamene S), enačba (2.7) se pretvori v obliko:
![]() (2.8)
(2.8)
Pogoj gorenja ogljikovega monoksida v zraku je torej v veliki meri odvisen od prisotnosti in vzorcev gorenja vodika. Oksidacija CO z reakcijo (I) je odvisna od koncentracije OH radikalov, ki nastanejo v reakcijah, ki vključujejo vodik.
Posebnost reakcije zgorevanja ogljikovega monoksida je v njeni hitri inhibiciji, ko se v reaktivni sistem snovi z visoko afiniteto za vodikove atome vnašajo majhni dodatki. Take snovi, ki zavirajo izgorevanje CO, so halogenidi in halo-derivati ogljikovodikov. Njihov inhibicijski učinek zaradi prekinitve reakcijskih verig pri interakciji z atomi vodika z reakcijo
2.4. Izgorevanje ogljikovodikov
Pregled procesov zgorevanja vodika in ogljikovega monoksida kaže kompleksnost mehanizma reakcije zgorevanja. V primeru H 2 in CO se reakcija odvija kot veriga z udeležbo številnih osnovnih faz in vmesnih produktov. Zato je naravno pričakovati, da je mehanizem zgorevalnih reakcij bolj kompleksnih snovi - ogljikovodikov - še bolj zapleten, učinki, ki spremljajo procese vžiga in zgorevanja teh spojin, pa so bolj raznoliki.
Trenutno razpoložljive informacije o naravi kemičnih povišanj ogljikovodikov v procesu njihovega zgorevanja nam omogočajo, da z opazovanimi približki razložimo opažene učinke.
Ugotovljeno je bilo, da v plamenih ogljikovodikov, skupaj z že znanimi aktivnimi delci, obstaja veliko število vmesnih produktov bolj kompleksne strukture. V nekaterih primerih postanejo viri nastanka novih verig. Glavno vlogo pri procesih vžiga in izgorevanja ogljikovodikov imajo naslednje vrste vmesnih spojin:
Korolchenko A.Ya. Procesi zgorevanja in eksplozije
1. Ogljikovodični radikali, ki so molekula
levodoroda, ki je odstranila enega ali več vodikovih atomov. To
ostanki se imenujejo alkil (CH3-metil; C2H5-etil; C3H7-propil in
itd.). Zaradi visoke reaktivnosti so prosti alkili
ne obstajajo dolgo časa. Prisotni v plamenih kot vmesni
izdelkov. Pri medsebojnem delovanju z drugimi molekulami se obnašajo
kot samostojna strukturna skupina. Radikali ogljikovodikov
ponavadi ga predstavlja črka R.
2. Peroksidi - spojine s splošno formulo R-00-R ".
3. Aldehidi - Vrsta spojin
![]()
Najenostavnejši aldehidi so mravljični (formaldehid) in ocetni (acetaldehid). ![]() . Vse te snovi so vse
. Vse te snovi so vse
so prisotni v proizvodih nepopolnega izgorevanja ogljikovodikov.
Oblikovanje verige med izgorevanjem ogljikovodikov je lahko katera koli reakcija, pri kateri se tvorijo ogljikovodični radikali. To je lahko reakcija razgradnje molekule etana z nastankom dveh prostih metilnih skupin:
![]()
ali reakcija ogljikovodika s kisikom: \\ t
![]()
Nadaljevanje verig nastane kot posledica reakcij tvorbe peroksid ali hidroperoksid:
![]()
Pri razpadu hidroperoksida se izvaja verižna veja:
Poglavje 2. Kemični procesi med zgorevanjem
Navedeno zaporedje reakcij vodi v postopno povečanje koncentracije peroksidnih spojin v reakcijskem sistemu.
Hkrati s kopičenjem peroksidov, radikalov in začetkom
obstajajo vzporedne reakcije:

Te reakcije so eksotermne; ko tečejo velike količine toplote.
S povečanjem temperature reakcijske zmesi vloga aktivnih središč prehaja iz enega vmesnega produkta v drugega v naslednjem vrstnem redu: alkil hidroperoksidi, acil hidroperoksidi, formaldehidi.
Eksperimentalne študije o spremembah v sestavi reakcijske zmesi skozi čas v visokotemperaturnem območju (600-800 ° C) kažejo, da se proces pretvorbe začetnih ogljikovodikov v končne produkte zgorevanja razdeli na dve stopnji: prva, ki se pojavi pri zelo visoki stopnji, oksidira ogljikovodike v CO. V drugi, počasni fazi se CO oksidira v. Sledi zelo pomemben zaključek: veliko zakonov zgorevanja ogljikovodikov je mogoče razložiti z značilnostmi zgorevanja ogljikovega monoksida.
2.5. Gorjenje ogljika
Sežig ogljika poteka po mehanizmu heterogenega procesa, katerega specifičnost je v tem, da kemijske faze ni mogoče obravnavati ločeno od procesa prenosa plinastega oksidanta (kisika zraka) iz okolice na površino goreče trdne snovi. Hitrost gorenja je odvisna od kemijskih lastnosti ogljika in lastnosti, ki določajo postopek dovajanja kisika na površino goriva. Dovod kisika v območje zgorevanja se izvaja z difuzijo in zato
Korolchenko A.Ya. Procesi zgorevanja in eksplozije
odvisna od številnih dejavnikov: oblike in velikosti gorečega telesa, gibanja plinastega medija, difuzijskih koeficientov kisika in reakcijskih produktov tako v prostoru nad gorivnim površjem kot v razpokah in pore v premogu in koksu v znatnih količinah.
Za ponazoritev značilnosti heterogenega sežiganja ogljika upoštevamo obnašanje ločenega premoga, ki ga postavimo v peč, segreto na temperaturo 900 ° C. V začetnem trenutku se bo zgorevanje premoga zgodilo na račun kisika, ki se nahaja blizu njegove površine. Po porabi se okoli segrete površine oblikuje plast produktov zgorevanja. Hitrost gorenja se bo zmanjšala, proces pa bi lahko prenehal, če ne bi prišlo do kisika iz bolj oddaljenih območij plinskega prostora.
Ta tok poteka skozi difuzijo, hitrost gorenja pa se določi z difuzijskim tokom. Intenzivnost difuzije je v veliki meri odvisna od intenzivnosti in narave gibanja plinskega medija v bližini goreče površine. Hitrost kemijske reakcije je odvisna predvsem od temperature. Heterogene reakcije, pa tudi homogene, se držijo Arreyusovega zakona.
Pri visokih temperaturah oksidacijska reakcija ogljika poteka zelo hitro, skupna hitrost procesa pa bo omejena z difuzijo kisika na površino.
Proces gorenja ogljika je tako sestavljen iz dveh procesov različne narave: procesa prenosa kisika zraka iz plinskega prostora do mesta njegove porabe in procesa njegove kemične interakcije s površino trdnega ogljika. Oba procesa sta med seboj povezana, vsak pa ima svoje zakone. Najpomembnejši od teh procesov je proces porabe kisika, za katerega so značilne različne kemijske reakcije.
Mehanizem kompleksne reakcije združevanja kisika z ogljikom je sestavljen iz istočasnega nastajanja dveh oksidov CO in C0 2 skozi vmesni fizikalno-kemijski kompleks tipa C X 0 Y, ki se nato razdeli na CO in. Razmerje med temi oksidi je odvisno od pogojev gorenja. V skladu s tem lahko enačbo za reakcijo gorenja ogljika zapišemo takole:
Poglavje 2. Kemični procesi med zgorevanjem
Nato poteka homogena reakcija gorenja ogljikovega monoksida:
mehanizem, o katerem je razpravljeno v oddelku 2.3.
Ta reakcija lahko poteka v bližini površine ogljika, takoin znotraj premogove mase, v njenih pore in razpokah.
Druga reakcija je heterogena reakcija med vročim ogljikom in ogljikovim dioksidom:
![]()
Na mestih, kjer primanjkuje kisika, teče z opazno hitrostjo, kjer pa je temperatura ogljika dovolj visoka.
Kombinacija opisanih reakcij določa sestavo produktov zgorevanja ogljika.
ZASNOVANJE PROCESOV IZPORABE. \\ T
| R |
namakanje v vnetljivih mešanicah je lahko posledica samovžiga, vžiga z zunanjim virom ali samovžiga. Če so procesi samovžiga in vžiga značilni za snovi, ki so v plinastem, tekočem ali trdnem stanju, je spontano izgorevanje značilno za trdne materiale (zlasti tiste v fino porazdeljenem stanju) ali tekočine z visokim vreliščem, razporejene na materialih z razvito površino.
3.1. Samovžig. Stacionarna teorija
Požar je nenadzorovano sežiganje, ki se razvija v času in prostoru, nevarno za ljudi in povzroča materialno škodo.
Nevarnost požara za ljudi je odprt ogenj, iskre, vročina, strupeni produkti zgorevanja, dim, zmanjšan kisik, propad zgradb ali naprav.
Izgorevanje je hitra fizikalno-kemijska reakcija, ki jo spremlja sproščanje toplote in dima, videz plamena ali tlenje. V normalnih pogojih je zgorevanje proces oksidacije ali združevanja gorljive snovi s kisikom v atmosferi. Vendar pa lahko nekatere snovi (na primer stisnjen acetilen, dušikov klorid, ozon) eksplodirajo brez kisika, da tvorijo toploto in plamen. Posledično lahko zgorevanje nastane zaradi reakcij ne le spojine, temveč tudi razgradnje. Znano je tudi, da lahko vodik in številne kovine gorijo v atmosferi klora, bakra v žveplenih parah, magnezija v ogljikovem dioksidu itd.
Najbolj nevarno zgorevanje, ki se pojavi med oksidacijo vnetljive snovi s kisikom v zraku. Hkrati je treba imeti vir vžiga, ki je sposoben dovajati potrebno količino energije v sistem za gorivo. Najpogostejši viri vžiga so: iskre, ki se pojavijo pri motnjah v električni opremi, udarjanju kovinskih teles, varjenju, kovanju; toplota, ustvarjena s trenjem; tehnološke ogrevalne naprave; požarni aparati; toplota adiabatne kompresije; razelektritev statične elektrike iz isker; pregrevanje električnih kontaktov; kemijske reakcije, ki se nadaljujejo z sproščanjem toplote.
Temperatura ogrevanja teh virov je drugačna. Torej ima lahko iskra, ki se pojavi, ko je udarjeno kovinsko telo, temperaturo do 1900 ° C, plamen tekme je približno. 800 ° C, vodilni boben tračnega transporterja med drsenjem je do 600 ° C, v toploti električnega razelektritve pa temperatura doseže 10.000 ° C, s skoraj trenutnimi kemičnimi reakcijami.
Burning je lahko popoln in nepopoln. S popolnim izgorevanjem, ki nastane s presežkom kisika, so reakcijski produkti ogljikov dioksid, voda, dušik, žveplov dioksid. Nepopolno zgorevanje nastane s pomanjkanjem kisika, produkti zgorevanja so v tem primeru strupene in vnetljive snovi - ogljikov monoksid, alkoholi, ketoni, aldehidi itd. Za popolno izgorevanje gorljive snovi je potrebna določena količina zraka: 1 kg lesa - 4,18, šote - 5 , 8, propan - 23,8 m3.
Proces zgorevanja si lahko predstavljamo na naslednji način. Hladen vnetljiv medij z vnosom toplotnega impulza se segreva, intenzivno oksidira vnetljiv medij s kisikom in dodatno toploto. To pa povzroči segrevanje sosednjega sloja gorljivega materiala, v katerem poteka tudi intenzivna kemijska reakcija. S tako zgorevanjem gorljive snovi po plasti se območje zgorevanja premika; Hitrost tega gibanja določa intenzivnost procesa zgorevanja in je njena najpomembnejša značilnost. Postopek segrevanja po plasti, oksidacije in zgorevanja se nadaljuje, dokler ni izčrpan celoten volumen gorljivega materiala.
Ozko območje, v katerem se snov segreva in kemična reakcija poteka, se imenuje fronta plamena.
Gorljivi sistemi so lahko kemično homogeni in heterogeni. Kemično homogeni sistemi so mešanice gorljivih plinov, hlapov ali prahu z zrakom, v katerih sta vnetljiva snov in zrak enakomerno pomešana. Sežiganje takih sistemov se imenuje homogeno. V kemijsko nehomogenih sistemih gorljiva snov in zrak nista mešana in imata vmesnik. To so pogosto trdni gorljivi materiali in njihovo izgorevanje se imenuje heterogeno.
Skupni čas izgorevanja gorljive zmesi Tg je vsota časa, ki je potreben za stik med vnetljivo snovjo in kisikom τ k, in čas, v katerem se kemikalija zgodi, oksidacijska reakcija τ x.
Odvisno od razmerja teh dveh izrazov se razlikujeta difuzija in kinetično izgorevanje. Pri gorenju trdih gorljivih snovi je čas, potreben za prodiranje kisika (difuzno) na površino snovi, veliko daljši od kemijskega reakcijskega časa, zato je skupna hitrost gorenja v celoti določena s hitrostjo difuzije kisika v gorljivo snov. Sežiganje takšnih snovi se najpogosteje pojavlja pri požarih in se imenuje difuzno. Izgorevanje, katerega hitrost je določena s hitrostjo kemične reakcije, se imenuje kinetična. Ta tip zgorevanja je značilen za homogene gorljive sisteme.
Razlikujte kalorimetrično, teoretično in dejansko temperaturo gorenja.
Kalorimetrična temperatura zgorevanja se nanaša na temperaturo, do katere se ogrevajo produkti popolnega zgorevanja, če se vsa izpuščena toplota porabi za ogrevanje, količina zraka je teoretično potrebna, snovi v celoti izgorejo in začetna temperatura je 0 ° C. Predpostavlja se, da so toplotne izgube enake nič. Če je začetna temperatura goriva in zraka 0 ° C, potem kalorimetrično temperaturo zgorevanja
![]()
kjer je Qn neto kalorična vrednost gorljive snovi, kcal / kg; V je prostornina produktov zgorevanja, m3 / kg; c je povprečna prostorninska toplotna zmogljivost produktov izgorevanja, kcal / m3 · deg.
Posledično je kalorimetrična temperatura gorenja odvisna samo od lastnosti gorljive snovi in ni odvisna od njene količine. Teoretična temperatura izgorevanja upošteva toplotne izgube med zgorevanjem za disociacijo. Kalorimetrična temperatura gorenja je najvišja za vnetljivo snov in se uporablja za kvalitativno oceno. V resnici so pri sežiganju vedno prisotne toplotne izgube zaradi sevanja, segrevanja presežnega zraka in okolja.
Dejanska temperatura gorenja je temperatura ognja. Razlikujte temperaturo notranjega in zunanjega požara. Temperatura zunanjega požara je temperatura plamena, notranja temperatura pa je temperatura dima v prostoru. Dejanske temperature, ki se razvijejo v primeru požara zaradi izgube toplote v okolju, segrevanja produktov izgorevanja in struktur
vedno manj kot teoretično za 30 ... 50%. Na primer, teoretična temperatura gorenja bencina je 1730 ° C, dejanska temperatura pa 1400 ° C.
Zmes gorljivih hlapov in plinov z oksidacijskim sredstvom lahko v njem zažge le določeno količino goriva.
Najnižja koncentracija gorljivega plina, pri kateri je zgorevanje že možno, se imenuje spodnja meja koncentracije vžiga (LEL). Najvišja koncentracija, pri kateri je še vedno možno zgorevanje, se imenuje zgornja meja koncentracije vžiga (AIPW). Področje koncentracije, ki leži znotraj teh meja, se imenuje regija vžiga. Vžig je ogenj (začetek gorenja), ki ga spremlja videz plamena. To je stalna dolga gorenja, ki se ne ustavi niti po odstranitvi vira vžiga. Vrednosti spodnje in zgornje meje vžiga so odvisne od lastnosti plina, pare in prahu zmesi zraka, vsebnosti inertnih komponent v gorljivi mešanici. Dodajanje inertnih plinov v gorljivo mešanico zoži območje vžiga in sčasoma postane negorljivo. Znatno zožite meje vžiga, nekatere nečistoče, ki upočasnijo reakcijo zgorevanja. Najbolj aktivni so halogenirani ogljikovodiki. Obe označeni lastnosti se uporabljata za zaustavitev zapisovanja. Znižanje tlaka mešanice pod atmosferskim tlakom tudi zoži območje vžiga in pri določenem tlaku zmes postane negorljiva. Povečanje tlaka gorljive mešanice širi območje vžiga, vendar, praviloma, rahlo. Povečanje temperature vnetljive mešanice razširi območje vžiga. Na koncentracijo vžiga vpliva tudi moč vira vžiga.
Obstajajo ne le koncentracije, temveč tudi temperaturne meje vžiga.
Temperaturne meje za vžig hlapov v zraku so temperature vnetljive snovi, pri kateri njeni nasičeni hlapi tvorijo koncentracije, ki ustrezajo spodnji ali zgornji meji koncentracije vžiga. Temperatura vžiga je najnižja temperatura, pri kateri se snov vname ali začne tinjati in po odstranitvi vira še vedno goreča ali tinja. Temperatura vžiga označuje sposobnost snovi do samovžiga. Če je vžigna temperatura snovi odsotna, se imenuje počasna ali negorljiva.
Pospešek oksidacijske reakcije pod vplivom temperature vodi do samovžiga. Za razliko od vžigalnega procesa, v katerem se vžge le omejen del prostornine - površina - se pojavi samovžig v celotnem volumnu snovi. Temperatura samovžiga se razume kot najnižja temperatura, do katere je treba segreti snov, tako da se bo pri nadaljnji avto-oksidaciji vnela. Samovžig je možen le, če količina toplote, ki se sprosti med postopkom oksidacije, presega izpust toplote v okolje.
Temperatura samovžiga za snov ni konstantna, saj je v veliki meri odvisna od pogojev njene določitve. Za pridobitev primerjalnih podatkov sta standardizirana preskusna naprava in metoda za določanje temperature samovžiga plinov in hlapov (GOST 13920-68). Najnižja temperatura, določena s standardno metodo, na katero je treba mešanico plinov in hlapov z zrakom enakomerno segreti, da se lahko vžge brez vnašanja zunanjega vira v njem, se imenuje standardna temperatura samovžiga.
Vrsta spontanega vžiga je samovžig, tj. Izgorevanje zaradi samosegrevanja brez vpliva vira vžiga. Razlika med spontanim vžigom in spontanim izgorevanjem je v obsegu temperature. Samovžig se pojavi pri sobni temperaturi, za samovžig pa je treba snov ogrevati od zunaj.

 Sprejem indikacij števcev oskrbe s toplo in hladno vodo
Sprejem indikacij števcev oskrbe s toplo in hladno vodo Izračun površine zračnih kanalov različnih oblik in fitingov
Izračun površine zračnih kanalov različnih oblik in fitingov Kemija procesov zgorevanja. Energija eksplozije
Kemija procesov zgorevanja. Energija eksplozije Kaj se bo zgodilo, če ne prenašate odčitkov
Kaj se bo zgodilo, če ne prenašate odčitkov