Burning kalles. Kjemiske prosesser under forbrenning
Noen grunnleggende definisjoner
Antallet atomer og molekyler uttrykkes beleilig i form av mengder stoff eller antall mol stoff. En mol materie tilsvarer 6,023 ∙ 10 23 partikler (atomer og molekyler). Tallet N A = 6,023 ∙ 10 23 mol -1 kalles Avogadro-nummeret. Mole fraksjon x ikomponent jeg er forholdet mellom antall mol n jeg komponent jeg til totalt antall mol n = Σ n jeg blandinger ( x i = n i / n).
vekt m er en grunnleggende egenskap av et stoff (måleenheten i SI-systemet er kilo). Massefraksjonen Wi er massens forhold m jeg komponent jeg til total masse av blandingen m = Σ m jeg (Wi = m i / m).
Molekylvekt (eller molekylvekt) M jeg(g / mol) komponent jeg - er massen av en mol av denne komponenten. Så for atomkull, molekylært hydrogen, oksygen og metan har vi: M c = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. Den gjennomsnittlige molarmasse av blandingen M (g / mol) kan uttrykkes i forhold til de molære fraksjonene av komponentene (M = x jeg m jeg).
Bestemmelse av forbrenningsprosesser
brenning - Dette er en kompleks fysisk-kjemisk prosess hvor brennbare stoffer og materialer som påvirkes av høye temperaturer, kommer inn i kjemisk interaksjon med et oksidasjonsmiddel (oksygen i luften), blir til forbrenningsprodukter, og som er ledsaget av intens varme og lysutslipp.
Forutsetningene som er nødvendige for forekomsten av forbrenningsprosessen:
Tilstedeværelsen av et brennbart stoff (GV);
Tilstedeværelsen av et oksidasjonsmiddel (O.) - luft oksygen;
Tilstedeværelsen av en antennekilde (I.Z.).
Det brennbare materialet må oppvarmes til en viss temperatur ved hvilken oksidasjonsprosessen vil begynne;
For å oppvarme et brennbart stoff til en bestemt temperatur, er det nødvendig med en bestemt antennekildeffekt;
For å opprettholde forbrenningsprosessen er det nødvendig med visse konsentrasjoner av drivstoff og oksidasjonsmiddel.
De viktigste forbrenningsprosessene er varme og masseoverføring. Den vanligste egenskapen ved å brenne er forekomsten av en flamme og beveger den gjennom den brennbare blandingen ved å overføre varmen eller diffusere de aktive partikler fra forbrenningssonen til en frisk brennbar blanding.
brann - Dette er en synlig manifestasjon av brenning. Det kalles også brenningsonen. Dette er delen av rommet hvor transformasjonen av den brennbare blandingen til produkter med fullstendig og ufullstendig forbrenning forekommer.
De viktigste parametrene i forbrenningsprosessen, som fører til død og forårsaker materiell skade, er:
Stor mengde varme;
Høy temperatur;
Giftig sammensetning av forbrenningsprodukter.
Forbrenningsprosessen fra standpunktet til den molekylære kinetiske teorien om gasser
Fig. 2.1. Andelen aktive molekyler avhengig av temperatur: T 2\u003e T 1
Når oppvarmet gass brennbar blanding i det øker overflødig energi.
Forskjellen mellom gjennomsnittlig energinivå for molekyler i aktiv tilstand og gjennomsnittlig nivå av inaktiv tilstand kalles aktiveringsenergien. Dette kan representeres grafisk (figur 2).

Fig. 2.2. Energidiagram over reaksjonskurset G.V. + O. ® PG: E act - aktiveringsenergi; Q xr. - Termisk effekt av forbrenningsreaksjonen
Energien som frigjøres som følge av samspillet mellom de "første" reagerte molekylene overføres til nærliggende molekyler. De er begeistret, prosessen gjentas rundt de reagerte molekylene med stor frekvens og intensitet. En selvbærende, selvakselerende prosess for kjemisk interaksjon i hele reaksjonsblandingen (2H2 + 02) begynner, ledsaget av dannelse av vannmolekyler og frigjøring av varme inn i miljøet og ledsaget av luminescens, dvs. oppstår og sprer brenningsprosessen.
Jo høyere numeriske verdien av E-handlingen er, desto vanskeligere er det å få dette paret av komponenter inn i kjemisk interaksjon. Derfor er verdien av E-handlingen en indirekte indikator på graden av brannfare for dette kjemiske systemet.
Typer og former for forbrenning
Forbrenning kan klassifiseres med følgende parametere:
1. Ifølge betingelsen om brennbare komponenter blander:
a) kinetisk - forbrenning av forblandte gass- eller damp-luftblandinger. Siden blandingen av drivstoff og oksydasjonsmiddel er klar for forbrenning til den antennes, avhenger den totale mengden av forbrenningsprosessen kun av frekvensen av den kjemiske reaksjonen ved forbrenning. Hvis en slik forbrenning skjer i et lukket eller begrenset volum, kan det oppstå en eksplosjon. Siden energien som frigjøres under forbrenningen av blandingen, ikke har tid til å bli utladet utover dette volumet, ved å øke trykket, kan strukturen ødelegges;
b) diffusjon, diffusjonsforbrenning kalles forbrenning, når dannelsen av et brennbart medium (en blanding av brennstoff og oksidasjonsmiddel) oppstår før forbrenningsområdet eller i forbrenningsområdet.
2. I henhold til intensiteten av kvitteringen av brennbare komponenter i den kjemiske reaksjonssonen:
a) laminar, mens komponentene i den brennbare blandingen kommer inn i forbrenningssonen relativt rolig. I dette tilfellet vil den numeriske verdien av Reynolds-kriteriet, som karakteriserer det termodynamiske regimet, være betydelig mindre enn det kritiske (Re<2300).
b) turbulent, med komponentene i den brennbare blandingen som kommer inn i forbrenningssonen ved høy hastighet. Reynolds-nummeret i dette tilfellet er mer enn 2300.
3. Ifølge aggregatets tilstand av komponentene i den brennbare blandingen:
a) homogen drivstoff og oksidasjonsmiddel er i samme aggregerende tilstand (gassformig);
b) heterogen (flerfaset) - brensel og oksidant er i forskjellige aggregative tilstander.
4. I henhold til utbredelseshastigheten for sonen av kjemisk reaksjon ved forbrenning:
a) Deflagrering (sakte) fordeling av den kjemiske reaksjonssonen (hastighet fra 0,5 til 50 m / s);
b) detonasjon (eksplosiv), når sone for kjemisk reaksjon av forbrenning forplantes med hastigheten på en sjokkbølge (fra flere hundre meter per sekund til flere kilometer per sekund).
Rommet der damp eller gasser brenner kalles av flamme .
Laminarflammer forhåndsblandet. I laminar flammer av en ferdigblandet blanding blandes brennstoffet og oksidanten før forbrenningsstart og strømmen er laminær.
Flammen til den ferdige blandingen kalles støkiometrisk Hvis drivstoffet (hydrokarbon) og oksidasjonsmiddelet (oksygen - O 2) forbruker hverandre helt, danner karbondioksid (CO 2) og vann (H 2 O). Hvis det er overskudd av drivstoff, sier de at blandingen er rik, og hvis det er overflødig oksidant, sier de at blandingen er dårlig.
Vurder de enkleste eksemplene:
1) 2H2 + 02 - 2H20-støkiometrisk blanding,
2) ЗН 2 + О 2 → 2H 2 O + 2 - rik blanding (2 overmål),
3) CH4 + ZO2 → 2H20 + CO2 + 02 - magert blanding (O2 i overskudd).
Hvert symbol i en slik kjemisk reaksjonsligning tilsvarer en mol av et stoff. Således betyr den første av disse ligningene at to mol H2 reagerer med en mol O2 for å danne to mol H20.
Hvis den kjemiske reaksjonsligningen er skrevet på en slik måte at den beskriver reaksjonen av bare en mol brennstoff, kan molfraksjonen av brensel i en støkiometrisk blanding lett bestemmes ut fra forholdet
x fjell, stokh = 1 / ((1 + v)
her vangir antall mol O2 i reaksjonsligningen med dannelsen av C02 og H20. Et eksempel er reaksjonen
H2 + 0,5O2 → H20, v = 0,5, xH2, stok = 2/3
Hvis oksidasjonsmidlet er luft, bør det tas hensyn til at tørr luft inneholder bare 21% oksygen, samt 78% nitrogen og 1% edelgasser. Således for luft, XN2 = 3,762 X 02. Herfra vil molære fraksjoner for støkiometrisk blanding med luft være like
x fjell, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
hvor v som før betyr antall mol O2 i reaksjonsligningen for fullstendig omdannelse av en mol brennstoff til CO og H20. Noen eksempler på verdier v og molære brøkdeler av brensel for støkiometriske blandinger av brensel med luft er vist i tabell 1.
Forblandede blandinger av drivstoff og luft (i dette tilfellet må en passende mengde N 2 tilsettes til reaksjonsligningen, se tabell 1) kjennetegnes av ekvivalentforholdet for luft:
λ = (x w / x fjell) / (x w, stok / x fjell, stoh) = (w w / w fjell) / (w w, stoch / w fjell, stoch)
eller gjensidig av - ekvivalentforholdet for drivstoff F (F = 1 / λ). Denne formel kan transformeres for å kunne bestemme størrelsen på de molære fraksjoner av blandingen etter verdi F:
x fjell = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x fjell,
X vekt / 4,762, = ∙ 3,762
Eksempler på v-verdier og molfraksjoner av drivstoff x fjell, støki for støkiometriske blandinger av drivstoff med luft
vanning er alltid ledsaget av kjemiske transformasjoner. Forbrenning i luft - samspillet mellom et brennbart stoff med oksygen. Det skal imidlertid huskes at oksider av nitrogen, halogenider og ozon kan virke som oksidasjonsmidler i forbrenningsprosessen. Kjente forbrenningsprosesser som oppstår med deltagelse av bare én kilde til produktet - forbindelser som er i stand til rask nedbrytning. Eksempler på slike forbindelser er acetylen og hydrazin.
Kjemiske prosesser som oppstår under forbrenning er ekstremt komplekse. Selv for det enkleste tilfellet - forbrenningen av hydrogen i oksygen, den generaliserte ligningen har form
2H2 + O2 = 2H20,
flere dusin grunnleggende stadier er etablert og studert.
Til dags dato har mekanismene for kjemiske transformasjoner under forbrenning av bare noen få stoffer, som hydrogen, karbonmonoksid, metan og etan blitt studert i tilstrekkelig detalj. Denne kunnskapen brukes til å forutse forholdene for tenning og forbrenning av mange stoffer.
2.1. Kjedereaksjoner
Kjedereaksjoner, i motsetning til vanlige kjemiske transformasjoner, er preget av utseendet i hver elementær handling av en aktiv partikkel: et atom med en upparet elektron, et fritt radikal eller en ion. Utseendet av aktive partikler forårsaker en kjede av transformasjoner av utgangsmaterialene i reaksjonsprodukter. Atomer, frie radikaler og ioner er mer reaktive enn valens-mettede molekyler. Derfor, til tross for de betydelige energikostnadene som kreves for å bryte kjemiske bindinger og dannelsen av aktive partikler, viser kjerneutviklingen av en reaksjon seg ofte å være energisk mer fordelaktig enn den direkte vekselvirkning mellom molekyler.
Forbrenningsprosesser skjer hovedsakelig gjennom en kjedemekanisme. Kjedereaksjoner - komplekse reaksjoner som foregår i flere stadier, som representerer:
Opprinnelsen til kjedene (initiering), hvor de aktive partikler dannes;
Fortsettelsen av kjedene, hvori de aktive partiklene inngår kjemisk interaksjon med utgangsmaterialene, som et resultat av hvilke nye aktive partikler dannes;
Brudd på kjeder der "død" av de aktive partiklene oppstår med dannelsen av de endelige reaksjonsprodukter
Opprinnelsen til kjedene kan forekomme under ulike forhold. For eksempel, som et resultat av dissociering av molekyler under virkningen av termisk energi, eller ioniserende stråling, i en elektrisk utladning. Død av aktive partikler oppstår når de rekombinerer *, når frie radikaler interagerer (homogen kjedebrudd), når aktive partikler samhandler med faste overflater (heterogen kjedebrudd) eller som et resultat av deres reaksjon med forbrenningsinhibitorer.
Det er uforgrenede og forgrenede kjedereaksjoner. I den uforgrenede for hver aktiv partikkel som forbrukes i reaksjonene for fortsettelse av kjeden, er det en gjenoppstående. Antall dannede produktmolekyler per initial aktiv partikkel kalles kjedelengden. Lengden på kjeder i forbrenningsreaksjoner varierer fra hundretusener til titalls millioner. Antallet av uforgrenede kjedereaksjoner kan påvirkes av mindre blandinger av stoffer som effektivt kan samhandle med aktive partikler, for eksempel forbrenningsinhibitorer.
Noen stoffer - initiatorer - letter dannelsen av aktive partikler og derved akselerere uforgrenede kjedereaksjoner.
Ved forgrenede reaksjoner på en aktiv partikkel, konsumert med fortsettelsen av kjeden, dannes to eller flere aktive partikler. En av dem fortsetter primærkjeden, mens andre begynner nye kjeder, danner en forgrening (figur 2.1).
"Rekombinering er prosessen med dannelse av nøytrale atomer eller molekyler fra ladede partikler. Atomer og molekyler dannet under rekombinasjon kan være i bakken eller opphisset tilstand.
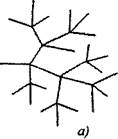
Fig. 2.1. Skjematisk fremstilling av reaksjonskjedene:
a) forgrening i hver ledd i kjeden
6) sjeldne forgreninger
For eksempel, under forbrenning av hydrogen i kjedeinitieringsreaksjonen:
et aktivt atom dannes. I kjeden fortsettelse reaksjonen:

det er en økning i antall aktive atomer som er begynnelsen på nye kjeder.
Forgrenede kjedereaksjoner kan fortsette i en stasjonær modus, hvor forgreningshastigheten er mindre enn dødsgraden av de aktive partikler, og i ikke-stasjonære, hvor døden skjer sakte enn forgrening. I sistnevnte tilfelle øker hastigheten til kjedereaksjonen eksponentielt og er begrenset bare ved forbruket av utgangsmaterialene. Overgangen fra stasjonær til ikke-stationær modus skjer brått med en liten endring i reaksjonsbetingelsene: temperatur, trykk eller konsentrasjon av en av reaktantene. En slik rask akselerasjon betraktes som selvantennelse av reaksjonsblandingen eller en kjedeeksplosjon.
Oppdagelsen av forgrenede reaksjoner var av stor betydning for opprettelsen av en teori om forbrenningsprosesser. Det er bevist at det er to typer tenning: termisk og kjede. Mønstre satt inn
Kapittel 2. Kjemiske prosesser på brenning
teorien om kjedeprosesser, kan effektivt påvirke utviklingen og undertrykket av forbrenningsprosesser under branner.
Kjensens opprinnelse.Kjerneprosessen av de første aktive sentrene spiller en stor rolle i utviklingen av uforgrenede kjedereaksjoner. Den kompenserer for tap av aktive sentre i løpet av kjedetermineringsreaksjoner. Denne mekanismen bestemmer betingelsene for dannelsen av et stasjonært regime i den opprinnelige perioden for akkumulering av aktive sentre. Med en lav innledningsgrad kan denne perioden være betydelig.
De fleste kjemiske reaksjoner i flammer har et betydelig energibesparelse av aktive sentre. Under disse forholdene er initieringen av aktive sentre forbundet med å overvinne en betydelig energibarriere.
I dette tilfellet spilles en viktig rolle av faktorer som sikrer en betydelig fremvekst av aktive sentre: kjemisk aktive tilsetningsstoffer, stråling, elektrisk utslipp, radioaktive henfallsprodukter.
Blant de faktorene som i stor grad letter etableringen av aktive sentre, bør heterogene reaksjoner noteres. I molekylene av brennbare stoffer som er adsorbert på en fast overflate, blir interatomiske bindinger svekket og deres brudd krever mindre energiforbruk. Under disse forhold er frekvensen av generering av aktive sentre betydelig høyere enn i gassvolumet. Aktiveringsenergien i den heterogene vekselvirkning av komponentene i den brennbare blandingen er også lavere enn i tilfellet av en homogen en. Heterogen oppstart av aktive sentre under forhold med egentlige forbrenningsprosesser er en viktig faktor i den akselererte oppnåelsen av et stasjonært regime med uforgrenede kjedeprosesser.
Noen funksjoner karakteriserer uforgrenede kjedereaksjoner som forekommer med deltagelse av atomkomponenter. I fravær av urenheter som samvirker med aktive sentre uten regenerering, blir kjedeterminering bare mulig når atomer rekombinerer ved trippelkollisjoner og på overflaten.
Ved enhver temperatur blir alle gassformige stoffer dissociert delvis. Noen av molekylene brytes ned i atomer. I dette tilfellet er det en likevekt mellom prosessene for dissosiasjon og forening av atomer i molekyler. Graden av dissosiasjon eksponensielt avhenger av temperaturen.
Hvis det ikke er noen urenheter i den brennbare blandingen som bryter kjedene, forblir konsentrasjonen av atomkomponentene i reaksjonen praktisk talt uendret. Atomer som gikk inn i reaksjonen regenereres umiddelbart i det samme
Korolchenko A.Ya. Forbrenning og eksplosjonsprosesser
lichestve. Den innledende initiering kompenserer for de reagerte atomer i samme mengde som i det ikke-reaktive systemet. Stasjonær reaksjon påvirker ikke denne prosessen. Balansen av en av komponentene i reaksjonen, som utmerker seg ved minst sterk binding mellom atomene i molekylet, er et karakteristisk trekk ved denne modusen. Konsentrasjonen av en annen atomkomponent i dette tilfellet er kvasistasjonær, men mer likevekt.
Med den homogene initieringen av forbrenningsreaksjoner vil det stasjonære regimet bli etablert bare etter en viss tidsperiode, da dissosiasjon krever en stor aktiveringsenergi. I løpet av denne perioden overskrider dissocieringshastigheten rekombinasjonshastigheten, og de aktive sentrene akkumuleres i reaksjonssystemet. Antallet av begge prosessene sammenlignes bare etter å øke konsentrasjonen av aktive sentre til likevekt. Denne tidsperioden kalles induksjonsperioden.
Tilstedeværelsen av en fast overflate som katalysator i reaksjonssonen endrer ikke tilstanden til termodynamisk likevekt. Katalysatoren påvirker også forover- og reversreaksjonene. Aktive sentre kommer ikke bare fra en solid overflate, men bryter også av den. Tilstedeværelsen av en katalysator akselererer imidlertid oppnåelsen av en likevektsdissociasjonstilstand.
Hvis aktive stoffer er tilstede i den brennbare blandingen, som kan delta i kjedebrytningsreaksjoner, reduserer de konsentrasjonen av aktive sentre. I dette tilfellet forstyrres likevektsdissociasjonen av en av de opprinnelige komponentene, noe som senker reaksjonen og kan føre til at den avsluttes.
Eksperimenter viser at ved innledning av en uforgrenet kjedereaksjon ved en ekstern kilde (for eksempel en lyskilde), kan konsentrasjonen av aktive sentre ved den første fasen av forbrenningsprosessutviklingen vesentlig overstige likevekten.
Under forgrenede reaksjonsreaksjoner har betingelsene for innledende initiering en betydelig innvirkning på reaksjonens utvikling. Ved sakte bevegelsesprosesser forkortes tilsetningen av en delvis reagert blanding til den opprinnelige en induksjonsperiode og akselererer øyeblikket av flammeforbrenning.
Fortsettelsen av kjedene.Et karakteristisk trekk ved uforgrenede kjedereaksjoner er kvasi-stasjonariteten av konsentrasjonen av aktive sentre. I fravær av en åpen krets dannes aktive partikler i
Kapittel 2. Kjemiske prosesser under forbrenning
det samme beløpet de blir brukt på. Nytt oppstår bare ved oppstart. Med like høye generasjoner av aktive sentre og kjedeavslutning etableres en konstant konsentrasjon av aktive sentre og en stasjonær reaksjonsmodus. Reaksjonshastigheten vil avta når de opprinnelige komponentene blir konsumert.
Ved en forgrenet kjedereaksjon øker konsentrasjonen av aktive sentre i det reagerende systemet uavhengig av betingelsene for deres innledende initiering. Implementert selvakselererende reaksjonsmodus, som har en lavine karakter. I dette tilfelle er det for en fullstendig transformasjon av de opprinnelige komponentene i reaksjonsproduktene en tilstrekkelig aktiv senter.
Den kinetiske ligningen av en forgrenet verdifull reaksjon er som følger. Forandringen i konsentrasjonene av de stabile startkomponentene over tid kan neglisjeres til en første tilnærming, og kun raskere endringer i konsentrasjonen av aktive sentre kan tas i betraktning. n.Endringer i denne hastigheten bestemmes av hastigheten av innledende initiering og forholdet mellom hastigheten av reaksjonene av forgrening og kjedeavslutning. Den initiale initieringshastigheten er ikke avhengig av konsentrasjonen av aktive sentre som er tilstede i systemet. Satsene for forgrening og bruddprosesser er proporsjonale med konsentrasjonene av aktive sentre. Under disse forhold bestemmes den totale balansen mellom dannelsen og utgiften til aktive sentre av summen av satsene for initieringsprosessene, forgrening og brudd:
![]() (2.1)
(2.1)
hvor og er hastighetskonstantene av forgrenings- og bruddreaksjonene. Betyring, vi får:
![]() (2.2)
(2.2)
Når tidsavledet av konsentrasjonen av aktive sentre
er positiv. Reaksjonshastigheten øker med tiden. Denne egenskapen ved forgrenede reaksjoner skyldes multiplikasjonen av aktive sentre i slike regimer når frekvensen av forgreningsreaksjonen overskrider frekvensen av kjedeavslutningsreaksjonen.
Korolchenko A.Ya. Forbrenning og eksplosjonsprosesser
Hvis før reaksjonsstart begynte, inneholdt systemet ikke aktive sentre, dvs. vedt= 0, n = 0 integrasjon av ligning (2.2) gir:
![]() (2.3)
(2.3)
Den totale reaksjonshastigheten av CO bestemmes av graden av forgreningsprosessen. De endelige produktene dannes bare under denne reaksjonen. For hver elementærkjedeforgreningshendelse dannes molekyler av sluttproduktet. Det følger:
![]() (2.4)
(2.4)
Utviklingen av en kjedereaksjon i tide bestemmes av forholdet mellom hastighetskonstantene av reaksjonene av forgrening og kjedeavslutning, og når eksponenten i ligning (2.4) er positiv og re-
handlingen er ubegrenset akselerert. I den opprinnelige perioden for utvikling av reaksjonen, gjelder følgende forhold:
På grunn av det faktum at innledningsfrekvensen er liten, er det ingen merkbar kjemisk transformasjon i opprinnelig periode. Etter en tid blir verdien betydelig større enn en. Etter det begynner reaksjonshastigheten i samsvar med ligning (2.4) å øke raskt og når svært store verdier, selv om det var praktisk talt umerkelig før.
Tilstedeværelsen av en forsinkelsesperiode (induksjonsperiode) under utviklingen av en kjedereaksjon skyldes nødvendigheten av å akkumulere et visst antall aktive sentre i det reagerende system. Først etter denne kjemiske transformasjonen blir merkbar.
Størrelsen på induksjonsperioden i kjedereaksjoner bestemmer forholdet mellom graden av forgrening og kjedeavslutningsprosesser, ikke graden av innledende initiering. I sin tur skyldes frekvensene av forgrenings- og bruddreaksjoner de kjemiske egenskapene til hvert reagenssystem, de bestemmes av avhengighet av temperatur og konsentrasjon av utgangskomponentene. Kjennetegn ved kjedereaksjoner for
er at forgreningsprosessene krever betydelig aktiveringsenergi, mens temperaturkoeffisienten av hastighetskonstanten i bruddprosessen er nær null. I reaksjonene ved terminering av kjeder av alle tre typer: i tilfelle av bulk og heterogene rekombinasjoner, i samspillet mellom radikaler med aktive urenheter, er aktiveringsenergiene null.
Med en temperaturøkning er det totale trykk av blandingen, eller en endring i konsentrasjonen av de reagerende komponentene, en endring i hastighetskonstantene for forgrening og brudd mulig, hvor reaksjonen endres fra stasjonær til ikke-stationær. Egenheten ved denne prosessen ligger i den plutselige overgangen fra en modus til en annen, ved å endre reaksjonshastigheten fra en ubetydelig verdi til en ubegrenset økning.
Strømmen av noen kjedereaksjoner ledsages av dannelsen av mellomprodukter som er forholdsvis stabile, men med evnen til å generere aktive sentre. Slike reaksjoner innbefatter for eksempelr, som mellomprodukter hvor peroksider og aldehyder dannes. Dette fører til forgrening av kjeden. På grunn av den relative stabiliteten til mellomprodukter strekker imidlertid akselerasjonen av reaksjonen over tid. Slike sakte forgreningskjeder kalles degenerert.
Kjedereaksjoner med den vanlige radikalforgreningsmekanismen, som regel, på grunn av den høye aktiviteten til radikaler, fortsetter ganske raskt. De resulterende radikaler initierer enten en hurtig-akselererende reaksjon, eller rekombinere og avslutte prosessen.
Åpen krets Den aktive partikkelen, som et hvilket som helst gassmolekyl, gjør tilfeldige bevegelser inne i det reagerende system, kolliderer med andre molekyler. Samtidig er det en viss sannsynlighet ved noen kollisjon av samhandling med en annen aktiv partikkel eller molekyl og dannelsen av en ny aktiv partikkel, fortsetter banen til den forrige. Utviklingen av reaksjonskjeden ligner den bruniske bevegelsen av inerte molekyler, selv om overføringen av aktive sentre ledsages av en kjemisk reaksjon. På vei for utvikling av kjeden er alternative aktive sentre av to eller flere typer.
Korolchenko A.Ya. Forbrenning og eksplosjonsprosesser
Reaksjonskæden fortsetter til det øyeblikk når den aktive partikkelen ikke reagerer uten regenerering. I dette tilfellet oppstår den såkalte åpne kretsen. Bruddprosesser spiller en stor rolle i kinetikken av kjedereaksjoner. Det er to typer reaksjoner som fører til at aktive sentre dør:
Homogen pause (død i volumet av reaksjonsblandingen);
Heterogen pause (død på en fast overflate) Homogen kollisjon av kjeder er mulig med en av to prosesser:
når radikaler rekombinere eller når ulike kjemisk aktive komponenter samhandler med aktive sentre uten regenerering av sistnevnte.
Heterogen kjedebrudd oppstår på sotpartikler dannet under forbrenning, eller på overflaten av faste brennstoffmaterialer. En åpen krets på en fast overflate kan betraktes som diffusjon av aktive sentre fra gassblandingen til denne overflaten som de forsvinner på. Rekombinasjonsmekanismen på en fast overflate er at den aktive partikkelen, som har økt reaktivitet, er sorbert * på overflaten. De radikaler som er sorbert på tilstøtende steder, rekombinere med hverandre, siden det ikke er noen energi og romlige hindringer for denne prosessen. Molekylene av stabile forbindelser dannet som et resultat av rekombinasjon er ikke lenger involvert i utviklingen av en kjedereaksjon.
Imidlertid fører ikke hver kollisjon av en aktiv partikkel med en solid overflate til adsorpsjonen. Kanskje dens refleksjon fra overflaten. Sannsynligheten for adsorpsjon av et aktivt senter ved en fast overflate kalles innkvarteringskoeffisienten. Denne koeffisienten er karakteristisk for den aktive partikkels og overflatenes kjemiske affinitet. I praktisk viktige tilfeller beveger den aktive partikkelen etter refleksjon fra veggen seg ikke langt unna. Det er sannsynligheten for nye kollisjoner med veggen til innkvarteringen skjer. På grunn av denne prosessen, under visse forhold, er reaksjonshastigheten praktisk talt uavhengig av innkvarteringskoeffisienten. Prosessen fortsetter på en slik måte som EU
* Sorption - absorpsjon av et fast stoff (eller væske) av et stoff ha av miljøet. Den absorberende kroppen kalles en sorbent, absorbert- sorbate. Skille absorpsjonen av hele masse av sorbenten (absorpsjon) og overflatelaget (adsorpsjon). Sorpsjon på grunn av samspillet mellom den kjemiske typen mellom overflaten av det faste sorbent og sorbatet kalles kjemisorption.
__________________________ Kapittel 2. Kjemiske prosesser under forbrenning
hvis det oppstod en åpen krets ved hver kollisjon. Konsentrasjonen av aktive sentre ved overflaten kan tas til å være null.
I fravær av aktive urenheter i den reagerende blanding kan bruddene av kjedene forekomme enten på faste overflater eller homogent ved rekombinering av radikaler i bulk. I virkelige branner blir den andre veien hovedsakelig implementert.
Visse innflytelser på kinetikken av kjedereaksjoner har additiver i det reaktive systemet av inerte gasser. Inerte tilsetningsstoffer øker antall kollisjoner med aktive partikler, øker sannsynligheten for kjedebryt og forhindrer følgelig den totale reaksjonen.
Mer effektiv inhibering av kjedereaksjoner oppnås ved innføring av reaktive additiver - inhibitorer i den reagerende blanding. Inhibitorer samhandler med de aktive sentrene, som leder reaksjonen, bryter kjeden. Kinetikken av reaksjonen i den hemmerte blanding bestemmes av konkurransevilkårene mellom inhibitoren og hovedkomponentene i reaksjonen når den interagerer med aktive sentre. Med høye virkningsgrad av inhibitoren og den moderate hastigheten av generering av nye aktive sentre, kan allerede små tilsetningsstoffer av inhibitoren helt undertrykke løpet av kjedereaksjonen.
Inhiberingsprosessene er av stor betydning når det gjelder brann- og eksplosjonssikkerhet. Bruk av inhibitorer gjør at du effektivt kan påvirke forbrenningsprosessene.
2.2. Kjemiske prosesser under forbrenning av hydrogen
Samspillet mellom et hydrogenmolekyl og et oksygenmolekyl går videre på en kompleks måte gjennom en rekke suksessive stadier. Det er nå fastslått at forbrenning av hydrogen skjer ved en kjedemekanisme, hvor partikler spiller rollen som aktive sentre. Sekvensen og betydningen av elementære reaksjoner under forbrenning av hydrogen beskrives i stor detalj for forskjellige betingelser for fremveksten og utviklingen av hydrogenflammer.
Den mest detaljerte analysen av hydrogenforbrenningsprosessen i autoignisjonsmodus ved hjelp av eksperimentelle og beregningsmetoder ble utført av professor A. N. Baratov. Han foreslo følgende prosessplan, inkludert fjorten grunnleggende elementære reaksjoner:
Korolchenko A.Ya. Forbrenning og eksplosjonsprosesser
Opprinnelsen til de aktive sentrene skjer ved reaksjon
![]()
Fortsettelse av kjeden av reaksjoner
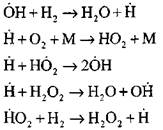
Forgreningskjeder
 |
åpen krets
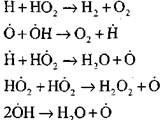 |
Konsentrasjonen av hydrogenatomer i den første fase av autoignisjonsprosessen er en ubetydelig del av det innledende hydrogeninnholdet. Med utviklingen av en kjedereaksjon blir konverteringsgraden av molekylært hydrogen så høy at den forbrukes i hundrevis av sekunder.
2.3. Kjemiske reaksjoner ved brenning av karbonmonoksid
Samspillet mellom karbonmonoksid og oksygen er en stor reaksjon for forbrenningsprosesser. Forløpet av denne reaksjonen under
__________________________ Kapittel 2. Kjemisk prosesss ved brenning
mange tilfeller bestemmer forbrenningslovene av karbonholdige stoffer. Reaksjonen er karakterisert ved en forgrenet mekanisme. Den har en rekke funksjoner.
I lang tid var det tro på at en helt tørr blanding av CO og 0 2 ikke kunne antennes og brenne. Imidlertid forsiktig forsøksforsøk hvor fraværet av vann ble overvåket ved hjelp av massespektrograf, viste at tenning også er mulig for en tørr blanding. Det skal bemerkes at tilstedeværelsen av CO + 0 2 vanndamp eller hydrogen i systemet aktiverer tenn- og forbrenningsprosessen ved å øke antall mulige aktive sentre. Den akselererende effekten av vann er spesielt merkbar ved lave konsentrasjoner.
Forbrenning av karbonmonoksid i nærvær av vanndamp eller små tilsetninger av hydrogen skjer med deltagelse av følgende elementære prosesser:

De radikaler, H02, som dannes ved reaksjon (VI), kan fortsette kjeden (reaksjon VIII) eller føre til brudd ved reaksjon (IX-XII).
For å vurdere betingelsene for overgangen av langsom oksydasjon av CO til en kjedeeksplosjon, la oss anslå sannsynligheten for en kjedebrudd gjennom den radikale H02; her tar vi hensyn til at rollen av reaksjoner (X) og (XI) i kjedeavslutningen vil være ubetydelig når det gjelder
sammenlignet med reaksjonen (IX), da hastighetskonstantene i prosessene (IX-XI) ved temperaturer i størrelsesorden 1000 K er nær hverandre, men konsentrasjonen av radikaler er mye lavere enn konsentrasjonen av hydrogenatomer, da radikaler har en høyere kjemisk aktivitet. Derfor kan sannsynligheten for en åpen krets gjennom det radikale H0 2 skrives i form:
Ved en temperatur på 1000K
Derfor, forutsatt at
![]()
![]()
størrelseseffekten
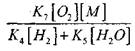
ved å løse ligning (2.7) vil det være svakt.
Kapittel 2. Kjemiske prosesser under forbrenning
I tilfelle av ![]() eller
eller ![]() (hva er observert i
(hva er observert i
ekte flammer MED), blir ligning (2.7) omgjort til skjemaet:
![]() (2.8)
(2.8)
Dermed er tilstanden til å brenne karbonmonoksid i luften i stor grad bestemt av nærvær og mønstre av hydrogenforbrenning. Oksydasjonen av CO ved reaksjon (I) avhenger av konsentrasjonen av OH-radikaler dannet i reaksjonene som involverer hydrogen.
Egenheten ved forbrenningsreaksjonen av karbonmonoksid ligger i sin hurtige inhibering når små tilsetningsstoffer innføres i det reaktive systemet av stoffer med høy affinitet for hydrogenatomer. Slike stoffer som hemmer forbrenningen av CO er halogenider og halogenderivater av hydrokarboner. Deres inhibitoriske effekt på grunn av terminering av reaksjonskjedene når de interagerer med hydrogenatomer ved reaksjonen
2.4. Kullbrenning
En undersøkelse av forbrenningsprosessene av hydrogen og karbonmonoksid viser kompleksiteten av forbrenningsreaksjonsmekanismen. Når det gjelder H2 og CO, fortsetter reaksjonen som en kjede med deltagelse av mange elementære trinn og mellomprodukter. Derfor er det naturlig å forutse at mekanismen for forbrenningsreaksjoner av mer komplekse stoffer - hydrokarboner - er enda mer kompleks og virkningen som følger med prosessene for antennelse og forbrenning av disse forbindelsene er mer varierte.
Foreløpig tilgjengelig informasjon om karakteren av kjemiske forhøyninger av hydrokarboner ved forbrenningsprosessen tillater oss å forklare de observerte virkningene med litt tilnærming.
Det ble etablert at i hydrokarbonflammer, sammen med allerede kjente aktive partikler, er det et stort antall mellomprodukter av en mer kompleks struktur. I noen tilfeller blir de kilder til fremveksten av nye kjeder. Hovedrollen i prosesser for tenning og forbrenning av hydrokarboner spilles av følgende typer mellomprodukter:
Korolchenko A.Ya. Forbrenning og eksplosjonsprosesser
1. Hydrokarbonradikaler, som er et molekyl av
levodoroda, som fjernet ett eller flere hydrogenatomer. disse
rester kalles alkyl (CH3-metyl; C2H5-etyl; C3H7-propyl og
etc.). På grunn av sin høye reaktivitet, frie alkyler
eksisterer ikke i lang tid. Til stede i flammer som mellomliggende
STATLIGE produkter. Når interaksjon med andre molekyler oppfører seg
som en uavhengig strukturgruppe. Hydrocarbon Radicals
vanligvis representert ved bokstaven R.
2. Peroksider - forbindelser med generell formel R-00-R ".
3. Aldehyder - Type forbindelser
![]()
De enkleste aldehyder er myresyre (formaldehyd) og eddiksyre (acetaldehyd) ![]() . Disse stoffene er alle
. Disse stoffene er alle
finnes i produkter av ufullstendig forbrenning av hydrokarboner.
Kjededannelse under forbrenning av hydrokarboner kan være hvilken som helst reaksjon der hydrokarbonradikaler dannes. Dette kan være en dekomponeringsreaksjon av et etanmolekyl med dannelsen av to frie metylgrupper:
![]()
eller reaksjonen av et hydrokarbon med oksygen:
![]()
Fortsettelsen av kjeder oppstår som følge av formasjonsreaksjoner peroksid eller hydroperoksid:
![]()
Kjedeforgrening utføres under dekomponering av hydroperoksid:
Kapittel 2. Kjemiske prosesser under forbrenning
Den angitte sekvens av reaksjoner fører til en gradvis økning i konsentrasjonen av peroksydforbindelser i det reagerende systemet.
Samtidig med akkumulering av peroksider, radikaler og start
det er parallelle reaksjoner:

Disse reaksjonene er eksoterme; når de flyter en stor mengde varme.
Med en økning i temperaturen i reaksjonsblandingen, passerer rolle aktive sentre fra ett mellomprodukt til et annet i følgende rekkefølge: alkylhydroperoksyder, acylhydroperoksider, formaldehyder.
Eksperimentelle studier av endringer i sammensetningen av reaksjonsblandingen over tid i høy temperaturområdet (600-800 ° C) viser at prosessen med transformasjon av de første hydrokarboner til sluttforbrenningsprodukter er delt i to trinn: den første, som forekommer i meget høy grad, oksyderer hydrokarbonene til CO. På den andre, sakte, fase oksideres CO til. En svært viktig konklusjon følger: Mange av lovene om forbrenning av hydrokarboner kan forklares ved egenskapene ved forbrenning av karbonmonoksid.
2.5. Kullbrenning
Kullbrenning fortsetter i henhold til mekanismen for en heterogen prosess, hvor spesifisiteten ligger i det faktum at kjemikalietrinnet ikke kan betraktes isolert fra prosessen med overføring av et gassformig oksidasjonsmiddel (oksygen av luften) fra det omgivende rom til overflaten av et brennende faststoff. Brennhastigheten avhenger av både kjemiske egenskaper av karbon og egenskapene som bestemmer prosessen med å forsyne oksygen til brenseloverflaten. Oksygenforsyning til forbrenningsområdet utføres ved diffusjon og derfor
Korolchenko A.Ya. Forbrenning og eksplosjonsprosesser
avhenger av mange faktorer: Forbrenningens form og størrelse, bevegelsen av gassformet medium, oksygenes diffusjonskoeffisienter og reaksjonsproduktene både i rommet over brenseloverflaten og i sprekker og porene som finnes i kull og koks i betydelige mengder.
For å illustrere egenskapene ved heterogen kullforbrenning betrakter vi oppførselen til et separat stykke kull plassert i en ovn oppvarmet til en temperatur på 900 ° C. Ved første øyeblikk vil forbrenningen av kull forekomme på bekostning av oksygen som ligger nær overflaten. Etter at det er brukt opp, dannes et lag av forbrenningsprodukter rundt den oppvarmede overflaten. Brennhastigheten vil senke, og prosessen kan opphøre hvis det ikke var oksygen som kommer fra fjernere områder av gassrommet.
Denne strømningen skjer gjennom diffusjon, og brennhastigheten bestemmes av diffusjonsflensen. Diffusjonsintensiteten er i stor grad avhengig av intensiteten og naturen til bevegelsen av gassmediet nær brenningsflaten. Frekvensen av kjemisk reaksjon bestemmes hovedsakelig av temperatur. Heterogene reaksjoner, så vel som homogene, adlyder Arre-nius loven.
Ved høye temperaturer går oksidasjonsreaksjonen av karbon meget raskt, og prosessens totale hastighet vil bli begrenset av diffusjon av oksygen til overflaten.
Således består prosessen med brennende karbon av to prosesser av forskjellig art: prosessen med å transportere luft oksygen fra gassrommet til forbruksstedet og prosessen med dets kjemiske samspill med overflaten av fast karbon. Begge disse prosessene er sammenhengende, men hver har sine egne lover. Den viktigste av disse prosessene er oksygenforbruket, som er preget av en rekke kjemiske reaksjoner.
Mekanismen for den komplekse reaksjonen av å kombinere oksygen med karbon består i samtidig dannelse av to oksider av CO og CO 2 gjennom et mellomliggende fysisk kjemisk kompleks av typen C X 0 Y, som deretter deles i CO og. Forholdet mellom disse oksydene avhenger av brennevilkårene. Følgelig kan ligningen for reaksjonen av brennende karbon skrives som følger:
Kapittel 2. Kjemiske prosesser under forbrenning
Deretter fortsetter en homogen reaksjon av brennende karbonmonoksid:
mekanismen som er omtalt i avsnitt 2.3.
Denne reaksjonen kan finne sted nær karbonoverflaten, såog i kullmassen, i porer og sprekker.
En annen reaksjon er en heterogen reaksjon mellom varmt karbon og karbondioksid:
![]()
Den flyter med merkbar hastighet på steder der det er mangel på oksygen, men hvor temperaturen på karbon er høy nok.
Kombinasjonen av de beskrevne reaksjoner bestemmer sammensetningen av produktene av forbrenning av karbon.
NØD FOR FORBRUKNINGSPROSESSER
| D |
vanning i brannfarlige blandinger kan oppstå som følge av selvantennelse, tenning ved ekstern kilde eller spontan forbrenning. Hvis selvantennelsesprosessen og tenningen er karakteristisk for stoffer som er i gassformig, flytende eller fast tilstand, er spontan forbrenning karakteristisk for faste materialer (spesielt de i finfordelt tilstand) eller høykokende væsker fordelt på materialer med en utviklet overflate.
3.1. Selvantennelse. Stasjonær teori
En brann er en ukontrollert brenning som utvikler seg i tid og rom, farlig for mennesker og forårsaker materiell skade.
Brannfarer for mennesker er åpen ild, gnister, feber, giftige forbrenningsprodukter, røyk, redusert oksygen, sammenbrudd av bygninger eller installasjoner.
Forbrenning er en raskt pågående fysisk-kjemisk reaksjon, ledsaget av utgivelse av varme og røyk, utseendet av en flamme eller smoldering. Under normale forhold er forbrenning prosessen med å oksidere eller kombinere et brennbart stoff med atmosfærisk oksygen. Noen stoffer (for eksempel komprimert acetylen, nitrogenklorid, ozon) kan imidlertid eksplodere uten oksygen for å danne varme og flamme. Følgelig kan forbrenning skyldes reaksjoner ikke bare av forbindelsen, men også av dekomponering. Det er også kjent at hydrogen og mange metaller kan brenne i atmosfæren av klor, kobber i svoveldamp, magnesium i karbondioksid etc.
Den farligste forbrenningen som oppstår under oksidasjon av et brennbart stoff med oksygen i luften. Samtidig er det nødvendig å ha en antennekilde som er i stand til å levere den nødvendige mengden energi til drivstoffsystemet. De vanligste antennekildene er: gnister som oppstår når elektrisk utstyr ikke fungerer, slående metalllegemer, sveising, smiing av verk; varme generert av friksjon; teknologisk oppvarming enheter; brann apparater; varme av adiabatisk kompresjon; gnist utladning av statisk elektrisitet; Overoppheting av elektriske kontakter; kjemiske reaksjoner går videre med varmeutslipp.
Oppvarmingstemperaturen til disse kildene er forskjellig. Så gnisten som oppstår når en metalllegeme rammes, kan ha en temperatur på opptil 1900 ° C, en flamme i en kamp er omtrent. 800 ° C, den ledende trommelen i beltetransportøren under glidning er opp til 600 ° C, og i varmen til den elektriske utladningen når temperaturen 10.000 ° C, med nesten øyeblikkelige kjemiske reaksjoner.
Brenning kan være komplett og ufullstendig. Ved fullstendig forbrenning, som forekommer med overskudd av oksygen, er reaksjonsproduktene karbondioksid, vann, nitrogen, svoveldioksid. Ufullstendig forbrenning oppstår med mangel på oksygen, forbrenningsprodukter i dette tilfellet er giftige og brennbare stoffer - karbonmonoksid, alkoholer, ketoner, aldehyder etc. En viss mengde luft er nødvendig for fullstendig forbrenning av brennbare stoffer: 1 kg tre - 4,18, torv - 5 , 8, propan - 23,8 m3.
Forbrenningsprosessen kan forestilles som følger. Et kaldt brennbart medium med innføring av en varmepuls oppvarmes, det er en intensiv oksidasjon av det brennbare medium med oksygen og ytterligere varmefrigivelse. Dette fører igjen til oppvarming av det tilstøtende lag av brennbart materiale, hvor en intens kjemisk reaksjon også finner sted. Ved en slik lag-for-lag-forbrenning av en brennbar substans beveger forbrenningssonen seg; Hastigheten til denne bevegelsen bestemmer intensiteten av forbrenningsprosessen og er dens viktigste karakteristikk. Prosessen med lag-for-lag oppvarming, oksidasjon og forbrenning fortsetter til hele volumet av brennbart materiale er uttømt.
Den smale sone hvor stoffet er oppvarmet og den kjemiske reaksjonen finner sted kalles flammefronten.
Brennbare systemer kan være kjemisk homogene og heterogene. Kjemisk homogene systemer er blandinger av brennbare gasser, damper eller støv med luft, hvor brennbart materiale og luft er jevnt blandet. Brenningen av slike systemer kalles homogen. I kjemisk inhomogene systemer, er brennbart materiale og luft ikke blandet og har et grensesnitt. Disse er ofte faste brennbare materialer og deres forbrenning heter heterogen.
Den totale forbrenningstiden for den brennbare blandingen Tg er summen av tiden som er nødvendig for kontakten mellom det brennbare stoffet og oksygenet τ к, og tiden hvor kjemikaliet i seg selv finner sted, oksidasjonsreaksjonen x
Avhengig av forholdet mellom disse to betingelsene, skilles diffusjon og kinetisk forbrenning. Ved brenning av faste brennbare stoffer, er tiden som kreves for at oksygen skal trenge (diffus) til overflaten av stoffet langt lenger enn den kjemiske reaksjonstiden, og den totale brennhastigheten bestemmes derfor helt av diffusjonen av oksygen til det brennbare stoffet. Forbrenningen av slike stoffer er oftest funnet på branner og kalles diffusiv. Forbrenning, hvis hastighet bestemmes av frekvensen av kjemisk reaksjon, kalles kinetisk. Denne typen forbrenning er karakteristisk for homogene brennbare systemer.
Avgrense kalorimetrisk, teoretisk og faktisk temperatur for brenning.
Kalorimetrisk temperatur ved forbrenning refererer til temperaturen til hvilken produkter med fullstendig forbrenning oppvarmes, dersom all den varme som frigjøres brukes til oppvarming, mengden luft er teoretisk nødvendig, stoffene er fullstendig brent og innledende temperatur er 0 ° С. Varmetap antas å være null. Hvis opprinnelig temperatur på drivstoff og luft er 0 ° C, så kalorimetrisk temperatur for forbrenning
![]()
hvor Qn er nettobalansverdien av brennbare stoffer, kcal / kg; V er volumet av forbrenningsprodukter, m3 / kg; c er den gjennomsnittlige volumetriske varmekapasiteten til forbrenningsproduktene, kcal / m3 · deg.
Følgelig er kalorimetrisk brenntemperatur bare avhengig av egenskapene til brennbare stoffer og er ikke avhengig av mengden. Den teoretiske forbrenningstemperaturen tar hensyn til varmetapet under forbrenning for å dissociere. Kalorimetrisk brenntemperatur er høyest for et brennbart stoff og brukes til kvalitativ vurdering. I virkeligheten, når det brenner, er det alltid varmetap som skyldes stråling, oppvarming av overflødig luft og miljø.
Den faktiske brenntemperaturen er branntemperaturen. Fordel temperaturen på den interne og eksterne brannen. Temperaturen på den eksterne brannen er flammens temperatur, og den indre temperaturen er temperaturen på røyken i rommet. Faktiske temperaturer som utvikler seg ved brann på grunn av varmetap til miljøet, oppvarming av forbrenningsprodukter og konstruksjoner
alltid mindre enn teoretisk med 30 ... 50%. For eksempel er den teoretiske brenntemperaturen på bensin 1730 ° C, og den faktiske temperaturen er 1400 ° C.
En blanding av brennbare damper og gasser med et oksidasjonsmiddel kan bare brenne med et visst innhold av drivstoff i den.
Den laveste konsentrasjonen av brennbar gass der forbrenning allerede er mulig kalles den lavere konsentrasjonsgrense for tenningen (LEL). Den høyeste konsentrasjonen der forbrenning fortsatt er mulig kalles øvre konsentrasjonsgrense for tenning (AIPW). Koncentrasjonsområdet som ligger innenfor disse grensene kalles antennegionen. Tenning er en brann (begynnelsen av brenning), ledsaget av en flammes utseende. Dette er en jevn lang forbrenning, som ikke stopper selv etter at tenningskilden er fjernet. Verdiene av nedre og øvre grenseverdier av tenning er avhengig av egenskapene til gass, damp og støv av luftblandinger, innholdet av inerte komponenter i den brennbare blandingen. Tilsetningen av inerte gasser til den brennbare blandingen reduserer tennene og til slutt gjør det ubrennbart. Vesentlig begrense antennens grenser, noen urenheter som senker forbrenningsreaksjonen. De mest aktive av disse er halogenerte hydrokarboner. Begge merkede egenskaper brukes til å slutte å brenne. Ved å senke trykket av blandingen under atmosfæretrykk, reduseres også tenningsområdet, og ved et visst trykk blir blandingen ikke brennbar. Økning av trykket i den brennbare blandingen utvider tennningsområdet, men som regel litt. Øk temperaturen i den brennbare blandingen utvider området av tenningen. Konvensjonen av tenningen påvirkes også av kraften i tenningskilden.
Det er ikke bare konsentrasjon, men også temperaturbegrensninger for tenning.
Temperaturgrenser for antennelse av damp i luft er de temperaturer i et brennbart stoff hvor dets mettede damper danner konsentrasjoner som tilsvarer den nedre eller øvre konsentrasjonsgrense for tenningen. Antennelsestemperaturen er den laveste temperaturen der et stoff tenner eller begynner å smolere og fortsetter å brenne eller smolde etter at antennekilden er fjernet. Antennelsestemperaturen karakteriserer et stoffs evne til selvforbrenning. Hvis antennelsestemperaturen til et stoff er fraværende, refereres det til som langsomt brennbart eller ikke brennbart.
Accelerasjonen av oksidasjonsreaksjonen under påvirkning av temperatur fører til selvantennelse. I motsetning til tenningsprosessen, hvor bare en begrenset del av volumet - overflaten - tennes, oppstår selvantennelse i hele volumet av stoffet. Selvantennelsestemperaturen forstås som den laveste temperaturen, som stoffet må oppvarmes for, slik at det vil antennes som følge av ytterligere auto-oksidasjon. Selvantennelse er bare mulig dersom mengden varme som slippes ut under oksidasjonsprosessen, overstiger varmenes utslipp til miljøet.
Selvantennelsestemperaturen er ikke konstant for et stoff, siden det i stor grad avhenger av betingelsene for dets bestemmelse. For å oppnå sammenlignende data er testapparatet og metoden for å bestemme selvantennelsestemperaturen for gasser og damper standardisert (GOST 13920-68). Den laveste temperaturen bestemt av standardmetoden, som blandingen av gasser og damper med luft må oppvarmes jevnt for å kunne antennes uten å innføre en ekstern tennkilde i den, kalles standard automatisk antennelsestemperatur.
En type spontan tenning er spontan forbrenning, dvs. forbrenning som et resultat av selvoppvarming uten påvirkning av en tenningskilde. Forskjellen mellom spontant tenning og spontan forbrenning er i temperaturens størrelse. Spontan forbrenning skjer ved omgivelsestemperatur, og for selvantennelse er det nødvendig å varme opp stoffet fra utsiden.

 Mottak av indikasjoner på tellere av varmt og kaldt vannforsyning
Mottak av indikasjoner på tellere av varmt og kaldt vannforsyning Beregning av arealet av luftkanaler av forskjellige former og beslag
Beregning av arealet av luftkanaler av forskjellige former og beslag Kjemisk forbrenningsprosesser. Eksplosjonsenergi
Kjemisk forbrenningsprosesser. Eksplosjonsenergi Hva vil skje hvis du ikke sender måleavlesninger
Hva vil skje hvis du ikke sender måleavlesninger