Tiek dedzināta dedzināšana. Ķīmiskie procesi degšanas laikā
Dažas pamata definīcijas
Atomu un molekulu skaits ir ērti izteikts kā vielas daudzumus arī vielas molu skaits. Viena mola vielas atbilst 6,023 ∙ 103 23 daļiņām (atomiem un molekulām). Numuru N A = 6,023 ∙ 10 23 mol -1 sauc par Avogadro numuru. Mola daļa x ikomponentu i ir mola n skaita attiecība i komponentu i kopējais molu skaits n = ∑ n i maisījumi ( x i = n i / n).
Masa m ir vielas pamatīpašums (mērvienība SI sistēmā ir kilograms). Masas daļa Wi ir masas attiecība m i komponentu i līdz maisījuma kopējai masai m = ∑ m i (Wi = m i / m).
Molekulmasa (vai molekulmasa) M i(g / mol) komponents I - ir šīs sastāvdaļas vienas mola masa. Tātad attiecībā uz atomu oglekli, molekulāro ūdeņradi, skābekli un metānu mums ir: M c = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. Maisījuma M (g / mol) vidējo mola masu var izteikt kā sastāvdaļu molārās frakcijas (M = x i M i).
Degšanas procesu noteikšana
Degšana - Tas ir komplekss fizikāli ķīmisks process, kurā uzliesmojošas vielas un materiāli, kas pakļauti augstām temperatūrām, nonāk ķīmiskā mijiedarbībā ar oksidētāju (skābekli gaisā), pārvēršoties sadegšanas produktos un kam pievienojas intensīva siltuma un gaismas emisija.
Nosacījumi, kas nepieciešami sadegšanas procesa iestāšanai: \\ t
Uzliesmojošas vielas (GV) klātbūtne;
Oksidētāja (O.) klātbūtne - gaisa skābeklis;
Aizdegšanās avota (I.Z.) klātbūtne.
Uzliesmojošais materiāls jāuzsilda līdz noteiktai temperatūrai, kurā sāksies oksidācijas process;
Lai karsētu degošu vielu noteiktā temperatūrā, ir nepieciešama noteikta aizdegšanās avota jauda;
Lai uzturētu degšanas procesu, ir nepieciešamas noteiktas degvielas un oksidētāja koncentrācijas.
Svarīgākie sadegšanas procesi ir siltuma un masas pārnese. Visbiežāk sastopamā degšanas īpašība ir liesmas rašanās un to pārvietošana visā degošā maisījumā, pārnesot siltumu vai izkliedējot aktīvās daļiņas no degšanas zonas uz svaigu degošu maisījumu.
Liesmas - Tā ir redzama degšanas izpausme. To sauc arī par degšanas zonu. Tā ir kosmosa daļa, kurā notiek degoša maisījuma pārveidošanās par pilnīgas un nepilnīgas sadegšanas produktiem.
Galvenie degšanas procesa parametri, kas izraisa nāvi un rada materiālus zaudējumus, ir:
Liels siltuma daudzums;
Augsta temperatūra;
Degšanas produktu toksisks sastāvs.
Degšanas process no gāzu molekulārās kinētiskās teorijas viedokļa
Att. 2.1. Aktīvo molekulu proporcija atkarībā no temperatūras: T 2\u003e T 1
Apkures gāzes degošs maisījums tajā palielina enerģijas pārpalikumu.
Atšķirība starp molekulu vidējo enerģijas līmeni aktīvajā stāvoklī un neaktīvā stāvokļa vidējo līmeni sauc par aktivācijas enerģiju. To var attēlot grafiski (2. attēls).

Att. 2.2. Reakcijas kursa enerģijas diagramma G.V. + O. ® PG: E darbība - aktivācijas enerģija; Q xr - sadegšanas reakcijas termiskā ietekme
Enerģija, kas atbrīvojas "pirmās" reakcijas molekulu mijiedarbības rezultātā, tiek pārnesta uz blakus esošajām molekulām. Tie ir satraukti, process tiek atkārtots ap reaģētajām molekulām ar lielu frekvenci un intensitāti. Tiek sākta pašrealizējoša, paātrinoša reakcija uz visu reakcijas maisījuma (2H 2 + O 2) ķīmiskās mijiedarbības procesu, ko papildina ūdens molekulu veidošanās un siltuma izdalīšanās vidē, kā arī luminiscence, t.i. rodas un izplatās degšanas process.
Jo augstāks ir E akta skaitliskais lielums, jo grūtāk ir padarīt šo komponentu pāris ķīmiskajā mijiedarbībā. Tāpēc E darbības vērtība ir netiešs rādītājs šīs ķīmiskās sistēmas ugunsbīstamības pakāpei.
Degšanas veidi un veidi
Degšanu var klasificēt pēc šādiem parametriem:
1. Atbilstoši degošu sastāvdaļu maisījumam:
a) kinetika - iepriekš sajauktas gāzes vai tvaika-gaisa maisījumu sadedzināšana. Tā kā degvielas un oksidētāja maisījums ir gatavs sadegšanai, līdz tas aizdegas, kopējais sadegšanas procesa ātrums ir atkarīgs tikai no degšanas reakcijas ātruma. Ja šāda sadegšana notiek slēgtā vai ierobežotā tilpumā, var rasties sprādziens. Tā kā maisījuma sadegšanas laikā atbrīvotajai enerģijai nav laika, lai to izlādētu pēc šī tilpuma, palielinot spiedienu, konstrukcijas var iznīcināt;
b) difūziju, difūzijas sadegšanu sauc par sadegšanu, kad degošas vides (degvielas un oksidētāja maisījuma) veidošanās notiek pirms degšanas zonas vai sadegšanas zonā.
2. Saskaņā ar degošo komponentu saņemšanas intensitāti ķīmiskās reakcijas zonā:
a) laminārs, bet degoša maisījuma sastāvdaļas nonāk sadegšanas zonā salīdzinoši mierīgi. Šajā gadījumā Reynolda kritērija skaitliskā vērtība, kas raksturo termodinamisko režīmu, būs ievērojami mazāka par kritisko (Re<2300).
b) nemierīgs, degoša maisījuma sastāvdaļas nonāk degšanas zonā ar lielu ātrumu. Reynolda numurs šajā gadījumā ir vairāk nekā 2300.
3. Saskaņā ar degoša maisījuma sastāvdaļu kopējo stāvokli: \\ t
a) viendabīgs kurināmais un oksidētājs ir tādā pašā agregatīvā stāvoklī (gāzveida);
b) heterogēna (daudzfāzu) - degviela un oksidētājs atrodas dažādos agregatīvos stāvokļos.
4. Par ķīmiskās degšanas reakcijas zonas izplatīšanās ātrumu:
a) ķīmiskās reakcijas zonas deflagrācija (lēni) (ātrums no 0,5 līdz 50 m / s);
b) detonācija (sprāgstviela), kad degšanas ķīmiskās reakcijas zona izplatās ar šoka viļņu ātrumu (no vairākiem simtiem metru sekundē līdz vairākiem kilometriem sekundē).
Tiek saukta telpa, kurā izgaismojas tvaiki vai gāzes ar liesmu .
Laminārās liesmas pirms sajaukšanas. Iepriekš sajaukta maisījuma laminārajās liesmās degviela un oksidētājs tiek sajaukti pirms sadegšanas sākuma un plūsma ir lamināra.
Iepriekš sajaukta maisījuma liesmu sauc stehiometriski ja degviela (ogļūdeņradis) un oksidētājs (skābeklis-O2) pilnībā patērē viens otru, veidojot oglekļa dioksīdu (CO 2) un ūdeni (H20). Ja ir daudz degvielas, viņi saka, ka maisījums ir bagāts, un, ja ir oksidētāja pārpalikums, viņi saka, ka maisījums ir slikts.
Apsveriet vienkāršākos piemērus:
1) 2H 2 + O 2 → 2H 2 O - stehiometriskais maisījums,
2) ЗН 2 + О 2 → 2H 2 O + Н 2-bagāts maisījums (Н 2 pārmērīgi),
3) CH4 + ZO 2 → 2H 2 O + CO 2 + O 2 - liesa maisījums (O 2 pārpalikums).
Katrs simbols šādā ķīmiskās reakcijas vienādojumā atbilst vienai vielas daļai. Tādējādi pirmais no šiem vienādojumiem nozīmē, ka divi moli H2 reaģē ar vienu molu O2, veidojot divus molus H2O.
Ja ķīmiskās reakcijas vienādojums ir rakstīts tādā veidā, ka apraksta tikai vienas mola degvielas reakciju, tad stohiometriskā maisījumā esošās degvielas mola frakciju var viegli noteikt no attiecības
x kalni, stokh = 1 / ((1 + v)
Šeit vapzīmē O2 molu skaitu reakcijas vienādojumā ar CO 2 un H 2 O veidošanos.
H 2 + 0,5O 2 → H20, v = 0,5, x 2, stoh = 2/3
Ja oksidētājs ir gaiss, jāņem vērā, ka sausais gaiss satur tikai 21% skābekļa, kā arī 78% slāpekļa un 1% cēlgāzu. Tādējādi, gaisam, X N 2 = 3,762 X O 2. No šejienes stehiometriskajam maisījumam ar gaisu būs vienādas molārās frakcijas
x kalni, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
kur v tāpat kā iepriekš, ir O 2 molu skaits reakcijas vienādojumā, kurā viena mola degviela ir pilnībā pārveidota par CO 2 un H 2 O. Daži vērtību piemēri v un degvielas molārās frakcijas stehiometriskiem degvielas maisījumiem ar gaisu ir parādīti 1. tabulā.
Iepriekš sajauktiem degvielas un gaisa maisījumiem (šajā gadījumā reakcijas vienādojumam jāpievieno atbilstošs N 2 daudzums, sk. 1. tabulu) ir raksturīgs gaisa ekvivalents:
λ = (x w / x kalni) / (x w, stoch / x kalni, stoh) = (w w / w kalni) / (w w, stoch / w kalni, stoch)
vai - līdzvērtīga attiecība degvielai F (F = 1 / λ). Šo formulu var pārveidot, lai varētu noteikt maisījuma molārās frakcijas lielumu pēc vērtības F:
x kalni = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x kalni,
X svars / 4,762, = 3,762
V vērtības un degvielas molu frakciju piemēri x kalni, stoichi stehiometriskiem degvielas maisījumiem ar gaisu
apūdeņošanai vienmēr ir pievienotas ķīmiskās transformācijas. Degšana gaisā - degošas vielas mijiedarbība ar skābekli. Tomēr jāatceras, ka slāpekļa oksīdi, halogenīdi un ozons degšanas procesā var darboties kā oksidētāji. Zināmi sadegšanas procesi, kas notiek, piedaloties tikai vienam produkta avotam - savienojumiem, kas spēj ātri sadalīties. Šādu savienojumu piemēri ir acetilēns un hidrazīns.
Ķīmiskie procesi, kas rodas degšanas laikā, ir ārkārtīgi sarežģīti. Pat visvienkāršākajā gadījumā - ūdeņraža sadedzināšana skābeklī, kura vispārīgajam vienādojumam ir forma
2H 2 + 0 2 = 2H 2 0,
ir izveidoti un pētīti vairāki desmiti elementāru posmu.
Līdz šim pietiekami detalizēti pētīti ķīmisko transformāciju mehānismi tikai dažu vielu, piemēram, ūdeņraža, oglekļa monoksīda, metāna un etāna, sadegšanas laikā. Šīs zināšanas tiek izmantotas, lai prognozētu daudzu vielu aizdegšanās un sadegšanas apstākļus.
2.1. Ķēdes reakcijas
Ķēdes reakcijas, atšķirībā no parastajām ķīmiskajām transformācijām, raksturo aktīvās daļiņas izskats katrā elementārajā aktā: atoms ar nesavienotu elektronu, brīvo radikāļu vai jonu. Aktīvo daļiņu parādīšanās izraisa izejmateriālu transformācijas ķēdi reakcijas produktos. Atomi, brīvie radikāļi un joni ir reaktīvāki nekā valences piesātinātās molekulas. Tāpēc, neraugoties uz ievērojamām enerģijas izmaksām, kas nepieciešamas ķīmisko saišu izjaukšanai un aktīvo daļiņu veidošanai, reakcijas ķēdes attīstība bieži izrādās enerģiski izdevīgāka nekā tieša mijiedarbība starp molekulām.
Degšanas procesi galvenokārt notiek, izmantojot ķēdes mehānismu. Ķēdes reakcijas - sarežģītas reakcijas, kas notiek vairākos posmos, kas pārstāv:
Ķēžu izcelsme (iniciācija), kurā veidojas aktīvās daļiņas;
Ķēdes turpinājums, kurās aktīvās daļiņas nonāk ķīmiskā mijiedarbībā ar izejvielām, kā rezultātā veidojas jaunas aktīvās daļiņas;
Ķēdes, kurās notiek aktīvo daļiņu "nāve", rodas, veidojoties gala reakcijas produktiem
Ķēdes izcelsme var notikt dažādos apstākļos. Piemēram, molekulu disociācijas rezultātā siltumenerģijas vai jonizējošā starojuma ietekmē elektriskā izlādē. Aktīvo daļiņu nāve notiek, kad tās rekombinējas *, kad brīvie radikāļi mijiedarbojas (viendabīga ķēdes lūzums), kad aktīvās daļiņas mijiedarbojas ar cietām virsmām (heterogēnas ķēdes lūzums) vai to reakcijas rezultātā ar degšanas inhibitoriem.
Ir ķēdes reakcijas ar sazarotu un sazarotu ķēdi. Katrai aktīvai daļiņai, kas tiek izmantota ķēdes turpināšanas reakcijās, ir nejauša virkne, kas ir viena no jauna. Par sākotnējo aktīvo daļiņu veidoto produktu molekulu skaitu sauc par ķēdes garumu. Ķēdes garums degšanas reakcijās svārstās no simtiem tūkstošu līdz desmitiem miljonu. Nozaru ķēdes reakciju ātrumu var ietekmēt nelielas vielas, kas var efektīvi mijiedarboties ar aktīvām daļiņām, piemēram, sadegšanas inhibitoriem.
Dažas vielas - ierosinātāji - veicina aktīvo daļiņu veidošanos un tādējādi paātrina ķēdes ķēdes reakcijas.
Zarotas ķēdes reakcijās uz vienu aktīvo daļiņu, ko patērē, turpinot ķēdi, izveidojas divas vai vairākas aktīvās daļiņas. Viens no tiem turpina primāro ķēdi, bet citi sāk jaunas ķēdes, veidojot sazarojumu (2.1. attēls).
"Rekombinācija ir neitrālu atomu vai molekulu veidošanās no uzlādētām daļiņām. Rekombinācijas laikā veidotie atomi un molekulas var būt zemes vai ierosinātā stāvoklī.
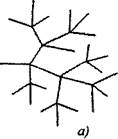
Att. 2.1. Reakcijas ķēžu shematisks attēlojums:
a) sazarošana katrā ķēdes posmā
6) retas sazarošanas
Piemēram, ūdeņraža degšanas laikā ķēdes uzsākšanas reakcijā:
veidojas aktīvs atoms. Ķēdes turpināšanas reakcijā:

pieaug aktīvo atomu skaits, kas ir jaunu ķēžu sākums.
Ķēdes ķēdes reakcijas var turpināties stacionārā režīmā, kad sazarojuma ātrums ir mazāks par aktīvo daļiņu nāves ātrumu un nestacionārā, kurā nāve notiek lēnāk nekā zarošana. Pēdējā gadījumā ķēdes reakcijas ātrums palielinās eksponenciāli un to ierobežo tikai izejvielu patēriņš. Pāreja no stacionāra uz nestacionāru režīmu notiek pēkšņi, nedaudz mainoties reakcijas apstākļiem: temperatūra, spiediens vai viena no reaģentu koncentrācija. Šādu strauju paātrinājumu uzskata par reakcijas maisījuma pašaizdegšanos vai ķēdes eksploziju.
Nozaru ķēdes reakciju atklāšana bija ļoti svarīga, lai radītu sadegšanas procesu teoriju. Pierādīts, ka ir divi aizdedzes veidi: termiskā un ķēdes. Ievietotie raksti
2. nodaļa. Ķīmiskie procesi dedzināšana
ķēdes procesu teorija var efektīvi ietekmēt degšanas procesu attīstību un apspiešanu ugunsgrēku laikā.
Ķēdes izcelsme.Sākotnējo aktīvo centru kodēšanas procesam ir liela nozīme nesaistītu ķēdes reakciju attīstībā. Tas kompensē aktīvo centru zudumus ķēdes izbeigšanas reakciju laikā. Šis mehānisms nosaka apstākļus stacionārā režīma veidošanai aktīvo centru uzkrāšanas sākotnējā periodā. Ar nelielu uzsākšanas ātrumu šis periods var būt nozīmīgs.
Lielākajai daļai ķīmisko reakciju liesmās ir ievērojams aktīvo centru enerģijas rezerves. Šādos apstākļos aktīvo centru uzsākšana ir saistīta ar ievērojamas enerģijas barjeras pārvarēšanu.
Šajā gadījumā svarīgu lomu spēlē faktori, kas nodrošina ievērojamu aktīvo centru rašanās ātrumu: ķīmiski aktīvās piedevas, radiācija, elektriskā izlāde, radioaktīvie bojājumi.
Starp faktoriem, kas lielā mērā veicina aktīvo centru veidošanos, jāņem vērā neviendabīgas reakcijas. Uz cietas virsmas adsorbēto uzliesmojošo vielu molekulās mazinās interatomiskās saites, un to laušana prasa mazāk enerģijas. Šajos apstākļos aktīvo centru veidošanās ātrums ir ievērojami lielāks nekā gāzes tilpumā. Aktīvā enerģija degošas maisījuma sastāvdaļu heterogēnajā mijiedarbībā ir arī zemāka nekā viendabīgas. Aktīvo centru heterogēnā uzsākšana faktisko sadegšanas procesu apstākļos ir svarīgs faktors stacionārā režīma paātrinātā sasniegšanā ar ķēdes ķēdes procesiem.
Dažas iezīmes raksturo nesaistītas ķēdes reakcijas, kas rodas, piedaloties atomu komponentiem. Tā kā nav piemaisījumu, kas mijiedarbojas ar aktīviem centriem bez reģenerācijas, ķēdes izbeigšana kļūst iespējama tikai tad, kad atomi rekombinējas ar trīskāršām sadursmēm un virsmu.
Jebkurā temperatūrā visas gāzveida vielas ir daļēji atdalītas. Dažas molekulas sadalās atomos. Šajā gadījumā pastāv līdzsvars starp disociācijas procesiem un atomu savienojumiem ar molekulām. Disociācijas pakāpe eksponenciāli ir atkarīga no temperatūras.
Ja uzliesmojošajā maisījumā ķēdes sadalīšanā nav piemaisījumu, reakcijas atomu sastāvdaļu koncentrācija praktiski nemainās. Atomi, kas ievadīti reakcijā, nekavējoties atjaunojas tajā pašā
Korolčenko A.Ya. Degšanas un eksplozijas procesi
lichie. Sākotnējā uzsākšana kompensē reaktīvos atomus tādā pašā apjomā kā ne-reaktīvajā sistēmā. Stacionāra reakcija neietekmē šo procesu. Viena no reakcijas sastāvdaļām, kas atšķiras ar vismazāko spēcīgo saiti starp atomu molekulu, ir šī režīma raksturīga iezīme. Cita atoma komponenta koncentrācija šajā gadījumā ir kvazistāla, bet līdzsvarotāka.
Ar viendabīgu degšanas reakciju uzsākšanu stacionārais režīms tiks izveidots tikai pēc noteikta laika, jo disociācijai ir nepieciešama liela aktivācijas enerģija. Šajā periodā disociācijas ātrums pārsniedz rekombinācijas ātrumu, un aktīvie centri uzkrājas reakcijas sistēmā. Abu procesu rādītāji tiek salīdzināti tikai pēc aktīvo centru koncentrācijas palielināšanas līdz līdzsvaram. Šo laika periodu sauc par indukcijas periodu.
Cietas virsmas klātbūtne kā katalizators reakcijas zonā nemaina termodinamiskās līdzsvara stāvokli. Katalizators vienādi ietekmē uz priekšu un atpakaļgaitas reakcijas. Aktīvie centri ne tikai cēlušies no cietas virsmas, bet arī nojaucas. Tomēr katalizatora klātbūtne paātrina līdzsvara disociācijas stāvokļa sasniegšanu.
Ja degošajā maisījumā ir aktīvās vielas, kas spēj piedalīties ķēdes bojājumu reakcijās, tās samazina aktīvo centru koncentrāciju. Šajā gadījumā tiek traucēta viena no sākotnējām sastāvdaļām līdzsvara disociācija, kas palēnina reakciju un var izraisīt tā izbeigšanu.
Eksperimenti rāda, ka, uzsākot nesaistītas ķēdes reakciju ar ārēju avotu (piemēram, gaismas avotu), aktīvo centru koncentrācija degšanas procesa attīstības sākumposmā var ievērojami pārsniegt līdzsvaru.
Zarotu ķēdes reakciju gaitā sākotnējās uzsākšanas apstākļi būtiski ietekmē reakcijas attīstību. Lēnas kustības procesos daļēji reaģēta maisījuma pievienošana sākotnējam procesam saīsina indukcijas periodu un paātrina liesmas sadegšanas brīdi.
Ķēdes turpinājums.Nozaru ķēdes reakciju raksturīga iezīme ir aktīvo centru koncentrācijas kvazi-stacionārums. Ja nav atvērtas ķēdes, tad tiek veidotas aktīvās daļiņas
2. nodaļa. Ķīmiskie procesi degšanas laikā
tāda pati summa, kādā tās tiek izlietotas. Jauni rodas tikai sākotnējās uzsākšanas brīdī. Ar vienādiem aktīvo centru ģenerēšanas ātrumiem un ķēdes izbeigšanu tiek noteikta pastāvīga aktīvo centru koncentrācija un stacionāra reakcijas režīms. Reakcijas ātrums samazināsies, kad tiek patērētas sākotnējās sastāvdaļas.
Zarotas ķēdes reakcijas gadījumā aktīvo centru koncentrācija reakcijas sistēmā palielinās neatkarīgi no to sākotnējās uzsākšanas apstākļiem. Ieviests paātrinošs reakcijas režīms, kam ir lavīna raksturs. Šajā gadījumā, lai pilnībā pārveidotu sākotnējās sastāvdaļas reakcijas galaproduktos, pietiek ar vienu sākotnējo aktīvo centru.
Zarotas vērtīgas reakcijas kinētiskais vienādojums ir šāds. Stabilu sākuma komponentu koncentrāciju izmaiņas laika gaitā var ignorēt, veicot pirmo tuvinājumu, un var ņemt vērā tikai ātrākas izmaiņas aktīvo centru koncentrācijā. p.Izmaiņas šajā ātrumā nosaka sākotnējās uzsākšanas ātrums un sazarojuma un ķēdes izbeigšanas reakciju ātruma attiecība. Sākotnējais uzsākšanas ātrums nav atkarīgs no sistēmā esošo aktīvo centru koncentrācijas. Filiāles un lūzumu procesi ir proporcionāli aktīvo centru koncentrācijai. Šādos apstākļos aktīvo centru veidošanās un izdevumu kopējais līdzsvars ir atkarīgs no iniciācijas, sazarošanas un lūzuma procesu likmju summas:
![]() (2.1)
(2.1)
kur un ir ātruma konstantes un lūzumu reakcijas. Apzīmējums, mēs saņemam:
![]() (2.2)
(2.2)
Kad aktīvo centru koncentrācijas laika atvasinājums
ir pozitīvs. Reakcijas ātrums laika gaitā palielinās. Šī sazaroto ķēžu reakciju iezīme ir saistīta ar aktīvo centru vairošanos šādos režīmos, kad sazarošanas reakcijas ātrums pārsniedz ķēdes izbeigšanas reakcijas ātrumu.
Korolčenko A.Ya. Degšanas un eksplozijas procesi
Ja pirms reakcijas sākuma sistēmā nebija aktīvo centru, t.i. piet= 0, n = 0 vienādojums (2.2) sniedz:
![]() (2.3)
(2.3)
CO kopējo reakcijas ātrumu nosaka sazarošanas procesa ātrums. Galaprodukti veidojas tikai šīs reakcijas laikā. Katram elementāras ķēdes sazarošanas gadījumam tiek veidotas galaprodukta molekulas. Tas ir šāds:
![]() (2.4)
(2.4)
Ķēdes reakcijas attīstība laika gaitā ir atkarīga no sazarojuma un ķēdes izbeigšanas reakciju ātruma konstantu un kad eksponents vienādojumā (2.4) ir pozitīvs un atkārtots
darbība ir neierobežoti paātrināta. Sākotnējā reakcijas attīstības posmā šādas attiecības ir spēkā:
Sakarā ar to, ka sākotnējās uzsākšanas ātrums ir neliels, sākotnējā periodā ķīmiskā transformācija nav pamanāma. Pēc kāda laika vērtība kļūst ievērojami lielāka par vienu. Pēc tam reakcijas ātrums saskaņā ar (2.4) vienādojumu sāk strauji pieaugt un sasniedz ļoti lielas vērtības, lai gan tas bija praktiski nemanāms.
Atlikuma perioda (indukcijas periods) klātbūtne ķēdes reakcijas izstrādes gaitā ir saistīta ar nepieciešamību uzkrāt noteiktu skaitu aktīvo centru reakcijas sistēmā. Tikai pēc šīs ķīmiskās transformācijas pamanāmas.
Indukcijas perioda lielums ķēdes reakcijās nosaka sazarošanas un ķēdes izbeigšanas procesu ātrumu, nevis sākotnējās uzsākšanas ātrumu. Savukārt zaru un lūzumu reakcijas ātrums ir atkarīgs no katras reakcijas sistēmas ķīmiskajām īpašībām, tās nosaka atkarība no temperatūras un sākuma komponentu koncentrācijas. Ķēdes reakciju īpatnība
ir tas, ka sazarošanas procesi prasa ievērojamu aktivācijas enerģiju, bet lūzuma procesa ātruma konstantes temperatūras koeficients ir tuvu nullei. Visu trīs veidu ķēžu izbeigšanas reakcijās: lielapjoma un neviendabīgu rekombināciju gadījumā, aktīvo piemaisījumu radikāļu mijiedarbībā, aktivācijas enerģija ir nulle.
Pieaugot temperatūrai, maisījuma kopējam spiedienam vai reaktīvo komponentu koncentrācijas izmaiņām, ir iespējams mainīt zaru un lūzumu ātruma konstantes, pie kurām reakcija mainās no stacionāra uz nestacionāru. Šī procesa īpatnība ir pēkšņa pāreja no viena režīma uz citu, mainot reakcijas ātrumu no nenozīmīgas vērtības uz neierobežotu pieaugumu.
Dažu ķēdes reakciju plūsmu papildina starpproduktu veidošanās, kas ir salīdzinoši stabili, bet spēj radīt aktīvus centrus. Šādas reakcijas ir, piemēram, ogļūdeņražu sadegšanas reakcijas kā starpprodukti, kuros veidojas peroksīdi un aldehīdi. Tas noved pie ķēdes sazarojuma. Tomēr, pateicoties starpproduktu relatīvajai stabilitātei, reakcijas paātrinājums ilgst. Šādas lēnās sazarošanas ķēdes sauc par deģenerētu.
Ķēdes reakcijas ar parasto radikālās sazarošanas mehānismu, parasti, pateicoties radikāļu augstajai aktivitātei, notiek diezgan ātri. Iegūtie radikāļi vai nu uzsāk ātras paātrināšanas reakciju, vai rekombinē un iziet no procesa.
Atvērta ķēde Aktīvā daļiņa, tāpat kā jebkura gāzu molekula, reaģē sistēmas iekšienē nejaušās kustībās, sadursmes ar citām molekulām. Tajā pašā laikā pastāv zināma varbūtība, ka mijiedarbība ar citu aktīvo daļiņu vai molekulu ir sadursme un jaunas aktīvas daļiņas veidošanās, turpinot iepriekšējā ceļa ceļu. Reakcijas ķēdes attīstība ir līdzīga inertu molekulu Brauna kustībai, lai gan aktīvo centru pārnešana ir saistīta ar ķīmisku reakciju. Ķēdes attīstības ceļā alternatīvie aktīvi centri ar diviem vai vairākiem tipiem.
Korolčenko A.Ya. Degšanas un eksplozijas procesi
Reakciju ķēde turpinās līdz brīdim, kad aktīvā daļiņa nereaģē bez reģenerācijas. Šajā gadījumā notiek tā sauktā atvērtā ķēde. Lūzuma procesiem ir liela nozīme ķēdes reakciju kinētikā. Pastāv divu veidu reakcijas, kas izraisa aktīvo centru nāvi:
Homogēns pārtraukums (reakcijas maisījuma tilpuma nāve);
Heterogēns pārtraukums (nāve uz cietas virsmas) Homogēns ķēdes pārtraukums ir iespējams ar vienu no diviem procesiem:
ja radikāļi ir rekombinēti vai ja dažādas ķīmiski aktīvas sastāvdaļas mijiedarbojas ar aktīvajiem centriem bez pēdējās reģenerācijas.
Heterogēnas ķēdes lūzumi notiek uz kvēpu daļiņām, kas veidojas degšanas laikā vai uz cieto dedzināšanas materiālu virsmas. Atklātu ķēdi uz cietas virsmas var uzskatīt par aktīvo centru difūziju no gāzes maisījuma uz šo virsmu, uz kuras tās izzūd. Rekombinācijas mehānisms uz cietas virsmas ir tāds, ka aktīvā daļiņa, kurai ir paaugstināta reaktivitāte, ir virsmas virsmas. Radikāļi, kas sorbējas uz blakus esošajām vietām, apvienojas savā starpā, jo šajā procesā nav enerģijas un telpisko šķēršļu. Stabilu savienojumu molekulas, kas veidojas rekombinācijas rezultātā, vairs nav iesaistītas ķēdes reakcijas attīstībā.
Tomēr ne katra aktīvās daļiņas sadursme ar cietu virsmu noved pie tā adsorbcijas. Varbūt tā atstarošana no virsmas. Aktīvā centra adsorbcijas varbūtību ar cieto virsmu sauc par izmitināšanas koeficientu. Šis koeficients ir aktīvās daļiņas un virsmas ķīmiskās afinitātes raksturojums. Praktiski nozīmīgos gadījumos aktīvā daļiņa pēc atstarošanas no sienas nav tālu no tā. Ir iespējama jaunu sadursmju ar sienu iespēja, līdz notiek tā izvietošana. Šī procesa dēļ noteiktos apstākļos reakcijas ātrums ir praktiski neatkarīgs no izmitināšanas koeficienta. Process notiek tādā veidā, kā ES
* Sorbcija - vielas h) absorbcija cietā ķermenī (vai šķidrumā). Absorbējošo ķermeni sauc par sorbentu, kas absorbēts- sorbāts. Atšķirt visu sorbenta masas (absorbcijas) absorbciju un virsmas slāni (adsorbciju). Sorbciju ķīmiskā tipa mijiedarbības dēļ starp cietā sorbenta virsmu un sorbātu sauc par chemisorption.
__________________________ 2. nodaļa. Ķīmiskie procesi degšanas laikā
ja katrai sadursmei radās atvērta ķēde. Aktīvo centru koncentrāciju virsmā var uzskatīt par nulli.
Ja reaktīvajā maisījumā nav aktīvo piemaisījumu, ķēžu lūzums var notikt vai nu uz cietām virsmām, vai homogēni, rekombinējot radikāļus masā. Reālos ugunsgrēkos otrais veids galvenokārt tiek īstenots.
Noteikta ietekme uz ķēdes reakciju kinētiku ir reaktīvo gāzu reakcijas sistēmā. Inertās piedevas palielina sadursmju skaitu ar aktīvām daļiņām, palielina ķēdes lūzuma iespējamību un attiecīgi kavē kopējo reakciju.
Efektīvāka ķēdes reakciju inhibēšana tiek panākta, reaģējošajā maisījumā ieviešot reaktīvās piedevas - inhibitorus. Inhibitori mijiedarbojas ar aktīvajiem centriem, izraisot reakciju, pārtraucot ķēdi. Reakcijas kinētiku inhibētajā maisījumā nosaka konkurences apstākļi starp inhibitoru un reakcijas galvenajām sastāvdaļām, mijiedarbojoties ar aktīvajiem centriem. Pateicoties lielajam inhibitora efektivitātei un mērenajam jaunu aktīvo centru veidošanās ātrumam, jau mazās inhibitora piedevas var pilnībā nomākt ķēdes reakcijas gaitu.
Ugunsgrēka un sprādzienbīstamības praksē inhibēšanas procesi ir ļoti svarīgi. Inhibitoru lietošana ļauj efektīvi ietekmēt sadegšanas procesus.
2.2. Ķīmiskie procesi ūdeņraža degšanas laikā
Ūdeņraža molekulas mijiedarbība ar skābekļa molekulu notiek kompleksā veidā, izmantojot virkni secīgu posmu. Tagad ir stingri noskaidrots, ka ūdeņraža sadegšana notiek ķēdes mehānismā, un daļiņām ir aktīvo centru loma. Elementāru reakciju secība un nozīme ūdeņraža degšanas laikā ir sīki aprakstīta dažādiem apstākļiem, kas saistīti ar ūdeņraža liesmu rašanos un attīstību.
Detalizētāko ūdeņraža sadedzināšanas procesa analīzi automatizēšanas režīmā, izmantojot eksperimentālās un skaitļošanas metodes, veica profesors A. N. Baratovs. Viņš ierosināja šādu procesa shēmu, tostarp četrpadsmit pamata elementāras reakcijas:
Korolčenko A.Ya. Degšanas un eksplozijas procesi
Aktīvo centru izcelsme notiek pēc reakcijas
![]()
Reakciju ķēdes turpināšana
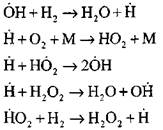
Filiāles ķēdes
 |
atvērtā ķēde
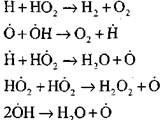 |
Ūdeņraža atomu koncentrācija autoignizācijas procesa sākumposmā ir nenozīmīga daļa no sākotnējā ūdeņraža satura. Attīstoties ķēdes reakcijai, molekulārā ūdeņraža konversijas ātrums kļūst tik augsts, ka tas tiek patērēts simtdaļās sekundes.
2.3. Ķīmiskās reakcijas, degot oglekļa monoksīdu
Oglekļa monoksīda mijiedarbība ar skābekli ir galvenā reakcija degšanas procesos. Šīs reakcijas gaita laikā
__________________________ 2. nodaļa. Ķīmiskais processs degot
daudzos gadījumos nosaka oglekli saturošu vielu sadedzināšanas likumus. Reakciju raksturo sazarotas ķēdes mehānisms. Tam ir vairākas funkcijas.
Ilgu laiku bija pārliecība, ka pilnīgi sauss CO un 0 2 maisījums nevarēja aizdegties un sadedzināt. Tomēr rūpīgi noteikti eksperimenti, kuros tika novērots ūdens trūkums, izmantojot masas spektrogrāfu, parādīja, ka aizdegšanās ir iespējama arī sausajam maisījumam. Jāatzīmē, ka CO + 0 2 ūdens tvaika vai ūdeņraža klātbūtne sistēmā aktivizē aizdegšanās un sadegšanas procesu, palielinot iespējamo aktīvo centru skaitu. Ūdens paātrinošā iedarbība ir īpaši pamanāma zemās koncentrācijās.
Oglekļa monoksīda sadedzināšana ūdens tvaiku klātbūtnē vai nelielu ūdeņraža piedevu klātbūtnē notiek, iesaistot šādus elementāros procesus:

Radikāļi H2, kas veidojas ar reakciju (VI), var turpināt ķēdi (reakcija VIII) vai izraisīt tās sadalīšanos ar reakciju (IX-XII).
Lai novērtētu CO lēnas oksidācijas pārejas uz ķēdes sprādzienu apstākļus, novērtēsim ķēdes pārrāvuma varbūtību cauri H2; šeit mēs ņemam vērā, ka reakciju (X) un (XI) loma ķēdes izbeigšanā būs nenozīmīga attiecībā uz
salīdzinājumā ar reakciju (IX), jo procesu (IX-XI) ātruma konstantes temperatūrā 1000 K ir tuvu viena otrai, bet radikāļu koncentrācija ir daudz zemāka nekā ūdeņraža atomu koncentrācija, jo radikāļiem ir augstāka ķīmiskā aktivitāte. Tāpēc atvērtās ķēdes varbūtību caur radikāli H0 2 var rakstīt šādā formā:
Temperatūrā 1000K
Tāpēc, ja tas ir iespējams
![]()
![]()
lieluma efekts
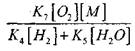
(2.7) vienādojuma atrisināšana būs vāja.
2. nodaļa. Ķīmiskie procesi degšanas laikā
Gadījumā, ja. \\ T ![]() vai
vai ![]() (kas ir novērots
(kas ir novērots
ar patiesu liesmu AR), (2.7.) vienādojums tiek pārvērsts formā:
![]() (2.8)
(2.8)
Tādējādi oglekļa monoksīda degšanas gaisā stāvokli lielā mērā nosaka ūdeņraža degšanas klātbūtne un raksturs. CO oksidācija ar reakciju (I) ir atkarīga no OH radikāļu koncentrācijas, kas veidojas ūdeņraža reakcijās.
Oglekļa monoksīda sadegšanas reakcijas īpatnība ir tās ātra inhibīcija, kad nelielas piedevas tiek ievadītas reaktīvajā sistēmā ar augstu afinitāti pret ūdeņraža atomiem. Šādas vielas, kas kavē CO sadegšanu, ir ogļūdeņražu halogenīdi un halogēna atvasinājumi. To inhibējošā iedarbība, ko izraisa reakcijas ķēžu izbeigšana, kad reakcija mijiedarbojas ar ūdeņraža atomiem
2.4. Ogļūdeņražu dedzināšana
Ūdeņraža un oglekļa monoksīda sadegšanas procesu pārbaude parāda sadegšanas reakcijas mehānisma sarežģītību. H 2 un CO gadījumā reakcija notiek kā ķēde, kurā piedalās daudzi elementārie posmi un starpprodukti. Tāpēc ir dabiski sagaidīt, ka sarežģītāku vielu - ogļūdeņražu - sadegšanas reakciju mehānisms ir vēl sarežģītāks, un šo savienojumu aizdegšanās un sadegšanas procesu sekas ir daudzveidīgākas.
Pašlaik pieejamā informācija par ogļūdeņražu ķīmisko paaugstināšanos to sadedzināšanas procesā ļauj mums zināmā mērā izskaidrot novēroto ietekmi.
Tika konstatēts, ka ogļūdeņražu liesmās kopā ar jau zināmām aktīvajām daļiņām ir liels skaits sarežģītākas struktūras starpproduktu. Dažos gadījumos tie kļūst par jaunu ķēžu rašanās avotiem. Galveno lomu ogļūdeņražu aizdedzināšanas un sadegšanas procesos spēlē šādi starpproduktu veidi:
Korolčenko A.Ya. Degšanas un eksplozijas procesi
1. Ogļūdeņraža radikāļi, kas ir
levodoroda, kas noņēma vienu vai vairākus ūdeņraža atomus. Tie ir
atliekas sauc par alkilgrupu (CH3 - metilgrupa; C2H5 - etilgrupa; C3H7 - propilgrupa un. \\ t
utt.). Sakarā ar augstu reaktivitāti, brīvie alkilgrupas
nav ilgu laiku. Uzliesmojumos kā starpprodukts
produktiem. Mijiedarbojoties ar citām molekulām, rīkojieties
kā neatkarīga strukturālā grupa. Ogļūdeņraža radikāļi
parasti ir burts R.
2. Peroksīdi - savienojumi ar vispārējo formulu R-00-R ”.
3. Aldehīdi - tipa savienojumi
![]()
Vienkāršākie aldehīdi ir skudrskābe (formaldehīds) un etiķskābe (acetaldehīds). ![]() . Šīs vielas ir visas
. Šīs vielas ir visas
ir nepietiekamas ogļūdeņražu sadegšanas produktos.
Ķēdes veidošanās ogļūdeņražu degšanas laikā var būt jebkura reakcija, kurā veidojas ogļūdeņraža radikāļi. Tas var būt etāna molekulas sadalīšanās reakcija ar divu brīvu metilgrupu veidošanos:
![]()
vai ogļūdeņraža reakcija ar skābekli:
![]()
Ķēdes turpinās veidošanās reakciju rezultātā peroksīds vai hidroperoksīds:
![]()
Ķēdes sazarošana tiek veikta hidroperoksīda sadalīšanās laikā:
2. nodaļa. Ķīmiskie procesi degšanas laikā
Dotā reakciju secība izraisa pakāpenisku peroksīda savienojumu koncentrācijas palielināšanos reakcijas sistēmā.
Vienlaikus ar peroksīdu uzkrāšanos, radikāļiem un iedarbināšanu
ir paralēlas reakcijas:

Šīs reakcijas ir eksotermiskas; ja tie ieplūst lielā daudzumā siltuma.
Pieaugot reakcijas maisījuma temperatūrai, aktīvo centru loma pāriet no viena starpprodukta uz citu šādā secībā: alkilhidroperoksīdi, acilhidroperoksīdi, formaldehīdi.
Eksperimentāli pētījumi par reakcijas maisījuma sastāva izmaiņām augstā temperatūras apgabalā (600–800 ° C) liecina, ka sākotnējo ogļūdeņražu pārveidošanās par galīgajiem sadegšanas produktiem ir sadalīta divos posmos: pirmais, kas notiek ļoti augstā ātrumā, oksidē ogļūdeņražus līdz CO. Otrajā, lēnajā stadijā CO oksidējas līdz. Ļoti svarīgs secinājums ir šāds: daudzus ogļūdeņražu sadedzināšanas likumus var izskaidrot ar oglekļa oksīda sadegšanas pazīmēm.
2.5. Oglekļa dedzināšana
Oglekļa dedzināšana notiek saskaņā ar neviendabīga procesa mehānismu, kura specifika ir tāda, ka ķīmisko stadiju nevar uzskatīt par izolētu no gāzveida oksidētāja (gaisa skābekļa) pārnešanas no apkārtējās telpas uz degošas cietas vielas virsmu. Degšanas ātrums ir atkarīgs gan no oglekļa ķīmiskajām īpašībām, gan no īpašībām, kas nosaka skābekļa piegādi degvielas virsmai. Skābekļa padevi sadegšanas zonā veic, izmantojot difūziju un līdz ar to
Korolčenko A.Ya. Degšanas un eksplozijas procesi
atkarīgs no daudziem faktoriem: dedzināšanas korpusa forma un izmērs, gāzveida vides kustība, skābekļa un reakcijas produktu difūzijas koeficienti gan telpā virs degvielas virsmas, gan plaisās un porās, kas atrodas ogĜos un koksa būtiskos daudzumos.
Lai ilustrētu heterogēno oglekļa dedzināšanas īpašības, mēs uzskatām, ka atsevišķa ogles gabals, kas novietots krāsnī, kura ir sasildīta līdz 900 ° C temperatūrai. Sākotnējā brīdī ogļu sadegšana notiks uz tās virsmas esošā skābekļa rēķina. Pēc tam, kad tas ir izlietots, ap apsildāmo virsmu veidojas sadegšanas produktu slānis. Degšanas ātrums samazināsies, un process var tikt pārtraukts, ja nebūtu skābekļa, kas nāk no attālākām gāzes telpas zonām.
Šī plūsma notiek caur difūziju, un degšanas ātrumu nosaka difūzijas plūsma. Difūzijas intensitāte lielā mērā ir atkarīga no gāzes vides intensitātes un rakstura tuvu degošajai virsmai. Ķīmiskās reakcijas ātrumu galvenokārt nosaka temperatūra. Heterogēnas reakcijas, kā arī viendabīgas, ievēro Arre-nius likumu.
Augstās temperatūrās oglekļa oksidēšanas reakcija notiek ļoti ātri, un procesa kopējo ātrumu ierobežos skābekļa difūzija uz virsmas.
Līdz ar to oglekļa sadedzināšanas process sastāv no diviem atšķirīga rakstura procesiem: gaisa skābekļa transportēšanas no gāzes telpas uz tās patēriņa vietu un tā ķīmiskās mijiedarbības procesu ar cietā oglekļa virsmu. Abi šie procesi ir savstarpēji saistīti, bet katram no tiem ir savi likumi. Svarīgākais no šiem procesiem ir skābekļa patēriņa process, ko raksturo dažādas ķīmiskās reakcijas.
Skābekļa un oglekļa savienošanas kompleksās reakcijas mehānisms ir divu CO un C02 oksīdu vienlaicīga veidošanās, izmantojot C X 0 Y tipa starpkonstrukcijas fizikāli ķīmisko kompleksu, kas pēc tam tiek sadalīts CO un. Šo oksīdu attiecība ir atkarīga no degšanas apstākļiem. Tādējādi degšanas oglekļa reakcijas vienādojumu var rakstīt šādi:
2. nodaļa. Ķīmiskie procesi degšanas laikā
Pēc tam notiek viendabīga oglekļa oksīda degšanas reakcija:
kura mehānisms ir aplūkots 2.3. sadaļā.
Šī reakcija var notikt pie oglekļa virsmas, \\ t tāun ogļu masas iekšienē, tās porās un plaisās.
Vēl viena reakcija ir neviendabīga reakcija starp karstu oglekli un oglekļa dioksīdu:
![]()
Tas strauji plūst vietās, kur trūkst skābekļa, bet oglekļa temperatūra ir pietiekami augsta.
Aprakstīto reakciju kombinācija nosaka oglekļa sadegšanas produktu sastāvu.
DEGVIELAS PROCESU NEPIECIEŠAMĪBA
| R |
apūdeņošana viegli uzliesmojošos maisījumos var rasties pašaizdegšanās, aizdegšanās rezultātā ar ārēju avotu vai pašaizdegšanos. Ja pašaizdegšanās un aizdegšanās procesi ir raksturīgi gāzveida, šķidrā vai cietā stāvoklī esošām vielām, tad spontāna sadegšana ir raksturīga cietiem materiāliem (īpaši tiem, kas ir smalki sadalīti) vai augstas viršanas šķidrumiem, kas izplatīti uz materiāliem ar attīstītu virsmu.
3.1. Pašaizdegšanās. Stacionārā teorija
Uguns ir nekontrolēta dedzināšana, kas attīstās laikā un telpā, bīstama cilvēkiem un rada materiālus zaudējumus.
Ugunsbīstamība cilvēkiem ir atklāta uguns, dzirksteles, drudzis, toksiski degšanas produkti, dūmi, samazināts skābeklis, ēku vai iekārtu sabrukums.
Sadedzināšana ir strauji turpinoša fizikāli ķīmiskā reakcija, ko papildina karstuma un dūmu izdalīšanās, liesmas izskats vai kvēpināšana. Normālos apstākļos sadedzināšana ir process, kurā oksidē vai apvieno degošu vielu ar atmosfēras skābekli. Tomēr dažas vielas (piemēram, saspiesta acetilēna, slāpekļa hlorīds, ozons) var eksplodēt bez skābekļa, lai veidotu siltumu un liesmu. Līdz ar to degšana var rasties ne tikai no savienojuma, bet arī noārdīšanās reakcijām. Ir zināms arī tas, ka ūdeņradis un daudzi metāli var degt hlora, vara sēra tvaikos, magnija oglekļa dioksīdā uc atmosfērā.
Visbīstamākā sadegšana, kas notiek degošas vielas oksidēšanas laikā ar skābekli gaisā. Tajā pašā laikā ir nepieciešams aizdedzes avots, kas spēj piegādāt nepieciešamo enerģijas daudzumu degvielas sistēmai. Visbiežāk sastopamie aizdegšanās avoti ir dzirksteles, kas rodas, ja elektrisko iekārtu darbības traucējumi, pārsteidzoši metāla korpusi, metināšana, kalšanas darbi; siltums, ko rada berze; tehnoloģiskās apkures ierīces; ugunsdzēsības aparāti; adiabātiskās saspiešanas siltums; statiskās elektrības dzirksteļaizdedze; elektrisko kontaktu pārkaršana; ķīmiskās reakcijas, kas sākas ar siltuma izdalīšanos.
Šo avotu apkures temperatūra ir atšķirīga. Tātad dzirkstelei, kas rodas, kad metāla korpuss tiek sasprādzēts, var būt temperatūra līdz 1900 ° C. 800 ° C, vadošā konveijera cilindra slīdēšanas laikā ir līdz 600 ° C, un elektriskās izlādes siltumā temperatūra sasniedz 10 000 ° C, gandrīz tūlītējas ķīmiskās reakcijas.
Degšana var būt pilnīga un nepilnīga. Ar pilnīgu sadegšanu, kas rodas ar skābekļa pārpalikumu, reakcijas produkti ir oglekļa dioksīds, ūdens, slāpeklis, sēra dioksīds. Nepietiekama sadegšana notiek ar skābekļa trūkumu, šajā gadījumā sadegšanas produkti ir toksiski un viegli uzliesmojošas vielas - oglekļa monoksīds, spirti, ketoni, aldehīdi uc Noteikts gaisa daudzums ir nepieciešams, lai pilnībā sadedzinātu degošu vielu: 1 kg koksnes - 4,18, kūdra - 5 , 8, propāns - 23,8 m3.
Degšanas procesu var iedomāties šādi. Silda aukstu degošu vidi, ieviešot siltuma impulsu, intensīvi sadedzināmā vide oksidējas ar skābekli un papildu siltuma izdalīšanos. Tas savukārt noved pie blakus esošā degoša materiāla slāņa sildīšanas, kurā notiek arī intensīva ķīmiskā reakcija. Šādā veidā sadedzinot uzliesmojošu vielu, degšanas zonas kustas; Šīs kustības ātrums nosaka degšanas procesa intensitāti un ir tās svarīgākā īpašība. Siltumizolācijas, oksidācijas un sadegšanas process notiek pa kārtām, līdz viss degošā materiāla daudzums ir izsmelts.
Šaurā zona, kurā viela tiek sildīta, un ķīmiskā reakcija tiek saukta par liesmas priekšpusi.
Degošas sistēmas var būt ķīmiski viendabīgas un neviendabīgas. Ķīmiski viendabīgas sistēmas ir viegli uzliesmojošu gāzu, tvaiku vai putekļu maisījumi ar gaisu, kuros degošas vielas un gaiss ir vienmērīgi sajaukti. Šādu sistēmu dedzināšana tiek saukta par viendabīgu. Ķīmiski nehomogēnās sistēmās degošas vielas un gaiss nav sajaukti un tiem ir saskarne. Tie bieži vien ir cieti degoši materiāli, un to sadegšanu sauc par neviendabīgu.
Kopējais degošā maisījuma sadegšanas laiks Tg ir laiks, kas vajadzīgs, lai notiktu saskare starp degošo vielu un skābekli τ, un laiku, kurā notiek ķīmiskā viela, oksidācijas reakcija τ x
Atkarībā no šo divu terminu attiecības atšķiras difūzija un kinētiskā sadegšana. Degot cietas uzliesmojošas vielas, laiks, kas nepieciešams skābekļa iekļūšanai (difūzai) uz vielas virsmu, ir daudz ilgāks par ķīmiskās reakcijas laiku, tāpēc kopējo degšanas ātrumu pilnībā nosaka skābekļa difūzijas ātrums uz degošo vielu. Šādu vielu dedzināšana visbiežāk tiek konstatēta ugunsgrēkos, un to sauc par difūzu. Degšanu, kuras ātrumu nosaka ķīmiskās reakcijas ātrums, sauc par kinētisko. Šis sadegšanas veids ir raksturīgs viendabīgām degošām sistēmām.
Atšķiriet degšanas kalorimetrisko, teorētisko un faktisko temperatūru.
Degšanas kalorimetriskā temperatūra attiecas uz temperatūru, uz kuras tiek uzsildīti pilnīgas sadegšanas produkti, ja viss izdalītais siltums tiek izlietots to uzsildīšanai, teorētiski nepieciešams gaisa daudzums, vielas ir pilnībā sadedzinātas un sākotnējā temperatūra ir 0 ° С. Tiek pieņemts, ka siltuma zudumi ir nulle. Ja degvielas un gaisa sākotnējā temperatūra ir 0 ° C, tad kalorimetriskā degšanas temperatūra
![]()
kur Qn ir uzliesmojošas vielas siltumspēja, kcal / kg; V ir sadegšanas produktu tilpums, m3 / kg; c ir sadegšanas produktu vidējā tilpuma siltuma jauda, kcal / m3 · deg.
Tādējādi kalorimetriskās degšanas temperatūra ir atkarīga tikai no degošās vielas īpašībām un nav atkarīga no tā daudzuma. Teorētiskā sadegšanas temperatūra ņem vērā siltuma zudumus sadegšanas laikā, lai atdalītos. Kalorimetriskās degšanas temperatūra ir visaugstākā degošai vielai un tiek izmantota kvalitatīvai novērtēšanai. Patiesībā, sadedzinot, vienmēr rodas siltuma zudumi radiācijas, gaisa pārkaršanas un vides dēļ.
Faktiskā degšanas temperatūra ir uguns temperatūra. Atšķirt iekšējās un ārējās uguns temperatūru. Ārējās uguns temperatūra ir liesmas temperatūra, un iekšējā temperatūra ir dūmu temperatūra telpā. Faktiskās temperatūras, kas rodas ugunsgrēka gadījumā, ko izraisa siltuma zudumi videi, sadegšanas produktu un struktūru apsilde
vienmēr mazāk nekā teorētiski par 30 ... 50%. Piemēram, benzīna teorētiskā dedzināšanas temperatūra ir 1730 ° C, un faktiskā temperatūra ir 1400 ° C.
Uzliesmojošu tvaiku un gāzu maisījums ar oksidētāju var sadedzināt tikai ar noteiktu degvielas saturu.
Vismazākā degošo gāzu koncentrācija, kurā jau ir iespējama sadegšana, tiek saukta par zemāko aizdegšanās robežvērtību (LEL). Augstāko koncentrāciju, pie kuras degšana joprojām ir iespējama, sauc par augšējo aizdegšanās koncentrāciju (AIPW). Koncentrācijas reģionu, kas atrodas šajās robežās, sauc par aizdegšanās reģionu. Aizdedze ir ugunsgrēks (degšanas sākums), kam pievienots liesmas izskats. Tā ir stabila ilgstoša degšana, kas neapstājas pat pēc aizdedzes avota izņemšanas. Apakšējās un augšējās aizdegšanās robežvērtības ir atkarīgas no gaisa maisījumu gāzu, tvaiku un putekļu īpašībām, inertu komponentu satura degošajā maisījumā. Inertu gāzu pievienošana degošajam maisījumam sašaurina aizdegšanās zonu un galu galā padara to nedegošu. Ievērojami samazina aizdegšanās robežas, daži piemaisījumi, kas palēnina degšanas reakciju. Visaktīvākie no tiem ir halogenētie ogļūdeņraži. Abas iezīmētās īpašības tiek izmantotas, lai apturētu dedzināšanu. Samazinot maisījuma spiedienu zem atmosfēras spiediena, arī tiek sašaurināta aizdegšanās zona, un zināmā spiedienā maisījums kļūst neuzliesmojošs. Uzliesmojoša maisījuma spiediena palielināšana paplašina aizdegšanās zonu, bet parasti nedaudz. Uzliesmojoša maisījuma temperatūras paaugstināšana paplašina aizdegšanās vietu. Aizdegšanās koncentrāciju ietekmē arī aizdegšanās avota jauda.
Ir ne tikai koncentrācija, bet arī aizdegšanās temperatūras robežas.
Temperatūras ierobežojumi tvaiku aizdegšanai gaisā ir tādas degošas vielas temperatūra, pie kuras tā piesātinātie tvaiki veido koncentrāciju, kas atbilst zemākajai vai augšējai aizdedzes robežkoncentrācijai. Aizdegšanās temperatūra ir zemākā temperatūra, kurā viela aizdegas vai sāk smirdēt un turpina degt vai smēķēt pēc aizdegšanās avota izņemšanas. Aizdegšanās temperatūra raksturo vielas spēju pašaizdegties. Ja vielas aizdegšanās temperatūra nav, tad to sauc par lēni sadedzinošu vai nedegošu.
Oksidācijas reakcijas paātrinājums temperatūras ietekmē izraisa pašaizdegšanos. Atšķirībā no aizdedzes procesa, kurā tikai neliela tilpuma daļa - virsma - aizdegas, pašaizdegšanās notiek visā vielas tilpumā. Pašaizdegšanās temperatūru uzskata par zemāko temperatūru, kurai viela jākarsē, lai tā aizdegtos turpmākās automātiskās oksidācijas rezultātā. Pašaizdegšanās ir iespējama tikai tad, ja oksidācijas procesā izdalītā siltuma daudzums pārsniedz siltuma izdalīšanos vidē.
Pašaizdegšanās temperatūra vielai nav nemainīga, jo tā lielā mērā ir atkarīga no tā noteikšanas apstākļiem. Salīdzinošo datu iegūšanai ir standartizētas testēšanas iekārtas un metode gāzu un tvaiku pašaizdegšanās temperatūras noteikšanai (GOST 13920-68). Zemāko temperatūru, kas noteikta ar standarta metodi, kurai gāzu un tvaiku maisījums ar gaisu vienmērīgi jāuzsilda, lai tas varētu aizdegties, neievietojot tajā ārēju aizdegšanās avotu, sauc par standarta pašaizdegšanās temperatūru.
Spontānas aizdegšanās veids ir spontāna sadegšana, t.i., sadegšana pašsasilšanas rezultātā bez aizdegšanās avota ietekmes. Atšķirība starp spontānu aizdegšanos un spontānu sadegšanu ir temperatūras vērtībā. Spontāna sadegšana notiek apkārtējās vides temperatūrā, un pašaizdegšanās gadījumā vielu nepieciešams sildīt no ārpuses.

 Karstā un aukstā ūdens apgādes indikatoru uztveršana
Karstā un aukstā ūdens apgādes indikatoru uztveršana Dažādu formu un veidgabalu gaisa kanālu laukuma aprēķins
Dažādu formu un veidgabalu gaisa kanālu laukuma aprēķins Degšanas procesu ķīmija. Sprādziena enerģija
Degšanas procesu ķīmija. Sprādziena enerģija Kas notiks, ja nenosūtīsiet skaitītāju rādījumus
Kas notiks, ja nenosūtīsiet skaitītāju rādījumus