წვის პროცესების ქიმია. აფეთქება ენერგია
აფეთქება ენერგია
ენერგიის სხვა წყაროებზე ასაფეთქებელი ნივთიერებების ძირითადი უპირატესობები კომპაქტურია, ტრანსპორტირება და ის ფაქტი, რომ ენერგეტიკის გათავისუფლება შესაძლებელია მოკლე დროში, რაც შესაძლებელს გახდის უზარმაზარი ძალაუფლების განვითარებას. ასე რომ, 1 კგ მასა და 1.65 გ / სმ 3 სიმკვრივის აფეთქებით, რომელიც ძლიერი აფეთქების - ჰექსოგენის, აღინიშნება (ინიცირებული) ცენტრიდან, ასაფეთქებელი ტრანსფორმაციის გამრავლების სიჩქარით (დეტონაცია) 8300 მ / წმ. გზა რ (რადიუსი), რომელიც გაივლის დეტონაციას, განისაზღვრება თანასწორობისგან
სადაც გუპი - მასობრივი და სატენდერო სიმჭიდროვე, შესაბამისად.
პროცესის განხორციელების დრო - τ = რ / დ (დ - აფეთქების სიჩქარე).
ძალაუფლება ნ (kJ / e), აფეთქების დროს განვითარებული, შეიძლება შეფასდეს, იცის, თუ რა მოცულობის სითბო გაათავისუფლეს რ 1 კგ RDX- ის ასაფეთქებელი ტრანსფორმაციით:
RDX- ისთვის რ = 5420 კჯ / კგ. გაანგარიშებული სიმძლავრე გადაჭარბებულია, რადგან დრო, რომლის დროსაც გაფართოების აირები არ ასრულებდნენ მუშაობას. აღსანიშნავია, რომ იგი აღემატება მსოფლიოს უდიდეს ელექტროსადგურებს. ასეთი სწრაფი ტრანსფორმაციის მქონე ასაფეთქებელი ნივთიერებები ეწოდება აფეთქება.
ასაფეთქებელი ასაფეთქებელი ნივთიერებები აფეთქების დაწყებას ითვალისწინებს, რომელთაც პრაქტიკულად არ გააჩნიათ დამოუკიდებელი გამოყენება და გამოიყენება მხოლოდ ასაფეთქებელი ნივთიერებების მომზადებისთვის. აფეთქების საშუალება (ასაფეთქებელი კაფსები, ასაფეთქებელი კარტრიჯები, ფუჟები, აფეთქებადი კვანძები და სხვ.) შერწყმულია სპეციალური ქვეჯგუფში. ასაფეთქებელი ასაფეთქებელი ნივთიერებები, სახანძრო და ასაფეთქებელი ნივთიერებები ქმნიან ასაფეთქებელ მასალებს. აფეთქების დროს აფეთქებისას და აფეთქების დროს დამატებით პირობებს აწესრიგებენ: დამატებითი ზომები იარაღის გადასაყრელად - სხვადასხვა წნევაზე განლაგებული იარაღისთვის - სტაბილური ფეთქებადი ასაფეთქებელი ნივთიერებებისათვის - ნივთიერების ტრანსფორმაციის პროპაგანდის ძალიან მაღალი მაჩვენებელი.
თუმცა, ასაფეთქებელი ნივთიერებები მხოლოდ სწრაფი ტრანსფორმაციის შესაძლებლობას იძლევა. თუ აფეთქების მცირე რაოდენობას ჩვეულებრივ საშუალებებთან ერთად ავიწროებთ და ატმოსფერულ პირობებში დამწვრობის საშუალებას იძლევა, აირების ჩამორჩენის გარეშე, წვიმა ნელა და მშვიდად გაიმართება. დაუსაბუთებელი ასაფეთქებელი ნივთიერებების განადგურების მეთოდით დამონტაჟება ეფუძნება ამ კვალიფიციურ აღსრულებას, უსაფრთხო და მოსახერხებელია. არასწორი წვის შემთხვევაში, შესაძლოა წარმოიშვას ის გარემოებები, რომლებშიც წვის სპონტანურად მოხდება აფეთქების აფეთქების სწრაფი გატარება.
რა არის აფეთქება? აფეთქება ეხება ნივთიერების ფიზიკურ თუ ქიმიურ ტრანსფორმაციას, რომლის ენერგია სწრაფად გადადის ნივთიერების შეკუმშვისა და გადაადგილების ენერგიად ან მისი ტრანსფორმაციისა და გარემოს პროდუქტებზე. აფეთქების ენერგია შეიძლება განსხვავებული იყოს. ქიმიური, ელექტრო, ბირთვული, თერმობირთვული, თერმული, კინეტიკური ენერგიის, ელასტიური შეკუმშვის ენერგიის გათავისუფლება შეიძლება თან ახლდეს ფეთქებადი პროცესები. მაგალითად, ელექტრული ნაპერწკლოვანი მასალების განადგურებისას მიკროელექტრონები გამოიყენება, რომლის ელექტროენერგიის წყარო ელექტროგადამცემია და ენერგიის გადამზიდავი არის აორთქლებისა და რღვევა ან უბრალოდ გათბობის საშუალება, რომელშიც შესრულებულია ხსნარი. შეკუმშული გაზის ცილინდრების, ორთქლის ქვაბების, მაღალი წნევის ჭურვების განადგურებით გამოწვეული აფეთქება შეიძლება მაღალ სიჩქარით გააგრძელოს და სერიოზული ზიანი მიაყენოს მიმდებარე სივრცეს.
თუმცა, მთავარია პოტენციური ქიმიური ენერგიის გამოყენება, რაც გარკვეულ პირობებში ბევრ ნივთიერებას (შედეგად ქიმიური რეაქცია) შეიძლება სწრაფად გაივლის ენერგეტიკული შეკუმშული აირები. ამგვარი ტრანსფორმაციის მქონე ნივთიერებები აფეთქებასა და აფეთქებას - ქიმიას უწოდებენ. მომავალში, აფეთქების შედეგად, სპეციალურ დათქმების გარეშე, მხოლოდ ქიმიური აფეთქების გაგებაში გვექნება, ხოლო ყველა პროცესი გათვალისწინებულია ქიმიური აფეთქების დროს მომხდარი პროცესებისადმი.
აფეთქება შეიძლება ხასიათდებოდეს გამოთავისუფლებული ენერგიის მოცულობით. მას შემდეგ, რაც ეს პროცესი ზოგჯერ განსაზღვრავს მოწყობილობის პარამეტრებს (მაგალითად, პნევმატური რადიატორისთვის - პალატის მოცულობით და შეკუმშული ჰაერის წნევით), უნდა შეეძლოს საკუთარი ენერგიის განსაზღვრა. პნევმატური რადიატორისთვის, უდრის PV /(კ - 1), სადაც რ - შეკუმშული გაზის წნევა; V - პალატის მოცულობა; k - კორექციის ფაქტორი (ჰაერისთვის კ = 1.4), ელექტროგადამცემი რადიატორისთვის - UC2/2, სადაც ერთად - მოცულობა U - დაძაბულობა. ქიმიური ასაფეთქებელი ნივთიერებების ენერგია ყველაზე ხშირად კილოგრამების კილოგრამებში აფეთქების სითბოს მიერ არის განსაზღვრული. ბუნებრივად, წყაროების შედარება მოიცავს ენერგიის ერთ ერთეულში გადატანას (კალორიებს ჯუელს და ა.შ.).
აფეთქების განხილვასთან დაკავშირებით, მოდი მიმართოთ პროცესი, გარკვეულწილად ამის საპირისპიროდ, იმპულსი, რომელიც ტექნოლოგიით დაიწყო. აფეთქების აფეთქების შედეგად, ენერგეტიკული დონე გაზების საშუალებით საშუალებას იძლევა გაზარდოს ექსპანსირება გარე გარემოზე მუშაობისთვის. იმპულსების დროს, გარემოში არსებულ გარემოზე ზეგავლენას აქვს უფრო მაღალი ზეწოლა, ვიდრე თავად წყაროზე, ხოლო როდესაც გამიჯვნის დაბრკოლებას მოხსნის, შესაძლებელია წყაროს შიგნით. ასეთი პროცესი შეიძლება გამოიწვიოს ტალღის დარღვევები. იმპულსის მარტივი მაგალითია ელექტრობალტის ბოლში (ევაკუაცია), ჰაერში გატეხილი. უფრო მაღალი წნევის საშუალო, უფრო ენერგია შეიძლება გაათავისუფლოს, როდესაც ღრუს ჩამოინგრა. ღრმა ჭაბურღილში, ეს ხდება მცირე წრეშიც კი. მსგავსი ფენომენი შეინიშნება წყალქვეშა აფეთქების დროს, როდესაც აფეთქების აფეთქება ზეგავლენას ახდენს ჰიდროქირურგიული წნეხის ქვეშ. სეისმურად, ეს არის რეზერვუარის წარმოქმნილი აფეთქების მეორე გავლენა, მასში საკმარისი სიღრმისეული სიდიდე.
ქიმიური აფეთქება - ნივთიერების თვითგამრავლებელი ქიმიური ტრანსფორმაცია, რომელიც მაღალ სიჩქარეზე, სითბოს წარმოქმნას და მაღალი წნევით შეკუმშული აირების ფორმირებას ახორციელებს. აფეთქება არის კონკრეტული შემთხვევა აფეთქება, რომელიც განხორციელდა მოცემულ ნივთიერებაზე მაქსიმალური მაქსიმალური სიჩქარით.
პირველ რიგში, საჭიროა აფეთქების დროს გამოთავისუფლებული ენერგიის (სითბოს რაოდენობა) შეფასება. რეაქციები ორი ტიპისაა - სითბოს (ეგზოთერმული) და შთანთქმის (ენდომოთერმული) გათავისუფლებით. მოლეკულების ფორმირების სითბოს - ატომების ნაერთები (ამ უკანასკნელის ფორმირების სითბო არის ნულოვანი) - შეიძლება იყოს უარყოფითი (აუცილებელია დამატებითი ენერგიის დახარჯვა მათი ფორმირებისაგან ელემენტებისაგან) და დადებითად. ასაფეთქებელი ნივთიერებების გამონაბოლქვი ჩვეულებრივ გამოწვეულია რეზისტენტული მჟავების კომპონენტებსა და ჟანგბადის აგენტებს შორის. თუ ასაფეთქებელია ინდივიდუალური ქიმიური ნაერთი, მაშინ ისინი სხვადასხვა ჯგუფებად იქნებიან მოლეკულაში, თუ შერეულია, ისინი სხვადასხვა ნივთიერებებია, რომლებიც ქმნიან ნარევი. მათი კოეფიციენტი განსაზღვრავს ნივთიერების ჟანგბადის ბალანსს. როდესაც ჟანგბადი არ არის საკმარისი იმისათვის, რომ მთლიანად დაასხით ასაფეთქებელი ნივთიერებების კომპონენტი, ბალანსი არის უარყოფითი. ნივთიერებების დადებითი ჟანგბადის ბალანსი, ნაწილი ჟანგბადის აფეთქება რჩება გამოუყენებელი და unproductively დაკარგა. კომპოზიტური ასაფეთქებელი ნივთიერებების თვისებები შეიძლება შეიცვალოს შესაბამისი ოქსიდანტები და აალებადი.
ჟანგბადის ბალანსი განისაზღვრება როგორც ჟანგბადის დეფიციტის ან ჭარბი (გრამებში) ჟანგბადისთვის ან ჟანგვის დროს დარჩენილი 100 გ ასაფეთქებელი ნივთიერებებისათვის. Tetranitrometa C (ΝO2) 4 ესაა +49, ammonium nitrate ΝH4 NO3 - +20, trotyl C7H5N3O6 - -74, hexogen (СH2N2) 3 - -21.6. მაქსიმალური უარყოფითი ჟანგბადის ბალანსი, განსაზღვრავს წყალბადის (-794), მაქსიმალური დადებითი არის ჟანგბადის (+100).
აფეთქების მაგალითი უარყოფითი ჟანგბადის ბალანსით არის ტრატოლი, საერთო მაღალი ასაფეთქებელი. მისი ქიმიური სახელი ტრინიტრტოლუვენია, გვხვდება სახელები, ტნტი. როგორც ჩანს, სტრუქტურული ფორმულადან, წყალბადის და ნახშირბადის ატომები და ჟანგვითი აგენტი - არის ჟანგბადი, რომელიც ნიტრო ჯგუფის (NO2) ნაწილისაა, TNT- ის მოლეკულაში ჯერ კიდევ არ არის დაკავშირებული:

ნივთიერების ფორმულაზე დაყრდნობით, შეგიძლიათ მიუთითოთ რომელი მიმართულებით რეაქცია გაგრძელდება მასში, რა პროდუქტი შეიძლება ჩამოყალიბდეს ამ შემთხვევაში. TNT- ისთვის, ასაფეთქებელი დისკომფორტის რეაქცია ასეთია:
პროდუქციის შემადგენლობა დამოკიდებულია აფეთქების პირობებსა და მათი საბოლოო მდგომარეობის შესახებ (გაფართოების ხარისხი). ბევრი ასაფეთქებელი სისტემა პირველია იმ რეაქციების გააზრებაზე, რომლებიც ხასიათდება ენერგიის მაქსიმალური გათავისუფლებით. ამგვარად, CaH4McOd ფორმის ფორმის მქონე ნივთიერებაში ჟანგბადის შედარებით მცირე ნაკლებობა [ დ< (2+ ბ / 2) პირველ რიგში, წყალბადის რეაქცია ჟანგბადში ყველაზე ხელსაყრელია, რადგან 255 კჯ ჟანგბადის ერთეულს გამოყოფენ H2O- ს წარმოქმნის დროს და 187 კჯ / CO2- ის ფორმირების დროს (CO2- ს ფორმირების სიცხე 379 კჯ / მოლ).
ასაფეთქებელი ნივთიერებების ტრანსფორმაციის სითბოს გაანგარიშების მიდგომა, რომელშიც რეაქციის შესაძლო რეაქციის პროდუქტებია დაფიქსირებული, რომლის ფორმირება უზრუნველყოფს მაქსიმალურ თერმული ეფექტს, ეწოდება მაქსიმალური ოპერაციის პრინციპი. გაანგარიშება გარკვეულწილად პროცესი იდეალიზებას პროცესში და აძლევს მაქსიმალურ სიზუსტეს სისტემებს დადებითი ან ოდნავ უარყოფითი ჟანგბადის ბალანსს. სინამდვილეში, აფეთქების პროდუქციის შემადგენლობა (PT) ჩვეულებრივ არ შეესაბამება ამ გაანგარიშებას. ეს უკანასკნელი იმით არის გამოწვეული, რომ აფეთქების შემდეგ გარკვეული პერიოდის განმავლობაში ურთიერთქმედება გრძელდება და წონასწორობა ეფუძნება რეაქციის პროდუქტებს როგორც დადებითი, ასევე უარყოფითი თერმული ეფექტებით. ეს უკანასკნელი მაგალითები რეაქციებია
უარყოფითი ჟანგბადის ბალანსის სისტემების სავარაუდო გათვლებით, შეგიძლიათ გამოიყენოთ Le Chatelier მეთოდი მაქსიმალური მოცულობის პრინციპზე დაყრდნობით და თუ ტომი იგივეა, მაშინ რეაქცია დიდი სითბოს გათავისუფლებასთან ერთად პრიორიტეტს წარმოადგენს. მეთოდი ყველაზე მეტად მოქმედებს აფეთქების პროდუქტის საბოლოო მდგომარეობის განსაზღვრისათვის. უპირატესობის რეაქცია არის ნახშირბადის ნახშირჟანგის დაჟანგვა. თუ ჟანგბადი არის underexposed, მაშინ იგი თანაბრად გაატარა დამატებითი ოქსიდაცია CO და H2. ამ შემთხვევაში RDX- ის დაშლის რეაქცია დაწერილია:
აფეთქების პროდუქტების კომპოზიციის უფრო ზუსტი გაანგარიშება ხორციელდება რეაქციის კინეტიკისა და პირობების გათვალისწინებით. ამ გათვლების სიზუსტე ყოველთვის საკმარისი არ არის იმის გამო, რომ საიმედო ინფორმაციის ნაკლებობა მაღალი ტემპერატურისა და ზეწოლის ქვეშ არსებულ მდგომარეობას წარმოადგენს. ექსპერიმენტულად მოიპოვება მონაცემები სითბოს და აფეთქების პროდუქციის შემადგენლობის შესახებ, რისთვისაც შემუშავებულია და წარმატებით გამოიყენება აფეთქების გამოძიების სპეციალური მეთოდები.
როგორც უკვე აღინიშნა, აფეთქების ენერგია ხასიათდება ფეთქებადი ასაფეთქებელი ტრანსფორმაციის სითბოს მიერ. აფეთქების წინამორბედებისა და პროდუქტების ფორმირების სითბოს გაცნობა და ჰესის კანონის გამოყენება (პროცესის თერმული ეფექტი არ არის დამოკიდებული ტრანსფორმაციის გზაზე, მაგრამ ნივთიერებების საწყისი და საბოლოო შტატებზე), ჩვენ შეგვიძლია გამოვყოთ სითბოს და აფეთქების მრავალი სხვა პარამეტრი. ასეთი გათვლები ასევე შეიძლება მოხდეს გეოფიზიკური ინჟინრის პრაქტიკაში, ვინაიდან გამოყენებულია შერეული ასაფეთქებელი ნივთიერებები და დენთის გამოყენება და გამოყენებული იქნება მზარდი რაოდენობით.
შეასრულეთ თხევადი საწვავით გრანულირებული ამონიუმის ნიტრატისგან Idanit ტიპის იაფი ასაფეთქებელი ნარევი გაანგარიშება. ნავთობპროდუქციის ნაცვლად გამოიყენება მზის ნავთობის ან ნავთობპროდუქციის ნაცვლად, რომლებიც ნივთიერებების ნარევია - ბენზოლის (C6H6) მიღება. განვიხილოთ შემთხვევა, როდესაც ასაფეთქებელი ნარევი მითითებულია კომპონენტების და ჟანგბადის ბალანსის მითითებით. ნება მიბოძეთ, რომ ბენზოლისა და ამონიუმის ნიტრატის ნარევი უნდა ჰქონდეს ჟანგბადის ბალანსი -10, წინააღმდეგ შემთხვევაში არ იქნება 10 გ ჟანგბადი, რომელიც მთლიანად ჟანგავს 100 გრ ნარევს. დასაწყისისთვის, ჩვენ დავადგენთ, თუ რა კომპოზიცია უნდა ჰქონდეს ნარევი, რათა დააკმაყოფილოს ამოცანა.
გამოსავლის გამარტივების მიზნით, წარმოიდგინეთ, რომ ჩვენი ასაფეთქებელი ნივთიერებები, როგორც ეს შედგებოდა ორი ნაწილისაგან - ერთ-ერთი კომპონენტი (ამ შემთხვევაში, საწვავი, რადგან ბალანსი უარყოფითია) მიღებული თანხა, რომელიც უზრუნველყოფს სასურველ ბალანსს და ნულოვანი ჟანგბადის ბალანსის სპეციფიკური ნივთიერებების ნაზავს stoichiometric). თუ დავამატებთ ამგვარი ნარევი საწვავის გამოითვლება საწვავით, წონაში 100 გ-ს მივაღწევთ, შემადგენლობა მივიღებთ მოცემული ჟანგბადის ბალანსს.
თანმიმდევრულად განახორციელოს გათვლები.
ბენზოლის მოლეკულის ჟანგვის შესახებ (მისი მოლეკულური წონაა 78)
საჭიროა 15 ჟანგბადის ატომი. შესაბამისად, ბენზინის ოდენობა x1, რომლის ჟანგვის საჭიროა 10 გ ჟანგბადის, ვიღებთ პროპორციულად "ბენზენ - ჟანგბადი აუცილებელია":
![]()
ამ რაოდენობის დამატება (100 - x1) ნულოვანი ჟანგბადის ბალანსის ნაზავი, მივიღებთ მოცემული შემადგენლობის ნარევი.
მოდით მივმართოთ კომპონენტების კონტექსტს 96.75 გ სტოიდიომეტრიული ნარევიდან. ჟანგბადი ზედმეტი ჟანგბადის განსაზღვრა. Saltpeter decomposes და რელიზები ჟანგბადის:
გარდა ამისა, 80 გ ჟანგვის აგენტი (მოლეკულური წონის ამონიუმის ნიტრატი 80) გათავისუფლდება 16 გ ჟანგბადის. ბენზოლისა და ამონიუმის ნიტრატის რეაქცია ნულოვანი ჟანგბადის ბალანსის ნარევიდან არის დაწერილი
შემდეგ ჩვენ მივიღებთ პროპორციას: ![]()
აქედან გამომდინარე, 96.75 გ ნარევი იქნება ბენზოლის 5.85 გრამი და ამონიუმის ნიტრატის 90.85 გ. ამგვარად, მოცემული ჟანგბადის ბალანსის შემადგენლობის საბოლოო შემადგენლობა და აფეთქების პროდუქციის შემადგენლობა მაქსიმალური ექსპლუატაციის პრინციპით გამოითვლება:
გაანგარიშების გარეშე, შესაძლებელი იყო დაუყოვნებლივ ჩაიწეროს თავისუფალი ნახშირბადის შემცველობა აფეთქების პროდუქტებში, ვინაიდან სწორედ მისი ყოფნა, რომელიც განსაზღვრავს ნარევი ჟანგბადის ბალანსს. ვინაიდან 12 გ ნახშირბადის სრული ჟანგვის ჟანგბადის 32 გრს მოითხოვს, 10 გ ჟანგბადს შეუძლია ნახშირბადის გაჟონვის ჟანგბადი ან ნახშირბადის მოლეტის ფრაქცია. ეს მოსაზრებები კარგია იმისთვის, რომ მოხდეს გაანგარიშებების ანალიზი.
ასეთი ნარევი მოამზადოს ძალიან მარტივია: ნიტრატის სწორი თანხა უნდა იყოს შერეული ბენზენით. საწყისი კომპონენტებით და აფეთქების პროდუქციის შედგენას იცნობენ, ადვილია სისტემის აფეთქების სითბოს გამოთვლა. აფეთქების პირველადი კომპონენტების და პროდუქტების ფორმირების სითბოს ნაპოვნია შესაბამისი დირექტორიები. ასე რომ, ბენზინის 1 მოლეტისთვის ესაა (kJ / mol) -39.1, ამონიუმის ნიტრატი - +410.8, CO2 - +444.2, H2O - +271.7.
აფეთქების თერმული ეფექტი კითხვაx საფასური შეიძლება განისაზღვროს განტოლებადან
 (4.29)
(4.29)
ეს იქნება 374 kJ / 100 გ ნარევი, ან 3740 კჯ / კგ.
გაზის წარმოების მოცულობა (ლიტრებში) შეიძლება გამოითვალოს რეაქციის განტოლებადან 22.4 (გრამი მოლეკულის მოცულობის) მიერ გაზის მჟავების რაოდენობის გამრავლებით. ბუნებრივია, ეს უნდა გაითვალისწინოს ნივთიერების მდგომარეობას. ასე რომ, ნახშირბადის (ნედლეული ტემპერატურა 3700 ° C- ზე ნორმალურ ატმოსფერულ წნევაზე) არ აძლევს გაზის ფაზას, წყლის, რა თქმა უნდა, იქნება ორთქლი. აფეთქების პროდუქტების მოცულობა, რომელსაც ეწოდება ნორმალური ატმოსფერული პირობები, ეწოდება მოცემული მოცულობა. ზემოთ განხილულ პრობლემაში, ეს იქნება დაახლოებით 800 ლ / კგ.
თუ აფეთქების პროდუქტის სითბო და შემადგენლობა ცნობილია, მაშინ მათი ტემპერატურა თმზე შეიძლება განისაზღვროს კავშირიდან თup = = Q / Cvcr სადაც ერთადv cp არის ინტერვალით აფეთქების პროდუქციის საშუალო სიცხე (მუდმივი მოცულობით) Τ 0–Τ ბრალდება მნიშვნელოვანია აღინიშნოს, რომ ტემპერატურა ტემპერატურის ფუნქციაა.
ეს უკანასკნელი შემოგთავაზებთ გარკვეულ (წმინდა ტექნიკურ) გართულებებს გაანგარიშებაში, ვინაიდან დამოკიდებულების სახეა. თუმცა, ადვილია გამოიყენოთ მზა სითბოს შემცველობა სხვადასხვა ტემპერატურაზე (ცხრილი 4.1).
ცხრილი 4.1
ცვლილებები სითბოს შინაარსით (შიდა ენერგია) ზოგიერთი აირის (kJ / mol)
|
ტემპერატურა, კ |
C (გრაფიტი) |
||||||
ტემპერატურის გათვალისწინებით და აფეთქების პროდუქტების შედგენის იცნობა, შეგიძლიათ მათი სითბოს შემცველობა და შეადაროთ აფეთქების სითბოს. შედარება განსაზღვრავს ტემპერატურის არჩევისას შეცდომის ბუნებას. ოპერაციის განმეორება, მაგრამ განსხვავებული (შესწორებული) ტემპერატურით, შეგიძლიათ გამოიყენოთ დაახლოების მეთოდი აფეთქების ტემპერატურის დასადგენად.
აღსანიშნავია, რომ აფეთქების დროს გათავისუფლებული ენერგია შედარებით მცირეა: ყველაზე ძლიერი ასაფეთქებელი ნივთიერებები აქვს აფეთქების სითბოს 6500-6700 კჯ / კგ. 1 კგ TNT- ის აფეთქებით ჰაერში დაახლოებით 4000 კვტ სითბო გათავისუფლდა, ხოლო 1 კგ დიზელის ნავთობის დაწვა - დაახლოებით 44,000 კჯ. მაგრამ დიზელის ნავთობის ჟანგბადის 1 კგ წნევის სითბოს მხოლოდ 10,000 კჯ, ხოლო 1 კგ დიზელის ნავთობისა და ჰაერის ნარევი - 2670 კჯ. განმეორებითი ყურადღება გამახვილდა იმაზე, რომ ენერგეტიკის გათავისუფლების გარდა, აფეთქება ახდენს აფეთქების დროს მიღებულ იმ ტემპერატურულ ნაწილში, რომლებიც გაზიანურ მდგომარეობაშია.
მიუხედავად იმისა, რომ სითბოს რეაქციის სითბო
დაახლოებით 2.3-ჯერ უფრო მაღალია, ვიდრე TNT- ის ასაფეთქებელი დაშლის სითბოს, მისი წვა ხდება მშვიდად; შედეგად მიღებული პროდუქტები, თუნდაც იმ ტემპერატურებზე, რომლებსაც ისინი თბება, თხევადი რჩება. მაგრამ ერთს მხოლოდ ტერტიტის სველი აქვს, რადგან სურათი იცვლება: სითბოს წყალი ორთქლზე გადააქვს და იწვის ასაფეთქებელი პროცესი. ასაფეთქებელი ნივთიერებით, რომელიც აფეთქებულად ითვლებოდა, აფეთქება დაუყოვნებლივ ჩამოყალიბდა უზარმაზარი წნევის გაზომვებისათვის - რეაქციის პროდუქტები, რაც უზრუნველყოფს გაზის გაფართოების შედეგად გათავისუფლებული ენერგიის რეალიზაციას.
ასაფეთქებელი ნივთიერების შექმნისას ჩვენ ბუნებრივია დაინტერესებული, რომ ასი აფეთქებით, უფრო მეტი ენერგია გათავისუფლდება და შეკუმშული აირები ჩამოყალიბებულია, რომლებიც ენერგიის სწორად გააზრება შეუძლიათ. ზოგჯერ ეს მოთხოვნები კონფლიქტს წარმოადგენს. ამდენად, ასაფეთქებელი დანგრევის ენერგია შეიძლება გაიზარდოს შესაბამისი საწვავის შერჩევით, კერძოდ, ასაფეთქებელი შემადგენლობის ლითონების შესამცირებლად, მაგალითად, ალუმინის (A12O3- ის ფორმირების სიცხე 1599 კჯ / მოლ). ალუმინის ჟანგვის პროდუქტები მყარია. დამატებით (მდე გარკვეული ლიმიტი) ალუმინის ზოგიერთი ასაფეთქებელი ნარევები შეიძლება გაიზარდოს ეფექტურობის ამ უკანასკნელის. ასაფეთქებელი ნივთიერებები აფეთქების გაზრდისას, რომლებიც შეიცავს შემადგენლობის ლითონებს. როგორც უკვე აღინიშნა, აფეთქების პროდუქციის შემადგენლობა დამოკიდებულია არა მხოლოდ ასაფეთქებელზე, არამედ აფეთქების პირობებზე: დაწყების მეთოდი, ბრალის ზომა და დიზაინი და შელი, გარემო პირობები, სადაც აფეთქება ხდება. თუ პირველადი პროდუქტები მუდმივად რჩება და აფეთქების პროდუქტების ცვლილების შემადგენლობა შეიცვლება, აფეთქების თერმული ეფექტიც შეიცვლება, რის შედეგადაც აფეთქების სხვადასხვა ღირებულებების აფეთქება სხვადასხვა ღირებულებების გათვალისწინებით ხდება იმის მიხედვით, თუ რა პირობებში ხორციელდება იგი. მაგალითად, მაგიდაზე. 4.2 შოუ (რ. შმიდტის მიხედვით) TNT- ის აფეთქების პროდუქტების შემადგენლობა (სიმკვრივე 1.52), როდესაც ბრალის აფეთქება აღელვებს სუსტი და ძლიერი ინიციატორების მიერ.
სწრაფი ქიმიური რეაქციის დაწყების გამო ასაფეთქებელი ნივთიერებების ტრანსფორმაციის მიზნით, მთლიანი მუხტის გადალახვა, პროცესი უნდა იყოს თვითდაფრაგმირება. ამისათვის ქიმიური რეაქცია უნდა ჰქონდეს შესაბამისი კინეტიკური მახასიათებლები, ხოლო ენერგიის გათავისუფლება უნდა გადაეცეს გარდაუვალი დანაკარგების კომპენსაციას. რეაქციის სიჩქარე, თვითმმართველობის გავრცელების, ეგზოთერმიურობის, გაზის ფორმირების უნარი მჭიდროდაა დაკავშირებული და გავლენას ახდენს ერთმანეთზე და ასაფეთქებელი პროცესის საზღვრებზე.
ცხრილი 4.2
TNT- ის აფეთქების პროდუქტების შემადგენლობა
ჩანართში. 4.3 გვიჩვენებს ინდუსტრიის მიერ გამოყენებული რაოდენობის ასაფეთქებელი და ფხვნილის მახასიათებლები.
ცხრილი 4.3
ასაფეთქებელი ნივთიერებების ასაფეთქებელი მახასიათებლები
აფეთქების აფეთქება ენერგეტიკის შედეგად გამოწვეულია იმის გამო, რომ მცირე რაოდენობით მყარი ან თხევადი ასაფეთქებელი ნივთიერებები იქცევა უზარმაზარ გაზონებად, რომელიც თბება ათასობით დონის ტემპერატურაზე. სხვადასხვა ტიპის ასაფეთქებელი ნივთიერებებისათვის, გამოთავისუფლებული აირების მოცულობა 1 კგ ასაფეთქებელი ნივთიერებით, რომელთა საწყისი მოცულობა არ აღემატება 0.8-1 ლ, არის ღირებულება 300-დან 1000 ლ-მდე. ასაფეთქებელი ნივთიერებების ცხელი აირისებრი დეკორაციის პროდუქტების აფეთქების შედეგად წარმოიქმნება მექანიკური სამუშაოების წარმოება. ამგვარად, ასაფეთქებელ ნივთიერებებს აფეთქების შედეგად გამოთავისუფლებული ლატენტური ქიმიური ენერგიის რეზერვი აქვთ. თუმცა, არა მხოლოდ ასაფეთქებელი ნივთიერებები აქვთ ლატენტურ ენერგიას, მაგალითად, ბენზინის, ქვანახშირის, შეშის და სხვა მწვავე ნივთიერებების. აალებადი ნივთიერებების ეს ენერგია შეიძლება გამოთავისუფლდეს წვის დროს. რატომ, ნაცვლად იმისა, რომ განადგურება და სროლა, ასაფეთქებელი და დენთის ნაცვლად, მაგალითად, ბენზინი? ცნობილია, რომ 1 კგ ბენზინის ენერგია 10 ჯერ აღემატება 1 კგ ტნტს, ხოლო 12-ჯერ უფრო მეტია, ვიდრე smokeless pyroxylin ფხვნილი. მაგრამ ასაფეთქებელი დანადგარი და საწვავის გადაუხდელობა უზარმაზარი სიჩქარით გაზის მიწოდებასთან ერთად, ბენზინზე ან ნებისმიერ საწვავს არ შეუძლია ცეცხლგამძლე საჰაერო ან თავისუფალი ჟანგბადის გარეშე. 1 კგ ბენზინის წვის საჭიროა ჟანგბადი, რადგან იგი შეიცავს 15,5 კგ ჰაერს. აქედან გამომდინარე, საწვავის წვის (ენერგია) სითბოს უნდა ჩაითვალოს 1 კგ მისი ნარევი მისი სრული წვისათვის აუცილებელი ჟანგბადისთვის. ამ გაანგარიშებით, განსხვავება ენერგეტიკული წნევის ენერგია ჟანგბადის და აფეთქების ენერგია იმავე თანხის ასაფეთქებელი ბრალდებაზე დაბალია, თუმცა ამ შემთხვევაში, გაზის წვის დროს გათავისუფლებული ენერგიის რაოდენობა უფრო მეტია: მყარი ფხვნილი - 2860 კჯ / კგ, ტროტილ - 4100 კჯ / კგ, ჟანგბადის ბენზინის ნარევი - 11,000 კჯ / კგ. შესაბამისად, ეს არ არის ასაფეთქებელი ნივთიერებების და დენთის ენერგეტიკული ოდენობა, რაც განადგურებისა და განადგურების მიზნებისთვის მათი გამოყენების ძირითადი მიზეზია. მთავარი მიზეზი არ არის ენერგეტიკის მასშტაბები, არამედ მისი სწრაფი გათავისუფლება. თუ ავტომობილის ძრავში 1 კგ ბენზინის დაწვა მოხდა (ძრავის სიმძლავრეზე დატვირთვაზე) 10-60 წთ-ში, 1 კგ ფხვნილს ცეცხლსასროლი იარაღის საარტილერიო იარაღით, რამდენიმე ათასით, და 1 კგ ტნტის აფეთქება გრძელდება მხოლოდ 30 -40 წუთი მეორე. აფეთქების დროს ენერგია ათავისუფლებს ათობით მილიონჯერ უფრო სწრაფად, ვიდრე საწვავის წვის დროს. ეს აფეთქების უზარმაზარ ძალას განმარტავს. თუმცა, უფრო სწორად, აფეთქების ძალაუფლების გამოთვლა არ არის მთლიანი მუხტის აფეთქების დრო, არამედ იმ დროისთვის, აფეთქების პროდუქტი აღემატება ნორმალურ ატმოსფერულ წნევაზე, აფეთქების პროცესის მაღალსიჩქარიანი სროლის შედეგად, რამდენიმე მილიწამებში ხდება. ამ შემთხვევაში, 1 კგ TNT- ის სიმძლავრე 1 მგვტ-ზე მეტია. მაგრამ რეალურ პირობებშიც კი, ეს ძალა არ შეიძლება სრულყოფილად განხორციელდეს მისი ხანმოკლე ხანგრძლივობის გამო, მასალის გადაცემის ან განადგურების მატერიალური ინერცია, რომელზეც იგი მოქმედებს, ისევე როგორც დანაკარგების გამო გარემოსდაცვითი გათბობის, გადაჭარბებული სახეხი და გავრცელება, ნარჩენი სითბოს აფეთქება პროდუქციის საბოლოო გაფართოების შემდეგ და გარდაუვალი ქიმიური დანაკარგების შესახებ. შედეგად, მექანიკური სამუშაოები ხშირად არ აღემატება 1-2% -ს, ხოლო აფეთქების დროს მყარი საშუალო - 8-9% შეფუთვაში. თუმცა, ასაფეთქებელი ნივთიერებებისა და სახანძროების დიდი პოტენციალი ენერგეტიკისთვის შეუძლებელია, მიუხედავად იმისა, რომ აფეთქების არასრული გამოყენება მოხდა. მაღალი ძალაუფლება დამახასიათებელია ასაფეთქებელი ნივთიერებებისთვის და როდესაც ისინი გამოყენებული იქნება ექსპლუატაციისთვის. მსხვილი კალიბრის არტილერიის გასროლის ფხვნილი ბრალია ძალა 10 მეგავატი.
პირველი ქრონოლოგიურად (მეცხრამეტე საუკუნის ბოლოს) იყო თერმული თეორია, რომლის დამფუძნებლებიც არიან მხატვარი, ლე ჭატიელი და ნუსელსტი. ამ თეორიის საფუძველს წარმოადგენს ვანოჰის ჰიპოთეზა ქიმიური რეაქციის ტემპერატურული დამოკიდებულების შესახებ. თერმული აფეთქების პირობა არის სითბოს შეყვანის უპირატესობა რეაქციის ენერგიით, იმის გამო, რომ გარემოში სითბოს მოხსნა. ამ შემთხვევაში, სისტემა აგროვებს სითბოს, რაც იწვევს თვითმმართველობის გათბობას და, შესაბამისად, რეაქციის თვითდაჩქარებას.
ხანძარსაწინააღმდეგო რეაქციის სისტემაში გამოწვეული შემთხვევები ყველაზე ხშირად ასოცირდება ანთების საწინააღმდეგო წყაროს მიერ. როდესაც საწვავის სისტემა მწვავეა, საწვავის მოლეკულებისა და ჟანგბადის ენერგია იზრდება და, როდესაც ის გარკვეულ ღირებულებას აღწევს, ისინი გააქტიურდებიან, ანუ. აქტიური ცენტრები (რადიკალები და ატომები) თავისუფალი ღირებულებით იქმნება, რის შედეგადაც მყარი ნივთიერების მოლეკულები ადვილად შეუერთდებიან ჟანგბადს ჰაერიდან. ა. 1898 წელს ბახმა და C. ენგლერმა დამოუკიდებლად წარმოადგინეს ჟანგვის პეროქსიდირების თეორია, რომლის მიხედვითაც, როდესაც მჟავას აცხელებენ, ჟანგბადი გააქტიურებულია ატომების შორის ერთმანეთთან დაშორებით და აქტიური მოლეკულა შედის შემადგენლობაში საწვავი ნივთიერებებით, არღვევს ატომებში პეროქსიდის ნაერთების ტიპი: R 1-OOR 2 ან ROO-OH.
თუმცა, პეროქსიდის თეორია ვერ ახსნის ჟანგვის პროცესის ზოგიერთ დამახასიათებელ მახასიათებელს, მაგალითად, მკვეთრ ეფექტს, ზოგჯერ უმნიშვნელო უჯრედების კვალი.
ქიმიური რეაქციის სიჩქარე, მ / რ, შეიძლება გამოითვალოს არიენიუსის კანონის საფუძველზე შემდეგი განტოლების მიხედვით:
![]() , (1.12)
, (1.12)
სად არის რეაქციის სიჩქარე მუდმივი (ქიმიური რეაქციის მაჩვენებელი რეაქციების კონცენტრაციებზე ერთიანად შემცირებული);
რეაგენტების კონცენტრაცია, mol / m3;
სტოიქომეტრიული კოეფიციენტები, რომლებიც განსაზღვრულია საწყის რეაგენტების კონცენტრაციის თანაფარდობით სტოიქომეტრიული რეაქციის განტოლებაში;
ბუნებრივი ლოგარითმის საფუძველი;
უნივერსალური გაზის მუდმივი, 8.3 J / (mol ∙ K);
- ტემპერატურა, კ.
თბოიზოლაციის თერმული თეორია (ასევე თერმული აფეთქების თეორია) ეფუძნება ეგზოთერმული ჟანგვის დროს სითბოს წარმოების ტარიფების შედარებას და სითბოს მოცილებისგან რეაგირების ნარევიდან, რომელიც შეიცავს ხომალდის კედელში. თვითმფრინავის მდგომარეობა განისაზღვრება ამ სიჩქარის თანასწორობით. ხომალდის კედლის ტემპერატურა, რომლითაც ამ თანასწორობის მიღწევა ხდება, ავტოინტექნიკური ტემპერატურა ეწოდება. ამ ტემპერატურის დაწყებიდან (სპეციფიკური პირობებისთვის დამახასიათებელი თითოეული შემთხვევა - გემის ზომა და ფორმა, გაზის თერმოფიზიკური თვისებები), თვითმმართველობის გათბობა ხდება, რამაც შეიძლება გამოიწვიოს ფლეშ (თვით-ანთება).
ზემოაღნიშნულიდან გამომდინარე, თვითრეგულირებად რეაქციულ გარემოში შეგვიძლია დავწეროთ:
სად არის სითბური სიმძლავრე მუდმივი მოცულობით, J / K;
გაზის სიმკვრივე, კგ / მ 3;
გაზის ტემპერატურა, K;
დრო, s;
რეაქციის სითბოს ეფექტი, W;
რეაქციის განაკვეთი, მ / წმ;
რეაქციის გემის ზედაპირი, მ 2;
რეაქციის ჭურვის მოცულობა, მ 3;
სითბოს გადაცემის კოეფიციენტი, W / (მ 2 × K);
გემის კედლის ტემპერატურა, კ.
DA Frank-Kamenetsky შემოთავაზებული კრიტერიუმი თერმული ანთება, საფუძველზე დარღვევის სტაციონარული ტემპერატურის განაწილების თვითმფრინავი გემის საკმარისი სითბოს გათავისუფლების კურსი:
 , (1.14)
, (1.14)
სად არის გემის დამახასიათებელი ზომა, მ;
პრიორიტეტული ფაქტორი;
გაზის ნარევი თბური გამტარობა, W / (M × K);
განზომილებიანი კრიტერიუმი 3.3; 0.88 და 2, შესაბამისად, სფერული, პარალელური და ცილინდრული ხომალდებისათვის.
D.A. Frank-Kamenetsky- ის კრიტერიუმი უნდა მიხვდნენ შემდეგს: თუ ყველა პარამეტრის ჩანაცვლებისას განსაზღვრავს ღირებულება, მაშინ არ იქნება ანთება, როდესაც ანთება მოხდება. კრიტერიუმის განტოლებადან გამომდინარეობს, რომ რეაქციის სითბო და რადიუსის რეაქცია, რომელშიც რეაქცია ხდება, აფეთქების ფაქტორების განსაზღვრა მნიშვნელოვანია. თერმული აფეთქება გამოხატულია ნათელი, მით უკეთესია უთანასწორობა:
თუ ეს უტოლობები ცუდად შესრულდა, მაშინ თერმული აფეთქება დეგენერატები - ერთდროულად ტემპერატურის ზრდასთან ერთად, არსებობს ორიგინალური ნივთიერების სწრაფი წვა, რომელიც აფეთქების სურათს ლუბრიკავს.
წვის დამწველი ყველაზე ხშირად ასოცირდება დამანგრეველი სისტემის გათბობით, ანუ ანთების ერთი ან სხვა წყაროდან. აკადემიკოს ნ.ნ.-ს თეორიის მიხედვით სემენოვის, ჟანგვის პროცესს თან ახლავს სითბოს გათავისუფლება და გარკვეულ პირობებში შეიძლება დააჩქაროს. ეს პროცესი აჩქარებასთან დაკავშირებული ჟანგვის რეაქციის თვითმმართველობის აჩქარებას თვითგამორკვევას უწოდებენ.
იმ შემთხვევაში, თერმული თვითმმართველობის ანთება, ეს ხდება ზედმეტი სითბოს გათავისუფლების განაკვეთი მეტი სითბოს რადიატორის კურსი.
განვიხილოთ თერმული ანთების პროცესი, საწვავის მაგნიტური გაზის ან საყრდენის საჰაერო ხომალდის მაგალითზე, საჰაერო ხომალდით მოცულობით. გაზრდის ტემპერატურისა და საწვავის ნარევი, რეაქციის სიჩქარე და სითბო გაიზრდება. ტემპერატურის სითბოს გათავისუფლების დამოკიდებულება, J / s განისაზღვრება:
![]() , (1.15)
, (1.15)
სად არის გაზის წვის სითბოს სითბო, J;
საწვავის ნარევი, მ 3;
რეაქციის სიჩქარე მუდმივი;
რეაქტიანების კონცენტრაცია, კგ / მ 3;
რეაგირების დავალება;
აქტივაცია ენერგია, j / mol;
უნივერსალური გაზის მუდმივი J / (mol · K);
ტემპერატურა ნარევი, კ
გამოთავისუფლებული სითბოს გადაეცემა საწვავი ნარევი და ის აჩერებს. ერთხელ ტემპერატურის ნარევი აღემატება ტემპერატურა სისხლძარღვების კედლებს, სითბოს გაფრქვევა დაიწყება მეშვეობით გემის კედლები ერთეულის დრო პროპორციული ტემპერატურის სხვაობა ნარევი და სისხლძარღვების კედლებს და განისაზღვრება ურთიერთობა:
![]() , (1.16)
, (1.16)
სადაც - სითბოს მოშორების კურსი გემის კედლებით, ჯ /
სითბოს გადაცემის კოეფიციენტი, J / (KM2 × s);
გემის კედლის ზედაპირი, მ 2;
ნარევი ტემპერატურა, K;
გემის კედლების ტემპერატურა, კ

ფიგურა 1.5 - ტემპერატურის სითბოს გამომუშავება სხვადასხვა ზეწოლის დროს
ფიგურა 1.5, მოსახვევებში 2, 3 და 4 აჩვენებს ტემპერატურაზე სითბოს წარმოქმნას სხვადასხვა ზეწოლისა და იმავე ნარევი კომპოზიციის დროს. მუდმივი ჭურჭლისა და საშუალო ტემპერატურისა და მუდმივი ნარევი შემადგენლობის დროს წვის ზონებიდან ამოღებული სითბოს სიდიდე გამოირჩევა სწორი ხაზით 1. როდესაც ნარევი შემადგენლობა იცვლება, სითბოს დაკარგვის მაჩვენებელი და, შესაბამისად, სწორი ხაზის ფერდობზე შეიცვლება. უფრო მაღალი წნევა, უფრო სითბო გამოწვეულია რეაქციის დროს (მრუდი 4). მრუდის 2-ის პირობებში, თვითმმართველობის ანთება შეიძლება არ მოხდეს, რადგან სითბოს დაკარგვა (სწორი ხაზი 1) უფრო მაღალია, ვიდრე ამ ზეწოლისას სითბოს დამუშავება. სწორხაზოვანი მრუდის 3-ის შემადგენელი ნაწილი შეესაბამება წონასწორობასა და მოშორებულ სითბოს შორის - მოცემულ პირობებში მოცემული მყარი სისტემის მინიმალური ავტომატური ანთების ტემპერატურა. გარედან ენერგიის პატარა მიწოდება, თვითმმართველობის ანთება შესაძლებელია. Curve 4 აღწერს იმ პირობებს, რომლითაც თვითმმართველობის ანთება გარდაუვალია, რადგან სითბო გათავისუფლებულია, ვიდრე ის ამოღებულია.
მოცემული სქემის ანალიზი N.N. სემიონოვმა დაამყარა დამოკიდებულება:
 , (1.17)
, (1.17)
სად არის მინიმალური ანთება ზეწოლა, პა;
თვითმმართველობის ანთების მინიმალური ტემპერატურა, K;
რეაგირების დავალება;
მუდმივი, დამოკიდებულია კომპოზიციისა და ნარევი სხვა თვისებების მიხედვით.
ამ განტოლების საფუძველზე (1.17) შეიძლება წინასწარ განსაზღვროს თეორიულად განსაზღვრული პირობები, თუ რამდენად შესაძლებელია ამ მყარი ნარევი თვითმფრინავი. მინიმალური ზეწოლისა და ავტომატური ჰაერის ტემპერატურის ურთიერთობამ დაადასტურა მრავალრიცხოვანი ექსპერიმენტები და დადასტურდა წვის პროცესების შესწავლა.
ჯაჭვის თეორია წვის
ჯერ კიდევ 1928 წლიდან NN.Semenov წარმოადგინა ორი ტიპის აფეთქების - ჯაჭვი და თერმული ქიმიური სისტემების არსებობის შესაძლებლობა.
ჯაჭვური რეაქციები ისეთებიც არიან, რომლებიც გადიან ეტაპების სერიას (შუალედური რეაქციების სერიის მეშვეობით), სადაც ხდება შუალედური ნაერთები თავისუფალი სიდიდეებით, ე.წ. აქტიური ცენტრები, რომლებიც წარმოიქმნება პროცესის შემდგომი სწრაფი დინების ეტაპები.
ჯაჭვური რეაქციის კონცეფცია პირველად გამოჩნდა 1913 წელს, როდესაც გერმანიის ფიზიკო ქიმიკოსი მ. ბოდენსინმა დაადგინა, რომ როდესაც ქლორითი წყალბადის ნარევი იყო განათებული, ქლორის მოლეკულა, რომელიც იძლევა სინათლის ენერგიის კვანტურს,
![]() .
.
ქლორის ატომები მყისიერად რეაგირებენ წყალბადის, რის შედეგადაც აფეთქების ნარევი. ქლორის ერთი მოლეკულის გააქტიურება გამოიწვევს ორი მოლეკულის ფორმირებას:
![]() .
.
თუმცა, ექსპერიმენტები აჩვენებს, რომ ეს აწარმოებს 100,000 მოლეკულის წყალბადის ქლორიდს. ეს შეიძლება იქნეს განმარტებული, თუ ვივარაუდოთ, რომ წყალბადის წყლულოვანი ქლორნის ურთიერთქმედება აწარმოებს პროდუქციას, როდესაც იგი შედის მეორად რეაქციებში, აღდგება და განაგრძობს რეაქციას. ეს ვარაუდი შეესაბამება შემდეგ რეაგირებას:
მე პირველადი რეაქცია
IV ღია circuit
ამ სქემის მიხედვით, ერთი ქლორის მოლეკულის (I) გააქტიურება იწვევს ორი ქლორის ატომის წარმოქმნას - ჯაჭვური რეაქციის ორი აქტიური ცენტრი. თითოეული ქლორის ატომი იწვევს თავის ჯაჭვურ რეაქციას, რომელშიც აქტიური ცენტრი მუდმივად აღდგება (II, III). ამრიგად, ინიცირებული რეაქციის (I) ზემოქმედების შედეგად, რეაქცია მოხდება ჯაჭვის (II, III და სხვა) ფორმირებისა. ჯაჭვის წამოწყების მომენტიდან ასეთი რეაქციების რაოდენობა ჯაჭვის სიგრძეს ეწოდება. ჯაჭვი შეიძლება დაარღვიოს ქლორის (IV) ატომების ან წყალბადის (ა) ატომებისა და მათგან მოლეკულების ფორმირების დროს, ან აქტიური ცენტრების შეჯახებისას მყარ ზედაპირთან. ეს არის ტიპიური არასამთავრობო branching ჯაჭვური რეაქცია. მასში, თითოეული აქტიური ცენტრი იწვევს მხოლოდ ერთი ახალი აქტიური ცენტრის გამოჩენა, ამიტომ რეაქცია გაგრძელდება, მაგრამ დაჩქარება არ არის.
ფილიალი ჯაჭვურ რეაქციაში, თითოეული აქტიური ცენტრი იწვევს ორ ან ახალ აქტიურ ცენტრს.
ჯაჭვური რეაქციების თეორიის მიხედვით, ჟანგვის პროცესი იწყება საწვავი ნივთიერების გააქტიურებით.
პრაქტიკა აჩვენა, რომ ანთება შეიძლება მოხდეს ისთერმული პირობების ქვეშ, მაგალითად, რეაქციის საშუალო ტემპერატურის გაზრდის გარეშე (ნარევი "ცივი" ანთება). ამ შემთხვევაში ისინი საუბრობენ ჯაჭვის (იზომეტრული) აფეთქების შესახებ.
ორი თავდაპირველი კომპონენტები: საწვავისა და დამჟანგველის ყოფნის შედარებით სტაბილური მოლეკულური სახელმწიფოს წინაშე უკავშირდება ახალი, უფრო სტაბილური მოლეკულების წვის პროდუქტების გაიაროს ჯაჭვის რთული შუალედური გარდაქმნების, რომ შედეგი ფორმირების არასტაბილური პროდუქცია: ატომები, რადიკალები, აღფრთოვანებული მოლეკულების შედარებით დიდი ionization (ფორმალდეჰიდის, ნახშირწყალბადების და ჰიდროქლორიდის რადიკალების, ატომური ჟანგბადის და წყალბადის) ხარისხი.
კოდრატრიევუ ვ.ნ. ეს იყო შეუძლია აღმოაჩინოს ალი სხვადასხვა ნახშირწყალბადების დიდი კონცენტრაცია ატომური ჟანგბადის (O), gidrokislogo რადიკალური (OH), ნახშირწყალბადების რადიკალების (CH 3), ნახშირჟანგის (CO), ფორმალდეჰიდი (CH 2 O), და სხვები. კონცენტრაცია ამ ნივთიერებების ალი არიან ათასობით საბოლოო რეაქციის პროდუქტების ფლეიმის ტემპერატურაზე თერმული რღვევის დროს მათი წონასწორული კონცენტრაციის მილიონობით ჯერ მეტია, მაგალითად, H 2 O → H + OH.
ამ დაკვირვების შედეგებმა გამოიწვია დასკვნა იმის შესახებ, რომ ატომებისა და რადიკალების განხილვა, რომლებიც რეაგირების პროცესში გადიან, არ წარმოადგენენ პროდუქციის საბოლოო დაშლას, მაგრამ რეაქციის შუალედური პროდუქტებია.
ამდენად, დაფუძნებული ჯაჭვი ანთება მექანიზმი მთელი ჯაჭვი ქიმიური გარდაქმნის ერთი ნივთიერება კიდევ ერთი, რომ შედეგად ფორმირების შერჩეული შუალედური ეტაპები ქიმიურად ძალიან აქტიური არასტაბილური პროდუქტები, ცნობილია, როგორც აქტიური საიტები, რომ რეაგირება ადვილად შორის ერთმანეთთან და მოლეკულების საწყისი მასალის შექმნას მაგალითად, ახალი აქტიური ცენტრები და საბოლოო პროდუქტი, მაგალითად, H 2 O და CO2- ის მეთანის ჰაერის ნარევი.
რადიკალების და ატომების მაღალი რეაქტიულობა ახდენს მათი რეაქციების დაბალი აქტივაციის ენერგიით, რაც ატომური რეაქციების აქტივაციის ენერგიასთან არის დაკავშირებული:
OH + H 2 = H 2 O + H - 25 kJ / mol
СН 3 + С 3 Н 6 - 12.5 კჯ / მოლ
CH 3 + C 6 H 6 - 23.5 kJ / mol
H 2 O → H + OH
ნებისმიერი აქტიური ნაწილაკები (H ან OH) უკიდურესად არასტაბილურია და, შესაბამისად, ქიმიურად აქტიური, ორიგინალური ნივთიერების მოლეკულათან ერთად, გაყოფა, ახალი აქტიური ნაწილაკების ჩამოყალიბება:
H + O 2 = OH + O
OH + H 2 = H 2 O + H
აქტიური ნაწილაკების რეაქციის შედეგად მიღებული ნაწილაკები კვლავ აღწევენ რეაქციებს და წყალბადთან ურთიერთქმედების ნაწილაკებს:
O + H 2 = OH + H.
ეს არის აქტიური ნაწილაკების და მასალის მოლეკულებს შორის რეაქციის შედეგად არა მხოლოდ საბოლოო პროდუქტები, არამედ ახალი აქტიური ნაწილაკები. რეაქციის შედეგად წარმოქმნილი აქტიური ნაწილაკები წარმოადგენენ ქიმიურ ტრანსფორმაციის ახალ ეტაპებს, რომლებიც წარმოიქმნება დაწყებული მასალების სრული მოხმარებამდე.
ასეთი არაერთგვაროვანი ქიმიური რეაქციები ეწოდება ჯაჭვურ რეაქციებს და აქტიურ ნაწილაკებს, რომლებიც ქმნიან ტრანსფორმაციის ახალ ჯაჭვებს, აქტიური ცენტრებია.
წყალბადის წვის ზემოთ ჯაჭვის პროცესი შეიძლება წარმოადგენდეს დიაგრამას (სურათი 1.6).

ფიგურა 1.6 - წყალბადის ჯაჭვის წვის დიაგრამა
დიაგრამიდან ჩანს, რომ მხოლოდ წყალბადის (H) ნაწილაკები, რომლებიც აქტიურ ცენტრებს ქმნიან ახალ ტრანსფორმაციის ჯაჭვებზე. ამავე დროს, ჯაჭვის პროცესის ყოველი ბმულიდან აქტიური ცენტრის H და ჟანგბადის მოლეკულა O 2 შორის საბოლოო პროდუქტის H 2 O- ს, ახალი 3 აქტიური ცენტრების ჰქმნით ჩამოყალიბების შედეგად შეიქმნა ახალი ტრანსფორმაციის ჯაჭვები.
ასეთი ჯაჭვური რეაქცია, რომელიც მოქმედებს აქტიურ ცენტრებში, ეწოდება branched. რეაქცია ვითარდება როგორც ზვავი და ძალიან მაღალი მაჩვენებლებით, ჩვეულებრივი მოლეკულური რეაქციების სიჩქარით.
ტიპიური რეაქცია არალეგიტიმური ჯაჭვით არის ქლორინის წყალბადის წყება. ამ რეაქციის აქტიური ცენტრები ქლორისა და წყალბადის ატომებია. როდესაც ქლორის ატომი რეაგირებს, წყალბადის ატომი იქმნება, როგორც მაშინ, როდესაც წყალბადის ატომი რეაგირებს, ერთი ქლორის ატომი იქმნება. აქედან გამომდინარე, რეაქცია შეიძლება გაგრძელდეს, მაგრამ არ დააჩქარა.
კარგად ცნობილი ფაქტი, რომ ქლორინის ჰიდროგენიანი რეაქცია კვლავაც წყდება აფეთქებაზე (თვით-ანთება), იმის გამო, რომ საკმარისად მაღალ ჯაჭვურ რეაქციულ მაჩვენებლებში სითბოს გამონაბოლქვი აღემატება სითბოს რაუნდს, რის შედეგადაც ნარევი ძალიან ცხელია და თერმული თვითმფრინავებისთვის აუცილებელი პირობები წარმოიქმნება.
როდესაც ჰიდროკარბონატის ტიპიურია, მაშინ აქტიური ცენტრების კონცენტრაცია შეიძლება გაიზარდოს თავდაპირველი ინიციატივის პირობების მიუხედავად, ხოლო თუ ფილიალის დროს აქტიური ცენტრების ფორმირების მაჩვენებელი აღემატება ჯაჭვის დაზიანების მაჩვენებელს, მაშინ თვითმფრინავების მსგავსი პროცესი იწვევს ანთების საწინააღმდეგო პროცესს.
ჯაჭვური რეაქციების თეორია გვაძლევდა წვის პროცესების მრავალი თავისებურებას (მინარევების ძლიერი გავლენა, ზეწოლის, კატასტროფისა და წნევის დათრგუნვისა და ა.შ.), რაც არ უნდა აიხსნას თერმული თეორიით. რეალური ხანძრისა და აფეთქებების წარმოშობის და განვითარების მექანიზმი ხასიათდება კომბინირებული ჯაჭვის თერმული პროცესით. დაწყების ჯაჭვის გზა, ჟანგვის რეაქცია გამო მისი exothermicity კვლავ დაჩქარება მიერ თერმული გზა. ამრიგად, საბოლოო ჯამში, მწვავე (შეზღუდვის) პირობები მდგრადობის და განვითარებისთვის განისაზღვრება გარემოზე რეაგირების სისტემის სითბური წარმოებისა და სითბოს გაცვლის პირობებით.
ბევრი ქიმიური პროცესი ეფუძნება ქიმიურ ჯაჭვურ რეაქციებს. ასეთი პროცესები მოიცავს მაგალითად, პოლიმერიზაციის პროცესებს, რომლებიც წარმოადგენენ სინთეზური რეზინის, პლასტმასის, პოლიმერული ბოჭკოების და მრავალი სხვა პროდუქტის წარმოების საფუძველს. მათ შორისაა ისეთი მნიშვნელოვანი სამრეწველო პროცესები, როგორიცაა სინთეზური ცხიმოვანი მჟავების წარმოება, ადრე გამოყენებული საკვები ცხიმების შეცვლა საწმენდი საპოხი მასალების წარმოებაში, cracking - ნავთობის მაღალხარისხოვანი საწვავის მოპოვების პროცესი.
დამწვრობა - სწრაფი მიედინება ქიმიური ურთიერთქმედების საწვავი ნივთიერებების ჟანგვითი აგენტი, რომელსაც თან ახლავს დიდი მოცულობის სითბოს და ნათელი ბრწყინვალების (ფლეიმის) გათავისუფლება. წვა შესაძლებელია მხოლოდ იმ შემთხვევაში, თუ არსებობს სამი ფაქტორი: მყარი ნივთიერება, ჟანგვითი აგენტი, სითბოს წყარო.
სითბოს წყარო (ცეცხლი) შეიძლება იყოს ღია ფლეიმის, ნაპერწკალი, სითბო, გაბერილი შედეგად ხახუნის (ქამრები ქამარი გადაცემა), გავლენა, ზეწოლა. სითბოს წყაროს შეუძლია ელექტრო (გათბობის დირიჟორები, რკალის), ქიმიური და radiant ენერგია მზე.
ჟანგვითი აგენტები ქლორი, ფლორენცია, ბრომი. ყველაზე გავრცელებული ჟანგვითი აგენტია საჰაერო ჟანგბადი, წვის პროცესი დამოკიდებულია ჰაერში მისი შინაარსით. თუ ჰაერში ჟანგბადი 14-16% -ზე მეტს აღწევს, მაშინ მწვავე დამწვრობა აღინიშნება. როდესაც ჟანგბადის შემცველობა 14% -ზე ნაკლებია, smoldering აღინიშნება, ხოლო მისი შინაარსი არანაკლებ 8-10%, smoldering ასევე შეწყვეტს.
საყრდენი საკითხია. ისინი შეიძლება იყოს გაზები (ამიაკი, აცეტილენი, წყალბადის), სითხეები (ბენზინი, აცეტონი, ალკოჰოლი), მყარი (ქვანახშირი, ხის). იმისათვის, რომ მყარი ან თხევადი გაჟონვისთვის აუცილებელია ტემპერატურის გაცხელება სითბური წყაროს მეშვეობით, ისე, რომ მტვერიანი ამოფრქვევის ინტენსიური გათავისუფლება ხდება მათი ზედაპირებიდან. როდესაც გარკვეული კონცენტრაცია მიაღწევს, ეს ორთქლი იკვეთება. წვის პროცესი არ იცვლება მათი აგრეგაციის მდგომარეობაში.
წვის შემდეგი სახეებია: 1) ფლეშ; 2) ანთება; 3) თვითმმართველობის ანთება; 4) სპონტანური წვისა; 5) smoldering; 6) აფეთქება.
1. Flash ე.წ. ჰაერის ჟანგბადის ნარევის მყისიერი წვის ეწოდება ორთქლის, აირის, მტვრისგან, რომელსაც არ შეჰყავს შეკუმშული აირების ფორმირება. Flash წერტილი - ყველაზე დაბალი ტემპერატურა აალებადი ნივთიერება, რომელიც მის ზედაპირზე წარმოიქმნება წყვილი, ან აირები, რომ შეიძლება სროლების მდე წყარო ანთება, მაგრამ შემდგომი სტაბილური წვის მაჩვენებელი მათი ფორმირება არ არის საკმარისი.
ამ ტემპერატურის მასშტაბის მიხედვით, აალებადი სითხეები იყოფა:
ა) აალებადი (აალებადი სითხეები - ბენზინი, აცეტონი, ალკოჰოლი) - tf ≤ + 45 ° C;
ბ) მყარი სითხეები (GZH - ზეთები, დიზელის საწვავი, საწვავის ზეთი) - t vec\u003e + 45 ° C.
2. იგნორირება ე.წ. უწყვეტი წვის დამუშავება ნივთიერების სითბოს წყაროსგან. მყარი ნივთიერების მინიმალური ტემპერატურა, რომლის დროსაც იგი იშვიათი წყაროდან იწვევს და აგრძელებს დამწვრობის შემდგომ დამწვრობას ანთება ტემპერატურას. ეს უფრო მაღალია, ვიდრე ფლეშ წერტილი.
ჰაერში აალებადი ნივთიერებების კონცენტრაცია, რომელზედაც შესაძლებელია ანთება ან აფეთქება, შესაძლებელია გარკვეული შეზღუდვების ფარგლებში: ქვედა - CWP და ზედა - ERW. საყლაპავის ნაერთების ანთება შეუძლებელია CEL- ზე ნაკლები კონცენტრაციით (არ არის საკმარისი მყარი მოლეკულები ნარევი) და მაღალი ERW (არ არის საკმარისი ჟანგბადის მოლეკულები ნარევი). უფრო მეტი განსხვავება ERW- სა და CWP- ს შორის, უფრო საშიში ნივთიერებაა. ამ პარამეტრების ღირებულებები შეიძლება შემცირდეს, მაგალითად, მტვრის ჰაერის ნარევი (PLN) ტენიანობის გაზრდაში, მაგალითად, ჰაერის ნარევი შაქრის, ფქვილის, ქვანახშირის მტვრის.
მოდით მივცეთ NVP- ის და SVV- ის მნიშვნელობები სითხის რაოდენობის და ორთქლისთვის:
აცეტილენ 3.5-82%;
ბუნებრივი აირი 3.8-19.2%;
ბენზინი 1-6%;
კარბონის მონოქსიდი 12.8-75%.
3.თვითმმართველობის ანთება- გარე წყაროდან ნივთიერებების ანთების პროცესი (ცეცხლი, მწვავე ან მწვავე ორგანო) უშუალო კონტაქტის გარეშე, ანთება ტემპერატურაზე. ეს ტემპერატურა შეამცირებს გაზრდის ზეგავლენას და ხშირია აალებადი გაზები 400-700 ° C- მდე, ხისთვის - 340-400 ° C; ნახშირი - 400-500 ° C. თვითმმართველობის ანთების მაგალითზე: ტყავის, ქაღალდის, გათბობის და შემდგომი ანთება ღია ღია ფლეიმის მახლობლად (უშუალო კონტაქტის გარეშე) ან ცხელი ობიექტების (ქვანახშირის, ღია სპირალის გამათბობელი).
4. სპონტანური წვა ნივთიერებები წარმოიქმნება ნივთიერების (მატერიიდან) ფიზიკურ, ქიმიურ და ბიოლოგიურ რეაქციების შედეგად, რასაც იწვევს ანთების წყაროს არარსებობისას.
სველი მარცვლის, თივის, ჩალისა და ამ მასალებში არასაკმარისი ვენტილაციის დროს დიდი რაოდენობით ინახება ბიოქიმიური პროცესები (სითხე), რომელიც იწვევს სითბოს გათავისუფლებას. ამ მასალების ტემპერატურა იზრდება, მათი დიდი მასა (მწვერვალები, სტეკები) ხელს უშლიან გენერირებული სითბოს დარბევას გარემოში, რაც იწვევს ცეცხლს. ასეთი მასალები უნდა მოხდეს შენახვის წინ. ქსოვილის კონტაქტს (ზედაპირზე, დასუფთავების მასალას), რომელიც შეიცავს ნავთობის ლაქებს და იკვრება უჯრედში არა სპონტანურად. აქედან გამომდინარე, სამუშაო ტანსაცმელი უნდა ჩამოიხრჩო ისე, რომ უზრუნველყოს ჰაერის თავისუფალი წვდომა და ნავთობი დაუყოვნებლივ უნდა ამოღებულ იქნას სამუშაო ადგილებიდან.
რეაქციის სიჩქარის მიხედვით, წვის პროცესი მიმდინარეობს კორუფცია (სიჩქარე რამდენიმე სმ / წ), რეალურად იწვის (რამდენიმე მ / წმ) და აფეთქება (რამდენიმე ასეული ათასი მ / წმ).
5. აფეთქება- მაღალი ტემპერატურის, ზეწოლის, ქიმიური რეაქციების გავლენის ქვეშ არსებულ ნივთიერებათა ფიზიკური და ქიმიური მდგომარეობის მოულოდნელი ცვლილება. აფეთქებით, წარმოქმნილი აირებისა და ორთქლის დიდი მოცულობის მოცულობა იზრდება, ენერგეტიკის დიდი ოდენობა გათავისუფლდება, რაც შოკის ტალღის ფორმით შეუძლია შეასრულოს მექანიკური სამუშაოები (შენობების, ნაგებობების განადგურების, დაზიანების ხალხის).
მასალების წვა შეიძლება იყოს სრული ან არასრული. როდესაც სრული წვის (ჭარბი ჟანგბადის) ჩამოყალიბდა incombustible პროდუქცია (CO 2 და H 2 O) არასრული წვის (არასაკმარისი O 2) წარმოიქმნება ნაწილობრივი ჟანგვის პროდუქტები (CO, სპირტი, მჟავების). ისინი ტოქსიკური და ასაფეთქებელია. ამიტომ, საწვავის წვის პროცესის ორგანიზებისას (ქვაბებში, ღუმელებში) აუცილებელია ღუმელის ჟანგბადის საკმარისი რაოდენობა.
1. წვის თეორიის ძირითადი ცნებები.
1. წვის პროცესების მახასიათებლები.
დამწვრობა ძნელია ფიზიკური ქიმიური პროცესირომელშიც ქიმიური ტრანსფორმაცია
სენენის თანხლებით ენერგეტიკის გათავისუფლება (ძირითადად სითბოს და რადიაციის სახით)
და სითბოს და მასობრივი გადაცემის გარემოში.
წვის პროცესის საფუძველია ქიმიური რეაქცია, რომელიც შეიძლება გაგრძელდეს
დაჩქარება. თვითმმართველობის დაჩქარების მიზეზი შეიძლება იყოს:
1. სითბოს დაგროვება სისტემაში - თერმული აჩქარება
2. აქტიური ნაწილაკების დაგროვება - ჯაჭვის თვითდაჩქარება
3. Autocatalysis არის მისი პროდუქციის რეაქციის დაჩქარება.
ხშირ შემთხვევაში, პრაქტიკულად მნიშვნელოვანი წვის პროცესები ემორჩილებიან წმინდა ფიზიკას
იმის გამო, რომ მაღალი ტემპერატურის დროს ქიმიური ტრანსფორმაციის გაგრძელება შესაძლებელია მაღალ სიჩქარეებზე და ქიმიური პროცესი ექვემდებარება წმინდა ფიზიკურ კანონებს, როგორიცაა სითბოს გადატანა და გავრცელება და რეგულირდება მათ მიერ. ეს იმას ნიშნავს, რომ ქიმიური რეაქცია, რომელსაც შეუძლია გააგრძელოს მაღალი მაჩვენებელი
აქვს შეზღუდული სიჩქარე და ემორჩილება ერთ ან მეორე კანონებს
zic ფენომენი.
წვის პროცესების მთავარი მახასიათებელია ის, რომ თვითმმართველობის აჩქარების პირობები
ქიმიური რეაქცია თავად შექმნილია. კიბერნეტიკაში, ამ ფენომენს ეწოდება პოზიტიური გამოხმაურება, ანუ, მცირე ცვლილებებით გარე პირობებში, შესაძლებელია რეაქციის სტაციონარული რეჟიმის შეცვლა დაბალი სიჩქარით რეჟიმში,
სადაც რეაქციის მაჩვენებელი იზრდება ექსპონენციალურად. გარე ფაქტორებში მცირე ცვლილებებით რეაქციის რეჟიმში მკვეთრი ცვლილების ასეთი მოვლენები ეწოდება
არიან კრიტიკული მოვლენებიდა პირობები, რომელთა დაცვასაც ისინი აკვირდებიან
კრიტიკული პირობები.
კრიტიკული მოვლენები მოიცავს:
1. თვითმმართველობის ანთება
2. იგნორირება
3. ფლეიმის გამრავლების კონცენტრაციის ლიმიტები.
კრიტიკული მოვლენები არ ხდება იმით, რომ ბუნების კანონები რადიკალურად შეიცვლება, მაგრამ
რეაგირების სისტემასა და გარემოს შორის დისბალანსის შედეგია
გარემო.
თვითმფრინავების მდგომარეობა თერმული ან დიფუზიის შეუძლებლობაა
გარემოს პირობები, ანთება მდგომარეობა არის დისბალანსი მოცემულ საწყის პირობებში.
წვის პროცესების მეორე მახასიათებელია მათი გავრცელების უნარი
სივრცეში. წვის თერმული რეჟიმში, გამრავლება ხდება სითბოს გადაცემის გზით, ჯაჭვის ან ავტოკატალიტის შემთხვევაში - აქტიური ნაწილაკების გავრცელების გზით.
2. წვის სახეები და რეჟიმები.
1. მონაწილეთა საერთო მდგომარეობის მიხედვით:
ა. წვის გაზის სისტემები - ჰომოგენური წვა
ბ. მყარი და თხევადი მყარი (მყარი თხევადი სისტემა და მყარი გაზის სისტემების) წვა - ჰეტეროგენული წვა
გ. შედედებული სისტემების წვა (მყარი თხევადი სისტემები,
თხევადი თხევადი, მყარი თხევადი).
2. პროცესის გამრავლების სიჩქარის მიხედვით:
ა. დეფლაგაცია იწვის - პროცესი ნელი გამრავლებისთვის (სითბური გატარებით ან გავრცელებით)
ბ. დეტონაცია იწვის - პროცესის სწრაფი გავრცელება (ერთად
შოკის ტალღის ძალა).
3. აეროდინამიკური პირობებით:
ა. Laminar წვა არის გლუვი ფლეიმის წინა.
ბ. ცვალებადი წვის არის ძალიან curved ფლეიმის წინა.
მონაწილეთა საერთო მდგომარეობის შესახებ სხვადასხვა სახის წვის მაგალითები:
ჰომოგენური წვის:
ორგანული წვა ჟანგბადში
CH4 (გ) + 2O2 (გ) = CO2 (გ) + 2H2 O (ორთქლი)
წვისა სხვა ჟანგვის აირების თანდასწრებით
H2 (გ) + Cl2 (გ) = 2HCl (გ)
არასტაბილური ნივთიერებების დაშლა (ოზონი)
2O3 (გ) = 3O2 (გ)
ჰეტეროგენული წვა
თხევადი ჰიდრაზინი იწვის:
N2 H4 (გ) + O2 (გ) = N2 (გ) + 2H2 O (ორთქლი)
ნახშირბადის წვა:
C (TV) + O2 (გ.) = CO2 (გ.)
არასტაბილური ნივთიერებების დაშლა (აცეტილენი)
C2 H2 (გ) = 2C (s) + H2 (გ)
წვის სისტემები იწვის:
2K2 (გრ) + 4H2 O (ორთქლის) + O2 (გ)
3. წვის პროცესების თერმოდინამიკა. სითბოს ბალანსი.
წვის ტემპერატურა: ჩვეულებრივ, წვის პროცესების დამახასიათებელია ოთხი ტემპერატურა
peruraty იწვის
თეორიული | თ თეორი | სტოიქომეტრიული წვის სითბოს მიერ განსაზღვრული (მაგ. |
||
რეაქციის განტოლების შესაბამისი ნარევი), მისი გათბობისა და დისოციაციის გათვალისწინებით |
||||
წვის პროდუქტების გარეშე სითბოს გაცვლა გარემოსთან. |
||||
Calorimetric T calor - განისაზღვრება სითხის წვის stoichiometric |
||||
ნარევი საწყისი ტემპერატურა T 0 273K სითბოს გაცვლის გარეშე
გარემო.
3. Adiabatic Tg ad - განისაზღვრება თვითნებური კომპოზიციის ნარევი წვის სითბოს მიერ სითბოს გაცვლა გარემოსთან.
4. ფაქტობრივი Tg ქმედება რეალურად დაფიქსირდა (იზომება) ტემპერატურა
თანაფარდობა ტემპერატურის დაწვის სხვადასხვა განსაზღვრებებს შორის
წვის პროცესების სითბური ბალანსი ეფუძნება სითბოს გამოყოფის განსაზღვრას
წვის პროდუქტები. სითბოს ბალანსის განტოლება აქვს ფორმას:
Q pq Q pQ ishQ ქოთანში, |
სადაც Q PG არის სითბოს შეიწოვება წვის პროდუქტებით, Q p არის ქიმიური რეაქციის სითბო,
Q ex არის სითბოს მიღებული გარე წყაროებიდან, Q sweat არის სითბოს დაკარგვა.

იწვის. წვის პროდუქტების თითქმის დისოციაცია მნიშვნელოვან წვლილს ქმნის მხოლოდ 20 000 C. ზემოთ ტემპერატურაზე
არსებობს მაღალი და დაბალი კალორიული ღირებულება. პირველ შემთხვევაში, წყალი, როგორც წვის პროდუქტი, ხდება თხევადი ფორმით, მეორე შემთხვევაში, ორთქლის ფორმით. მას შემდეგ, რაც თქვენ
სითბოს, რომელიც გაყოფილია დამოკიდებულია დამწვარი ნივთიერების ოდენობაზე, მოლური ტემპერატურაა
წვის და კონკრეტული სითბოს წვის. ანუ სითბოს გამოყოფა 1
mole ან კილოგრამის საწვავი მასალა.
წვის სპეციფიური სითბოს გამოთვლა (კჯ / კგ), ხშირად გამოიყენება D.I. ფორმულა.
მენდელეევი
Q 339, 4C 1257H 108.9 O N 25 9H W, |
სადაც X არის შინაარსი ელემენტის შემადგენლობაში საწვავის% (მასობრივი), W - ტენიანობა.
რეაქციის სითბოს გამოთვლის ზოგადი მიდგომა ეფუძნება ქიმიურ თერმოდინამიკას
გაკეთდა სისტემა. შემდეგ თერმოდინამიკის პირველი კანონიდან (ენერგიის კონსერვაციის კანონი
gii) შემდეგნაირად | |||
სადაც Q არის სითბოს მიერ მიღებული სითბო, U არის შიდა ენერგიის შეცვლა, W არის სამუშაო, |
|||
მიერ სისტემა. უსასრულოდ მცირე ცვლილებებისთვის, ჩვენ გვაქვს | |||
დ.უ არის შიდა ენერგიის საერთო დიფერენციალი (ნაკადის გზების დამოუკიდებელია |
|||
პროცესი) Q, W - სითბოს და მუშაობის უსასრულო რაოდენობით, რაც, | |||
საქმე იმაშია, რომ ისინი დამოკიდებულია სისტემაში გადასვლის გზაზე ერთი სახელმწიფოდან მეორეზე. | |||
მოდით სისტემაში მხოლოდ მექანიკური გაფართოების მუშაობა. | |||
pdV. | |||
შემცვლელი (1.6) შევიდა (1.5) მივიღებთ | |||
როდესაც იზოციორული პროცესი V = const dv = 0 და ინტეგრირება (1.7) მივიღებთ | |||
იზოკარური პროცესში p = კონსტრუქცია, ინტეგრაცია (1.7) და მარტივი გარდაქმნები

მდებარეობა (1.8) და (1.10) შემდეგნაირად, ისochoric და isobar პროცესების სითბოს იძენს თვისებები სახელმწიფო ფუნქცია, ანუ არ არის დამოკიდებული პროცესის გზაზე. ეს დებულება ეწოდება gI- ის კანონი ჰესი. ქიმიური საწყისი და საბოლოო მდგომარეობა
აქციები იწყება მასალები და რეაქციის პროდუქტები. მარტივი ნივთიერებების ენთალპები,
სტაბილური პირობების პირობებში (298K და 0.10113 მპა) ნულოვანია. კომპლექსური ნივთიერებებისათვის, ენთალპიის ცვლილება ითვლება ელემენტებისგან, როდესაც ისინი ჩამოყალიბდებიან.
Ca (ტელევიზია) + C (ტელევიზორი) + 1.5O2 = CaCO3 | |||||||||||||||
ნივთიერებების ფორმირების ენთალპებით რეაქციის სითხის გაანგარიშების წესი შემდეგნაირადაა |
|||||||||||||||
ჰესი კანონი. | |||||||||||||||
რეაქციის პროდუქტებისა და დაწყებითი მასალების სტოიქომეტრიული კოეფიციენტები |
|||||||||||||||
შესაბამისად. თუმცა, ნიშნებიდან გამომდინარე შეთანხმების შესაბამისად | 0 შემდეგ რეაქციაზე |
||||||||||||||
ეგზოთერმული (გამოიმუშავებს სითბოს).
4. სითბოს ტევადობა. ტემპერატურის რეაქციის თერმული ეფექტის დამოკიდებულება
სითბოს ტევადობა - ე.წ. სითბოს მოცულობას უწოდებენ
ნივთიერების მასა 1 კ. განისაზღვრება კონკრეტული იმოლარის თერმული ტევადობა, ანუ 1 კგ სითბოსთვის საჭირო სითბოს რაოდენობა. ან 1 მლ 1 ნივთი ნივთიერება
ჭეშმარიტი მოლური სითბოს მოცულობა განისაზღვრება შემდეგნაირად:
C (1.12) dT
სადაც C არის molar სითბოს მოცულობა, mol K.
სითბოს შესაძლებლობების მუდმივი მოცულობისა და ზეწოლისთვის (იზოკორიკური და იზობარი)
გათვალისწინებით (1.8) და (1.10) მივიღებთ
; C გვ | ||||||

განვიხილოთ ტემპერატურის პროცესის სითბოს დამოკიდებულება მუდმივი მოცულობით ან წნევით. განტოლებების გათვალისწინებით (1.13) მივიღებთ
განტოლებები (1.14) ეწოდება kirchhoff განტოლებები.
რეაქციის დროს სითბოს სიმძლავრის ცვლილება განისაზღვრება გამოხატულებით
i Cp, i (prod) | jC p, j (ref), | ||
ანუ განსხვავება რეაქციის პროდუქტების სითბოს შესაძლებლობებისა და საწყისი მასალისაგან.
განტოლებადან (1.14) შემდეგნაირად, თუ რეაქციის დროს სითბოს სიმძლავრის ცვლილებაა
მიზანშეწონილია (მაგ., პროდუქციის სითბური სიმძლავრე ნაკლებია, ვიდრე საწყისი მასალების სითბური ტევადობა) და შემდეგ რეაქციის თერმული ეფექტი უფრო უარყოფითი ხდება, რეაქცია უფრო ეფექტური ხდება.
ზოოთერმული
პროცესის თერმული ეფექტის გამოთვლა T 2 (p = const), Kirchhoff განტოლება |
|||||
fa უნდა იყოს ინტეგრირებული. | |||||
Cp dT, | |||||
უნდა გაითვალისწინოს, რომ ტემპერატურის დიაპაზონში T 1 - T 2 | არ უნდა იყოს ფაზის გადასვლები |
||||
dov ნივთიერებები. | |||||
ჩვეულებრივ T 1 აირჩიოს 298K, მაშინ | r H 0 - რეაქციის თერმული ეფექტი სტან- |
||||
dart პირობები გამოითვლება (1.11).
რეალური ნივთიერებების სითბური ტემპერატურა კომპლექსურად დამოკიდებულია ტემპერატურაზე, ამიტომ
kirchhoff- ის განტოლების ინტეგრირებისთვის გამოიყენება შემდეგი დაახლოებები: | ||||
ნულოვანი - პროდუქციის სითბური სიმძლავრე ტოლია ორიგინალური ნივთიერებების სითბოსუნარიანზე, |
||||
ანუ C p 0 და რეაქციის თერმული ეფექტი დამოკიდებულია ტემპერატურაზე. | ||||
პირველი შეკვეთა - C გვ | კონსოლი, მაშინ | |||
t2 T1 | ||||
მოლეკულური ენერგია იწვის
უმეტეს წვის პროცესები მწვავეა, რომლებიც შეიცავს წყალბადის და ნახშირბადის, ჟანგბადის ჰაერიდან.
წვის თეორიის ფიზიკურ და მათემატიკურ საფუძვლებზე განხილვის დაწყებამდე მოდი ვცდილობთ გავიგოთ მოლეკულურ დონეზე, სადაც წვის ენერგია მოდის, რომლის გათავისუფლებაც დამოკიდებულია: გაზის გათბობა, აქტიური ქიმიური ცენტრების გამოჩენა და სხვა.
მოდი ვნახოთ, რა ხდება ჰაერის ჟანგბადის მქონე ნახშირბადის და წყალბადის კომბინირების ძირითად რეაქციებზე.
ჩვენ ვწერთ მონაცემთა ცხრილის შესაბამისად. 3.1 მყარი ნახშირბადის თანმიმდევრული ჟანგვის რეაქციების ენერგეტიკული ბალანსი, მაგალითად გრაფიტი:
აქედან გამომდინარე, საერთო მყარი ნახშირჟანგი რეაქცია, 386 კჯ / მოლი გამოდის:
ზომა და ენერგია გაათავისუფლეს წყალბადის წყლით ჟანგბადით:
CO მოლეკულა, ალბათ, ყველაზე გამძლეა, მისი სავალდებულო ენერგიაა 1016 kJ / mol. (შემდეგში ძალა არის N2 მოლეკულა 892 kJ / mol), არსებობს მოლეკულაში სამი წყვილი სავალდებულო ელექტრონებით, ქიმიური ენაა სამი ვალენტული ობლიგაციები: CO მოლეკულაში პირველი ელექტრონი გადის O- დან C- მდე, შემდეგ O + და C- გახდეს აზოტის ატომის მსგავსი, ეს დადასტურებულია CO მოლეკულაში დიპოლური მომენტის გამო.) CO2 მოლეკულაში მეორე ჟანგბადის ატომის ბონდის სისუსტეა: მაგიდის მიხედვით. 3.1
ამ ნაერთებში ჟანგბადის სავალდებულო ენერგია შედარებულია ორიგინალური ჟანგბადის მოლეკულის სავალდებულო ენერგიას. ასე რომ, როგორც
მაშინ მხოლოდ 240 კჯ / მლ თითო ჟანგბადის ატომი. ჟანგბადის მოლეკულის დაბალ სავალდებულო ენერგიას, ქიმიური აქტივობის მიზეზი და ენერგიის წყაროდ ჟანგვის გამოყენების მიზეზი.
ნახშირბადის ატმოსფეროს ბირთვული ენერგია კრამიტის კრისტალზე (ისევე, როგორც ალმასის და ამორფული ნახშირბადის) ძალიან მაღალია. შედარებით მცირე რეაქციის ენერგია C (s) + 0.5O2 = = CO + 98 kJ / mol არის ორი ძალიან დიდი რაოდენობით: ერთი უნდა გამოირიცხოს CO2 ვენური ენერგიის (256 kJ / mol) ) და გააუმჯობესოს ნახშირბადის ატომის სითბოს გატეხვა. სინამდვილეში ასევე განისაზღვრება 671 კჯ / მლ-ის სუნთქვის სიცხე. ეს არის ძალიან დიდი რაოდენობა.
მყარი ნახშირბადის და აირისებრი წყალბადის ნახშირწყალბადების კონცენტრაცია ხდება ენერგიის პატარა ცვლილებით. მეორე მხრივ, თირკმლის სპირტის, ალდეჰიდებისა და კეტონების ორგანული მოლეკულების, ორგანული მჟავების, ნახშირწყლების, ისევე როგორც ბევრი ენერგიის გათავისუფლებისას ჟანგბადი შემოდის როგორც მთლიანად წვის დროს (CO2 და H2O), ბუნებრივია, თანაბარი რაოდენობით ჟანგბადის მოხმარებით. აქედან გამომდინარე, შეიძლება შეფასდეს, რომ ნებისმიერი ორგანული საწვავის სრული წვის ერთად, 419-500 კჯ / მლ მოხმარებული ჟანგბადის გათავისუფლება. ერთადერთი გამონაკლისი არის ზოგიერთი ენდომოთერმული, ენერგეტიკული ნაერთები, როგორიცაა აცეტილენი და დიციანი, მაგალითად, მათი სითბოს სითბო უფრო დიდია.
არასრული წვა ენერგეტიკულად არახელსაყრელია არა მხოლოდ საწვავის მოლეკულის გაანგარიშებაში, არამედ დახარჯული ჟანგბადის მოლეკულაზე. რეაქციაში 2Q (s) + O2 = 2CO, მხოლოდ 210 kJ / mol გამოიყოფა ნაცვლად 466-ის შემთხვევაში, როდესაც წყალბადის დაწვა და 526 როდესაც CO იწვის.
მყარი ნახშირბადის ძლიერი ატომი C იწვევს იმ ფაქტს, რომ ნახშირბადის არ არის evaporate. ნახშირბადი მყარ მდგომარეობაში მდგომარეობს მხოლოდ ჟანგბადით CO ან CO2 სახით.
არასრული წვის და დაბალი ტემპერატურის შემთხვევაში, რეაქცია 2СО = СO2 + С (ტელევიზორი) + 41 kJ / mol არის ენერგიული ხელსაყრელი მხოლოდ მყარი ნახშირბადის მიმართ. თავისუფალი ნახშირბადის ატომის გაანგარიშების შემთხვევაში, შესაბამისი რეაქცია 2CO = СO2 + С-129 კჯ / მლ-ს აქვს დიდი ენერგეტიკული ბარიერი. აქედან გამომდინარე, წვის და ჭრილობა დროს წვის წარმოიქმნება მხოლოდ რღვევა ორგანული მოლეკულების რომ აქვს ნახშირბადის ჩონჩხი, მაგრამ არა CO.
ჩვენ ახლა მივმართოთ ჟანგვის რეაქციებს, რომლებიც შეიცავს აზოტს.
აზოტის მოლეკულა N2 ძალიან ძლიერია - მისი დისოციაციის ენერგია არის 226 კჯ / მლ. აქედან გამომდინარე, N2- ის და O2- ის 2NO- ს გადაკეთების რეაქცია ენდომოთერმულია და თერმოდინამიკური მიზეზების გამო შესაძლებელია მხოლოდ მაღალი ტემპერატურა.
აზოტისა და ჟანგბადიდან მიღებული მაღალი ოქსიდების (NO2, N2O3, N2O4, N2O5) ფორმირება პრაქტიკულად არ შეიცვლება ენერგიით (როგორც N2 და O2- ის სავალდებულო ენერგიასთან შედარებით). აქედან გამომდინარე, ენერგეტიკული თვალსაზრისით, აზოტის შემადგენლობაში შედის ჟანგბადი (CH3-ONO2 - ნიტროს ესტერი, CH3 (CeH2) (NO2) 3 - ტრინიტტროტოლუინი) თითქმის ოდენობით გაზის ჟანგბადი. ორგანული მოლეკულაში ინტეგრირებული ჟანგბადი, მაგრამ აზოტის შემცველობით, საშუალებას იძლევა, შეიქმნას ნივთიერებები, რომლებიც გამოიმუშავებენ უამრავ ენერგეტიკას, როდესაც მოლეკულა N2- ის ჩამოყალიბებას მოახდენს და ჟანგბადი გადადის CO2 და H2O მოლეკულებზე. ამ მიზეზით, ჟანგბადი შედის აზოტისა (ისევე, როგორც ქლორნის, ჯგუფებში SUC3 და СLO4 ჯგუფებში) გამოიყენება ფხვნილები და ასაფეთქებელი ნივთიერებები.
ეს არის ზოგადი იდეები წვის მოლეკულურ ენერგიას.


 Tyumenenergosbyt პირადი ანგარიში Tyumen
Tyumenenergosbyt პირადი ანგარიში Tyumen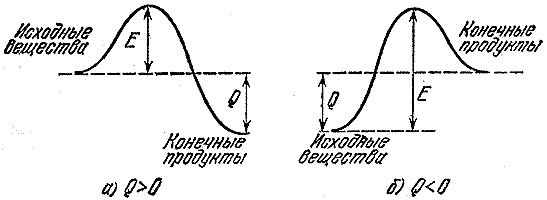 წვის პროცესის მახასიათებლები
წვის პროცესის მახასიათებლები გადახდა ელექტროენერგიის ახალი გზით
გადახდა ელექტროენერგიის ახალი გზით წყლის მრიცხველების გადატანა
წყლის მრიცხველების გადატანა