დამწვრობა ეწოდება. ქიმიური პროცესები დროს წვის
ზოგიერთი ძირითადი განმარტებები
ატომებისა და მოლეკულების რიცხვი მოხერხებულად გამოხატულია თვალსაზრისით ნივთიერებათა რაოდენობა ან ნივთიერების moles. ერთი მოლეკის საკითხი შეესაბამება 6.023 ∙ 10 23 ნაწილაკებს (ატომები და მოლეკულები). ნომერი N A = 6.023 ∙ 10 23 mol -1 ევაგადროს ნომერია. Mole ფრაქცია x iკომპონენტი მე არის რგოლების რაოდენობის თანაფარდობა n მე კომპონენტი მე მთლიანი რაოდენობის moles n = Σ n მე ნარევები ( x i = n მე / ნ).
მასობრივი მ არის ნივთიერების ფუნდამენტური ქონება (საზომი ერთეულის სისტემა SI სისტემაში არის კილოგრამი). Wi მასა ფრაქცია არის მასის თანაფარდობა მ კომპონენტი მე მთლიანი მასის m = Σ მ მე (Wi = მ მე / მ).
მოლეკულური წონა (ან მოლეკულური წონა) მ მე(g / mol) კომპონენტი მე - ეს კომპონენტის ერთი მოლეტის მასაა. ასე რომ, ატომური ნახშირბადის, მოლეკულური წყალბადის, ჟანგბადის და მეთანი გვაქვს: M გ 12 გ / მოლ, Mn 2 = 2 გ / მოლ, Mo 2 = 32 გ / მოლ, Mn 4 = 16 გ / მლ. კომპონენტების მოლარის ფრაქციებს შეიძლება გამოხატავდეს M (m / mol) ნალექის საშუალო molar მასა (M = x მე მ).
წვის პროცესების განსაზღვრა
დამწვრობა - ძნელია ფიზიკური და ქიმიური პროცესისადაც მწვავე ნივთიერებები და მასალები მაღალი ტემპერატურის გავლენის ქვეშ ქიმიური ურთიერთქმედება ჟანგვის აგენტი (ატმოსფერული ჟანგბადი), წვის პროდუქტების გადაქცევა, და რომელსაც თან ახლავს ინტენსიური სითბო და სინათლის ემისია.
წვის პროცესის წარმოშობის პირობები:
მყარი ნივთიერების არსებობა (GV);
ჟანგვითი აგენტის არსებობა (O.) - ჰაერის ჟანგბადი;
ანთების წყაროს არსებობა (I.Z.).
მყარი მასალა უნდა იყოს მწვავე ტემპერატურა, რომელიც იწყებს ჟანგვის პროცესს;
გარკვეული ტემპერატურისადმი მწვავე ნივთიერების დათბობის მიზნით საჭიროა გარკვეული ანთების წყარო.
წვის პროცესის შესანარჩუნებლად საჭიროა საწვავის და ოქსიდისტის გარკვეული კონცენტრაციები.
ყველაზე მნიშვნელოვანი წვის პროცესები არის სითბო და მასობრივი გადატანა. დამწვრობის ყველაზე გავრცელებული საკუთრებაა ცეცხლის გადაადგილება და სითბოს გადაადგილებისას სითბოს გადატანა ან წვის აქტიური ნაწილაკების განმსაზღვრელი მტვრისგან ახალი მტვრის ნარევით.
ფლეში - ეს არის მწვავე გამოვლინება. ის ასევე იწვის ზონას. ეს არის სივრცის ნაწილი, სადაც მოხდება საწვავის ნარევი სრული და არასრული წვის პროდუქტებში.
წვის პროცესის ძირითადი პარამეტრები სიკვდილისა და მატერიალური ზიანის გამომწვევი მიზეზებია:
დიდი რაოდენობით სითბო;
მაღალი ტემპერატურა;
წვის პროდუქტების ტოქსიკური შემადგენლობა
წვის პროცესი გაზების მოლეკულური კინეტიკური თეორიის თვალსაზრისით
ნახ. 2.1. აქტიური მოლეკულების პროპორცია დამოკიდებულია ტემპერატურაზე: T 2\u003e T 1
მას შემდეგ, რაც მწვავე გაზის საწვავი ნარევი იზრდება ჭარბი ენერგია.
განსხვავება აქტიურ მდგომარეობაში მოლეკულების საშუალო ენერგეტიკულ დონესა და არააქტიური ქვეყნის საშუალო დონეს შორის აქტივაციის ენერგიაა. ეს შეიძლება წარმოდგენილი იყოს გრაფიკულად (ნახ. 2).

ნახ. 2.2. რეაქციის კურსის ენერგეტიკული დიაგრამა G.V. + O. ® PG: E აქტი - აქტივაცია ენერგია; Q xr - წვის რეაქციის თერმული ეფექტი
"პირველი" რეაქტირებული მოლეკულების ურთიერთქმედების შედეგად გათავისუფლებული ენერგია მეზობელ მოლეკულებს გადაეცემა. ისინი აღფრთოვანებულნი არიან, პროცესი მეორდება მთელ რეაქციულ მოლეკულებზე დიდი სიხშირით და ინტენსიობით. ქიმიური ურთიერთქმედების მთელი რეაქციის ნარევი (2H 2 + O 2) პროცესის თვითგამძლეობა, თვით-დაჩქარება იწყება წყლის მოლეკულების ფორმირებისა და გარემოში სითბოს გათავისუფლებასთან ერთად, ერთად luminescence- თან ერთად. ჩნდება და ავრცელებს წვის პროცესს.
უფრო მაღალი რიცხვითი ღირებულება E აქტი, უფრო რთული, რათა ეს წყვილი კომპონენტები შედის ქიმიური ურთიერთქმედების. აქედან გამომდინარე, E მოქმედების ღირებულება ამ ქიმიური სისტემის სახიფათო საფრთხის ხარისხის ირიბი მაჩვენებელია.
წვის სახეები და რეჟიმები
წვის შეიძლება კლასიფიცირებული იყოს შემდეგი პარამეტრების მიხედვით:
1. მყარი კომპონენტების შერწყმის პირობით:
ა) წინა-შერეული აირის ან ორთქლის ჰაერის ნაერთების კინეტიკური წვა. ვინაიდან საწვავის და ოქსიდანტის ნარევი მზადაა, სანამ წვაზე არ იწვის, წვის პროცესის საერთო მაჩვენებელი დამოკიდებულია მხოლოდ სიჩქარეზე ქიმიური რეაქცია იწვის. თუ ასეთი წვადი ხდება დახურულ ან შეზღუდულ მოცულობაში, აფეთქება შეიძლება მოხდეს. მას შემდეგ, რაც ნარჩენების წვის შედეგად გათავისუფლებული ენერგია არ არის დრო, რომ ამ მოცულობიდან გამოთავისუფლდეს დრო, გაზრდის ზეწოლას, შეიძლება დაზიანდეს სტრუქტურები;
ბ) დიფუზია, დიფუზია წვის ეწოდება წვის, როდესაც ფორმირების კომბინირებული საშუალო (ნარევი საწვავი და oxidizer) ხდება ადრე წვის ზონაში ან წვის ზონაში.
2. ქიმიური რეაქციის ზონაში საწვავი კომპონენტების მიღების ინტენსივობის მიხედვით:
ა) ლამინარი, ხოლო მყარი ნარევი კომპონენტების შემადგენლობაში შედის წვის ზონა შედარებით მშვიდად. ამ შემთხვევაში, რეინოლდსის კრიტერიუმის რიცხვითი ღირებულება, რომელიც ახასიათებს თერმოდინამიკური რეჟიმს, მნიშვნელოვნად გაცილებით ნაკლებია ვიდრე კრიტიკული<2300).
ბ) მღელვარება, მწვავე ნარევი კომპონენტების კომპონენტებით მაღალი წვის მტვრის ზონაში შესვლისას. ამ შემთხვევაში რეინოლდსის ნომერი 2300-ზე მეტია.
3. საწვავის ნარევი კომპონენტების აგრეგირების მდგომარეობის მიხედვით:
ა) ერთგვაროვანი საწვავი და ოქსიდიზატორი ერთსა და იმავე აგრეგირებულ მდგომარეობაშია (აირისებური);
ბ) ჰეტეროგენული (მრავლობითის) - საწვავი და ოქსიდანტი სხვადასხვა აგრეგატურ ქვეყნებშია.
4. წვის ქიმიური რეაქციის ზონაში გავრცელების სიჩქარეზე:
ა) ქიმიური რეაქციის ზონის დეფლაგაცია (ნელი) განაწილება (სიჩქარე 0.5 დან 50 მ / წმ);
ბ) აფეთქება (ასაფეთქებელი), როდესაც წვის ქიმიური რეაქციის ზონაში პროვოცირება ხდება შოკის ტალღის სიჩქარით (რამდენიმე ასეული მეტრიდან წამში რამდენიმე კილომეტრამდე).
სივრცე, რომლის დროსაც ხდება ორთქლის ან აირების წვა ფლეიმის მიერ .
ლამინარი Flames წინასწარ შერეული. წინასწარ შერეული ნარევი ლამინირებული ნაკეში, საწვავი და ოქსიდანტი შერეული წვის დაწყებამდე შერეულია და ნაკადი ლამინარია.
წინასწარ შერეული ნარევი ალი ეწოდება stoichiometric თუ საწვავი (ჰიდროკარბონა) და ოქსიდიზატორი (ჟანგბადი - O 2) ერთმანეთს მთლიანად მოიხმარენ, ნახშირბადის დიოქსიდის (CO 2) და წყლის (H 2 O) ფორმირება. თუ არსებობს ზედმეტი საწვავი, ამბობენ, რომ ნარევი მდიდარია და თუ არსებობს ზედმეტი ოქსიდანტი, ამბობენ, რომ ნარევი ცუდია.
განვიხილოთ მარტივი მაგალითები:
1) 2H 2 + O 2 → 2H 2 O - stoichiometric ნარევი,
2) ЗН 2 + О 2 → 2H 2 O + Н 2 - მდიდარი ნარევი (Н 2 ზე ჭარბი),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - მჭლე ნარევი (O 2 ჭარბი).
ყოველი სიმბოლო ასეთ ქიმიურ რეაქციის განტოლებაში შეესაბამება ნივთიერების ერთი მოლეკს. ამგვარად, ამ განტოლებების პირველი ნაწილი ნიშნავს, რომ H 2- ის ორი ნატეხი O 2- ის ერთ მოლეჰთან ერთად რეაგირებს H 2 O- ის ორ მოლეკულს.
თუ ქიმიური რეაქციის განტოლება იწერება ისე, რომ ის აღწერს მხოლოდ ერთი მოლეტის საწვავის რეაქციას, მაშინ სტოიქომეტრიული ნარელის საწვავის მოლეკულური ფრაქცია ადვილად შეიძლება განისაზღვროს
x მთები, stokh = 1 / ((1 + v)
აქ vაღინიშნება რეაქციის განტოლებზე O 2 მოლეტების რაოდენობა CO 2 და H 2 O- ის ფორმირებით. მაგალითია რეაქცია
H 2 + 0.5O 2 → H 2 O, v = 0.5, x H 2, stoch = 2/3
თუ ოქსიდიზატორი ჰაერია, მაშინ უნდა ითქვას, რომ მშრალი ჰაერი შეიცავს მხოლოდ 21% ჟანგბადს, ასევე 78% აზოტს და 1% კეთილშობილურ აირებს. ამდენად, საჰაერო, X N 2 = 3.762 X O 2. აქედან მოლიარული ფრაქციები საყრდენი სტოიჩიომეტრიული ნარევისთვის თანაბარი იქნება
x მთები, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
სადაც v როგორც ადრე ნიშნავს O 2 მოლეტების რაოდენობას რეაქციის განტოლებზე CO 2 და H 2 O- ის ერთეული მოლეტის სრული კონვერტაციის სრული კონვერსიით. v საჰაერო საწვავის სტადიოიომეტრიული ნარევების საწვავის მოძრავი შემადგენლობა ნაჩვენებია ცხრილში 1.
საწვავის და ჰაერის წინასწარ შერეული ნარევები (ამ შემთხვევაში, რეაქციის განტოლებისთვის უნდა დაემატოს N 2 შესაბამისი თანხა, იხ. ცხრილი 1) ხასიათდება ჰაერის ექვივალენტური თანაფარდობით:
λ = (x w / x მთა) / (x w, stoch / x მთები, stoh) = (w w / w მთები) / (w w, stoch / w მთები, stoch)
ან საექსპლუატაციო - ეკვივალენტური თანაფარდობა საწვავისთვის ფ (ფ = 1 / λ). ეს ფორმულა შეიძლება გარდაიქმნას იმისათვის, რომ შეძლონ განსაზღვროს ნარევი მოლირის ფრაქციების მნიშვნელობა ფ:
x მთა = 1 / ((1 + (4,762 ∙ v) / F), x w = 1 - x მთები,
X წონა / 4,762, = ∙ 3,762
V ღირებულებების მაგალითები და საწვავის მოძრავი ფრაქციები x მთები, სტოიჩი საჰაერო საწვავის სტოიქომეტრიული ნარევები
სარწყავი ყოველთვის თან ახლავს ქიმიური გარდაქმნების. ჰაერის წვა - ჟანგბადის მჟავა ნივთიერების ურთიერთქმედება. თუმცა, უნდა აღინიშნოს, რომ აზოტის, ჰალოგენებისა და ოზონის ოქსიდები შეიძლება იმოქმედონ როგორც წვის პროცესში ოქსიდიზატორებად. ცნობილი წვის პროცესები, რომლებიც წარმოიქმნება პროდუქტის მხოლოდ ერთი წყაროს მონაწილეობით - სწრაფი დაშლის მქონე ნაერთები. ასეთი ნაერთების მაგალითებია აცეტილენი და ჰიდრაჟინი.
წვის დროს ქიმიური პროცესები ძალიან რთულია. თუნდაც მარტივი შემთხვევაში - წყალბადის წვის ჟანგბადში, რომლის განზოგადებული განტოლება აქვს ფორმას
2H 2 + 0 2 = 2H 2 0,
შეიქმნა და სწავლობდა რამდენიმე ათეული ელემენტარული ეტაპი.
დღეისათვის, ქიმიური გარდაქმნების მექანიზმები მხოლოდ რამდენიმე ნივთიერებების წვის დროს, როგორიცაა წყალბადის, ნახშირბადის მონოქსიდი, მეთანი და ეთანი, შესწავლილი იქნა საკმარისად დეტალურად. ეს ცოდნა გამოიყენება მრავალი ნივთიერების ანთების და წვის პირობების პროგნოზირებაში.
2.1. ჯაჭვური რეაქციები
ჯაჭვური რეაქციები, ჩვეულებრივი ქიმიური გარდაქმნებისგან განსხვავებით, ხასიათდება აქტიური ნაწილაკების თითოეული ელემენტური აქტით: ატომი შეუცვლელი ელექტრონული, თავისუფალი რადიკალური ან იონი. აქტიური ნაწილაკების გამოჩენა იწვევს რეაქციის პროდუქტებში დაწყებული მასალების გარდაქმნის ჯაჭვს. ატომები, თავისუფალი რადიკალები და იონები უფრო რეაქტიულია, ვიდრე valence- გაჯერებული მოლეკულები. აქედან გამომდინარე, მიუხედავად მნიშვნელოვანი ენერგო ხარჯები, რომლებიც საჭიროებენ ქიმიური კავშირების შესუსტებას და აქტიური ნაწილაკების ჩამოყალიბებას, რეაქციის ჯაჭვის განვითარება ხშირად ენერგიულად უფრო სასარგებლოა, ვიდრე მოლეკულებს შორის პირდაპირი ურთიერთქმედება.
წვის პროცესები ძირითადად ხდება ჯაჭვის მექანიზმის მეშვეობით. ჯაჭვური რეაქციები - კომპლექსური რეაქციები, რომელიც შედგება რამდენიმე ეტაპად, წარმოადგენს:
ჯაჭვების წარმოშობა (ინიციაცია), რომელშიც აქტიური ნაწილაკები იქმნება;
ჯაჭვების გაგრძელება, რომელშიც აქტიური ნაწილაკები ქიმიურ ურთიერთქმედებაში შედიან დაწყებული მასალებით, რის შედეგადაც ახალი აქტიური ნაწილაკები იქმნება;
ჯაჭვების გაუქმება, რომელშიც აქტიური ნაწილაკების "გარდაცვალება" ხდება საბოლოო რეაქციის პროდუქციის ჩამოყალიბებით
ჯაჭვების წარმოშობა შესაძლებელია სხვადასხვა პირობებში მოხდეს. მაგალითად, თბოელექტროსადგურის მოლეკულების გამჟღავნების შედეგად ან ელექტრომაგნიტური გამოსხივების დროს მაიონებელი გამოსხივების შედეგად. აქტიური ნაწილაკების გარდაცვალება ხდება მაშინ, როდესაც ისინი ხელახლა ჩაიწერება * თავისუფალი რადიკალების ურთიერთქმედება (ერთგვაროვანი ჯაჭვის დარღვევა), როდესაც აქტიური ნაწილაკები ურთიერთქმედებს მყარ ზედაპირებზე (ჰეტეროგენული ჯაჭვის დარღვევა) ან მათი რეზისტენტობის გამოხატვის შედეგად.
არსებობს unbranched და branched ჯაჭვური რეაქციები. ყოველ აქტიურ ნაწილაკზე, რომელიც მოხმარდება ჯაჭვის გაგრძელებაზე რეაგირებას, არსებობს ერთი ხელახლა განვითარება. პირველადი აქტიური ნაწილაკების წარმოქმნის პროდუქტის მოლეკულების რიცხვი ეწოდება ჯაჭვის სიგრძეს. წვის რეაქციების ჯაჭვების სიგრძე ასობით ათასიდან ათობით მილიონამდეა. შეუზღუდავი ჯაჭვური რეაქციების სიჩქარე შეიძლება გავლენა იქონიოს ნივთიერებების მცირე ნაერთებით, რომლებიც ეფექტურად ურთიერთქმედებენ აქტიურ ნაწილაკებს, როგორიცაა წვის ინჰიბიტორები.
ზოგიერთი ნივთიერებები - ინიციატორები - ხელს უწყობენ აქტიური ნაწილაკების ჩამოყალიბებას და ამცირებენ არანჟირებულ ჯაჭვურ რეაქციებს.
ჩამოყალიბებული ჯაჭვური რეაქციების ერთ აქტიურ ნაწილაკზე, რომელიც მოხმარდება ჯაჭვის გაგრძელება, იქმნება ორი ან მეტი აქტიური ნაწილაკი. ერთი მათგანი განაგრძობს პირველადი ჯაჭვის, ხოლო სხვები იწყებენ ახალ ჯაჭვებს, რომლებიც ქმნიან ფილიალს (ფიგურა 2.1).
"რეკომბინაცია არის ნეიტრალური ატომებისა და მოლეკულების ფორმირების პროცედურები, რომლებიც ბრალად ნაწილაკებისგან შედგება: რეკორბინაციის დროს ჩამოყალიბებული ატომები და მოლეკულები შეიძლება იყოს ადგილზე ან აღფრთოვანებული სახელმწიფო.
ნახ. 2.1. რეაქციის ჯაჭვების სქემატური წარმომადგენლობა:
ა) ჯაჭვის ყოველი ბმულიდან
6) იშვიათი ფილიალი
მაგალითად, წყალბადის წვის დროს ჯაჭვის ინიციატივის რეაქციაში:
აქტიური ატომი იქმნება. ჯაჭვის გაგრძელება რეაქციაში:

არსებობს აქტიური ატომების რიცხვი, რომლებიც ახალი ქსელების დასაწყისია.
ფილიალის ჯაჭვური რეაქციები შეიძლება გაგრძელდეს სტაციონარულ რეჟიმში, რომელშიც ფილიალის სიჩქარე აქტიური ნაწილაკების გარდაცვალების მაჩვენებელზე ნაკლებია და არა სტაციონარულში, სადაც სიკვდილი უფრო მეტად ნელია, ვიდრე ფილიალი. ამ უკანასკნელ შემთხვევაში ჯაჭვური რეაქციის სიჩქარე იზრდება ექსპონენციალურად და შემოიფარგლება მხოლოდ საწყისი მასალის მოხმარებით. სტაციონალური და არა სტაციონარული რეჟიმის გადასვლა უკიდურესად შეცვლის რეაქციის პირობებში: ტემპერატურა, ზეწოლა ან კონცენტრაცია ერთ-ერთი რეაქტიონისა. ასეთი სწრაფი დაჩქარება ითვლება რეაქციის ნარევი ან ჯაჭვური აფეთქების თვითმმართველობის ანთება.
სათემო ჯაჭვური რეაქციების აღმოჩენა დიდი მნიშვნელობა ჰქონდა წვის პროცესების თეორიის შექმნას. დადასტურდა, რომ არსებობს ორი სახის ანთება: თერმული და ჯაჭვი. ნიმუშების დაყენება
თავი 2. ქიმიური პროცესები იწვის
ჯაჭვის პროცესების თეორია, ეფექტურად ახდენს გავლენას ხანძრის დროს წვის პროცესების განვითარებასა და ჩახშობას.
წარმოშობის ჯაჭვები.თავდაპირველი აქტიური ცენტრების ნუკლეტაციის პროცესი მნიშვნელოვან როლს ასრულებს არაჩვეულებრივი ჯაჭვური რეაქციების განვითარებაში. იგი კომპენსირებას ახდენს ჯაჭვის შეწყვეტის რეაქციების დროს აქტიური ცენტრების დაკარგვისთვის. ეს მექანიზმი განსაზღვრავს სტაციონარული რეჟიმის ფორმირების პირობებს აქტიური ცენტრების დაგროვების საწყის პერიოდში. დაწყების დაბალი მაჩვენებლით, ეს პერიოდი მნიშვნელოვანია.
ცეცხლსაწინააღმდეგო ქიმიური რეაქციების უმრავლესობას აქვს აქტიური ცენტრების მნიშვნელოვანი ენერგეტიკული რეზერვი. ამ პირობებში, აქტიური ცენტრების ინიცირება დაკავშირებულია მნიშვნელოვანი ენერგეტიკული ბარიერის დაძლევაში.
ამ შემთხვევაში მნიშვნელოვანი როლი შეასრულებს ფაქტორებს, რომლებიც უზრუნველყოფს აქტიური ცენტრების წარმოქმნის მნიშვნელოვან მაჩვენებელს: ქიმიურად აქტიური დანამატები, რადიაცია, ელექტროგადაღება, რადიოაქტიური წარმოშობის პროდუქტები.
იმ ფაქტორებს შორის, რომლებიც ხელს უწყობენ აქტიური ცენტრების თაობას, ჰეტეროგენული რეაქციები უნდა აღინიშნოს. მყარ ზედაპირზე მოთავსებული მწვავე ნივთიერებების მოლეკულებში, ინტერმატომიური ობლიგაციები დასუსტებულია და მათი დარღვევა მოითხოვს ნაკლებ ენერგიას ხარჯვას. ამ პირობებში აქტიური ცენტრების გენერაციის მაჩვენებელი გაცილებით მაღალია, ვიდრე გაზის მოცულობა. აალებადი ნარევი კომპონენტების ჰეტეროგენული ურთიერთქმედების გააქტიურების ენერგია ასევე დაბალია, ვიდრე ერთგვაროვან შემთხვევაში. აქტუალური წვის პროცესების პირობებში აქტიური ცენტრების ჰეტეროგენული ინიციაცია მნიშვნელოვანია, როგორც სტაციონარულ რეჟიმის დაჩქარებულ მიღწევებში უმართავი ჯაჭვის პროცესებთან.
ზოგიერთი მახასიათებლები ახასიათებს არბილურ ჯაჭვურ რეაქციებს, რაც ატომური კომპონენტების მონაწილეობით ხდება. არარსებობის გარეშე აქტიური ცენტრების ურთიერთქმედების გარეშე რეგენერაცია, ჯაჭვის შეწყვეტა ხდება მხოლოდ მაშინ, როდესაც ატომები recombine მიერ სამჯერ collisions და ზედაპირზე.
ნებისმიერ ტემპერატურაზე, ყველა აირისებრი ნივთიერება ნაწილობრივ განცალკევებულია. ზოგიერთი მოლეკულა შემოიფარგლება ატომებში. ამ შემთხვევაში, არსებობს წონასწორობა დისოციაციისა და ატომების კავშირის მოლეკულებს შორის. დისოციაციის ხარისხი ექსპონენციურად დამოკიდებულია ტემპერატურაზე.
იმ შემთხვევაში, თუ არ არსებობს ჭუჭყიანი წებოვანი ნაერთების ჯაჭვების დარღვევა, რეაქციის ატომური კომპონენტების კონცენტრაცია პრაქტიკულად უცვლელი რჩება. რეაქციაში შეყვანილი ატომები დაუყოვნებლივ ხდებიან რეგენერაციას
კოროლჩენკო ა. წვის და აფეთქების პროცესები
lichie. თავდაპირველი ინიციატივა რეაგირებული ატომებისთვის კომპენსირებას ახდენს იგივე რეაქციულ სისტემაში, როგორიც არაა რეაქტიული სისტემა. სტაციონარული რეაქცია არ იმოქმედებს ამ პროცესში. რეაქციის ერთ-ერთი კომპონენტის ბალანსი, რომელიც გამოირჩევა მოლეკულის ატომებს შორის ყველაზე ნაკლებად ძლიერი კავშირისგან, წარმოადგენს ამ რეჟიმის მახასიათებელს. ამ შემთხვევაში სხვა ატომური კომპონენტის კონცენტრაცია არის quasistation, მაგრამ უფრო წონასწორობა.
წვის რეაქციების ჰომოგენური ინიციატივით, სტაციონარული რეჟიმი შეიქმნება მხოლოდ გარკვეული პერიოდის შემდეგ, რადგან დისოციაცია მოითხოვს ენერგიის დიდი გააქტიურებას. ამ პერიოდის განმავლობაში, დისოციაციის სიჩქარე აღემატება რეკომინაციის მაჩვენებელს და აქტიურ ცენტრებს რეაქციის სისტემაში დაგროვებენ. ორივე პროცესის განაკვეთები შედარებით მხოლოდ აქტიური ცენტრების კონცენტრაციის გაზრდის შემდეგ შეადგენს წონასწორობას. ამ პერიოდს ეწოდა ინდუქციური პერიოდი.
რეაქციის ზონაში მყარი ზედაპირი, როგორც კატალიზატორი, არ ცვლის თერმოდინამიკური წონასწორობის მდგომარეობას. კატალიზატორი თანაბრად აისახება წინ და საპირისპირო რეაქციებზე. აქტიური ცენტრები არა მარტო მყარ ზედაპირზეა, არამედ მასზე დაარღვიე. თუმცა, კატალიზატორის არსებობა აჩქარებს წონასწორობის დესტაბილიზაციის მდგომარეობას.
თუ აქტიური ნივთიერებები წარმოადგენენ საწვავის ნარევი ნივთიერებას, რომლებსაც შეუძლიათ მონაწილეობა მიიღონ ჯაჭვურ რეაქციებში, ისინი შეამცირებენ აქტიური ცენტრების კონცენტრაციას. ამ შემთხვევაში, ერთ-ერთი პირველი კომპონენტის წონასწორული დისოციაცია შეშფოთებულია, რაც ანელებს რეაქციას და შეიძლება გამოიწვიოს მისი შეწყვეტა.
ექსპერიმენტები აჩვენებს, რომ გარედან (მაგალითად, სინათლის წყაროდ) ჩამორჩენილი ჯაჭვის რეაქციის დაწყებისას წვის პროცესის განვითარების საწყის ეტაპზე აქტიური ცენტრების კონცენტრაცია მნიშვნელოვნად აღემატება წონასწორობას.
კვანძის რეაქციების დროს, თავდაპირველი ინიციაციის პირობები მნიშვნელოვან გავლენას ახდენს რეაქციის განვითარებაზე. ნელი გადაადგილების პროცესში, ნაწილობრივ რეაგირებენ ნარევი დამატებით პირს შეჰყავს ინდუქციური პერიოდი და აჩქარებს ფლეიმის წვის მომენტს.
გაგრძელება ჯაჭვების.Unbrranched ჯაჭვური რეაქციების მახასიათებელი ფუნქცია აქტიური ცენტრების კონცენტრაციის გამაცხელებელია. არარსებობის ღია circuit, აქტიური ნაწილაკების ჩამოყალიბდა
თავი II ქიმიური პროცესები წვის დროს
იგივე თანხა, რომელიც მათ იხარჯება. ახალი წარმოიქმნება მხოლოდ თავდაპირველი ინიციატივით. აქტიური ცენტრების და ჯაჭვის შეწყვეტის თაობის თანაბარი განაკვეთით შეიქმნება აქტიური ცენტრების მუდმივი კონცენტრაცია და სტაციონარული რეაგირების რეჟიმი. რეაქციის მაჩვენებელი შემცირდება, რადგან თავდაპირველი კომპონენტები მოხმარდება.
კვანძის რეაქციის შემთხვევაში, რეაგირების სისტემაში აქტიური ცენტრების კონცენტრაცია იზრდება მათი თავდაპირველი ინიციატივის პირობების მიუხედავად. განხორციელებული თვითმმართველობის დაჩქარება რეაქციის რეჟიმში, რომელსაც აქვს ზვავი ხასიათი. ამ შემთხვევაში, პირველადი კომპონენტების რეაქციის საბოლოო პროდუქტებში სრული ტრანსფორმაციისთვის, ერთი საწყისი აქტიური ცენტრი საკმარისია.
კბილების განმასხვავებელი რეაქციის კინეტიკური განტოლება შემდეგია. დროთა განმავლობაში სტაბილური საწყისი კომპონენტების კონცენტრაციებში ცვლილება შეიძლება უგულვებელყოფილი იყოს პირველი დაახლოებისათვის, ხოლო მხედველობაში მიიღება მხოლოდ აქტიური ცენტრების კონცენტრაციის სწრაფი ცვლილებები. გვ.ამ მაჩვენებელში ცვლილებები განისაზღვრება თავდაპირველი ინიციატივებისა და ფილიალის და ჯაჭვის შეწყვეტის რეაქციების განაკვეთების თანაფარდობით. თავდაპირველი ინიციატივა არ არის დამოკიდებული სისტემაში არსებული აქტიური ცენტრების კონცენტრაციაზე. ფილიალის და დაზიანების პროცესების განაკვეთები პროპორციულია აქტიური ცენტრების კონცენტრაციებზე. ამ პირობებში, აქტიური ცენტრების ფორმირებისა და ხარჯების მთლიანი ბალანსი განისაზღვრება ინიცირების, ფილიალისა და დამღუპველი პროცესების განაკვეთების ჯამიდან:
![]() (2.1)
(2.1)
სადაც და ფსევდო-რეაქციის რეაქციების სიჩქარის მუდმივი მაჩვენებლებია. Denoting, მივიღებთ:
![]() (2.2)
(2.2)
აქტიური ცენტრების კონცენტრაციის დროს წარმოებული დრო
დადებითია. რეაქციის მაჩვენებელი დროთა განმავლობაში იზრდება. ამ ჯაჭვური რეაქციების ფუნქცია განპირობებულია ისეთი რეჟიმების აქტიური ცენტრების გამრავლებისას, როდესაც ფილიალი რეაქციის სიჩქარე აღემატება ჯაჭვის შეწყვეტის რეაქციის მაჩვენებელს.
კოროლჩენკო ა. წვის და აფეთქების პროცესები
თუ რეაქციის დაწყებამდე სისტემაში არ არსებობდა აქტიური ცენტრები, ზეტ= 0, n = 0 განტოლების ინტეგრაცია (2.2) აძლევს:
![]() (2.3)
(2.3)
CO- ს მთლიანი რეაქციის სიჩქარე განისაზღვრება ფილიალის პროცესის მაჩვენებლით. საბოლოო პროდუქცია მხოლოდ ამ რეაქციის დროს იქმნება. თითოეული ელემენტარული ჯაჭვის ფილიალის შემთხვევაში, საბოლოო პროდუქტის მოლეკულები იქმნება. შემდეგნაირად:
![]() (2.4)
(2.4)
დროში ჯაჭვური რეაქციის განვითარება განისაზღვრება ფილიალისა და ჯაჭვის შეწყვეტის რეაქციების კოეფიციენტის კოეფიციენტის თანაფარდობით და როდესაც განტოლების განტოლება (2.4) არის დადებითი და ხელახლა
აქცია შეუზღუდავად დაჩქარებულია. რეაქციის შემუშავების საწყის ეტაპზე შემდეგი ურთიერთობებია ჭეშმარიტი:
იმის გამო, რომ თავდაპირველი ინიციაციის მაჩვენებელი მცირეა, საწყის პერიოდში არ არის შესამჩნევი ქიმიური ტრანსფორმაცია. გარკვეული დროის გასვლის შემდეგ, ღირებულება უფრო დიდია, ვიდრე ერთი. ამის შემდეგ, რეაქციის მაჩვენებელი განტოლების მიხედვით (2.4) იწყება სწრაფად და გაიზრდება ძალიან დიდი ღირებულებები, მიუხედავად იმისა, რომ ეს პრაქტიკულად შეუძლებელი იყო ადრე.
ჯაჭვური რეაქციის განვითარების დროს დაგვიანებული პერიოდი (ინდუქციური პერიოდი) არის რეაგირების სისტემის აქტიური ცენტრების გარკვეული რაოდენობის დაგროვების აუცილებლობა. მხოლოდ ამის შემდეგ ხდება ქიმიური ტრანსფორმაცია.
ჯაჭვურ რეაქციებში ინდუქციური პერიოდის სიდიდე განსაზღვრავს ფილიალებისა და ჯაჭვის შეწყვეტის პროცესების განაკვეთების კოეფიციენტებს და არა საწყისი ინიცირების მაჩვენებელს. თავის მხრივ, ფილიალი და გამანადგურებელი რეაქციების განაკვეთები გამოწვეულია თითოეული რეაგირების სისტემის ქიმიური მახასიათებლებით, მათი განპირობებულია ტემპერატურისა და საწყისი კომპონენტების კონცენტრაციის მიხედვით. ჯაჭვური რეაქციების თავისებურება
ის არის, რომ ფილიალი პროცესები მოითხოვს მნიშვნელოვან აქტივაციას ენერგეტიკულ ენერგიას, ხოლო ტემპერატურის კოეფიციენტი, რომელიც მუდმივი პროცესია, არის ნულოვანი. სამივე ტიპის ქსელების შეწყვეტის რეაქციაში: ნაყარი და ჰეტეროგენული რეაქციების დროს, რადიკალების ურთიერთქმედებისას აქტიური მინარევებით, აქტივაციის მივყავართ ნულოვანია.
ტემპერატურის ზრდა, ნარევითა საერთო წნევა, ან რეაგირების კომპონენტების კონცენტრაციის ცვლილება შესაძლებელია ფილიალის და დაზიანების სიჩქარის ცვლილებებში, სადაც რეაქცია იცვლება სტაციონარულიდან არა-სტაციონარამდე. ამ პროცესის თავისებურება მდგომარეობს იმაში, რომ ერთი რეჟიმიდან მეორეში მკვეთრი გარდამავალია, რეაქციის მაჩვენებელი უმნიშვნელო მნიშვნელობისაგან შეუზღუდავად გაზრდის ერთს.
ზოგიერთი ჯაჭვის რეაქციის ნაკადის თანხას ახდენს შუალედური პროდუქტების ფორმირება, რომლებიც შედარებით სტაბილურია, მაგრამ აქტიური ცენტრების გენერირების უნარი. ასეთი რეაქციები მოიცავს მაგალითად, ნახშირწყალბადების წვის რეაქციებს, როგორც შუალედებს, რომელშიც იქმნება პეროქსიდები და ალდეჰიდები. ეს იწვევს ჯაჭვის რამაციას. თუმცა, შუალედური პროდუქტების შედარების სტაბილურობის გამო, რეაქციის დაჩქარება დროთა განმავლობაში გრძელდება. ასეთი ნელი ფილიალი ჯაჭვების დეგენერაციას უწოდებენ.
ჯაჭვური რეაქციები ჩვეულებრივი რადიკალური ფილიალით მექანიზმით, როგორც წესი, რადიკალების მაღალი აქტივობის გამო, საკმაოდ სწრაფად გაგრძელდება. შედეგად რადიკალები იწყებენ სწრაფი დაჩქარების რეაქციას, ან recombine და გამოსვლის პროცესი.
ღია ჩართვა აქტიური ნაწილაკი, ისევე როგორც ნებისმიერი გაზის მოლეკულა, ქმნის შემთხვევითი შუამდგომლობები რეაქტურ სისტემაში, რომელიც სხვა მოლეკულებთან კავშირია. ამავდროულად, არსებობს გარკვეული ალბათობა, რომ ურთიერთქმედება სხვა აქტიურ ნაწილაკთან ან მოლეკულთან და ახალი აქტიური ნაწილის ჩამოყალიბება, რაც განაგრძობს წინამორბედის გზას. რეაქციის ჯაჭვის განვითარება ინერტული მოლეკულების ბრაუნის მოძრაობის მსგავსია, თუმცა აქტიური ცენტრების გადაცემა თან ახლავს ქიმიურ რეაქციას. ქსელის განვითარების გზაზე ორი ან მეტი ტიპის ალტერნატიული აქტიური ცენტრები.
კოროლჩენკო ა. წვის და აფეთქების პროცესები
რეაქციის ჯაჭვი გრძელდება იმ მომენტამდე, როდესაც აქტიური ნაწილაკები რეგენერაციის გარეშე რეაგირებენ. ამ შემთხვევაში, ე.წ. ღია წრიული ხდება. უკმარისობის პროცესები დიდ როლს ასრულებს ჯაჭვური რეაქციების კინეტიკაში. არსებობს ორი ტიპის რეაქციები, რომლებიც მივყავართ აქტიური ცენტრების სიკვდილს:
ჰომოგენური შესვენება (რეაქციის ნაერთის სიკვდილი);
ჰეტეროგენული შესვენება (მყარი ზედაპირის სიკვდილი) ჯაჭვების ჰომოგენური შესვენება შესაძლებელია ერთ-ერთი ორი პროცესით:
როდესაც რადიკალების რეკორბინი ან როდესაც ქიმიურად აქტიური კომპონენტები აქტიურ ცენტრებთან ურთიერთქმედებენ ამ უკანასკნელის რეგენერაციის გარეშე.
ჰეტეროგენული ჯაჭვის დარღვევა ხდება წვის დროს წარმოქმნილი ნაწილაკების ნაწილაკებზე, ან მყარი დამწვრობის მასალის ზედაპირზე. ღია ზედაპირზე მყარი ზედაპირზე შეიძლება ჩაითვალოს აქტიური ცენტრების დიფუზია გაზის ნარევიდან ამ ზედაპირზე, რომლითაც ისინი გაქრება. მყარი ზედაპირზე რეკომბინაციის მექანიზმი ისაა, რომ აქტიური ნაწილაკი, რომელსაც აქვს რეაქტიულობა, ზედაპირზე მოხდება. რადიკალები, რომლებიც მჭიდროდ არიან განლაგებული მიმდებარე ტერიტორიებზე, ერთმანეთთან ხდებიან, რადგან არ არსებობს ენერგეტიკული და სივრცითი დაბრკოლებები ამ პროცესში. რეაქტივაციის შედეგად წარმოქმნილი სტაბილური ნაერთების მოლეკულები აღარ არიან ჩართული ჯაჭვური რეაქციის განვითარებაში.
თუმცა, აქტიური ნაწილაკის ყველა შეჯერება მყარ ზედაპირთან არ იწვევს მის ადსორბციას. ალბათ მისი ასახვა ზედაპირზე. მდგრადი ზედაპირის აქტიური ცენტრის ადსორბციული ალბათობის ალბათობა სახელდება კოეფიციენტად. ეს კოეფიციენტი წარმოადგენს აქტიური ნაწილაკისა და ზედაპირის ქიმიური შემადგენლობის მახასიათებელს. პრაქტიკულად მნიშვნელოვან შემთხვევებში კედლისგან ასახვის აქტიური ნაწილაკი შორს არ გადადის. კედელთან ახალი შეჯახების ალბათობა არ არსებობს, სანამ მისი საცხოვრებელი ადგილი არ იქნება. ამ პროცესის გამო, გარკვეულ პირობებში, რეაქციის მაჩვენებელი პრაქტიკულად დამოუკიდებელია საცხოვრებლის კოეფიციენტზე. პროცესი ვითარდება ისე, როგორც ევროკავშირი
* სიმკვრივე - შთანთქმის გარემოში ჰაერის მყარი სხეულის (ან თხევადი) შთანთქმის. შთამნთქმელი სხეული ეწოდება სორბენტს, შეიწოვება- sorbate. გამოირჩევა სორბენტის (შთანთქმის) და ზედაპირის ფენის მთლიანი მასის (ადსორბციის) შთანთქმის. სორბირება ქიმიური ტიპის ურთიერთქმედების გამო მყარი sorbent და sorbate ზედაპირს შორის ეწოდება ქიმიორბციას.
__________________________ თავი II ქიმიური პროცესები წვის დროს
თუ ღია ჩართვა მოხდა ყველა შეჯახებასთან. ზედაპირზე აქტიური ცენტრების კონცენტრაცია შეიძლება იყოს ნულოვანი.
რეაგირების ნარევი აქტიური ჭუჭყის არარსებობის შემთხვევაში, ჯაჭვების შეტევა შეიძლება მოხდეს ან მყარ ზედაპირებზე ან ერთგვაროვანია რადიკალების რეკორბინაციით ნაყარი. რეალურ ხანძარში, მეორე გზა ძირითადად განხორციელდა.
ჯაჭვური რეაქციების კინეტიკაზე გარკვეულ გავლენას ინერტული აირების რეაქტურ სისტემაში დანამატები გააჩნიათ. ინერტული დანამატები გაზრდის აქტიური ნაწილაკების შეჯახების რაოდენობას, გაზრდის ჯაჭვის დაზიანების ალბათობას და, შესაბამისად, ზღუდავენ საერთო რეაქციას.
ჯაჭვური რეაქციების უფრო ეფექტური დათრგუნვა მიღწეულია რეაქტიული დანამატების ინჰიბიტორებით - ინჰიბიტორების რეაქციაში შეყვანისას. ინჰიბიტორები აქტიურ ცენტრებთან ურთიერთქმედებენ, რეაქციას უტარებენ, ჯაჭვის დარღვევას. ინჰიბირებული ნარევის რეაქციის კინეტიკა განისაზღვრება ინჰიბიტორსა და აქტიურ ცენტრებთან ურთიერთქმედებისას რეაქციის ძირითად კომპონენტებს შორის კონკურენციის პირობებში. ინჰიბიტორების მაღალი ეფექტურობით და ახალი აქტიური ცენტრების თაობის ზომიერი მაჩვენებლით, ინჰიბიტორის უკვე მცირე დანამატი მთლიანად შეუძლია შეაჩეროს ჯაჭვური რეაქციის კურსი.
ინჰიბირების პროცესები დიდი მნიშვნელობა აქვს ცეცხლისა და აფეთქების უსაფრთხოების პრაქტიკაში. ინჰიბიტორების გამოყენება საშუალებას იძლევა ეფექტურად გამოიყენოთ წვის პროცესები.
2.2. ქიმიური პროცესები წყალბადის წვის დროს
წყალბადის მოლეკულის ურთიერთქმედება ჟანგბადის მოლეკულასთან ერთად კომპლექსური გზით გრძელდება თანმიმდევრული ეტაპის სერიის მეშვეობით. ახლა მტკიცედ დადგინდა, რომ წყალბადის წვა ხდება ჯაჭვის მექანიზმით, ნაწილაკები აქტიური ცენტრების როლს თამაშობენ. წყალბადის წვის დროს ელემენტარული რეაქციების თანმიმდევრობა და მნიშვნელობა განსაკუთრებით აღწერილია სხვადასხვა პირობებში წყალბადის ცეცხლის გაჩენისა და განვითარებისათვის.
ექსპერიმენტული და გამოთვლითი მეთოდების გამოყენებით ავტომატური ჰაერის წვის პროცესის ყველაზე დეტალური ანალიზი შესრულდა პროფესორ ა. ბარატოვის მიერ. მან წარმოადგინა პროცესის შემდეგი სქემა, მათ შორის თოთხმეტი ძირითადი ელემენტარული რეაქციები:
კოროლჩენკო ა. წვის და აფეთქების პროცესები
აქტიური ცენტრების წარმოშობა ხდება რეაქციით
![]()
რეაქციების ჯაჭვის გაგრძელება
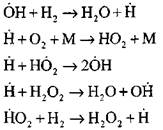
ფილიალი ჯაჭვები
 |
ღია ჩართვა
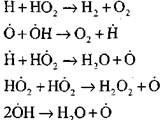 |
წყალბადის ატომების კონცენტრაცია ავტომაგისტრალის საწყის ეტაპზე თავდაპირველი წყალბადის შემცველობის უმნიშვნელო ნაწილია. ჯაჭვური რეაქციის შემუშავებით, მოლეკულური წყალბადის გარდაქმნის მაჩვენებელი იმდენად მაღალია, რომ იგი მოხმარდება მეორე რაუნდს.
2.3. ქიმიური რეაქციები ნახშირბადის მონოქსიდის დაწვისას
ჟანგბადის მქონე ნახშირბადის მონოქსიდის ურთიერთქმედება არის წვის პროცესების ძირითადი რეაქცია. ამ რეაქციის დროს
__________________________ თავი 2. ქიმიური პროცესიიწვის
ბევრი შემთხვევა განსაზღვრავს ნახშირბადის შემცველი ნივთიერებების წვის კანონებს. რეაქცია ხასიათდება სათემო ჯაჭვის მექანიზმით. მას აქვს მთელი რიგი თვისებები.
დიდი ხნის განმავლობაში იყო რწმენა, რომ CO- ს სრულიად მშრალი ნარევი და 0 2 ვერ იზიდავს და დამწვრობას. თუმცა, ყურადღებით შეიმუშავეს ექსპერიმენტები, სადაც წყლის არარსებობა მონიტორინგს ახდენდა მასობრივი სპექტროპით, რაც აჩვენა, რომ ანთება შესაძლებელია მშრალი ნარევი. აღსანიშნავია, რომ სისტემაში CO + 0 2 წყლის ორთქლის ან წყალბადის არსებობა ააქტიურებს ანთების და წვის პროცესს აქტიური ცენტრების რაოდენობის გაზრდით. წყლის დაჩქარების ეფექტი განსაკუთრებით შეინიშნება დაბალ კონცენტრაციებზე.
ნახშირორჟანგის წვის წყალბადის წყლების ან მცირე დამატებების არსებობისას ხდება შემდეგი ელემენტარული პროცესების მონაწილეობით:

რეაქციის (VI) მიერ წარმოქმნილი რადიკალების, H0 2, შეუძლია გააგრძელოს ჯაჭვი (რეაქცია VIII) ან გამოიწვიოს მისი დაზიანების რეაქცია (IX-XII).
შეაფასოს პირობები CO- ს ნელი ჟანგვის გადასაყვანად ჯაჭვის აფეთქებისას, მოდით შეაფასოთ ჯაჭვის გარღვევის ალბათობა H02- ის რადიკალების მეშვეობით; აქვე გავითვალისწინებთ იმას, რომ ჯაჭვის შეწყვეტაში რეაქციების (X) და (XI) როლი უმნიშვნელო იქნება თვალსაზრისით
შედარებით რეაქცია (IX), ვინაიდან 1000 K- ის ტემპერატურის ტემპერატურულ პროცესებში (IX-XI) ერთმანეთთან ახლოს არის, მაგრამ რადიკალების კონცენტრაცია გაცილებით დაბალია, ვიდრე წყალბადის ატომების კონცენტრაცია, რადგან რადიკალებს აქვს უმაღლესი ქიმიური აქტივობა. აქედან გამომდინარე, ღია რაუნდის ალბათობა რადიკალური H0 2- ის მეშვეობით შეიძლება ჩაითვალოს:
1000K ტემპერატურაზე
ამიტომ, იმ პირობით, რომ
![]()
![]()
მაგნიტუდის ეფექტი
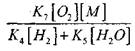
განტოლების გადაჭრა (2.7) სუსტი იქნება.
თავი II ქიმიური პროცესები წვის დროს
იმ შემთხვევაში ![]() ან
ან ![]() (რა შეინიშნება
(რა შეინიშნება
რეალურ ცეცხლთან ერთად), განტოლება (2.7) გადაყვანილია სახით:
![]() (2.8)
(2.8)
ამდენად, ჰაერში ნახშირბადის მონოქსიდის დაწვის მდგომარეობა დიდწილად განსაზღვრავს წყალბადის იწვის არსებობას და ნიმუშებს. რეაქციის (I) მიერ ნახშირჟანგი დამოკიდებულია ნახშირწყალბადზე რეაქციებში წარმოქმნილი OH რადიკალების კონცენტრაციაზე.
ნახშირბადის მონოქსიდის წვის რეაქციის თავისებურება მდგომარეობს მის სწრაფ ინჰიბირებასთან ერთად, როდესაც მცირე დანამატები შედის რეაქციულ სისტემაში რეაქციულ ნივთიერებათა წყალბადის ატომების მაღალი შეთავსებით. ნახშირორჟანგის ამგვარი ნივთიერებები ინჰიბირებენ ნახშირწყალბადების ჰალოგენს და ჰალო-წარმოებულებს. მათი ინჰიბიტორული ეფექტი რეაქციის ჯაჭვების შეწყვეტის შედეგად, როდესაც რეაქციის შედეგად წყალბადის ატომებთან ურთიერთქმედება
2.4. ჰიდროკარბონატის წვა
წყალბადის და ნახშირბადის მონოქსიდის წვის პროცესების გამოკვლევა აჩვენებს წვის რეაქციის მექანიზმის სირთულეს. H 2 და CO- ის შემთხვევაში რეაქცია წარმოადგენს როგორც ძირითად ეტაპებსა და შუალედურ პროდუქტთა მონაწილეობით ჯაჭვს. აქედან გამომდინარე, ბუნებრივია, ელიან, რომ უფრო რთული კომპლექსური ნივთიერებების - ჰიდროკარბონების რეაქციების მექანიზმი კიდევ უფრო კომპლექსურია და ამ ნაერთების აალებასა და წვის პროცესებთან ერთად უფრო მრავალფეროვანია.
ამჟამად არსებული ინფორმაცია მათი წვის პროცესში ნახშირწყალბადების ქიმიური დარგების ბუნების შესახებ გვაძლევს შესაძლებლობას, ახსნას დაკვირვების ეფექტი ზოგიერთი მიახლოებით.
დადგენილია, რომ ნახშირწყალბადების ნაერთებში, უკვე ცნობილი აქტიური ნაწილაკების გარდა, არსებობს უფრო კომპლექსური სტრუქტურის შუალედური პროდუქტების დიდი რაოდენობა. ზოგიერთ შემთხვევაში, ისინი გახდებიან ახალი ქსელების წარმოშობის წყაროები. ჰიდროკარბონების ანთების და წვის პროცესებში ძირითადი როლი ითამაშა შუალედური ნაერთების შემდეგი ტიპის მიხედვით:
კოროლჩენკო ა. წვის და აფეთქების პროცესები
1. ჰიდროკარბონალური რადიკალები, რომლებიც მოლეკულაა
ლევოდოროდა, რომელმაც ერთი ან მეტი წყალბადის ატომი ამოიღო. ეს
ნარჩენები ეწოდება ალკილს (CH 3 - მეთილი; C 2 H 5 - ეთილ; C 3 H 7 - propyl და
და ა.შ.). მაღალი რეაქტივის გამო, თავისუფალი ალკილები
არ არსებობს დიდი ხნის განმავლობაში. წარმოადგინეთ ცეცხლი, როგორც შუალედური
პროდუქცია. სხვა მოლეკულებთან ურთიერთქმედება იქცევა
როგორც დამოუკიდებელი სტრუქტურული ჯგუფი. ჰიდროკარბონალური რადიკალები
ჩვეულებრივ წარმოდგენილია წერილი რ.
2. პეროქსიდები - საერთო ფორმულა R-00-R ნაერთების ".
3. ალდაჰიდები - ტიპის ნაერთები
![]()
მარტივი ალდეჰიდები ფორმალურია (ფორმალდეჰიდი) და აცეტიკური (აცეტალჰეიდი) ![]() . ეს ნივთიერებები არის ყველა
. ეს ნივთიერებები არის ყველა
წარმოდგენილია ნახშირწყალბადების არასრული წვის პროდუქტებში.
ჯაჭვის ფორმირება ნახშირწყალბადების წვის დროს შეიძლება იყოს ნებისმიერი რეაქცია, რომელშიც იქმნება ნახშირწყალბადების რადიკალები. ეს შეიძლება იყოს ორი ეთერი მეთილის ჯგუფების ჩამოყალიბების გზით ეთანური მოლეკულის რღვევა.
![]()
ან ნახშირწყალბადების რეაქცია ჟანგბადთან:
![]()
ჯაჭვების გაგრძელება ხდება ფორმირების რეაქციების შედეგად პეროქსიდი ან ჰიდროპეროქსიდი:
![]()
Chaining branching ხორციელდება დროს დაშლის hydroperoxide:
თავი II ქიმიური პროცესები წვის დროს
რეაქციების მოცემული თანმიმდევრობა იწვევს რეაქციულ სისტემაში პეროქსიდის ნაერთების კონცენტრაციის თანდათანობით გაზრდას.
პარაქსიდების, რადიკალების დაგროვებისა და დაწყების პარალელურად
არსებობს პარალელური რეაქციები:

ეს რეაქციები ეგზოთერმულია; როდესაც ისინი მიედინება დიდი რაოდენობით სითბო.
რეაქციის ნარევი ტემპერატურის ზრდით, აქტიური ცენტრების როლი ერთ შუალედურ პროდუქტს გადადის შემდეგი წესით: ალკილი ჰიდროპოროიდები, აცილ ჰიდროპოროიდები, ფორმალდეჰიდები.
მაღალ ტემპერატურულ რეგიონში (600-800 ° C) დროში რეაქციის ნარევი შემადგენლობის ცვლილებების ექსპერიმენტული გამოკვლევები ცხადყოფს, რომ საბოლოო წვის პროდუქტებისადმი პირველი ნახშირწყალბადების ტრანსფორმაციის პროცესი ორ ეტაპად იყოფა: პირველი, რომელიც ძალიან მაღალი მაჩვენებლით ხდება, ნახშირწყალბადების დაჟანგვა. მეორე, ნელი, ეტაპი, CO არის oxidized to. ძალიან მნიშვნელოვანი დასკვნა შემდეგნაირად გამოიყურება: ნახშირჟანგის წვის ბევრი კანონი შეიძლება აიხსნას ნახშირბადის მონოქსიდის წვის თვისებებით.
2.5. ნახშირბადის წვა
ნახშირბადის წვა იწყება ჰეტეროგენური პროცესის მექანიზმის მიხედვით, რომლის სპეციფიკაც იმაში მდგომარეობს, რომ ქიმიური სცენა არ შეიძლება ჩაითვალოს იზოლაციაში მიმდებარე სივრცედან აირის ჟანგბადის ჟანგბადის (ჰაერის ჟანგბადის) გადატანის პროცესისგან, რომელიც იწვის მყარ ზედაპირზე. წვის მაჩვენებელი დამოკიდებულია ნახშირბადის ქიმიური თვისებებისა და თვისებების მიხედვით, რომლებიც განსაზღვრავს ჟანგბადის მიწოდების პროცესს საწვავის ზედაპირზე. წვის ზონაში ჟანგბადის მიწოდება ხორციელდება დიფუზია და შესაბამისად
კოროლჩენკო ა. წვის და აფეთქების პროცესები
დამოკიდებულია ბევრ ფაქტორზე: დამწვრობის ორგანოს ფორმირება და ზომა, აირის აირის მოძრაობა, ჟანგბადის და რეაქციის პროდუქტების დიფუზიის კოეფიციენტები, როგორც საწვავის ზედაპირზე ზემოთ, ასევე ნახშირბადის და ფორების კოროზიებში და კოკებში, რომლებიც შეიცავს მნიშვნელოვან რაოდენობას.
ჰეტეროგენული ნახშირბადოვანი წვის მახასიათებლების წარმოსაჩენად, მიგვაჩნია, რომ ქოქოსის ცალკე ნაწილის ქვაბში მოთავსებულია ღუმელით 900 ° C ტემპერატურაზე. საწყის ეტაპზე ნახშირის წვა მოხდება მისი ზედაპირის მახლობლად მდებარე ჟანგბადის ხარჯზე. მას შემდეგ, რაც გამოიყენება, აალებადი ზედაპირის გარშემო შეიქმნება წვის პროდუქტების ფენა. დამწვრობის მაჩვენებელი შეამცირებს და პროცესი შეწყდება, თუ გაზის სივრცის უფრო შორეული ტერიტორიებიდან ჟანგბადი არ იყო.
ეს ნაკადი ვრცელდება დიფუზიის საშუალებით და წვის მაჩვენებელი განისაზღვრება დიფუზიური ნაკადით. დიფუზიის ინტენსივობა დიდწილად დამოკიდებულია გაზის ზედაპირთან ახლოს გაზის საშუალო მოძრაობის ინტენსივობისა და ბუნების შესახებ. ქიმიური რეაქციის სიჩქარე ძირითადად განისაზღვრება ტემპერატით. ჰეტეროგენული რეაქციები, ისევე როგორც ერთგვაროვანი, დაემორჩილეთ Arre-nius კანონით.
მაღალი ტემპერატურის პირობებში, ნახშირჟანგის რეაქცია ძალიან სწრაფად მიმდინარეობს და პროცესის მთლიანი სიჩქარე შემოიფარგლება ზედაპირზე ჟანგბადის გავრცელებით.
ამრიგად, ნახშირბადის წვის პროცესი სხვადასხვა ბუნების ორი პროცესისგან შედგება: საჰაერო ჟანგბადის ტრანსპორტირების პროცესი გაზის სივრცეში მისი მოხმარების ადგილისა და მისი ქიმიური ურთიერთქმედების პროცესის მყარი ნახშირბადის ზედაპირზე. ორივე ეს პროცესი ურთიერთდაკავშირებულია, მაგრამ თითოეულს აქვს საკუთარი კანონები. ამ პროცესების ყველაზე მნიშვნელოვანია ჟანგბადის მოხმარების პროცესი, რომელიც ხასიათდება სხვადასხვა ქიმიური რეაქციების მიხედვით.
ნახშირჟანგთან ჟანგბადის კომბინირების კომპლექსური რეაქციის მექანიზმი შედგება C და C02- ის ორი ოქსიდის ერთდროულად ფორმირებაში C ტიპის X 0 Y- ის შუალედური ფიზიკოქიმიური კომპლექსის მეშვეობით, რომელიც შემდეგ გაყოფილია CO და. ამ ოქსიდებს შორის თანაფარდობა დამოკიდებულია დამწვრობის პირობებზე. შესაბამისად, ნახშირბადის წვის რეაქციის განტოლება შეიძლება დაიწერა შემდეგნაირად:
თავი II ქიმიური პროცესები წვის დროს
შემდეგ ნახშირბადის მონოქსიდის წვის ერთგვაროვანი რეაქცია მიმდინარეობს:
რომლის მექანიზმი განხილულია 2.3.
ეს რეაქცია შეიძლება მოხდეს ნახშირბადის ზედაპირთან ახლოს, ასე რომდა შიგნით ქვანახშირის მასა, მისი pores და ბზარები.
კიდევ ერთი რეაქცია არის ჰეტეროგენური რეაქცია ცხელი ნახშირბადის და ნახშირორჟანგს შორის:
![]()
იგი მიედინება შესამჩნევი სიჩქარით იმ ადგილებში, სადაც არ არის ჟანგბადის ნაკლებობა, მაგრამ სადაც ნახშირბადის ტემპერატურა მაღალია.
რეაქციის კომბინაცია აღწერილია ნახშირბადის წვის პროდუქტების შემადგენლობაზე.
კომბინირებული პროცედურების არსებობა
| რ |
აალებადი ნარევების ირეაცია შეიძლება გამოიწვიოს საკუთარი ანთების, ანთების საწინააღმდეგო ან სპონტანური წვის შედეგად. იმ შემთხვევაში, თუ თვით-ანთება და ანთების პროცესები დამახასიათებელია ნივთიერებების, რომლებიც აირის, თხევად ან მყარ მდგომარეობაშია, მაშინ სპონტანური წვისა დამახასიათებელია მყარი მასალების დამახასიათებელი (განსაკუთრებით წვრილმარცვლოვანი სახელმწიფოების) ან მაღალხარისხოვანი სითხეები, რომლებიც განაწილებულია მასალებზე განვითარებულ ზედაპირზე.
3.1. თვითმმართველობის ანთება. სტაციონარული თეორია
ცეცხლი უკონტროლო იწვებაა, რომელიც დროთა განმავლობაში და სივრცეში ვითარდება, საშიშია ადამიანი და მატერიალური ზიანი მიაყენოს.
ხანძარსაწინააღმდეგო ადამიანები ღია ცეცხლი, ხანდახან, საწვავი, წვის, ტოქსიკური ნივთიერებები, ჟანგბადი, შენობების ან დანადგარების დაშლა.
წვა არის სწრაფი რეაგირება ფიზიკურ-ქიმიური რეაქცია, რომელსაც თან ახლავს სითბოს და მოწევის გათავისუფლება, ნაპერწკალი ან smoldering. ნორმალურ პირობებში, წვის არის ატმოსფერული ჟანგბადის მჟავიანობის ან კომბინირებული ნივთიერების ათვისების პროცესი. თუმცა, ზოგიერთი ნივთიერებები (მაგალითად, შეკუმშული აცეტილენი, აზოტის ქლორიდი, ოზონი) შეიძლება აფეთქდეს ჟანგბადი სითბოს და ფლეიმის შექმნის გარეშე. შედეგად, წვის შეიძლება გამოიწვიოს რეაქციები არა მხოლოდ ნაერთი, არამედ რღვევა. ასევე ცნობილია, რომ წყალბადის და ბევრი ლითონების შეიძლება დამწვრობა ატმოსფეროში ქლორის, სპილენძის გოგირდის ორთქლის, მაგნიუმის ნახშირორჟანგი და ა.შ.
ყველაზე საშიში წვა, რომელიც იწვევს ჟანგბადის მჟავას ჰაერის ჟანგვის ჟანგვის დროს. ამავდროულად, საჭიროა ანთების საწინააღმდეგო წყარო, რომელსაც შეუძლია ენერგეტიკული საჭირო ენერგიის საწვავის სისტემის მიწოდების უნარი. ანთების ყველაზე გავრცელებული წყაროებია: ნაპერწკლები, რომლებიც აღმოჩნდებიან ელექტრო მოწყობილობების გაუმართაობაზე, ლითონის ხელსაწყოები, შედუღების, გაყალბების სამუშაოები; სითბოს მიერ წარმოებული სითბოს; ტექნოლოგიური გათბობის მოწყობილობები; ცეცხლის აპარატები; ადვიატური შეკუმშვის სითბოს; სტატიკური ელექტროენერგიის გათიშვა; ელექტრო კონტაქტების overheating; ქიმიური რეაქციები, რომლებიც წარმოიქმნება სითბოს გათავისუფლებასთან.
ამ წყაროების გათბობის ტემპერატურა განსხვავებულია. ასე რომ, ნაპერწკალი, რომელიც ხდება, როდესაც ლითონის სხეული დაარტყა შეიძლება ტემპერატურა მდე 1900 ° C, flame მატჩი დაახლოებით. 800 ° C, ზოლიანი ქამრების წამყვანი ბარაბანი 600 ° C- მდეა და ელექტროენერგიის სითბოს ტემპერატურა აღწევს 10,000 ° C, თითქმის მყისიერი ქიმიური რეაქციები.
დამწვრობა შეიძლება იყოს სრული და არასრული. სრული წვის ერთად, ჟანგბადის ჭარბი, რეაქციის პროდუქტები ნახშირორჟანგი, წყალი, აზოტი, გოგირდის დიოქსიდი. არასაკმარისი წვალობა ხორციელდება ჟანგბადის არარსებობით, ამ შემთხვევაში მწვავე ნივთიერებები ტოქსიკური და საწვავი ნივთიერებებია - ნახშირბადის მონოქსიდი, ალკოჰოლი, კეტონები, ალდეჰიდები და სხვა. მყარი ნივთიერების სრული წვის საჭიროა გარკვეული რაოდენობის ჰაერი: 1 კგ ხის - 4.18, ტორფის - 5 , 8, პროპანი - 23.8 მ 3.
წვის პროცესი შეიძლება წარმოიშვას შემდეგნაირად. თბური იმპულსის დანერგვით ცივი საწვავის საშუალებაა თბება, მჟავას და ინტენსიური ჟანგბადის შემცველი ინტენსიური ჟანგვითი და დამატებითი სითბოს გათავისუფლება. ეს, თავის მხრივ, იწვევს მწვავე მასალის მიმდებარე ფენას, რომელშიც ასევე ხდება ინტენსიური ქიმიური რეაქცია. მყარ ნივთიერებათა ასეთი ფენის მიერ ფენის წვის ერთად წვის ზონა მოძრაობს; ამ მოძრაობის სიჩქარე განსაზღვრავს წვის პროცესის ინტენსივობას და მისი უმნიშვნელოვანესი მახასიათებელია. შრის ფენების, ჟანგვისა და წვის პროცესის პროცესი გრძელდება მანამ, სანამ მწვავე მასალის მთლიანი მოცულობა ამოწურულია.
ვიწრო ზონა, სადაც ნივთიერება არის მწვავე და ქიმიური რეაქცია ხდება, ე.წ.
მყარი სისტემები შეიძლება იყოს ქიმიურად ერთგვაროვანი და ჰეტეროგენული. ქიმიური ჰომოგენური სისტემები საწვავის აირების, ორთქლისა და მტვერის ნარევები, რომელთა საწვავი და ჰაერი ერთნაირად შერეულია. ასეთი სისტემების დაწვა ერთგვაროვანია. ქიმიურად inhomogeneous სისტემები, საწვავი და საჰაერო არ შერეული და აქვს ინტერფეისი. ეს ხშირად მყარი მყარი ნივთიერებებია და მათი წვა ჰეტეროგენურია.
საწვავის შემადგენლობის წვის საერთო დრო Tg არის დროთა განმავლობაში საჭირო ნივთიერებასა და ჟანგბადს შორის კონტაქტისათვის საჭირო დროისა და დრო, რომლის განმავლობაშიც ხდება ქიმიური ნივთიერება, ჟანგვის რეაქცია τ x
ამ ორი ტერმინის თანაფარდობის მიხედვით გამოირჩევა გამრავლებისა და კინეტიკური წვის. ნივთიერებების ზედაპირზე ჟანგბადი (შეკუმშვის) შეღწევისთვის აუცილებელი დრო გაცილებით მეტია ქიმიური რეაქციის დროს, ამიტომ მთლიანი წვის მაჩვენებელი მთლიანად განისაზღვრება ჟანგბადის დიფუზიის ზომიერი ნივთიერების მიმართ. ასეთი ნივთიერებების დაწვა ყველაზე ხშირია ხანძარსაწინააღმდეგოდ და ეწოდება დიფუზური. წვის, რომლის განაკვეთი განისაზღვრება ქიმიური რეაქციის სიჩქარეზე, ეწოდება კინეტიკას. ამ ტიპის წვის არის დამახასიათებელი ჰომოგენური საწვავი სისტემები.
გაანგარიშება კალომომეტრიული, თეორიული და ფაქტობრივი ტემპერატურა.
წვის კალორიმეტრიული ტემპერატურა ეხება იმ ტემპერატურას, რომლის მიხედვითაც სრული წვის პროდუქტები მწვავეა, თუ ყველა სითბოს გათავისუფლება ხდება გათბობისთვის, ჰაერის რაოდენობა თეორიულად აუცილებელია, ნივთიერებები მთლიანად დამწვარია და საწყისი ტემპერატურა 0 ° С. სითბოს დანაკარგები ნულოვანია. თუ საწვავის და საჰაერო ჰაერის თავდაპირველი ტემპერატურა 0 ° C, მაშინ წვის კალთმეტრიული ტემპერატურა
![]()
სადაც Qn არის საწვავი ნივთიერების, კკალ / კგ-ის კალორიული ღირებულება; V არის წვის პროდუქტების მოცულობა, მ 3 / კგ; გ არის წვის პროდუქტების საშუალო მოცულობითი სითბური სიმძლავრე, კკალ / მ 3 · დე.
შესაბამისად, კალორიმეტრიული წვის ტემპერატურა დამოკიდებულია მხოლოდ მწვავე ნივთიერების თვისებებზე და არ არის დამოკიდებული მის რაოდენობასთან. თეორიული წვის ტემპერატურა ითვალისწინებს სითბოს დაკარგვას გამოყოფის დროს. Calorimetric წვის ტემპერატურა ყველაზე მაღალია მწვავე ნივთიერებისათვის და გამოიყენება ხარისხობრივი შეფასებისთვის. სინამდვილეში, როდესაც წვის, ყოველთვის სითბოს დანაკარგები გამო რადიაციული, გათბობის ჭარბი ჰაერის და გარემოს.
ფაქტობრივი წვის ტემპერატურა ცეცხლის ტემპერატურაა. განასხვავოთ შიდა და გარე ცეცხლის ტემპერატურა. გარე ცეცხლის ტემპერატურა ცეცხლის ტემპერატურაა და შიდა ტემპერატურაა კვამლის ტემპერატურა ოთახში. გარემოში სითბოს დაკარგვის გამო ხანძრის შემთხვევაში განვითარებული რეალური ტემპერატურა, წვის პროდუქტებისა და სტრუქტურების გათბობა
ყოველთვის ნაკლებია, ვიდრე თეორიული 30% ... 50%. მაგალითად, ბენზინის თეორიული წვის ტემპერატურაა 1730 ° C, ხოლო ფაქტობრივი ტემპერატურა შეადგენს 1400 ° C.
მჟავიან აგენტთან მავთულხლართების და აირების ნარევი შეიძლება ჩაიწეროს მხოლოდ საწვავის გარკვეულ შემცველობით.
აალებადი გაზის ყველაზე დაბალი კონცენტრაცია, რომლის დროსაც შესაძლებელია წვის გამტარუნარიანობა, ანთების ხანდაზმული კონცენტრაციის ზღვარია (LEL). ყველაზე მაღალი კონცენტრაცია, რომლის დროსაც შესაძლებელია წვის შეჩერება, ანთების ზედა კონცენტრაციის ლიმიტს (AIPW) უწოდებენ. კონცენტრაციის რეგიონი, რომელიც ამ საზღვრებში მდებარეობს, უწოდეს ანთების რეგიონი. აალება არის ცეცხლი (იწვის დასაწყისში), რომელსაც თან ახლავს ფლეიმის გამოჩენა. ეს არის მუდმივი ხანგრძლივი წვა, რომელიც არ წყდება მას შემდეგ, რაც ანთების წყარო ამოღებულია. ივნისის ქვედა და ზედა ზღვრული ღირებულებები დამოკიდებულია ჰაერის, ორთქლისა და მტვრის ჰაერის თვისებებზე, ინერტული კომპონენტების შემცველ მჟავებში. საწვავის ნარევი ინერტული აირების დამატებით ანთების არეალს იწვევს და საბოლოო ჯამში ხელს არ უწყობს ხელს. საანგარიშო ხანდახან იშვიათი ლიმიტები, ზოგიერთი მინარევები, რომლებიც შეანარჩუნებენ წვის რეაქციას. ყველაზე აქტიურია ჰალოგენირებული ნახშირწყალბადები. ორივე მონიშნული თვისებები გამოიყენება წვის შესაჩერებლად. ატმოსფერული ზეწოლის ქვედა წნევის შემცირება ასევე იწვევს ანთების არეალს, და გარკვეულ წნევზე ნარევი შეუძლებელია. საწვავის გაზრდის ზეწოლის გაზრდა იწვევს აფეთქების არეალს, მაგრამ, როგორც წესი, ოდნავ. საწვავის გაზრდის ტემპერატურის გაზრდა იფუნქციონირებს ფართობზე. ანთების კონცენტრაცია ასევე გავლენას ახდენს ანთების წყაროდან.
არსებობს არა მხოლოდ კონცენტრაცია, არამედ ანთების ტემპერატურის ლიმიტები.
ჰაერის ორთქლის ანთების საწინააღმდეგო ტემპერატურის ლიმიტები არის საწვავი ნივთიერების ტემპერატურა, როდესაც მისი გაჯერებული ორთქლი ქმნის კონცენტრაციებს, რომლებიც შეესაბამება ანთების ზედა და ზედა კონცენტრაციის ლიმიტს. ანთების ტემპერატურა არის ყველაზე დაბალი ტემპერატურა, რომლის დროსაც ნივთიერება იწვევს ან იწყებს smolder და აგრძელებს დამწვრობის ან smolder ათავისუფლებს შემდეგ წყაროების ანთება. ანთების ტემპერატურა ახასიათებს თვითგამწარებამდე არსებულ ნივთიერებას. თუ ნივთიერებათა ივნისის ტემპერატურა არ არსებობს, მაშინ იგი მოხსენიებულია, როგორც ნელი-წვა ან არასასურველი.
ტემპერატურის მოქმედებაში დაჟანგვის რეაქციის დაჩქარება იწვევს თვითგამოხატვას. ანთების საწინააღმდეგო პროცესისგან განსხვავებით, რომელშიც მხოლოდ მოცულობითი ნაწილი - ზედაპირი - იშვიათი, თვით-ანთება ხდება ნივთიერების მთელი მოცულობით. თვითმმართველობის ანთების ტემპერატურა მიხვდება, როგორც ყველაზე დაბალი ტემპერატურა, რომელსაც ნივთიერება უნდა იყოს მწვავე, ისე, რომ იგი ხელს შეუწყობს შემდგომი ავტომატური დაჟანგვის შედეგად. თვითმმართველობის ანთება შესაძლებელია მხოლოდ იმ შემთხვევაში, თუ ოქსიდების პროცესის დროს გამოთავისუფლებული სითბოს მოცულობა აღემატება გარემოზე სითბოს გათავისუფლებას.
ავტომატური ანთება ტემპერატურა არ არის მუდმივი ნივთიერებისათვის, ვინაიდან იგი დიდწილად დამოკიდებულია მისი განსაზღვრის პირობებზე. შედარებითი მონაცემების მისაღებად, სატესტო აპარატი და აირების და ორთქლის თვითგანათლების ტემპერატურის განსაზღვრის მეთოდი სტანდარტიზირებულია (GOST 13920-68). სტანდარტული მეთოდით განსაზღვრული ყველაზე დაბალი ტემპერატურა, რომლის მიხედვითაც ჰაერისა და აირების ნარევი საჰაერო ხომალდი უნდა იყოს თანაბრად გაცხელებული იმისათვის, რომ იგი იფუნქციონირებს გარე ანთების წყაროს მის გარეშე, რომელსაც ეწოდება სტანდარტული ავტომატური ანთების ტემპერატურა.
სპონტანური ანთების ტიპი სპონტანური წვისაა, ანუ, წვის აალება შედეგად თვითგამორკვევა, ანთების წყაროს გავლენის გარეშე. სპონტანური ანთების და სპონტანური წვის შორის სხვაობა ტემპერატურულ ღირებულებაშია. სპონტანური წვის გამომწვევი ხდება ტემპერატურის პირობებში და თვითმმართველობის ანთების საწინააღმდეგოდ აუცილებელია გარედან ნივთიერების სითხის გატარება.


 აალებადი ნივთიერებები და მასალები
აალებადი ნივთიერებები და მასალები გაზის მრიცხველის გადაგზავნა ნიჟეგოგენდერგენოგაზრაშჩენზე გაზის ტრანსპორტირება
გაზის მრიცხველის გადაგზავნა ნიჟეგოგენდერგენოგაზრაშჩენზე გაზის ტრანსპორტირება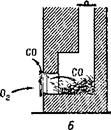 წვის პროცესის მთავარი ქიმიური რეაქცია
წვის პროცესის მთავარი ქიმიური რეაქცია ლიტმუსის ტესტი - pH გაზომვა
ლიტმუსის ტესტი - pH გაზომვა