Pembakaran disebut. Proses kimia selama pembakaran
Beberapa definisi dasar
Jumlah atom dan molekul diekspresikan dengan mudah dalam hal jumlah zat juga jumlah mol zat. Satu mol materi sesuai dengan 6.023 6.0 10 23 partikel (atom dan molekul). Angka N A = 6.023 ∙ 10 23 mol -1 disebut nomor Avogadro. Fraksi mol x ikomponen saya adalah rasio jumlah mol n saya komponen saya ke jumlah mol n = ∑ n saya campuran ( x i = n i / n).
Misa m adalah properti fundamental suatu zat (satuan pengukuran dalam sistem SI adalah kilogram). Fraksi massa Wi adalah rasio massa saya komponen saya terhadap massa total campuran m = ∑ m i (Wi = m saya / m).
Berat Molekul (atau Berat Molekul) M saya(g / mol) komponen Saya - adalah massa satu mol komponen ini. Jadi, untuk karbon atom, hidrogen molekuler, oksigen dan metana kita memiliki: Mc = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. Massa molar rata-rata dari campuran M (g / mol) dapat dinyatakan dalam fraksi molar komponen (M = x i M i).
Penentuan proses pembakaran
Terbakar - Ini adalah proses fisika-kimia yang kompleks di mana zat dan bahan yang mudah terbakar di bawah pengaruh suhu tinggi masuk ke dalam interaksi kimia dengan zat pengoksidasi (oksigen di udara), berubah menjadi produk pembakaran, dan yang disertai dengan panas yang intens dan emisi cahaya.
Kondisi yang diperlukan untuk terjadinya proses pembakaran:
Kehadiran zat yang mudah terbakar (GV);
Kehadiran agen pengoksidasi (O.) - oksigen udara;
Kehadiran sumber penyalaan (I.Z.).
Bahan yang mudah terbakar harus dipanaskan sampai suhu tertentu di mana proses oksidasi akan dimulai;
Untuk memanaskan zat yang mudah terbakar ke suhu tertentu, diperlukan sumber tenaga pengapian tertentu;
Untuk mempertahankan proses pembakaran, diperlukan konsentrasi bahan bakar dan oksidator tertentu.
Proses pembakaran yang paling penting adalah perpindahan panas dan massa. Sifat paling umum dari pembakaran adalah terjadinya nyala api dan memindahkannya ke seluruh campuran yang mudah terbakar dengan memindahkan panas atau mendispersikan partikel aktif dari zona pembakaran ke campuran yang mudah terbakar yang baru.
Nyala api - Ini adalah manifestasi nyata dari pembakaran. Itu juga disebut zona pembakaran. Ini adalah bagian dari ruang di mana transformasi campuran yang mudah terbakar menjadi produk dari pembakaran sempurna dan tidak lengkap terjadi.
Parameter utama dari proses pembakaran, yang menyebabkan kematian dan menyebabkan kerusakan material, adalah:
Sejumlah besar panas;
Suhu tinggi;
Komposisi toksik dari produk pembakaran.
Proses pembakaran dari sudut pandang teori molekul kinetik gas
Fig. 2.1. Proporsi molekul aktif tergantung pada suhu: T 2\u003e T 1
Ketika campuran gas yang mudah terbakar dipanaskan meningkatkan kelebihan energi.
Perbedaan antara tingkat energi rata-rata molekul dalam keadaan aktif dan tingkat rata-rata keadaan tidak aktif disebut energi aktivasi. Ini dapat direpresentasikan secara grafis (Gbr. 2).

Fig. 2.2. Diagram energi dari arah reaksi G.V. + O. ® PG: E act - energi aktivasi; Q xr. - efek termal dari reaksi pembakaran
Energi yang dilepaskan sebagai akibat interaksi dari molekul yang bereaksi pertama kali ditransfer ke molekul tetangga. Mereka bersemangat, proses ini diulangi di sekitar molekul yang bereaksi dengan frekuensi dan intensitas yang besar. Proses interaksi kimiawi yang berkelanjutan dan dipercepat sendiri untuk seluruh campuran reaksi (2H 2 + O 2) dimulai, disertai dengan pembentukan molekul air dan pelepasan panas ke lingkungan dan disertai dengan pendaran, yaitu. muncul dan sebarkan proses pembakaran.
Semakin tinggi nilai numerik tindakan E, semakin sulit untuk membuat pasangan komponen ini masuk ke dalam interaksi kimia. Oleh karena itu, nilai E act merupakan indikator tidak langsung tingkat bahaya kebakaran sistem kimia ini.
Jenis dan mode pembakaran
Pembakaran dapat diklasifikasikan berdasarkan parameter berikut:
1. Menurut kondisi pencampuran komponen yang mudah terbakar:
a) kinetik - pembakaran campuran gas atau uap pra-campuran. Karena campuran bahan bakar dan oksidan siap untuk pembakaran sampai terbakar, laju total proses pembakaran hanya bergantung pada laju reaksi kimia pembakaran. Jika pembakaran seperti itu terjadi dalam volume tertutup atau terbatas, maka ledakan dapat terjadi. Karena energi yang dilepaskan selama pembakaran campuran tidak memiliki waktu untuk dibuang melebihi volume ini, dengan meningkatkan tekanan, struktur dapat dihancurkan;
b) difusi, difusi pembakaran disebut pembakaran, ketika pembentukan media yang mudah terbakar (campuran bahan bakar dan oksidator) terjadi sebelum zona pembakaran atau di zona pembakaran.
2. Menurut intensitas penerimaan komponen yang mudah terbakar di zona reaksi kimia:
a) laminar, sedangkan komponen campuran yang mudah terbakar memasuki zona pembakaran relatif tenang. Dalam hal ini, nilai numerik kriteria Reynolds, yang mencirikan rezim termodinamika, akan secara signifikan lebih kecil daripada yang kritis (Re<2300).
b) turbulen, dengan komponen campuran yang mudah terbakar memasuki zona pembakaran dengan kecepatan tinggi. Jumlah Reynolds dalam hal ini lebih dari 2300.
3. Menurut keadaan agregasi komponen campuran yang mudah terbakar:
a) bahan bakar homogen dan pengoksidasi berada dalam keadaan agregat yang sama (gas);
b) heterogen (multifase) - bahan bakar dan oksidan berada dalam status agregat yang berbeda.
4. Pada kecepatan rambat zona reaksi kimia pembakaran:
a) distribusi deflagrasi (lambat) dari zona reaksi kimia (kecepatan 0,5 hingga 50 m / dtk);
b) detonasi (ledakan), ketika zona reaksi kimia pembakaran merambat dengan kecepatan gelombang kejut (dari beberapa ratus meter per detik hingga beberapa kilometer per detik).
Ruang di mana uap atau gas terbakar disebut dengan nyala api .
Api laminar pra-campur. Dalam api laminar dari campuran pra-campuran, bahan bakar dan oksidan dicampur sebelum dimulainya pembakaran dan alirannya adalah laminar.
Nyala campuran pra-campuran disebut stoikiometri jika bahan bakar (hidrokarbon) dan oksidator (oksigen - O 2) saling mengkonsumsi, membentuk karbon dioksida (CO 2) dan air (H 2 O). Jika ada kelebihan bahan bakar, mereka mengatakan bahwa campuran itu kaya, dan jika ada kelebihan oksidan, mereka mengatakan bahwa campuran itu buruk.
Pertimbangkan contoh paling sederhana:
1) 2H 2 + O 2 → 2H 2 O - campuran stoikiometrik,
2) ЗН 2 + О 2 → 2H 2 O + Н 2 - campuran kaya (Н 2 lebih banyak),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - campuran lean (O 2 berlebih).
Setiap simbol dalam suatu persamaan reaksi kimia sesuai dengan satu mol suatu zat. Jadi, yang pertama dari persamaan ini berarti bahwa dua mol H 2 bereaksi dengan satu mol O 2 untuk membentuk dua mol H 2 O.
Jika persamaan reaksi kimia ditulis sedemikian rupa sehingga menggambarkan reaksi hanya satu mol bahan bakar, maka fraksi mol bahan bakar dalam campuran stoikiometrik dapat dengan mudah ditentukan dari hubungan tersebut.
x pegunungan, stokh = 1 / ((1 + v)
Di sini vmenunjukkan jumlah mol O 2 dalam persamaan reaksi dengan pembentukan CO 2 dan H 2 O. Contohnya adalah reaksi
H 2 + 0,5 O 2 → H 2 O, v = 0,5, x H 2, stoch = 2/3
Jika oksidator adalah udara, maka harus diperhitungkan bahwa udara kering hanya mengandung 21% oksigen, serta 78% nitrogen dan 1% gas mulia. Jadi, untuk udara, X N 2 = 3,762 X O 2. Dari sini fraksi molar untuk campuran stoikiometrik dengan udara akan sama
x pegunungan, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
dimana v seperti sebelumnya berarti jumlah mol O 2 dalam persamaan reaksi konversi lengkap satu mol bahan bakar menjadi CO 2 dan H 2 O. Beberapa contoh nilai v dan fraksi molar bahan bakar untuk campuran stoikiometrik bahan bakar dengan udara ditunjukkan pada Tabel 1.
Campuran bahan bakar dan udara pra-campuran (dalam hal ini, jumlah N 2 yang tepat harus ditambahkan ke persamaan reaksi, lihat Tabel 1) dicirikan oleh rasio ekuivalen untuk udara:
λ = (x w / x gunung) / (x w, stoch / x pegunungan, stoh) = (w w / w pegunungan) / (w w, stoch / w pegunungan, stoch)
atau kebalikan - rasio setara untuk bahan bakar F (F = 1 / λ). Formula ini dapat ditransformasikan untuk dapat menentukan besarnya fraksi molar dari campuran berdasarkan nilai F:
x pegunungan = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x gunung,
X berat / 4,762, = ∙ 3,762
Contoh nilai v dan fraksi mol bahan bakar x pegunungan, stoichi untuk campuran stoikiometrik bahan bakar dengan udara
irigasi selalu disertai dengan transformasi kimia. Pembakaran di udara - interaksi zat yang mudah terbakar dengan oksigen. Namun, harus diingat bahwa oksida nitrogen, halida, dan ozon dapat bertindak sebagai pengoksidasi dalam proses pembakaran. Proses pembakaran yang dikenal terjadi hanya dengan partisipasi satu sumber produk - senyawa yang mampu terurai dengan cepat. Contoh senyawa tersebut adalah asetilena dan hidrazin.
Proses kimia yang terjadi selama pembakaran sangat kompleks. Bahkan untuk kasus yang paling sederhana - pembakaran hidrogen dalam oksigen, persamaan umum yang memiliki bentuk
2H 2 + 0 2 = 2H 2 0,
beberapa lusin tahap dasar telah ditetapkan dan dipelajari.
Sampai saat ini, mekanisme transformasi kimia selama pembakaran hanya beberapa zat, seperti hidrogen, karbon monoksida, metana dan etana, telah dipelajari secara cukup rinci. Pengetahuan ini digunakan untuk memprediksi kondisi pengapian dan pembakaran banyak zat.
2.1. Reaksi berantai
Reaksi berantai, berbeda dengan transformasi kimia biasa, dicirikan oleh penampakan setiap aksi dasar dari partikel aktif: atom dengan elektron tidak berpasangan, radikal bebas atau ion. Munculnya partikel aktif menyebabkan rantai transformasi bahan awal menjadi produk reaksi. Atom, radikal bebas, dan ion lebih reaktif daripada molekul jenuh valensi. Oleh karena itu, terlepas dari biaya energi yang cukup besar yang diperlukan untuk memutus ikatan kimia dan pembentukan partikel aktif, pengembangan rantai dari suatu reaksi seringkali ternyata lebih menguntungkan secara energi daripada interaksi langsung antara molekul.
Proses pembakaran terutama terjadi melalui mekanisme rantai. Reaksi berantai - reaksi kompleks yang terjadi dalam beberapa tahap, mewakili:
Asal mula rantai (inisiasi), di mana partikel aktif terbentuk;
Kelanjutan rantai, di mana partikel aktif masuk ke dalam interaksi kimia dengan bahan awal, sebagai akibatnya terbentuk partikel aktif baru;
Kerusakan rantai di mana "kematian" partikel aktif terjadi dengan pembentukan produk reaksi akhir
Asal mula rantai dapat terjadi dalam berbagai kondisi. Misalnya, sebagai akibat pemisahan molekul di bawah aksi energi panas, atau radiasi pengion, dalam pelepasan listrik. Kematian partikel aktif terjadi ketika mereka bergabung kembali *, ketika radikal bebas berinteraksi (kerusakan rantai homogen), ketika partikel aktif berinteraksi dengan permukaan padat (kerusakan rantai heterogen) atau sebagai akibat dari reaksi mereka dengan inhibitor pembakaran.
Ada reaksi berantai yang tidak bercabang dan bercabang. Dalam tidak bercabang untuk setiap partikel aktif yang dikonsumsi dalam reaksi kelanjutan rantai, ada satu yang muncul kembali. Jumlah molekul produk yang terbentuk per partikel aktif awal disebut panjang rantai. Panjang rantai reaksi pembakaran berkisar dari ratusan ribu hingga puluhan juta. Tingkat reaksi berantai tidak bercabang dapat dipengaruhi oleh pencampuran kecil zat yang dapat secara efektif berinteraksi dengan partikel aktif, seperti inhibitor pembakaran.
Beberapa zat - pemrakarsa - memfasilitasi pembentukan partikel aktif dan dengan demikian mempercepat reaksi berantai yang tidak bercabang.
Dalam reaksi berantai bercabang ke satu partikel aktif, dikonsumsi dengan kelanjutan rantai, dua atau lebih partikel aktif terbentuk. Salah satunya melanjutkan rantai utama, sementara yang lain memulai rantai baru, membentuk percabangan (gbr. 2.1).
"Rekombinasi adalah proses pembentukan atom netral atau molekul dari partikel bermuatan. Atom dan molekul yang terbentuk selama rekombinasi dapat berada di tanah atau keadaan tereksitasi.
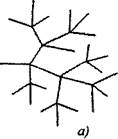
Fig. 2.1. Representasi skematis dari rantai reaksi:
a) bercabang di setiap mata rantai
6) percabangan langka
Misalnya, selama pembakaran hidrogen dalam reaksi inisiasi berantai:
sebuah atom aktif terbentuk. Dalam reaksi lanjutan rantai:

ada peningkatan jumlah atom aktif yang merupakan awal dari rantai baru.
Reaksi berantai bercabang dapat berlangsung dalam mode stasioner, di mana kecepatan percabangan kurang dari tingkat kematian partikel aktif, dan dalam non-stasioner, di mana kematian terjadi lebih lambat daripada bercabang. Dalam kasus terakhir, kecepatan reaksi berantai meningkat secara eksponensial dan hanya dibatasi oleh konsumsi bahan awal. Transisi dari mode stasioner ke non stasioner terjadi secara tiba-tiba dengan sedikit perubahan kondisi reaksi: suhu, tekanan atau konsentrasi salah satu reaktan. Akselerasi cepat seperti itu dianggap sebagai penyalaan sendiri campuran reaksi atau ledakan berantai.
Penemuan reaksi berantai bercabang sangat penting untuk penciptaan teori proses pembakaran. Terbukti ada dua jenis kunci kontak: termal dan rantai. Pola diatur
Bab 2. Proses kimia di terbakar
teori proses rantai, dapat secara efektif mempengaruhi pengembangan dan penekanan proses pembakaran selama kebakaran.
Asal usul rantai.Proses nukleasi pusat aktif awal memainkan peran besar dalam pengembangan reaksi berantai tidak bercabang. Ini mengkompensasi hilangnya pusat aktif selama reaksi pemutusan rantai. Mekanisme ini menentukan kondisi untuk pembentukan rezim stasioner pada periode awal akumulasi pusat aktif. Dengan tingkat inisiasi yang kecil, periode ini bisa signifikan.
Sebagian besar reaksi kimia dalam api memiliki cadangan energi yang signifikan dari pusat aktif. Dalam kondisi ini, inisiasi pusat aktif dikaitkan dengan mengatasi hambatan energi yang signifikan.
Dalam hal ini, peran penting dimainkan oleh faktor-faktor yang memastikan tingkat signifikan munculnya pusat aktif: zat kimia aktif, radiasi, pelepasan listrik, produk peluruhan radioaktif.
Di antara faktor-faktor yang sangat memfasilitasi pembentukan pusat aktif, reaksi heterogen harus diperhatikan. Dalam molekul zat yang mudah terbakar yang diadsorpsi pada permukaan padat, ikatan interatomik melemah dan pemutusannya membutuhkan lebih sedikit pengeluaran energi. Dalam kondisi ini, laju pembangkitan pusat aktif secara signifikan lebih tinggi daripada volume gas. Energi aktivasi dalam interaksi heterogen dari komponen-komponen dari campuran yang mudah terbakar juga lebih rendah daripada dalam kasus yang homogen. Inisiasi heterogen dari pusat aktif dalam kondisi proses pembakaran aktual adalah faktor penting dalam percepatan pencapaian rezim stasioner dengan proses rantai tidak bercabang.
Beberapa fitur mencirikan reaksi berantai tidak bercabang yang terjadi dengan partisipasi komponen atom. Dengan tidak adanya pengotor yang berinteraksi dengan pusat aktif tanpa regenerasi, pemutusan rantai menjadi mungkin hanya ketika atom bergabung kembali dengan tiga tumbukan dan di permukaan.
Pada suhu berapa pun, semua zat gas terdisosiasi sebagian. Beberapa molekul terurai menjadi atom. Dalam hal ini, ada keseimbangan antara proses disosiasi dan penyatuan atom menjadi molekul. Tingkat disosiasi secara eksponensial tergantung pada suhu.
Jika tidak ada pengotor dalam campuran yang mudah terbakar memutus rantai, konsentrasi komponen atom dari reaksi tetap praktis tidak berubah. Atom-atom yang masuk ke dalam reaksi segera diregenerasi dalam hal yang sama
Korolchenko A.Ya. Proses pembakaran dan ledakan
lichie. Inisiasi awal mengkompensasi atom yang bereaksi dalam jumlah yang sama seperti pada sistem non-reaktif. Reaksi diam tidak mempengaruhi proses ini. Keseimbangan salah satu komponen dari reaksi, yang dibedakan oleh ikatan paling kuat antara atom-atom dalam molekul, adalah fitur karakteristik mode ini. Konsentrasi komponen atom lain dalam kasus ini adalah quasistationary, tetapi lebih setimbang.
Dengan inisiasi reaksi pembakaran yang homogen, rezim stasioner akan terbentuk hanya setelah periode waktu tertentu, karena disosiasi memerlukan energi aktivasi yang besar. Selama periode ini, laju disosiasi melebihi laju rekombinasi, dan pusat aktif terakumulasi dalam sistem reaksi. Tingkat kedua proses tersebut dibandingkan hanya setelah meningkatkan konsentrasi pusat aktif ke kesetimbangan. Periode waktu ini disebut periode induksi.
Kehadiran permukaan padat sebagai katalis di zona reaksi tidak mengubah keadaan kesetimbangan termodinamika. Katalis sama-sama mempengaruhi reaksi maju dan mundur. Pusat aktif tidak hanya berasal dari permukaan padat, tetapi juga terputus. Namun, kehadiran katalis mempercepat pencapaian keadaan disosiasi kesetimbangan.
Jika zat aktif hadir dalam campuran yang mudah terbakar, yang dapat berpartisipasi dalam reaksi kerusakan rantai, mereka mengurangi konsentrasi pusat aktif. Dalam hal ini, disosiasi kesetimbangan salah satu komponen awal terganggu, yang memperlambat reaksi dan dapat menyebabkan penghentiannya.
Eksperimen menunjukkan bahwa ketika memulai reaksi berantai yang tidak bercabang oleh sumber eksternal (misalnya, sumber cahaya), konsentrasi pusat aktif pada tahap awal pengembangan proses pembakaran dapat secara signifikan melebihi kesetimbangan.
Selama berlangsungnya reaksi berantai bercabang, kondisi inisiasi awal memiliki dampak yang signifikan terhadap perkembangan reaksi. Dalam proses yang bergerak lambat, penambahan campuran yang bereaksi sebagian ke yang awal mempersingkat periode induksi dan mempercepat momen pembakaran nyala.
Kelanjutan dari rantai.Ciri khas dari reaksi berantai tidak bercabang adalah quasi-stationarity dari konsentrasi pusat aktif. Dengan tidak adanya sirkuit terbuka, partikel aktif terbentuk
Bab 2. Proses kimia selama pembakaran
jumlah yang sama di mana mereka dibelanjakan. Baru muncul hanya pada inisiasi awal. Dengan tingkat yang sama dari generasi pusat aktif dan pemutusan rantai, konsentrasi konstan pusat aktif dan mode reaksi diam ditetapkan. Laju reaksi akan berkurang ketika komponen awal dikonsumsi.
Dalam kasus reaksi berantai bercabang, konsentrasi pusat aktif dalam sistem bereaksi meningkat terlepas dari kondisi inisiasi awal mereka. Diimplementasikan mode reaksi akselerasi diri, yang memiliki karakter longsor. Dalam hal ini, untuk transformasi lengkap komponen awal menjadi produk akhir dari reaksi, satu pusat aktif awal sudah cukup.
Persamaan kinetik dari reaksi berharga bercabang adalah sebagai berikut. Perubahan konsentrasi komponen awal yang stabil dari waktu ke waktu dapat diabaikan dengan pendekatan pertama, dan hanya perubahan yang lebih cepat dalam konsentrasi pusat aktif yang dapat diperhitungkan. hal.Perubahan kecepatan ini ditentukan oleh laju inisiasi awal dan rasio laju reaksi percabangan dan pemutusan rantai. Tingkat inisiasi awal tidak tergantung pada konsentrasi pusat aktif yang ada dalam sistem. Tingkat proses percabangan dan kerusakan proporsional dengan konsentrasi pusat aktif. Dalam kondisi ini, keseimbangan keseluruhan dari pembentukan dan pengeluaran pusat aktif ditentukan oleh jumlah tingkat proses inisiasi, percabangan, dan kerusakan:
![]() (2.1)
(2.1)
di mana dan adalah konstanta laju reaksi percabangan dan kerusakan. Mendenotasikan, kita mendapatkan:
![]() (2.2)
(2.2)
Ketika waktu turunan dari konsentrasi pusat aktif
positif. Laju reaksi meningkat seiring waktu. Ciri reaksi berantai bercabang ini disebabkan oleh penggandaan pusat aktif dalam rejim tersebut ketika laju reaksi percabangan melebihi laju reaksi terminasi rantai.
Korolchenko A.Ya. Proses pembakaran dan ledakan
Jika sebelum dimulainya reaksi sistem tidak mengandung pusat aktif, yaitu dit= 0, n = 0 integrasi persamaan (2.2) memberikan:
![]() (2.3)
(2.3)
Total laju reaksi CO ditentukan oleh laju proses percabangan. Produk akhir hanya terbentuk selama reaksi ini. Untuk setiap peristiwa percabangan rantai elementer, molekul-molekul produk akhir terbentuk. Berikut ini:
![]() (2.4)
(2.4)
Perkembangan reaksi berantai dari waktu ke waktu ditentukan oleh rasio konstanta laju reaksi percabangan dan pemutusan rantai dan ketika eksponen dalam persamaan (2.4) positif dan
tindakan ini dipercepat tanpa batas. Pada periode awal perkembangan reaksi, hubungan berikut ini berlaku:
Karena fakta bahwa tingkat inisiasi awal kecil, tidak ada transformasi kimia yang terlihat pada periode awal. Setelah beberapa waktu, nilainya menjadi jauh lebih besar dari satu. Setelah itu, laju reaksi sesuai dengan persamaan (2.4) mulai meningkat dengan cepat dan mencapai nilai yang sangat besar, meskipun secara praktis tidak terlihat sebelumnya.
Kehadiran periode penundaan (periode induksi) selama pengembangan reaksi berantai adalah karena perlunya mengakumulasi sejumlah pusat aktif tertentu dalam sistem reaksi. Hanya setelah transformasi kimia ini menjadi nyata.
Besarnya periode induksi dalam reaksi berantai menentukan rasio laju percabangan dan proses terminasi rantai, bukan tingkat inisiasi awal. Pada gilirannya, laju reaksi percabangan dan kerusakan disebabkan oleh fitur kimia dari masing-masing sistem reaksi, mereka ditentukan oleh ketergantungan pada suhu dan konsentrasi komponen awal. Keunikan reaksi berantai untuk
adalah bahwa proses percabangan membutuhkan energi aktivasi yang signifikan, sedangkan koefisien suhu dari konstanta laju proses kerusakan mendekati nol. Dalam reaksi pemutusan rantai dari ketiga jenis: dalam kasus rekombinasi massal dan heterogen, dalam interaksi radikal dengan pengotor aktif, energi aktivasi adalah nol.
Dengan peningkatan suhu, tekanan total campuran, atau perubahan konsentrasi komponen yang bereaksi, perubahan konstanta laju percabangan dan kerusakan dimungkinkan, di mana reaksi berubah dari stasioner menjadi non stasioner. Keunikan dari proses ini terletak pada transisi tiba-tiba dari satu mode ke mode lain, dalam mengubah laju reaksi dari nilai yang diabaikan ke yang meningkat tanpa batas.
Aliran beberapa reaksi berantai disertai dengan pembentukan produk antara yang relatif stabil, tetapi dengan kemampuan untuk menghasilkan pusat aktif. Reaksi semacam itu termasuk, misalnya, reaksi pembakaran hidrokarbon, sebagai zat antara di mana peroksida dan aldehida terbentuk. Ini mengarah ke percabangan rantai. Namun, karena stabilitas relatif produk antara, percepatan reaksi membentang dari waktu ke waktu. Rantai percabangan yang lambat seperti itu disebut degenerasi.
Reaksi berantai dengan mekanisme percabangan radikal yang biasa, sebagai suatu peraturan, karena aktivitas radikal yang tinggi, berjalan cukup cepat. Radikal yang dihasilkan dapat memulai reaksi yang mempercepat, atau menggabungkan kembali dan keluar dari proses.
Sirkuit terbuka Partikel aktif, seperti halnya molekul gas, membuat gerakan acak di dalam sistem reaksi, bertabrakan dengan molekul lain. Pada saat yang sama, ada kemungkinan tertentu pada beberapa tabrakan interaksi dengan partikel atau molekul aktif lainnya dan pembentukan partikel aktif baru, melanjutkan jalur yang sebelumnya. Pengembangan rantai reaksi mirip dengan gerakan Brown dari molekul inert, meskipun transfer pusat aktif disertai dengan reaksi kimia. Di jalur pengembangan rantai pusat aktif alternatif dari dua atau lebih jenis.
Korolchenko A.Ya. Proses pembakaran dan ledakan
Rantai reaksi berlanjut hingga saat ketika partikel aktif tidak bereaksi tanpa regenerasi. Dalam hal ini, yang disebut sirkuit terbuka terjadi. Proses kerusakan memainkan peran besar dalam kinetika reaksi berantai. Ada dua jenis reaksi yang menyebabkan kematian pusat aktif:
Istirahat homogen (kematian dalam volume campuran reaksi);
Kerusakan heterogen (kematian pada permukaan padat) Kerusakan rantai yang homogen dimungkinkan dengan salah satu dari dua proses:
ketika radikal bergabung kembali atau ketika berbagai komponen aktif secara kimia berinteraksi dengan pusat aktif tanpa regenerasi yang terakhir.
Kerusakan rantai heterogen terjadi pada partikel jelaga yang terbentuk selama pembakaran, atau pada permukaan material pembakaran padat. Sirkuit terbuka pada permukaan padat dapat dianggap sebagai difusi pusat aktif dari campuran gas ke permukaan di mana mereka menghilang. Mekanisme rekombinasi pada permukaan padat adalah bahwa partikel aktif, yang memiliki reaktivitas yang meningkat, diserap * pada permukaan. Radikal yang diserang di situs yang berdekatan bergabung kembali satu sama lain, karena tidak ada energi dan hambatan spasial untuk proses ini. Molekul senyawa stabil yang terbentuk sebagai hasil rekombinasi tidak lagi terlibat dalam pengembangan reaksi berantai.
Namun, tidak setiap tumbukan partikel aktif dengan permukaan padat menyebabkan adsorpsi. Mungkin pantulannya dari permukaan. Probabilitas adsorpsi pusat aktif oleh permukaan padat disebut koefisien akomodasi. Koefisien ini adalah karakteristik afinitas kimiawi dari partikel aktif dan permukaan. Dalam kasus yang praktis penting, partikel aktif setelah pantulan dari dinding tidak bergerak menjauh darinya. Ada kemungkinan tabrakan baru dengan dinding sampai akomodasi terjadi. Karena proses ini, dalam kondisi tertentu, laju reaksi praktis independen dari koefisien akomodasi. Proses berlangsung sedemikian rupa seperti Uni Eropa
* Penyerapan - penyerapan oleh benda padat (atau cairan) zat ha dari lingkungan. Tubuh menyerap disebut sorben, diserap- sorbate Bedakan penyerapan dari seluruh massa sorben (penyerapan) dan lapisan permukaan (adsorpsi). Penyerapan karena interaksi jenis kimia antara permukaan sorben padat dan sorbat disebut chemisorption.
__________________________ Bab 2. Proses kimia selama pembakaran
jika sirkuit terbuka terjadi di setiap tabrakan. Konsentrasi pusat aktif di permukaan dapat dianggap nol.
Dengan tidak adanya pengotor aktif dalam campuran yang bereaksi, kerusakan rantai dapat terjadi baik pada permukaan padat atau secara homogen dengan rekombinasi radikal dalam jumlah besar. Dalam kebakaran nyata, cara kedua terutama diterapkan.
Pengaruh tertentu pada kinetika reaksi berantai memiliki aditif dalam sistem reaksi gas inert. Aditif lembam meningkatkan jumlah tumbukan dengan partikel aktif, meningkatkan kemungkinan kerusakan rantai dan, karenanya, menghambat keseluruhan reaksi.
Penghambatan reaksi berantai yang lebih efektif dicapai dengan memasukkan aditif reaktif - inhibitor ke dalam campuran reaksi. Inhibitor berinteraksi dengan pusat aktif, memimpin reaksi, memutus rantai. Kinetika reaksi dalam campuran yang dihambat ditentukan oleh kondisi persaingan antara inhibitor dan komponen utama dari reaksi ketika berinteraksi dengan pusat aktif. Dengan efisiensi tinggi dari inhibitor dan tingkat moderat dari pusat aktif baru, aditif kecil dari inhibitor dapat sepenuhnya menekan jalannya reaksi berantai.
Proses penghambatan sangat penting dalam praktik keselamatan kebakaran dan ledakan. Penggunaan inhibitor memungkinkan Anda untuk secara efektif memengaruhi proses pembakaran.
2.2. Proses kimia selama pembakaran hidrogen
Interaksi molekul hidrogen dengan molekul oksigen berlangsung dengan cara yang rumit melalui serangkaian tahapan berturut-turut. Sekarang telah dipastikan bahwa pembakaran hidrogen terjadi melalui mekanisme rantai, dengan partikel memainkan peran pusat aktif. Urutan dan signifikansi reaksi elementer selama pembakaran hidrogen dijelaskan dengan sangat rinci untuk berbagai kondisi untuk munculnya dan pengembangan api hidrogen.
Analisis paling rinci dari proses pembakaran hidrogen dalam mode autoignition menggunakan metode eksperimental dan komputasi dilakukan oleh Profesor A. N. Baratov. Dia mengusulkan skema proses berikut, termasuk empat belas reaksi dasar dasar:
Korolchenko A.Ya. Proses pembakaran dan ledakan
Asal usul pusat aktif terjadi melalui reaksi
![]()
Kelanjutan dari rantai reaksi
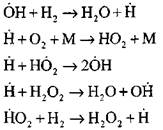
Rantai percabangan
 |
sirkuit terbuka
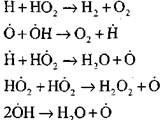 |
Konsentrasi atom hidrogen pada tahap awal proses autoignition adalah bagian yang tidak signifikan dari kandungan hidrogen awal. Dengan perkembangan reaksi berantai, laju konversi hidrogen molekuler menjadi sangat tinggi sehingga dikonsumsi dalam seperseratus detik.
2.3. Reaksi kimia saat membakar karbon monoksida
Interaksi karbon monoksida dengan oksigen merupakan reaksi utama untuk proses pembakaran. Jalannya reaksi ini selama
__________________________ Bab 2. Proses kimiasedang terbakar
banyak kasus menentukan hukum pembakaran zat yang mengandung karbon. Reaksi ditandai dengan mekanisme rantai bercabang. Ini memiliki sejumlah fitur.
Untuk waktu yang lama ada kepercayaan bahwa campuran CO dan 0 2 yang benar-benar kering tidak dapat terbakar dan terbakar. Namun, dengan hati-hati mengatur percobaan di mana tidak adanya air dipantau menggunakan spektograf massa menunjukkan bahwa pengapian juga memungkinkan untuk campuran kering. Perlu dicatat bahwa keberadaan uap air CO + 0 2 atau hidrogen dalam sistem mengaktifkan proses pengapian dan pembakaran dengan meningkatkan jumlah pusat aktif yang mungkin. Efek percepatan air terutama terlihat pada konsentrasi rendah.
Pembakaran karbon monoksida dengan adanya uap air atau penambahan hidrogen yang kecil terjadi dengan partisipasi proses elementer berikut:

Radikal, H0 2, yang dibentuk oleh reaksi (VI), dapat melanjutkan rantai (reaksi VIII) atau menyebabkan kerusakannya dengan reaksi (IX-XII).
Untuk menilai kondisi untuk transisi oksidasi lambat CO menjadi ledakan rantai, mari kita perkirakan probabilitas rantai menembus radikal H0 2; di sini kita memperhitungkan bahwa peran reaksi (X) dan (XI) dalam pemutusan rantai tidak signifikan dalam hal
dibandingkan dengan reaksi (IX), karena konstanta laju proses (IX-XI) pada suhu urutan 1000 K berdekatan satu sama lain, tetapi konsentrasi radikal jauh lebih rendah daripada konsentrasi atom hidrogen, karena radikal memiliki aktivitas kimia yang lebih tinggi. Oleh karena itu, kemungkinan rangkaian terbuka melalui radikal H0 2 dapat ditulis dalam bentuk:
Pada suhu 1000 ribu
Karena itu, asalkan
![]()
![]()
efek besarnya
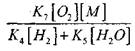
pada penyelesaian persamaan (2.7) akan menjadi lemah.
Bab 2. Proses kimia selama pembakaran
Dalam hal ![]() atau
atau ![]() (apa yang diamati di
(apa yang diamati di
nyala nyala DENGAN), persamaan (2.7) dikonversi ke bentuk:
![]() (2.8)
(2.8)
Dengan demikian, kondisi pembakaran karbon monoksida di udara sangat ditentukan oleh keberadaan dan pola pembakaran hidrogen. Oksidasi CO oleh reaksi (I) tergantung pada konsentrasi radikal OH yang terbentuk dalam reaksi yang melibatkan hidrogen.
Keunikan reaksi pembakaran karbon monoksida terletak pada penghambatannya yang cepat ketika zat tambahan kecil dimasukkan ke dalam sistem reaktif zat dengan afinitas tinggi untuk atom hidrogen. Zat-zat semacam itu yang menghambat pembakaran CO adalah halida dan turunan halo dari hidrokarbon. Efek penghambatan mereka karena penghentian rantai reaksi ketika berinteraksi dengan atom hidrogen oleh reaksi
2.4. Pembakaran hidrokarbon
Pemeriksaan terhadap proses pembakaran hidrogen dan karbon monoksida menunjukkan kompleksitas mekanisme reaksi pembakaran. Dalam kasus H 2 dan CO, reaksi berlangsung sebagai rantai dengan partisipasi dari banyak tahap dasar dan produk antara. Oleh karena itu, wajar untuk mengharapkan bahwa mekanisme reaksi pembakaran zat yang lebih kompleks - hidrokarbon - bahkan lebih kompleks dan efek yang menyertai proses pengapian dan pembakaran senyawa ini lebih beragam.
Saat ini informasi yang tersedia tentang sifat peningkatan kimia hidrokarbon dalam proses pembakarannya memungkinkan kami untuk menjelaskan efek yang diamati dengan beberapa perkiraan.
Telah ditetapkan bahwa dalam api hidrokarbon, bersama dengan partikel aktif yang telah diketahui, ada sejumlah besar produk antara dari struktur yang lebih kompleks. Dalam beberapa kasus, mereka menjadi sumber munculnya rantai baru. Peran utama dalam proses penyalaan dan pembakaran hidrokarbon dimainkan oleh jenis-jenis senyawa antara:
Korolchenko A.Ya. Proses pembakaran dan ledakan
1. Radikal hidrokarbon, yang merupakan molekul dari
levodoroda, yang menghilangkan satu atau lebih atom hidrogen. Ini
residu disebut alkil (CH3 - metil; C 2 H 5 - etil; C 3 H 7 - propil dan
dll.) Karena reaktivitasnya yang tinggi, alkil bebas
tidak ada untuk waktu yang lama. Hadir dalam api sebagai perantara
produk. Ketika berinteraksi dengan molekul lain berperilaku
sebagai kelompok struktural independen. Radikal Hidrokarbon
biasanya diwakili oleh huruf R.
2. Peroksida - senyawa rumus umum R-00-R ".
3. Aldehydes - Jenis Senyawa
![]()
Aldehida yang paling sederhana adalah formik (formaldehida) dan asetat (asetaldehida) ![]() . Zat-zat ini semuanya
. Zat-zat ini semuanya
hadir dalam produk pembakaran hidrokarbon yang tidak lengkap.
Pembentukan rantai selama pembakaran hidrokarbon dapat berupa reaksi di mana radikal hidrokarbon terbentuk. Ini bisa menjadi reaksi dekomposisi molekul etana dengan pembentukan dua kelompok metil bebas:
![]()
atau reaksi hidrokarbon dengan oksigen:
![]()
Kelanjutan rantai terjadi sebagai akibat dari reaksi pembentukan | peroksida atau hidroperoksida:
![]()
Percabangan rantai dilakukan selama dekomposisi hidroperoksida:
Bab 2. Proses kimia selama pembakaran
Urutan reaksi yang diberikan mengarah pada peningkatan bertahap konsentrasi senyawa peroksida dalam sistem reaksi.
Bersamaan dengan akumulasi peroksida, radikal dan mulai
ada reaksi paralel:

Reaksi-reaksi ini eksotermis; ketika mereka mengalirkan sejumlah besar panas.
Dengan peningkatan suhu campuran reaksi, peran pusat aktif berpindah dari satu produk antara ke produk lain dengan urutan sebagai berikut: alkil hidroperoksida, asil hidroperoksida, formaldehida.
Studi eksperimental dari perubahan komposisi campuran reaksi dari waktu ke waktu di wilayah suhu tinggi (600-800 ° C) menunjukkan bahwa proses transformasi hidrokarbon awal menjadi produk pembakaran akhir dibagi menjadi dua tahap: pertama, terjadi pada tingkat yang sangat tinggi, mengoksidasi hidrokarbon menjadi CO. Pada tahap kedua, lambat, CO dioksidasi menjadi. Kesimpulan yang sangat penting berikut: banyak hukum pembakaran hidrokarbon dapat dijelaskan oleh fitur pembakaran karbon monoksida.
2.5. Pembakaran karbon
Pembakaran karbon berlangsung sesuai dengan mekanisme proses heterogen, yang kekhususannya terletak pada kenyataan bahwa tahap kimia tidak dapat dipertimbangkan secara terpisah dari proses transfer oksidan gas (oksigen dari udara) dari ruang sekitar ke permukaan benda padat yang terbakar. Tingkat pembakaran tergantung pada sifat kimia karbon dan karakteristik yang menentukan proses memasok oksigen ke permukaan bahan bakar. Pasokan oksigen ke zona pembakaran dilakukan oleh difusi dan karenanya
Korolchenko A.Ya. Proses pembakaran dan ledakan
tergantung pada banyak faktor: bentuk dan ukuran tubuh yang terbakar, pergerakan medium gas, koefisien difusi oksigen dan produk-produk reaksi baik di ruang di atas permukaan bahan bakar dan dalam retakan dan pori-pori yang terkandung dalam batubara dan kokas dalam jumlah yang signifikan.
Untuk mengilustrasikan fitur-fitur pembakaran karbon yang heterogen, kami mempertimbangkan perilaku sepotong batubara terpisah yang ditempatkan di dalam tungku yang dipanaskan hingga suhu 900 ° C. Pada saat awal, pembakaran batubara akan terjadi dengan mengorbankan oksigen yang terletak di dekat permukaannya. Setelah habis, lapisan produk pembakaran terbentuk di sekitar permukaan yang dipanaskan. Laju pembakaran akan berkurang, dan prosesnya bisa berhenti jika tidak ada oksigen yang berasal dari area yang lebih jauh dari ruang gas.
Aliran ini terjadi melalui difusi, dan laju pembakaran akan ditentukan oleh fluks difusi. Intensitas difusi sangat tergantung pada intensitas dan sifat pergerakan medium gas di dekat permukaan yang terbakar. Laju reaksi kimia terutama ditentukan oleh suhu. Reaksi heterogen, serta homogen, mematuhi hukum Arre-nius.
Pada suhu tinggi, reaksi oksidasi karbon berlangsung sangat cepat, dan kecepatan total proses akan dibatasi oleh difusi oksigen ke permukaan.
Dengan demikian, proses pembakaran karbon terdiri dari dua proses yang berbeda sifatnya: proses pengangkutan oksigen udara dari ruang gas ke tempat konsumsinya dan proses interaksi kimianya dengan permukaan karbon padat. Kedua proses ini saling terkait, tetapi masing-masing memiliki hukumnya sendiri. Yang paling penting dari proses ini adalah proses konsumsi oksigen, yang ditandai oleh berbagai reaksi kimia.
Mekanisme reaksi kompleks menggabungkan oksigen dengan karbon terdiri dalam pembentukan simultan dua oksida CO dan C0 2 melalui kompleks fisikokimia menengah dari tipe C X 0 Y, yang kemudian dibagi menjadi CO dan. Rasio antara oksida ini tergantung pada kondisi pembakaran. Dengan demikian, persamaan reaksi reaksi pembakaran karbon dapat ditulis sebagai berikut:
Bab 2. Proses kimia selama pembakaran
Kemudian reaksi homogen pembakaran karbon monoksida terjadi:
mekanisme yang dibahas dalam bagian 2.3.
Reaksi ini dapat terjadi di dekat permukaan karbon, jadidan di dalam massa batu bara, di pori-pori dan retakannya.
Reaksi lain adalah reaksi heterogen antara karbon panas dan karbon dioksida:
![]()
Mengalir pada kecepatan yang terlihat di tempat-tempat di mana ada kekurangan oksigen, tetapi di mana suhu karbon cukup tinggi.
Kombinasi reaksi yang diuraikan menentukan komposisi produk pembakaran karbon.
DARURAT PROSES PEMBAKARAN
| R |
irigasi dalam campuran yang mudah terbakar dapat terjadi sebagai akibat dari penyalaannya sendiri, penyalaan oleh sumber eksternal atau pembakaran spontan. Jika proses penyalaan sendiri dan penyalaan merupakan karakteristik dari zat yang berada dalam kondisi gas, cair atau padat, maka pembakaran spontan adalah karakteristik bahan padat (terutama yang dalam kondisi terbelah halus) atau cairan mendidih tinggi yang didistribusikan pada bahan dengan permukaan yang dikembangkan.
3.1. Menyala sendiri. Teori stasioner
Api adalah pembakaran yang tidak terkendali yang berkembang dalam ruang dan waktu, berbahaya bagi manusia dan menyebabkan kerusakan material.
Bahaya kebakaran bagi manusia adalah kebakaran terbuka, percikan api, demam, produk beracun dari pembakaran, asap, berkurangnya oksigen, runtuhnya bangunan atau instalasi.
Pembakaran adalah reaksi fisika-kimia yang berlangsung cepat, disertai dengan pelepasan panas dan asap, munculnya nyala api atau membara. Dalam kondisi normal, pembakaran adalah proses oksidasi atau penggabungan zat yang mudah terbakar dengan oksigen atmosfer. Namun, beberapa zat (misalnya, asetilena terkompresi, nitrogen klorida, ozon) dapat meledak tanpa oksigen untuk membentuk panas dan nyala api. Akibatnya, pembakaran dapat dihasilkan dari reaksi tidak hanya dari senyawa, tetapi juga dari penguraian. Juga diketahui bahwa hidrogen dan banyak logam dapat terbakar di atmosfer klor, tembaga dalam uap belerang, magnesium dalam karbon dioksida, dll.
Pembakaran paling berbahaya yang terjadi selama oksidasi suatu zat yang mudah terbakar dengan oksigen di udara. Pada saat yang sama, perlu untuk memiliki sumber pengapian yang mampu memasok jumlah energi yang diperlukan untuk sistem bahan bakar. Sumber penyalaan yang paling umum adalah: percikan api yang muncul ketika kerusakan peralatan listrik, pemogokan benda logam, pengelasan, pekerjaan menempa; panas yang dihasilkan oleh gesekan; perangkat pemanas teknologi; aparatur api; panas kompresi adiabatik; percikan listrik statis; kontak listrik yang terlalu panas; reaksi kimia berlangsung dengan melepaskan panas.
Suhu pemanasan dari sumber-sumber ini berbeda. Jadi, percikan yang terjadi ketika benda logam dipukul dapat memiliki suhu hingga 1900 ° C, nyala korek api adalah tentang. 800 ° C, drum utama konveyor sabuk selama selip hingga 600 ° C, dan dalam panas dari pelepasan listrik suhunya mencapai 10.000 ° C, dengan reaksi kimia yang hampir seketika.
Pembakaran mungkin lengkap dan tidak lengkap. Dengan pembakaran sempurna, terjadi dengan kelebihan oksigen, produk-produk reaksi adalah karbon dioksida, air, nitrogen, sulfur dioksida. Pembakaran tidak sempurna terjadi dengan kekurangan oksigen, produk pembakaran dalam hal ini adalah zat beracun dan mudah terbakar - karbon monoksida, alkohol, keton, aldehida, dll. Sejumlah udara diperlukan untuk pembakaran penuh bahan yang mudah terbakar: 1 kg kayu - 4,18, gambut - 5 , 8, propana - 23,8 m3.
Proses pembakaran dapat dibayangkan sebagai berikut. Media yang mudah terbakar dingin dengan pengenalan impuls panas dipanaskan, ada oksidasi intensif dari media yang mudah terbakar dengan oksigen dan pelepasan panas tambahan. Ini, pada gilirannya, mengarah pada pemanasan lapisan yang berdekatan dari bahan yang mudah terbakar, di mana reaksi kimia yang intens juga terjadi. Dengan pembakaran lapis demi lapis dari zat yang mudah terbakar, zona pembakaran bergerak; Kecepatan gerakan ini menentukan intensitas proses pembakaran dan merupakan karakteristik terpentingnya. Proses pemanasan lapis demi lapis, oksidasi, dan pembakaran berlanjut hingga seluruh volume bahan yang mudah terbakar habis.
Zona sempit tempat zat dipanaskan dan reaksi kimia berlangsung disebut nyala depan.
Sistem yang mudah terbakar dapat secara kimiawi homogen dan heterogen. Sistem homogen secara kimiawi adalah campuran gas yang mudah terbakar, uap atau debu dengan udara, di mana materi yang mudah terbakar dan udara dicampur secara seragam. Pembakaran sistem semacam itu disebut homogen. Dalam sistem kimia yang tidak homogen, materi yang mudah terbakar dan udara tidak bercampur dan memiliki antarmuka. Ini seringkali merupakan bahan yang mudah terbakar dan pembakarannya disebut heterogen.
Total waktu pembakaran campuran yang mudah terbakar Tg adalah jumlah waktu yang diperlukan untuk kontak antara zat yang mudah terbakar dan oksigen τ к terjadi, dan waktu di mana bahan kimia itu sendiri terjadi, reaksi oksidasi τ x
Tergantung pada rasio kedua istilah ini, difusi dan pembakaran kinetik dibedakan. Ketika membakar zat-zat padat yang mudah terbakar, waktu yang dibutuhkan oksigen untuk menembus (menyebar) ke permukaan zat jauh lebih lama daripada waktu reaksi kimia, oleh karena itu, laju pembakaran total sepenuhnya ditentukan oleh laju difusi oksigen ke zat yang mudah terbakar. Pembakaran zat-zat tersebut paling sering ditemukan pada api dan disebut difusif. Pembakaran, laju yang ditentukan oleh laju reaksi kimia, disebut kinetik. Jenis pembakaran ini adalah karakteristik dari sistem mudah terbakar yang homogen.
Bedakan suhu pembakaran, teoritis dan aktual dari pembakaran.
Suhu kalorimetri pembakaran mengacu pada suhu di mana produk dari pembakaran sempurna dipanaskan, jika semua panas yang dikeluarkan dihabiskan untuk memanaskannya, jumlah udara secara teori diperlukan, zat-zat tersebut benar-benar terbakar dan suhu awal adalah 0 ° С. Kehilangan panas diasumsikan nol. Jika suhu awal bahan bakar dan udara adalah 0 ° C, maka suhu pembakaran kalorimetri
![]()
di mana Qn adalah nilai kalor bersih dari bahan yang mudah terbakar, kkal / kg; V adalah volume produk pembakaran, m3 / kg; c adalah kapasitas panas volumetrik rata-rata dari produk pembakaran, kcal / m3 · deg.
Akibatnya, suhu pembakaran kalorimetri hanya tergantung pada sifat-sifat zat yang mudah terbakar dan tidak tergantung pada kuantitasnya. Temperatur pembakaran teoretis memperhitungkan kehilangan panas selama pembakaran untuk dipisahkan. Temperatur pembakaran kalorimetri tertinggi untuk zat yang mudah terbakar dan digunakan untuk penilaian kualitatif. Pada kenyataannya, ketika terbakar, selalu ada kehilangan panas karena radiasi, pemanasan udara berlebih dan lingkungan.
Suhu pembakaran yang sebenarnya adalah suhu api. Bedakan suhu api internal dan eksternal. Suhu api eksternal adalah suhu nyala api, dan suhu internal adalah suhu asap di dalam ruangan. Suhu aktual berkembang jika terjadi kebakaran karena kehilangan panas ke lingkungan, pemanasan produk dan struktur pembakaran
selalu kurang dari teoritis sebesar 30 ... 50%. Misalnya, suhu pembakaran teoretis bensin adalah 1730 ° C, dan suhu sebenarnya adalah 1400 ° C.
Campuran uap dan gas yang mudah terbakar dengan zat pengoksidasi hanya dapat terbakar dengan kandungan bahan bakar tertentu di dalamnya.
Konsentrasi gas mudah terbakar terendah di mana pembakaran sudah dimungkinkan disebut batas konsentrasi rendah (LEL). Konsentrasi tertinggi di mana pembakaran masih memungkinkan disebut batas konsentrasi atas penyalaan (AIPW). Wilayah konsentrasi yang terletak di dalam batas-batas ini disebut wilayah pengapian. Pengapian adalah api (awal dari pembakaran), disertai dengan munculnya nyala api. Ini adalah pembakaran lama yang stabil, yang tidak berhenti bahkan setelah sumber kunci kontak dilepas. Nilai batas bawah dan batas atas pengapian tergantung pada sifat-sifat gas, uap dan debu campuran udara, kandungan komponen lembam dalam campuran yang mudah terbakar. Penambahan gas inert ke campuran yang mudah terbakar mempersempit area pengapian dan akhirnya membuatnya tidak mudah terbakar. Secara signifikan mempersempit batas penyalaan, beberapa kotoran yang memperlambat reaksi pembakaran. Yang paling aktif adalah hidrokarbon terhalogenasi. Kedua properti yang ditandai digunakan untuk berhenti membakar. Menurunkan tekanan campuran di bawah tekanan atmosfer juga mempersempit area penyalaan, dan pada tekanan tertentu campuran menjadi tidak mudah terbakar. Meningkatkan tekanan campuran yang mudah terbakar memperluas area pengapian, tetapi, sebagai aturan, sedikit. Meningkatkan suhu campuran yang mudah terbakar memperluas area pengapian. Konsentrasi penyalaan juga dipengaruhi oleh kekuatan sumber penyalaan.
Tidak hanya konsentrasi, tetapi juga batas suhu penyalaan.
Batas suhu untuk pengapian uap di udara adalah suhu bahan yang mudah terbakar di mana uap jenuh membentuk konsentrasi yang sesuai dengan batas konsentrasi rendah atau tertinggi pengapian. Suhu penyalaan adalah suhu terendah di mana suatu zat menyala atau mulai membara dan terus membakar atau membara setelah mengeluarkan sumber api. Temperatur penyalaan mencirikan kemampuan suatu zat untuk pembakaran sendiri. Jika suhu pengapian suatu zat tidak ada, maka itu disebut sebagai pembakaran lambat atau tidak mudah terbakar.
Percepatan reaksi oksidasi di bawah aksi suhu menyebabkan penyalaan sendiri. Berbeda dengan proses penyalaan, di mana hanya sebagian volume terbatas - permukaan - menyala, penyalaan sendiri terjadi pada seluruh volume bahan. Suhu penyalaan sendiri dipahami sebagai suhu terendah, di mana zat harus dipanaskan, sehingga akan menyala sebagai hasil dari oksidasi otomatis lebih lanjut. Penyalaan sendiri hanya dimungkinkan jika jumlah panas yang dilepaskan selama proses oksidasi melebihi pelepasan panas ke lingkungan.
Temperatur penyalaan otomatis tidak konstan untuk suatu zat, karena sangat tergantung pada kondisi penentuannya. Untuk mendapatkan data komparatif, alat uji dan metode untuk menentukan suhu penyalaan sendiri gas dan uap distandarisasi (GOST 13920-68). Suhu terendah yang ditentukan oleh metode standar, di mana campuran gas dan uap dengan udara harus dipanaskan secara merata agar dapat menyala tanpa memasukkan sumber pengapian eksternal ke dalamnya, disebut suhu pengapian otomatis standar.
Jenis penyalaan spontan adalah pembakaran spontan, yaitu pembakaran akibat pemanasan sendiri tanpa pengaruh sumber penyalaan. Perbedaan antara pengapian spontan dan pembakaran spontan adalah pada besarnya suhu. Pembakaran spontan terjadi pada suhu sekitar, dan untuk penyalaan sendiri perlu memanaskan bahan dari luar.

 Penerimaan indikasi counter pasokan air panas dan dingin
Penerimaan indikasi counter pasokan air panas dan dingin Perhitungan luas saluran udara dari berbagai bentuk dan perlengkapan
Perhitungan luas saluran udara dari berbagai bentuk dan perlengkapan Kimia proses pembakaran. Energi ledakan
Kimia proses pembakaran. Energi ledakan Apa yang akan terjadi jika Anda tidak mengirimkan pembacaan meter
Apa yang akan terjadi jika Anda tidak mengirimkan pembacaan meter