Az égést hívják. Kémiai folyamatok égés közben
Néhány alapvető definíció
Az atomok és molekulák száma kényelmesen kifejezve anyagmennyiséget vagy az anyag móljainak száma. Egy mól anyag felel meg 6,223 23 23 23 részecskének (atomok és molekulák). Az N A = 6,023 ∙ 10 23 mol -1 szám az Avogadro szám. Mólfrakció x iösszetevő én az n mólok számának aránya én összetevő én az n = ∑ n teljes mólszámára én keverékek ( x i = n i / n).
súly m az anyag alapvető tulajdonsága (az SI rendszerben a mérési egység kilogramm). A Wi tömegtömeg a tömeg aránya m i összetevő én a keverék teljes tömegéhez m = ∑ m i (Wi = m i / m).
M molekulatömeg (vagy molekulatömeg) én(g / mol) komponens én - a komponens egy móljának tömege. Tehát atomi szén, molekuláris hidrogén, oxigén és metán esetében: M c = 12 g / mol, Mn 2 = 2 g / mol, Mo 2 = 32 g / mol, Mn 4 = 16 g / mol. Az M (g / mol) keverék átlagos moláris tömege az alkotórészek moláris frakcióiban kifejezhető (M = x i M i).
Az égési folyamatok meghatározása
égő - Ez egy komplex fizikai-kémiai folyamat, amelyben az éghető anyagok és anyagok a magas hőmérséklet hatására kémiai kölcsönhatásba lépnek egy oxidálószerrel (a levegőben lévő oxigén), égési termékekké alakulnak, és amelyekhez intenzív hő- és fénykibocsátás tartozik.
Az égési folyamat előfordulásához szükséges feltételek: \\ t
Az éghető anyag (GV) jelenléte;
Oxidálószer (O.) - levegő oxigén jelenléte;
A gyújtóforrás jelenléte (I.Z.).
Az éghető anyagot olyan hőmérsékletre kell melegíteni, amelyen az oxidációs folyamat megkezdődik;
Az éghető anyag bizonyos hőmérsékletre történő felmelegítéséhez bizonyos gyújtóforrás-teljesítmény szükséges;
Az égési folyamat fenntartásához bizonyos üzemanyag- és oxidálószer-koncentrációk szükségesek.
A legfontosabb égési folyamatok a hő- és tömegátadás. Az égés leggyakoribb tulajdonsága a láng előfordulása, és az egész éghető keverékben való mozgatása, ha hő hatására vagy az aktív részecskéknek az égési zónából a friss éghető keverékbe való diffundálásával.
tűz - Ez az égés látható megnyilvánulása. Az égőzónának is nevezik. Ez az a része annak a térnek, ahol az éghető keverék teljes és nem teljes égésű termékké alakul át.
Az égési folyamat fő paraméterei, amelyek halálhoz és anyagi kárhoz vezetnek, a következők:
Nagy mennyiségű hő;
Magas hőmérséklet;
Az égéstermékek mérgező összetétele.
Az égési folyamat a gázok molekuláris kinetikai elmélete szempontjából
Ábra. 2.1. Az aktív molekulák aránya a hőmérséklet függvényében: T 2\u003e T 1
Amikor fűtött gáz éghető keveréke növeli a felesleges energiát.
Az aktív állapotban lévő molekulák átlagos energiaszintje és az inaktív állapot átlagos szintje közötti különbséget aktivációs energiának nevezzük. Ez grafikusan ábrázolható (2. ábra).

Ábra. 2.2. A reakcióvezetés energia diagramja G.V. + O. ® PG: E cselekvés - aktiválási energia; Q xr - az égési reakció termikus hatása
Az "első" reagált molekulák kölcsönhatása eredményeként felszabaduló energia a szomszédos molekulákba kerül. Izgatottak, a folyamatot nagy gyakorisággal és intenzitással ismételjük meg a reagált molekulák körül. Megkezdődik az önállóság, a teljes reakciókeverék (2H2 + O2) kémiai kölcsönhatás folyamatának folyamata, melyet a vízmolekulák képződése és a környezetbe való hő felszabadulása kísér. az égési folyamatot terjeszti és terjeszti.
Minél nagyobb az E-cselekmény numerikus értéke, annál nehezebb az, hogy ez az alkatrészpár vegyi kölcsönhatásba lépjen. Ezért az E-cselekmény értéke a kémiai rendszer tűzveszélyességének közvetett mutatója.
Az égés típusai és módjai
Az égést az alábbi paraméterek szerint lehet besorolni:
1. Az éghető komponensek keverésének állapota szerint:
a) kinetikus - elő kevert gáz- vagy gőz-levegő keverékek égése. Mivel az üzemanyag és az oxidálószer keveréke készen áll az égésre, amíg meg nem gyullad, az égési folyamat teljes sebessége csak az égés kémiai reakciósebességétől függ. Ha egy ilyen égés zárt vagy korlátozott térfogatban történik, akkor robbanás léphet fel. Mivel a keverék égése során felszabaduló energiának nincs ideje ahhoz, hogy ezen a térfogaton túlmenően ürítse ki, a nyomás növelésével a szerkezetek megsemmisülhetnek;
b) a diffúzió, a diffúziós égés az égés, amikor egy éghető közeg (üzemanyag és oxidálószer keveréke) képződik az égési zóna előtt vagy az égési zónában.
2. Az éghető komponensek kémiai reakciózónában történő átvételének intenzitása szerint:
a) lamináris, míg az éghető keverék összetevői viszonylag nyugodtan lépnek be az égési zónába. Ebben az esetben a Reynolds-kritérium számszerű értéke, amely a termodinamikai rendszert jellemzi, lényegesen kisebb lesz, mint a kritikus (Re<2300).
b) turbulens, az éghető keverék összetevői nagy sebességgel lépnek be az égési zónába. A Reynolds-szám ebben az esetben több mint 2300.
3. Az éghető keverék összetevőinek aggregálódási állapota szerint:
a) homogén üzemanyag és oxidálószer ugyanolyan aggregáló állapotban van (gáznemű);
b) heterogén (többfázisú) - az üzemanyag és az oxidálószer különböző aggregációs állapotban van.
4. A kémiai égési reakció zóna terjedésének sebességéről:
a) a kémiai reakciózóna deflagrációs (lassú) eloszlása (0,5 és 50 m / s közötti sebesség);
b) robbanás (robbanásveszélyes), amikor az égés kémiai reakciójának zónája sokkhullám sebességével terjed (másodpercenként több száz méterre másodpercenként).
Az a hely, ahol a gőzök vagy gázok égnek lánggal .
Lamináris lángok kevertek elő. Egy előre kevert keverék lamináris lángjaiban az üzemanyag és az oxidálószer keveredik az égés megkezdése előtt, és az áramlás lamináris.
Az előkeverék keverékének lángját hívják sztöchiometriai ha a tüzelőanyag (szénhidrogén) és az oxidálószer (oxigén-O2) teljesen fogyasztják egymást, szén-dioxidot (CO 2) és vizet (H20) képezve. Ha van egy túlzott mennyiségű üzemanyag, azt mondják, hogy a keverék gazdag, és ha van felesleges oxidálószer, azt mondják, hogy a keverék gyenge.
Fontolja meg a legegyszerűbb példákat:
1) 2H 2 + O 2 → 2H 2 O - sztöchiometrikus keverék,
2) ЗН 2 + О 2 → 2H 2 O + Н 2-gazdag keverék (Н 2 feleslegben),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - sovány keverék (O 2 feleslegben).
Minden ilyen szimbólum egy ilyen kémiai reakcióegyenletben egy anyag egy móljának felel meg. Az első ilyen egyenlet tehát azt jelenti, hogy két mol H2 reagált egy mól O 2-val, és két mol H 2 O-t képez.
Ha a kémiai reakcióegyenlet úgy van írva, hogy csak egy mól üzemanyagot ír le, akkor a sztöchiometrikus keverékben lévő üzemanyag mólfrakciója könnyen meghatározható a viszonylatban.
x hegyek, stokh = 1 / ((1 + v)
itt vaz O2 mólszámát jelenti a reakcióegyenletben CO 2 és H 2 O képződésével.
H 2 + 0,5O 2 → H20, v = 0,5, x 2, stoch = 2/3
Ha az oxidálószer levegő, akkor figyelembe kell venni, hogy a száraz levegő csak 21% oxigént, valamint 78% nitrogént és 1% nemesgázt tartalmaz. Így a levegő esetében XN2 = 3,762 XO 2. Innen a levegővel sztöchiometrikus keverékhez mért frakciók egyenlőek lesznek
x hegyek, stokh = 1 / (((1 + v ∙ 4.762), ![]() ,
,
ahol v az előzőekben leírtak szerint az O2 móljainak száma a reakcióegyenletben egy mól üzemanyag CO 2 -ra és H2O-ra történő teljes átalakulásával. v és a tüzelőanyagnak a levegővel való sztöchiometrikus keverékeihez mért frakcióit az 1. táblázatban mutatjuk be.
Az üzemanyag és a levegő előkeverékei (ebben az esetben a megfelelő mennyiségű N2-t hozzá kell adni a reakcióegyenlethez, lásd az 1. táblázatot) a levegő egyenértékű aránya jellemzi:
λ = (x w / x hegyek) / (x w, stoch / x hegyek, stoh) = (w w / w hegyek) / (w w, stoch / w hegyek, stoch)
vagy az üzemanyagra vonatkozó egyenérték aránya F (F = 1 / λ). Ezt a képletet transzformálhatjuk annak érdekében, hogy meghatározzuk a keverék moláris frakcióinak értékét érték szerint F:
x hegyek = 1 / ((1+ (4,762 ∙ v) / F), x w = 1 - x hegyek,
X tömeg / 4,762, = 3,762
Példák v értékekre és az üzemanyag mólfrakcióira x hegyek, sztoichi az üzemanyag levegővel való sztöchiometrikus keverékeire
az öntözést mindig kémiai átalakítások kísérik. Égés a levegőben - az éghető anyag és az oxigén kölcsönhatása. Emlékeztetni kell azonban arra, hogy a nitrogén-oxidok, a halogenidek és az ózonok oxidálószerként működhetnek az égési folyamatban. Ismert égési folyamatok, amelyek csak a termék egyetlen forrásának részvételével lépnek fel - a gyors bomlásra képes vegyületek. Ilyen vegyületek például az acetilén és a hidrazin.
Az égés során keletkező kémiai folyamatok rendkívül összetettek. Még a legegyszerűbb esetben is - a hidrogén oxigénben történő elégetése, amelynek általános képlete a formában van
2H 2 + 0 2 = 2H 2 0,
több tucat elemi fázist hoztak létre és vizsgáltak meg.
A kémiai átalakulások mechanizmusait eddig csak néhány anyag, például hidrogén, szén-monoxid, metán és etán égése során eddig részletesen tanulmányozták. Ezt a tudást arra használják, hogy megjósolják a sok anyag gyulladásának és égésének körülményeit.
2.1. Láncreakciók
A láncreakciókat a szokásos kémiai transzformációkkal ellentétben az aktív részecskék mindegyik elemi akciójában megjelenő: egy páratlan elektron, egy szabad gyökö vagy egy ion. Az aktív részecskék megjelenése a kiindulási anyagok reakciótermékké való átalakulásának láncát okozza. Atomok, szabadgyökök és ionok reaktívabbak, mint a valencia-telített molekulák. Ezért a kémiai kötések megszakításához és az aktív részecskék képződéséhez szükséges jelentős energiaköltségek ellenére a reakció lánc kialakulása gyakran energetikailag előnyösebb, mint a molekulák közötti közvetlen kölcsönhatás.
Az égési folyamatok láncmechanizmuson keresztül történnek. Láncreakciók - komplex reakciók, amelyek több szakaszban zajlanak:
A láncok eredete (iniciáció), amelyben az aktív részecskék képződnek;
A láncok folytatása, amelyekben az aktív részecskék kémiai kölcsönhatásba lépnek a kiindulási anyagokkal, aminek következtében új aktív részecskék képződnek;
Láncok törése, amelyekben a végső reakciótermékek képződése során az aktív részecskék "halálát" okozzák
A láncok eredete különböző körülmények között történhet. Például a molekulák hőenergia vagy ionizáló sugárzás hatására történő disszociációjának eredményeként elektromos kisülésben. Az aktív részecskék halála akkor következik be, amikor rekombinálódnak *, amikor a szabad gyökök kölcsönhatásba lépnek (homogén lánc törés), amikor az aktív részecskék szilárd felületekkel kölcsönhatásba lépnek (heterogén lánc törés) vagy az égésgátlókkal való reakciójuk eredményeként.
Elágazó és elágazó láncú reakciók vannak. A lánc folytatásának reakcióiban elfogyasztott minden egyes aktív részecske elágazásánál egy újbóli megjelenés van. A kezdeti aktív részecskékre képződő termékmolekulák számát lánchossznak nevezzük. Az égési reakciókban lévő láncok hossza több százezer és tízmillió között mozog. Az elágazó láncreakciók sebességét befolyásolhatják az olyan anyagok kisebb keverékei, amelyek hatékonyan kölcsönhatásba lépnek az aktív részecskékkel, például az égésgátlókkal.
Egyes anyagok - iniciátorok - elősegítik az aktív részecskék képződését és ezáltal felgyorsítják az elágazó láncreakciókat.
Elágazó láncú reakciókban egy lánc folytatásával elfogyasztott aktív részecskék esetén két vagy több aktív részecskék képződnek. Az egyikük folytatja az elsődleges láncot, míg mások új láncokat kezdenek, elágazást alkotva (2.1. ábra).
"A rekombináció a semleges atomok vagy molekulák képződésének folyamata a feltöltött részecskékből. A rekombináció során képződött atomok és molekulák talajban vagy gerjesztett állapotban lehetnek.
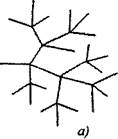
Ábra. 2.1. A reakcióláncok vázlatos ábrázolása:
a) a lánc minden egyes ágában elágazó
6) ritka elágazás
Például a láncindítási reakcióban a hidrogén égése során:
egy aktív atom képződik. A lánc folytatási reakciójában:

növekszik az aktív láncok száma, amelyek az új láncok kezdete.
Az elágazó láncreakciók álló állapotban folytatódhatnak, ahol az elágazás sebessége kisebb, mint az aktív részecskék halálozási sebessége, és nem álló helyzetben, ahol a halál lassabban fordul elő, mint az elágazás. Az utóbbi esetben a láncreakció sebessége exponenciálisan nő, és csak a kiindulási anyagok fogyasztása korlátozza. A helyhez kötött állapotból a nem stacionárius módba való átmenet hirtelen, a reakció körülményeinek enyhe változásával következik be: hőmérséklet, nyomás vagy az egyik reagens koncentrációja. Az ilyen gyors gyorsulást a reakcióelegy öngyulladásának vagy lánc robbanásnak tekintjük.
Az elágazó láncreakciók felfedezése nagy jelentőségű volt az égési folyamatok elméletének megteremtésében. Bizonyították, hogy kétféle gyújtás létezik: termikus és lánc. Beállított minták
2. fejezet. Kémiai folyamatok égő
a láncfolyamatok elmélete hatékonyan befolyásolhatja az égési folyamatok kialakulását és elnyomását a tüzek során.
A láncok eredete.A kezdeti aktív centrumok nukleációs folyamatának nagy szerepe van az elágazó láncreakciók kialakulásában. Ez kompenzálja az aktív centrumok elvesztését a láncvégződési reakciók során. Ez a mechanizmus meghatározza a helyhez kötött rendszer kialakulásának feltételeit az aktív központok felhalmozódásának kezdeti időszakában. Alacsony beindítási sebességgel ez az időszak jelentős lehet.
A lángokban bekövetkező kémiai reakciók többsége jelentős aktív tartalék energiával rendelkezik. Ilyen körülmények között az aktív központok elindítása a jelentős energiahatár leküzdéséhez kapcsolódik.
Ebben az esetben fontos szerepet játszanak az olyan tényezők, amelyek biztosítják az aktív központok jelentős előfordulását: kémiailag aktív adalékanyagok, sugárzás, elektromos kisülés, radioaktív bomlástermékek.
Az olyan tényezők közül, amelyek nagyban megkönnyítik az aktív centrumok létrehozását, heterogén reakciókat kell észlelni. A szilárd felületen adszorbeált éghető anyagok molekuláiban az interatomikus kötések gyengülnek, és törésük kevesebb energiát igényel. Ilyen körülmények között az aktív centrumok létrehozásának sebessége lényegesen magasabb, mint a gázmennyiségben. Az éghető keverék alkotórészeinek heterogén kölcsönhatásában az aktiválási energia is alacsonyabb, mint egy homogén. Az aktív központok heterogén indítása a tényleges égési folyamatok körülményei között fontos tényező az elágazó láncú folyamatokkal rendelkező álló rendszer gyorsított megvalósításában.
Egyes jellemzők az atomi komponensek részvételével előforduló, elágazó láncreakciókat jellemzik. Az aktív központokkal regenerálódás nélkül kölcsönhatásba lépő szennyeződések hiányában a láncvégződés csak akkor lehetséges, ha az atomok tripla ütközésekkel és a felszínen rekombinálódnak.
Bármelyik hőmérsékleten, minden gáz halmazállapotú anyagot részben elválasztanak. Néhány molekula atomokra bomlik. Ebben az esetben egyensúly van a disszociációs folyamatok és az atomok molekulák közötti összekapcsolódása között. A disszociáció mértéke exponenciálisan függ a hőmérséklettől.
Ha nincsenek szennyeződések a láncokat megszakító éghető keverékben, a reakció atom komponenseinek koncentrációja gyakorlatilag változatlan marad. A reakcióba bevitt atomok ugyanabban az esetben azonnal regenerálódnak
Korolchenko A.Ya. Égési és robbanási folyamatok
lichestve. A kezdeti indítás kompenzálja a reagált atomokat ugyanolyan mennyiségben, mint a nem reaktív rendszerben. A helyhez kötött reakció nem befolyásolja ezt a folyamatot. Ennek a módszernek a jellemzője a reakció egyik összetevőjének egyensúlya, amelyet a molekula atomjai közötti legkevésbé erős kötés jellemez. Egy másik atomkomponens koncentrációja ebben az esetben kvázisztikus, de nagyobb egyensúly.
Az égési reakciók homogén elindításával az álló rendszer csak bizonyos idő elteltével jön létre, mivel a disszociáció nagy aktiválási energiát igényel. Ebben az időszakban a disszociációs sebesség meghaladja a rekombinációs sebességet, és az aktív központok felhalmozódnak a reakciórendszerben. Mindkét folyamat sebességét csak az aktív centrumok egyensúlyának növelése után hasonlítják össze. Ezt az időtartamot indukciós időszaknak nevezzük.
Egy szilárd felület jelenléte katalizátorként a reakciózónában nem változtatja meg a termodinamikai egyensúly állapotát. A katalizátor egyformán befolyásolja az előremenő és a fordított reakciókat. Az aktív központok nem csak szilárd felületről származnak, hanem azt is megszakítják. A katalizátor jelenléte azonban felgyorsítja az egyensúlyi disszociációs állapot elérését.
Ha az éghető keverékben vannak olyan hatóanyagok, amelyek képesek részt venni a lánctörési reakciókban, csökkentik az aktív centrumok koncentrációját. Ebben az esetben a kezdeti komponensek egyikének egyensúlyi disszociációja zavar, ami lelassítja a reakciót, és annak megszűnéséhez vezethet.
A kísérletek azt mutatják, hogy ha egy külső forrásból (például fényforrásból) egy elágazó láncreakciót indít, az aktív centrumok koncentrációja az égési folyamat fejlesztésének kezdeti szakaszában jelentősen meghaladhatja az egyensúlyi szintet.
Az elágazó láncú reakciók során a kezdeti indítás feltételei jelentősen befolyásolják a reakció kialakulását. Lassan mozgó folyamatokban a részlegesen reagált keverék hozzáadása a kezdetihez csökkenti az indukciós periódust és felgyorsítja a láng égési pillanatát.
A láncok folytatása.Az elágazó láncreakciók jellegzetessége az aktív centrumok koncentrációjának kváziállósága. Nyílt áramkör hiányában az aktív részecskék képződnek
2. fejezet Kémiai folyamatok égés közben
ugyanolyan mennyiségben, amennyit költenek. Az újdonságok csak az első indításkor keletkeznek. Az aktív központok és a láncvégződés egyenlő előfordulási gyakoriságával az aktív központok állandó koncentrációja és egy álló reakciómód áll fenn. A reakciósebesség csökken, amikor a kezdeti komponensek elfogynak.
Elágazó láncú reakció esetén az aktív centrumok koncentrációja a reakcióképes rendszerben, függetlenül a kezdeti indítás feltételeitől. Végrehajtott öngyorsító reakciómód, amely lavina jellegű. Ebben az esetben a kezdeti komponensek teljes reakciójának végtermékké történő teljes átalakításához elegendő egy kezdeti aktív centrum.
Az elágazó értékes reakció kinetikai egyenlete a következő. A stabil kiindulási komponensek koncentrációjának változása az idő múlásával elhanyagolható az első közelítésre, és csak az aktív centrumok koncentrációjának gyorsabb változása vehető figyelembe. n.A sebesség változásait a kezdeti indítás sebessége és az elágazás és a láncvégződés reakciósebessége aránya határozza meg. A kezdeti indítási sebesség nem függ a rendszerben lévő aktív centrumok koncentrációjától. Az elágazási és törési folyamatok aránya arányos az aktív centrumok koncentrációjával. Ilyen körülmények között az aktív központok kialakulásának és kiadásának teljes egyensúlyát az iniciálás, az elágazás és a törés folyamatainak aránya határozza meg:
![]() (2.1)
(2.1)
ahol és az elágazási és törési reakciók sebesség konstansai. Jelölés, kapunk:
![]() (2.2)
(2.2)
Amikor az aktív centrumok koncentrációjának idő deriváltja
pozitív. A reakció sebessége idővel nő. Az elágazó láncú reakciók ez a jellemzője az ilyen központokban lévő aktív centrumok szaporodása, amikor az elágazó reakció sebessége meghaladja a láncvégző reakció sebességét.
Korolchenko A.Ya. Égési és robbanási folyamatok
Ha a reakció megkezdése előtt a rendszer nem tartalmaz aktív centrumokat, azaz at= 0, n = 0 (2.2) egyenlet integrálása:
![]() (2.3)
(2.3)
A CO teljes reakciósebességét az elágazási folyamat sebessége határozza meg. A végtermékeket csak a reakció során állítjuk elő. Minden elemi lánc elágazó esemény esetében a végtermék molekulái képződnek. Ez a következő:
![]() (2.4)
(2.4)
A láncreakció időbeli alakulását az elágazás és a láncvégződés reakciókoncentrációjának aránya határozza meg, és amikor a (2.4) egyenletben található exponens pozitív és újra
a cselekvés korlátlanul gyorsul. A reakció kialakulásának kezdeti időszakában a következő kapcsolat igaz:
Mivel a kezdeti beindítás sebessége kicsi, a kezdeti időszakban nincs észrevehető kémiai átalakulás. Egy idő után az érték lényegesen nagyobb lesz, mint egy. Ezután a (2.4) egyenletnek megfelelő reakciósebesség gyorsan növekszik, és eléri a nagyon nagy értékeket, bár gyakorlatilag észrevehető volt.
A láncreakció kialakulása során egy késleltetési periódus (indukciós periódus) jelenléte annak szükségessége, hogy bizonyos számú aktív centrumot fel kell gyűjteni a reagáló rendszerben. Csak ezután következik be a kémiai átalakulás.
Az indukciós periódus nagysága a láncreakciókban meghatározza az elágazási és a láncvégződési folyamatok arányát, nem pedig a kezdeti indítás sebességét. Az elágazási és törési reakciók sebessége az egyes reakciórendszerek kémiai jellemzőinek köszönhető, ezeket a hőmérséklet és a kiindulási komponensek koncentrációitól függően határozzák meg. A láncreakciók sajátossága
az, hogy az elágazási folyamatok jelentős aktiválási energiát igényelnek, míg a törési folyamat sebesség konstansának hőmérsékleti együtthatója közel nulla. Mindhárom típus láncainak megszüntetésének reakcióiban: ömlesztett és heterogén rekombinációk esetén az aktív szennyeződésekkel rendelkező radikálisok kölcsönhatásában az aktiválási energiák nulla.
A hőmérséklet emelkedésével, a keverék teljes nyomásával vagy a reagáló komponensek koncentrációjának változásával lehetséges az elágazás és a törés sebesség konstansának változása, amelynél a reakció álló helyzetből nem álló helyzetbe változik. Ennek a folyamatnak a sajátossága abban rejlik, hogy az egyik módból a másikba való hirtelen átmenet, amikor a reakciósebességet elhanyagolható értékről korlátlanul növekvő értékre változtatjuk.
Néhány láncreakció áramlását viszonylag stabil közbenső termékek képződése kísérte, de képesek aktív centrumok létrehozására. Ilyen reakciók például a szénhidrogén-égési reakciók, mint intermedierek, amelyekben peroxidokat és aldehideket képeznek. Ez a lánc elágazásához vezet. A közbenső termékek viszonylagos stabilitása miatt azonban a reakció gyorsulása az idő múlásával folyik. Az ilyen lassú elágazó láncokat degeneráltnak nevezik.
A láncreakciók a szokásos radikális elágazási mechanizmussal, általában a radikálisok nagy aktivitása miatt, elég gyorsak. Az így kapott radikálisok gyorsított reakciót kezdeményeznek, vagy rekombinálódnak és kilépnek az eljárásból.
Nyitott áramkör Az aktív részecskék, mint minden gázmolekula, véletlenszerű mozgásokat hoznak létre a reagáló rendszeren belül, ütközve más molekulákkal. Ugyanakkor van egy bizonyos valószínűsége egy másik aktív részecskével vagy molekulával való kölcsönhatás ütközésében és egy új aktív részecske képződésében, folytatva az előző útvonalat. A reakciólánc fejlődése hasonló az inert molekulák Brown-mozgásához, bár az aktív centrumok átruházása kémiai reakcióval jár. A lánc alternatív aktív központjainak két vagy több típusú fejlesztésének útján.
Korolchenko A.Ya. Égési és robbanási folyamatok
A reakciólánc addig folytatódik, amíg az aktív részecske regenerálódás nélkül nem reagál. Ebben az esetben az úgynevezett nyitott áramkör lép fel. A láncreakciók kinetikájában a törési folyamatok nagy szerepet játszanak. Az aktív központok halálához kétféle reakció létezik:
Homogén törés (halál a reakcióelegy térfogatában);
Heterogén törés (halál a szilárd felületen) A láncok homogén törése két eljárás egyikével lehetséges:
ha radikálisok rekombinálódnak, vagy ha különböző kémiailag aktív komponensek kölcsönhatásba lépnek az aktív központokkal az utóbbi regenerálása nélkül.
Heterogén lánc törés keletkezik az égéskor keletkező koromrészecskéknél vagy a szilárd égőanyagok felületén. A szilárd felületen lévő nyitott áramkör úgy tekinthető, mint az aktív centrumok diffúziója a gázkeverékből ezen a felületre, amelyen azok eltűnnek. A szilárd felületen végzett rekombináció mechanizmusa az, hogy az aktív részecskék, amelyek fokozott reaktivitással rendelkeznek, a felületre * beágyazódnak. A szomszédos helyeken sorbálódó gyökök rekombinálódnak egymással, mivel nincsenek energia- és térbeli akadályok ennek a folyamatnak. A rekombináció eredményeként képződött stabil vegyületek molekulái már nem vesznek részt a láncreakció kialakulásában.
Azonban az aktív részecskék szilárd felülettel való összeütközése nem vezet az adszorpciójához. Talán a felszínre visszaverődése. Az aktív központ szilárd felülettel való adszorpciójának valószínűségét elhelyezési együtthatónak nevezzük. Ez az együttható az aktív részecskék és a felület kémiai affinitásának jellemzője. Gyakorlatilag fontos esetekben a falról visszaverődés után az aktív részecske nem mozdul el messze. Valószínű, hogy új falak ütközik a falhoz, amíg a szállás meg nem történik. Ennek az eljárásnak köszönhetően bizonyos körülmények között a reakciósebesség gyakorlatilag független a tartózkodási tényezőtől. A folyamat az EU-val folytatódik
* Szorpció - egy környezetben lévő anyag egy szilárd test (vagy folyadék) felszívódása. Az abszorbeáló testet szorbensnek nevezik, felszívódik- szorbát. Megkülönböztesse a szorbens (abszorpció) és a felszíni réteg (adszorpció) teljes tömegének abszorpcióját. A szilárd szorbens és a szorbát felülete közötti kémiai típus kölcsönhatása miatt a szorpciót chemisorpciónak nevezik.
__________________________ 2. fejezet Kémiai folyamatok égés közben
ha minden ütközésnél nyitott áramkör történt. Az aktív centrumok koncentrációja a felületen nulla.
Aktív szennyeződések hiányában a reakcióelegyben a láncok törése akár szilárd felületeken, akár homogénen előfordulhat a tömbben lévő gyökök rekombinációjával. A valódi tüzeknél a második módszert főként végrehajtják.
A láncreakciók kinetikájához való bizonyos hatások az inert gázok reakciórendszerében adalékanyagokat tartalmaznak. Az inert adalékanyagok növelik az aktív részecskékkel való ütközések számát, növelik a lánc törés valószínűségét, és ezáltal gátolják a teljes reakciót.
A láncreakciók hatékonyabb gátlása a reaktív adalékanyagok - inhibitorok bejuttatásával érhető el. Az inhibitorok kölcsönhatásba lépnek az aktív centrumokkal, ami a reakciót megszakítja, és megszakítja a láncot. A gátolt keverékben a reakció kinetikáját az inhibitorok és a reakció fő komponensei közötti verseny körülményei határozzák meg az aktív centrumokkal való kölcsönhatás során. Az inhibitor nagy hatásfokával és az új aktív centrumok mérsékelt előfordulási sebességével már a kis gátló adalékok teljesen elnyomhatják a láncreakció lefolyását.
A gátlási folyamatok nagy jelentőséggel bírnak a tűz és robbanásbiztonság gyakorlatában. Az inhibitorok alkalmazása lehetővé teszi az égési folyamatok hatékony befolyásolását.
2.2. Kémiai folyamatok a hidrogén égése során
A hidrogén molekula és az oxigén molekula kölcsönhatása komplex módon halad át egymást követő lépések sorozatán keresztül. Most már határozottan megállapították, hogy a hidrogén égése egy láncmechanizmus révén történik, és a részecskék aktív centrumok szerepét töltik be. Az elemi reakciók szekvenciáját és jelentőségét a hidrogén égése során részletesen ismertetjük a hidrogén lángok kialakulásának és kialakulásának különböző körülményei között.
A hidrogénégés folyamatának leggyakoribb elemzését kísérleti és számítási módszerek alkalmazásával az N. sz. A folyamat következő rendszerét javasolta, beleértve a tizennégy alapvető elemi reakciót:
Korolchenko A.Ya. Égési és robbanási folyamatok
Az aktív centrumok eredete a reakció útján történik
![]()
A reakció láncának folytatása
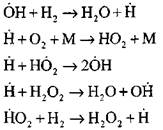
Elágazó láncok
 |
nyitott áramkör
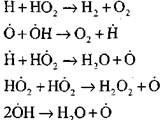 |
A hidrogénatomok koncentrációja az autoigníciós folyamat kezdeti szakaszában a kezdeti hidrogén tartalom jelentéktelen része. Egy láncreakció kialakulásával a molekuláris hidrogén átalakulási sebessége olyan magas lesz, hogy egy másodperc századában fogyasztják.
2.3. Kémiai reakciók szénmonoxid égésekor
A szén-monoxid és az oxigén közötti kölcsönhatás az égési folyamatok fő reakciója. Ennek a reakciónak a folyamata
__________________________ 2. fejezet Kémiai folyamats égő
sok esetben meghatározza a szén tartalmú anyagok égetésének törvényeit. A reakciót elágazó láncú mechanizmus jellemzi. Számos funkciója van.
Hosszú ideig azt hitték, hogy a CO és a 0 2 teljesen száraz keveréke nem tudott meggyulladni és égni. Azonban gondosan beállított kísérletek, amelyek során a víz hiányát tömegspektrográfiával figyelték meg, azt mutatják, hogy a száraz keveréknél is lehetséges a gyújtás. Meg kell jegyezni, hogy a CO + 0 2 vízgőz vagy hidrogén jelenléte a rendszerben aktiválja a gyújtási és égési folyamatot a lehetséges aktív központok számának növelésével. A víz felgyorsító hatása különösen alacsony koncentrációban érzékelhető.
A szén-monoxid égése vízgőz jelenlétében vagy kis mennyiségű hidrogénnel történik a következő elemi folyamatok részvételével: \\ t

A (VI) reakcióval képzett H2 csoportok folytathatják a láncot (VIII. Reakció), vagy a (IX-XII) reakcióval megszakíthatják.
A CO lassú oxidációjának láncrobbanássá való átalakulásának feltételeinek megítéléséhez meg kell becsülnünk, hogy a lánc megszakad-e a H02 csoportban; itt figyelembe vesszük, hogy a reakciók (X) és (XI) szerepe a lánc megszűnésében jelentéktelen lesz
összehasonlítva a (IX) reakcióval, mivel az (IX-XI) folyamatok 1000 K nagyságrendű hőmérséklet-állandói közel állnak egymáshoz, de a radikális koncentráció sokkal alacsonyabb, mint a hidrogénatomok koncentrációja, mivel a radikálisok nagyobb kémiai aktivitással rendelkeznek. Ezért a nyílt áramkör H0 2-n keresztüli valószínűsége a következő formában írható:
1000 K hőmérsékleten
Ezért, feltéve, hogy
![]()
![]()
nagyságrendű hatás
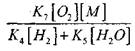
a (2.7) egyenlet megoldása gyenge lesz.
2. fejezet Kémiai folyamatok égés közben
Esetében ![]() vagy
vagy ![]() (ami megfigyelhető
(ami megfigyelhető
valódi lángok KI), a (2.7) egyenletet a következő formára konvertáljuk:
![]() (2.8)
(2.8)
Így a szénmonoxid levegőben való égésének feltétele nagyrészt a hidrogénégetés jelenléte és mintái határozzák meg. A CO (I) reakcióval történő oxidációja a hidrogénatomot tartalmazó reakciókban képződő OH-csoportok koncentrációjától függ.
A szén-monoxid égési reakciójának sajátossága abban rejlik, hogy gyorsan gátolja, ha kis adalékokat vezetnek be a hidrogénatomokkal nagy affinitású anyagok reaktív rendszerébe. Ilyen anyagok, amelyek gátolják a CO égését, szénhidrogének halogenidjei és halogénszármazékai. Gátló hatásuk a reakcióláncok végbemeneteléből adódik, amikor a reakció során hidrogénatomokkal lépnek kapcsolatba
2.4. Szénhidrogén égetés
A hidrogén és a szén-monoxid égési folyamatainak vizsgálata az égési reakciómechanizmus komplexitását mutatja. H 2 és CO esetében a reakció láncként megy végbe számos alapfokozat és közbenső termék részvételével. Ezért természetes, hogy a bonyolultabb anyagok - szénhidrogének - égési reakcióinak mechanizmusa még összetettebb, és ezeknek a vegyületeknek a gyújtási és égési folyamataival járó hatások változatosabbak.
A jelenleg rendelkezésre álló információk a szénhidrogének kémiai emelkedésének természetéről az égési folyamat során lehetővé teszik számunkra, hogy néhány közelítéssel elmagyarázzuk a megfigyelt hatásokat.
Megállapítást nyert, hogy a szénhidrogén lángokban, valamint a már ismert aktív részecskékben nagyszámú, összetettebb szerkezetű köztes termék van. Egyes esetekben az új láncok megjelenésének forrásaivá válnak. A szénhidrogének gyújtási és égési folyamataiban a fő szerepet a következő típusú köztes vegyületek játszanak:
Korolchenko A.Ya. Égési és robbanási folyamatok
1. Szénhidrogén gyökök, amelyek egy molekula
levodoroda, amely egy vagy több hidrogénatomot eltávolított. ezek
a maradékokat alkil-csoportnak nevezzük (CH3-metil; C 2H 5-etil; C3H7-propil és
stb.) Magas reakcióképessége miatt szabad alkilcsoportok
nem léteznek sokáig. A lángokban közepes
ÁLLAMI termékeket. Amikor más molekulákkal kölcsönhatásba lép, viselkedjen
mint független strukturális csoport. Szénhidrogén-gyökök
általában az R. betűvel van jelölve.
2. Peroxidok - R-00-R általános képletű vegyületek.
3. Aldehidek - típusú vegyületek
![]()
A legegyszerűbb aldehidek a hangyasav (formaldehid) és az ecetsav (acetaldehid). ![]() . Ezek az anyagok mind
. Ezek az anyagok mind
a szénhidrogének nem teljes égési termékeiben vannak jelen.
A szénhidrogének égése során a láncképződés bármely olyan reakció lehet, amelyben szénhidrogéncsoportok képződnek. Ez egy etánmolekula bomlási reakciója két szabad metilcsoport kialakulásával:
![]()
vagy egy szénhidrogén reakciója oxigénnel:
![]()
A láncok folytatása a képződési reakciók eredményeként következik be peroxid vagy hidroperoxid:
![]()
A hidroperoxid lebomlása során a forgó elágazást hajtjuk végre:
2. fejezet Kémiai folyamatok égés közben
A reakciók adott sorrendje a peroxidvegyületek koncentrációjának fokozatos növekedéséhez vezet a reagáló rendszerben.
Ezzel párhuzamosan a peroxidok, a radikálisok felhalmozódása és az indítás
léteznek párhuzamos reakciók:

Ezek a reakciók exotermek; amikor nagy mennyiségű hőt áramolnak.
A reakcióelegy hőmérsékletének növekedésével az aktív centrumok szerepe az egyik közbenső termékből a másikba jut, az alábbi sorrendben: alkil-hidroperoxidok, acil-hidroperoxidok, formaldehidek.
A reakcióelegy összetételének időbeli változásai kísérleti tanulmányai a magas hőmérsékletű tartományban (600-800 ° C) azt mutatják, hogy a kezdeti szénhidrogének végső égéstermékké történő átalakításának folyamata két szakaszra oszlik: az első, nagyon nagy sebességgel előforduló, oxidálja a szénhidrogéneket CO-nak. A második, lassú szakaszban a CO oxidálódik. Nagyon fontos következtetés következik: a szénhidrogének égetésére vonatkozó számos törvény magyarázható a szén-monoxid elégetésének jellemzőivel.
2.5. Szénégetés
A szénégetés heterogén eljárás mechanizmusa szerint megy végbe, amelynek sajátossága abban rejlik, hogy a kémiai stádium nem tekinthető elkülönítettnek a gáz halmazállapotú oxidálószer (levegő oxigénje) a környező térből az égő szilárd anyag felületére történő átvitelétől. Az égési sebesség a szén kémiai tulajdonságaitól és az oxigénnek az üzemanyag felületre történő adagolását meghatározó jellemzőktől függ. Az égési zónába történő oxigénellátást diffúzióval, és így azáltal, hogy az égéstérbe kerül
Korolchenko A.Ya. Égési és robbanási folyamatok
számos tényezőtől függ: az égő test alakja és mérete, a gáz halmazállapotú közeg mozgása, az oxigén diffúziós koefficiensei és a reakciótermékek mind az üzemanyagfelület felett, mind a szén és a koksz repedések és pórusok jelentős mennyiségben.
A heterogén szénégetés jellemzőinek szemléltetésére 900 ° C-ra melegített kemencében elhelyezett külön szénszálak viselkedését tekintjük. A kezdeti pillanatban a szén elégetése a felszínén található oxigén rovására történik. A felhasznált felület után egy égési termékréteg keletkezik a fűtött felület körül. Az égési sebesség csökken, és a folyamat megszűnik, ha a gázterület távolabbi területein nincs oxigén.
Ez az áramlás diffúzió útján történik, és az égési sebességet a diffúziós fluxus határozza meg. A diffúziós intenzitás nagymértékben függ az égő felület közelében lévő gázközeg mozgásának intenzitásától és jellegétől. A kémiai reakció sebességét elsősorban a hőmérséklet határozza meg. A heterogén reakciók, valamint a homogén reakciók betartják az Arre-nius törvényt.
Magas hőmérsékleten a szén oxidációs reakciója nagyon gyorsan megy végbe, és az eljárás teljes sebességét korlátozza az oxigén felületének diffúziója.
Így a szénégetés folyamata két különböző természetű folyamatból áll: a levegő oxigénjének a gázterületről a fogyasztás helyére történő szállítására és a szilárd szén felületével való kémiai kölcsönhatás folyamatára. Mindkét folyamat egymással összefügg, de mindegyiknek saját törvényei vannak. Ezek közül az egyik legfontosabb az oxigénfogyasztás folyamata, amelyet számos kémiai reakció jellemez.
Az oxigén és a szén kombinációjának komplex reakciómechanizmusa két CO és C02 oxid egyidejű kialakulását jelenti egy C X 0 Y típusú közbenső fiziko-kémiai komplexen keresztül, amely ezt követően CO és O. Az oxidok aránya az égési körülményektől függ. Ennek megfelelően az égő szén reakciójának egyenlete a következőképpen írható le:
2. fejezet Kémiai folyamatok égés közben
Ezután homogén reakció lép fel a szén-monoxid égetésével:
amelynek mechanizmusát a 2.3. fejezet tárgyalja.
Ez a reakció a szénfelület közelében történhet, ígyés a szén tömegében, pórusaiban és repedéseiben.
Egy másik reakció a meleg szén és a szén-dioxid közötti heterogén reakció:
![]()
Jól látható sebességgel áramlik az olyan helyeken, ahol oxigénhiány van, de ahol a szén hőmérséklete elég magas.
A leírt reakciók kombinációja meghatározza a szén égési termékeinek összetételét.
A KOMBINÁCIÓS FOLYAMATOK JELENTÉSE
| D |
a gyúlékony keverékekben történő öntözés öngyulladás, külső forrás által történő gyújtás vagy öngyulladás következhet be. Ha az öngyulladás és a gyújtás folyamatai jellemzőek a gáz halmazállapotú, folyékony vagy szilárd állapotban lévő anyagokra, akkor a spontán égés jellemző a szilárd anyagokra (különösen a finomra osztott állapotban) vagy a magas forráspontú folyadékokra, amelyek a fejlett felületű anyagokra oszlanak.
3.1. Öngyulladás. Helyhez kötött elmélet
A tűz egy ellenőrizetlen égés, amely időben és térben alakul ki, veszélyes az emberekre és anyagi kárt okoz.
Az emberek tűzveszélye a nyílt tűz, szikra, láz, mérgező égéstermékek, füst, csökkent oxigén, épületek vagy létesítmények összeomlása.
Az égés gyors fizikai-kémiai reakció, amelyhez hő és füst felszabadulása, a láng megjelenése vagy a füstölés lép fel. Normál körülmények között az égés az éghető anyag légköri oxigénnel való oxidálása vagy kombinálása. Néhány anyag (pl. Préselt acetilén, nitrogén-klorid, ózon) oxigén nélkül felrobbanhat a hő és a láng kialakulásához. Következésképpen az égés nemcsak a vegyület reakciójából, hanem a bomlásból is eredhet. Ismert, hogy a hidrogén és sok fém a klór, a réz kéngőzben, a magnézium szén-dioxidban stb.
A legveszélyesebb égés, amely egy éghető anyag oxigénnel való levegőn történő oxidációja során keletkezik. Szükséges egy olyan gyújtóforrás, amely képes biztosítani a szükséges mennyiségű energiát az üzemanyagrendszerre. A leggyakoribb gyújtóforrások a következők: szikrák, amelyek az elektromos berendezések meghibásodásakor, feltűnő fémtesteknél, hegesztésnél, kovácsolási munkáknál jelentkeznek; a súrlódás által termelt hő; technológiai fűtőberendezések; tűzoltó készülékek; az adiabatikus tömörítés hője; sztatikus elektromosság szikrakibocsátása; az elektromos érintkezők túlmelegedése; a hő felszabadulásával járó kémiai reakciók.
Ezeknek a forrásoknak a fűtési hőmérséklete más. Tehát a szikra, amely akkor keletkezik, amikor egy fémtest ütközik, akár 1900 ° C-os hőmérséklet is lehet, a mérkőzés lángja kb. 800 ° C-on, a csúszáskor a szállítószalag vezető dobja 600 ° C-ig terjed, és az elektromos kisülés hőjében a hőmérséklet eléri a 10 000 ° C-ot, majdnem azonnal kémiai reakciókkal.
Az égés teljes és hiányos lehet. Ha a teljes égés során oxigén feleslegben fordul elő, a reakciótermékek szén-dioxid, víz, nitrogén, kén-dioxid. Az elégtelen égés oxigénhiány miatt történik, ebben az esetben az égéstermékek mérgezőek és éghető anyagok - szén-monoxid, alkoholok, ketonok, aldehidek stb. Az éghető anyag teljes égéséhez szükséges mennyiségű levegő: 1 kg fa - 4,18, tőzeg - 5 , 8, propán - 23,8 m3.
Az égési folyamat az alábbiak szerint képzelhető el. Hideg éghető közeg hevítő impulzus bevezetésével felmelegszik, az éghető közeg oxigénnel és további hőelnyeléssel intenzíven oxidálódik. Ez viszont az éghető anyag szomszédos rétegének fűtéséhez vezet, amelyben intenzív kémiai reakció is bekövetkezik. Az éghető anyag ilyen rétegenként történő elégetésével az égési zóna mozog; Ennek a mozgásnak a sebessége határozza meg az égési folyamat intenzitását, és a legfontosabb jellemzője. A rétegenként történő fűtés, oxidáció és égés folyamata addig folytatódik, amíg az éghető anyag teljes mennyisége kimerül.
A keskeny zóna, amelyben az anyagot melegítik, és a kémiai reakció történik, láng elülsőnek nevezik.
Az éghető rendszerek kémiailag homogének és heterogének lehetnek. A kémiailag homogén rendszerek az éghető gázok, gőzök vagy porok levegővel alkotott keverékei, amelyekben az éghető anyag és a levegő egyenletesen elkeveredik. Az ilyen rendszerek égését homogénnek nevezzük. Kémiailag inhomogén rendszerekben az éghető anyag és a levegő nem keverhető össze, és van egy interfészük. Ezek gyakran szilárd éghető anyagok, és égésüket heterogénnek nevezik.
Az éghető keverék Tg elégetésének teljes ideje az éghető anyag és az oxigén közötti érintkezéshez szükséges idő és az idő, amely alatt a kémia maga történik, az τ x oxidációs reakció összege.
E két kifejezés arányától függően megkülönböztetjük a diffúziót és a kinetikus égést. A szilárd éghető anyagok égetésénél az oxigénnek az anyag felületére történő behatolásához szükséges idő sokkal hosszabb, mint a kémiai reakcióidő, ezért a teljes égési sebességet az oxigén diffúziójának sebessége határozza meg. Az ilyen anyagok égését leggyakrabban tűzvészeken találjuk, és diffúziósnak nevezzük. Az égést, amelynek mértékét a kémiai reakció sebessége határozza meg, kinetikusnak nevezzük. Ez a fajta égés a homogén éghető rendszerekre jellemző.
Megkülönböztetjük az égési kalorimetriás, elméleti és tényleges hőmérsékletet.
Az égés kalorimetriás hőmérséklete arra a hőmérsékletre utal, amelyre a teljes égésű termékeket melegítik, ha az összes felszabaduló hőt fűtésre fordítják, a levegő mennyisége elméletileg szükséges, az anyagok teljesen égnek és a kezdeti hőmérséklet 0 ° С. A hőveszteségek nulla. Ha az üzemanyag és a levegő kezdeti hőmérséklete 0 ° C, akkor az égés kalorimetriás hőmérséklete
![]()
ahol Qn az éghető anyag nettó fűtőértéke, kcal / kg; V az égéstermékek térfogata, m3 / kg; c az égéstermékek átlagos térfogati hőteljesítménye, kcal / m3 · deg.
Következésképpen a kalorimetriás égési hőmérséklet csak az éghető anyag tulajdonságaitól függ, és nem függ a mennyiségétől. Az elméleti égési hőmérséklet figyelembe veszi az égés során keletkező hőveszteséget az elválasztáshoz. A kalorimetriás égési hőmérséklet a legmagasabb egy éghető anyag esetében, és a minőségi értékeléshez használatos. Valójában az égés során a sugárzás, a felesleges levegő fűtése és a környezet miatt mindig hőveszteség keletkezik.
A tényleges égési hőmérséklet a tűzhőmérséklet. Megkülönböztesse a belső és külső tűz hőmérsékletét. A külső tűz hőmérséklete a láng hőmérséklete, és a belső hőmérséklet a füstöt a szobában. Tűz esetén keletkező tényleges hőmérséklet, ami a környezet hőveszteségéből, az égéstermékek és szerkezetek melegítéséből ered
mindig kevesebb, mint az elméleti érték 30 ... 50%. Például a benzin elméleti égési hőmérséklete 1730 ° C, és a tényleges hőmérséklet 1400 ° C.
Az éghető gőzök és gázok oxidálószerrel alkotott keveréke csak bizonyos mennyiségű tüzelőanyagot tud égetni benne.
Az éghető gáz legalacsonyabb koncentrációja, amelyen az égés már lehetséges, az alacsonyabb gyújtási határ (LEL). A legmagasabb koncentrációt, amelyen az égés még lehetséges, a felső gyújtási határértéknek (AIPW) nevezzük. A koncentráció azon területe, amely ezen határokon belül helyezkedik el, a gyújtási régiónak nevezik. A gyújtás egy tűz (az égés kezdete), amelyet láng megjelenése kísér. Ez egy állandó hosszú égés, amely még a gyújtóforrás eltávolítása után sem áll meg. Az alsó és felső gyújtási határértékek a levegő keverékének gáz, gőz és por tulajdonságaitól, az éghető keverékben lévő inert komponensek tartalmától függenek. Inert gázok hozzáadása az éghető keverékhez szűkíti a gyújtási területet és végül nem éghetővé teszi. Jelentősen szűkítjük a gyújtási határokat, néhány szennyeződést, amely lassítja az égési reakciót. Ezek közül a legaktívabb a halogénezett szénhidrogének. Mindkét jelzett tulajdonság az égés leállítására szolgál. A keverék légköri nyomás alatti nyomásának csökkentése szintén csökkenti a gyújtási területet, és bizonyos nyomáson a keverék nem éghető. Az éghető keverék nyomásának növelése növeli a gyújtási területet, de általában enyhén. Az éghető keverék hőmérsékletének növelése növeli a gyújtási területet. A gyújtás forrását befolyásolja a gyújtás koncentrációja is.
Nem csak a gyújtás koncentrációja, hanem a hőmérsékleti határok is vannak.
A levegőben lévő gőzök gyulladásának hőmérsékleti határértékei olyan éghető anyag hőmérsékletei, amelyekben a telített gőzök a gyújtás alacsonyabb vagy felső koncentrációjának megfelelő koncentrációkat képeznek. A gyújtási hőmérséklet az a legalacsonyabb hőmérséklet, amelynél az anyag meggyullad vagy elkezd szaggatni, és a gyújtóforrás eltávolítása után továbbra is ég vagy füstöl. A gyújtási hőmérséklet jellemzi az anyag öngyulladásának képességét. Ha egy anyag gyulladási hőmérséklete hiányzik, akkor azt lassú égésnek vagy nem éghetőnek nevezik.
Az oxidációs reakció gyorsulása a hőmérséklet hatására öngyulladáshoz vezet. A gyújtási eljárással ellentétben, ahol a térfogat csak korlátozott része - a felület - meggyullad, az öngyulladás az anyag teljes térfogatában történik. Az öngyulladási hőmérsékletet a legalacsonyabb hőmérsékletnek kell tekinteni, amelyre az anyagot fel kell melegíteni, hogy a további automatikus oxidáció következtében meggyulladjon. Az öngyulladás csak akkor lehetséges, ha az oxidációs folyamat során felszabaduló hőmennyiség meghaladja a környezetbe jutó hőt.
Az öngyulladási hőmérséklet egy anyagra nem állandó, mivel nagyban függ a meghatározás körülményeitől. Az összehasonlító adatok megszerzéséhez a tesztberendezést és a gázok és gőzök öngyulladási hőmérsékletének meghatározására szolgáló eljárást standardizálták (GOST 13920-68). A legalacsonyabb hőmérsékletet, amelyet a standard módszer határoz meg, amelyhez a gázok és gőzök levegővel való keverését egyenletesen kell melegíteni úgy, hogy külső gyújtóforrás behelyezése nélkül meggyulladjon, az úgynevezett standard öngyulladási hőmérséklet.
A spontán gyújtás egyfajta spontán égés, vagyis az önmelegedés következtében történő égés, gyújtóforrás hatása nélkül. A spontán gyulladás és a spontán égés közötti különbség a hőmérséklet nagyságában van. A spontán égés környezeti hőmérsékleten történik, és az öngyulladáshoz szükséges az anyag külső fűtése.

 A forró és hideg vízellátás számlálóinak jelzése
A forró és hideg vízellátás számlálóinak jelzése A különböző formájú és szerelvényű légcsatornák területének kiszámítása
A különböző formájú és szerelvényű légcsatornák területének kiszámítása Az égési folyamatok kémia. Robbanási energia
Az égési folyamatok kémia. Robbanási energia Mi fog történni, ha nem ad meg mérőszámokat
Mi fog történni, ha nem ad meg mérőszámokat