બર્નિંગ કહેવામાં આવે છે. દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
કેટલીક મૂળભૂત વ્યાખ્યાઓ
પરમાણુ અને પરમાણુઓની સંખ્યા સરળ રીતે વ્યક્ત કરવામાં આવે છે પદાર્થ જથ્થો કાં તો પદાર્થના મોલ્સની સંખ્યા. બાબતનો એક છિદ્ર 6.023 ∙ 10 23 કણો (પરમાણુ અને પરમાણુ) ને અનુરૂપ છે. નંબર એ એ = 6.023 ∙ 10 23 એમોલ -1 એ એવૉગડ્રો નંબર કહેવામાં આવે છે. મોલ અપૂર્ણાંક એક્સ હુંઘટક હું એ moles ની સંખ્યા ગુણોત્તર છે હું ઘટક હું moles n = Σ n ની કુલ સંખ્યા માટે હું મિશ્રણ ( એક્સ હું = એન હું / એન).
માસ મી પદાર્થની મૂળભૂત મિલકત (એસઆઈ સિસ્ટમમાં માપન એકમ કિલોગ્રામ છે). સામૂહિક અપૂર્ણાંક Wii એ સમૂહનો ગુણોત્તર છે મી ઘટક હું મિશ્રણના કુલ સમૂહમાં m = Σ મી હું (વાઇ = મી હું / એમ).
પરમાણુ વજન (અથવા પરમાણુ વજન) એમ હું(જી / એમઓએલ) ઘટક હું - આ ઘટકની એક છિદ્રનો સમૂહ છે. તેથી, પરમાણુ કાર્બન માટે, પરમાણુ હાઇડ્રોજન, ઓક્સિજન અને મિથેન માટે આપણી પાસે: એમ સી = 12 જી / એમોલ, એમ 2 = 2 જી / એમોલ, મો 2 = 32 જી / એમોલ, એમએન 4 = 16 જી / એમોલ. મિશ્રણનો સરેરાશ દાઢ સમૂહ એમ (જી / એમોલ) ઘટકોના દાઢ ભિન્નતાના સંદર્ભમાં વ્યક્ત કરી શકાય છે (એમ = એક્સ હું એમ).
દહન પ્રક્રિયાઓ નક્કી
બર્નિંગ - આ એક જટિલ ભૌતિક-રાસાયણિક પ્રક્રિયા છે જેમાં હાઇ તાપમાનના પ્રભાવ હેઠળ દહનક્ષમ પદાર્થો અને પદાર્થો ઓક્સિડાઇઝિંગ એજન્ટ (હવામાં ઓક્સિજન) સાથે રાસાયણિક ક્રિયાપ્રતિક્રિયામાં પ્રવેશ કરે છે, દહનના ઉત્પાદનોમાં ફેરવાય છે, અને જે તીવ્ર ગરમી અને પ્રકાશ ઉત્સર્જન સાથે હોય છે.
દહન પ્રક્રિયાની ઘટના માટે આવશ્યક શરતો:
જ્વલનશીલ પદાર્થ (જીવી) ની હાજરી;
ઑક્સિડાઇઝિંગ એજન્ટ (ઓ.) - હવા ઑક્સિજનની હાજરી;
ઇગ્નીશન (આઇ. ઝેડ) ના સ્રોતની હાજરી.
જ્વલનશીલ પદાર્થ ચોક્કસ ઉષ્ણતામાનને ગરમ કરવી જ જોઇએ જેના પર ઓક્સિડેશન પ્રક્રિયા શરૂ થશે;
ચોક્કસ તાપમાને જ્વલનશીલ પદાર્થને ગરમી આપવા માટે, ચોક્કસ ઇગ્નીશન સ્રોત શક્તિ આવશ્યક છે;
દહન પ્રક્રિયાને જાળવવા માટે, બળતણ અને ઓક્સિડેઝરની ચોક્કસ સાંદ્રતા આવશ્યક છે.
સૌથી મહત્વપૂર્ણ દહન પ્રક્રિયાઓ ગરમી અને સમૂહ સ્થાનાંતરણ છે. બર્નિંગની સૌથી સામાન્ય મિલકત એ જ્યોતની ઘટના છે અને તે જ્વલંત મિશ્રણમાં ગરમી સ્થાનાંતરિત કરીને અથવા કમ્બશન ઝોનમાંથી સક્રિય કણોને તાજા દહનશીલ મિશ્રણમાં ફેલાવીને તેને ગતિશીલ મિશ્રણમાં ખસેડી રહી છે.
ફ્લેમ્સ - આ બર્નિંગ એક દૃશ્યમાન અભિવ્યક્તિ છે. તેને બર્નિંગ ઝોન પણ કહેવામાં આવે છે. આ તે જગ્યાનો ભાગ છે જ્યાં દહનશીલ મિશ્રણનું પરિવર્તન સંપૂર્ણ અને અપૂર્ણ દહનના ઉત્પાદનોમાં થાય છે.
દહન પ્રક્રિયાના મુખ્ય પરિમાણો, મૃત્યુ તરફ દોરી જાય છે અને સામગ્રીને નુકસાન પહોંચાડે છે, તે છે:
મોટી માત્રામાં ગરમી;
ઉચ્ચ તાપમાન;
દહન ઉત્પાદનો ઝેરી રચના.
વાયુઓના પરમાણુ ગતિવિજ્ઞાન સિદ્ધાંતના દૃષ્ટિકોણથી દહન પ્રક્રિયા
ફિગ. 2.1. તાપમાન પર આધાર રાખીને સક્રિય અણુઓનો પ્રમાણ: ટી 2\u003e ટી 1
જ્યારે ગરમ ગેસમાં જ્વલનશીલ મિશ્રણ વધારાની ઊર્જા વધારે કરે છે.
સક્રિય સ્થિતિમાં અણુઓના સરેરાશ ઊર્જા સ્તર અને નિષ્ક્રિય રાજ્યના સરેરાશ સ્તર વચ્ચેના તફાવતને સક્રિયકરણ ઊર્જા કહેવામાં આવે છે. આ ગ્રાફિકલી (ફિગ. 2) રજૂ કરી શકાય છે.

ફિગ. 2.2. પ્રતિક્રિયા અભ્યાસક્રમની એનર્જી ડાયાગ્રામ જી.વી. + ઓ. પીજી: ઇ એક્ટ - સક્રિયકરણ ઊર્જા; ક્યૂ એક્સઆર - દહન પ્રતિક્રિયા થર્મલ અસર
"પ્રથમ" પ્રતિક્રિયા આપતા અણુઓની ક્રિયાપ્રતિક્રિયાને પરિણામે બહાર પાડવામાં આવેલી ઊર્જા પડોશી અણુમાં તબદીલ કરવામાં આવે છે. તેઓ ઉત્સાહિત છે, પ્રક્રિયા ખૂબ જ આવર્તન અને તીવ્રતાવાળા પ્રતિક્રિયા કરેલા પરમાણુઓની આસપાસ પુનરાવર્તન કરવામાં આવે છે. રાસાયણિક ક્રિયાપ્રતિક્રિયાના સંપૂર્ણ પ્રતિક્રિયા મિશ્રણ (2H 2 + O 2) ની સ્વયં-ગતિશીલ, સ્વયં-ગતિશીલતા, પાણીના પરમાણુઓના નિર્માણ અને પર્યાવરણમાં ગરમીને છોડવા સાથે અને લુમિનેસેંસ સાથે, એટલે કે. ઊભી થાય છે અને બર્નિંગ પ્રક્રિયા ફેલાવે છે.
ઇ એક્ટની સંખ્યાત્મક મૂલ્ય વધારે છે, આ ઘટકોના જોડીને રાસાયણિક ક્રિયાપ્રતિક્રિયામાં દાખલ કરવાનું વધુ મુશ્કેલ છે. તેથી, ઇ એક્ટનું મૂલ્ય આ રાસાયણિક સિસ્ટમના આગના ભયની ડિરેક્ટરના અણુ સૂચક છે.
પ્રકાર અને દહન ની સ્થિતિઓ
નીચેના પરિમાણો દ્વારા દહન વર્ગીકૃત કરી શકાય છે:
1. મિશ્રણ ઘટકોની મિશ્રણની સ્થિતિ અનુસાર:
એ) Kinetic - પૂર્વ મિશ્રિત ગેસ અથવા બાષ્પીભવન એર મિશ્રણ દહન. બળતણ અને ઓક્સિડેન્ટનું મિશ્રણ દહન માટે તૈયાર થાય છે ત્યાં સુધી તે દહન માટે તૈયાર થાય છે, દહન પ્રક્રિયાના કુલ દર દહનના રાસાયણિક પ્રતિક્રિયાના દર પર જ આધાર રાખે છે. જો આવા દહન બંધ અથવા મર્યાદિત જથ્થામાં થાય છે, તો વિસ્ફોટ થઈ શકે છે. કારણ કે મિશ્રણના દહન દરમિયાન મુક્ત થયેલ શક્તિમાં આ જથ્થાથી બહાર કાઢવામાં સમય નથી, દબાણ વધારીને, માળખાં નાશ થઈ શકે છે;
બી) પ્રસરણ, પ્રસરણ દહનને દહન કહેવામાં આવે છે, જ્યારે જ્વલનશીલ માધ્યમ (બળતણ અને ઓક્સિડેઝરનું મિશ્રણ) ની રચના દહન ઝોન અથવા દહન ઝોનમાં થાય છે.
2. રાસાયણિક પ્રતિક્રિયા ઝોનમાં દહન ઘટકોની પ્રાપ્તિની તીવ્રતા મુજબ:
એ) લેમિનર, જ્યારે દહન મિશ્રણના ઘટકો પ્રમાણમાં શાંત રીતે દહન ઝોન દાખલ કરે છે. આ કિસ્સામાં, રેનોલ્ડ્સના માપદંડનું આંકડાકીય મૂલ્ય, જે થર્મોડાયનેમિક શાસનને પાત્ર બનાવે છે, તે મહત્વપૂર્ણ (એક<2300).
બી) અસ્પષ્ટ, દહનશીલ મિશ્રણના ઘટકો સાથે હાઇ સ્પીડ પર દહન ઝોનમાં દાખલ થવું. આ કેસમાં રેનોલ્ડ્સનો નંબર 2300 થી વધુ છે.
3. દહનશીલ મિશ્રણના ઘટકોના એકત્રીકરણની સ્થિતિ અનુસાર:
એ) સમર્પિત બળતણ અને ઓક્સિડાઇઝર સમાન એગ્રીગ્રેટીવ રાજ્ય (વાયુ) માં છે;
બી) વિષુવવૃત્તીય (મલ્ટિફેઝ) - બળતણ અને ઓક્સિડેન્ટ વિવિધ એકત્રીકરણના રાજ્યોમાં છે.
4. દહનની રાસાયણિક પ્રતિક્રિયાના ક્ષેત્રના પ્રસારની ગતિ પર:
એ) રાસાયણિક પ્રતિક્રિયા ઝોન (0.5 થી 50 મીટર / સે ની ઝડપ) ની ડિફ્લેગ્રેશન (ધીમું) વિતરણ;
બી) ડિટોનેશન (વિસ્ફોટક), જ્યારે દહનની રાસાયણિક પ્રતિક્રિયાના ઝોનને આંચકો તરંગની ગતિ સાથે ફેલાવે છે (કેટલાક સેકટર પ્રતિ સેકન્ડ પ્રતિ સેકન્ડથી બીજા કિલોમીટર સુધી).
બાષ્પીભવન અથવા વાયુઓને બાળી નાખવાની જગ્યા કહેવાય છે જ્યોત દ્વારા .
લામિનેર પૂર્વ મિશ્રિત છે. પૂર્વ-મિશ્રિત મિશ્રણની લેમિનર જ્યોતમાં, બળતણ અને ઑક્સિડેન્ટ દહનની શરૂઆત પહેલા મિશ્રિત થાય છે અને પ્રવાહ લૅમિનર હોય છે.
પૂર્વ-મિશ્રિત મિશ્રણની જ્યોત કહેવામાં આવે છે stoichiometric જો ઇંધણ (હાઇડ્રોકાર્બન) અને ઓક્સિડેઝર (ઓક્સિજન - ઓ 2) એકબીજાને સંપૂર્ણ રીતે વાપરે છે, કાર્બન ડાયોક્સાઇડ (સીઓ 2) અને પાણી (એચ 2 ઓ) બનાવે છે. જો બળતણ વધારે હોય, તો તેઓ કહે છે કે મિશ્રણ સમૃદ્ધ છે, અને જો ત્યાં ઓક્સિડેન્ટ વધારે હોય, તો તેઓ કહે છે કે મિશ્રણ ગરીબ છે.
સરળ ઉદાહરણો ધ્યાનમાં લો:
1) 2 એચ 2 + ઓ 2 → 2 એચ 2 ઓ - સ્ટેચિઓમેટ્રિક મિશ્રણ,
2) ЗН 2 + ઑ 2 → 2H 2 ઑ + ન 2 - સમૃદ્ધ મિશ્રણ (વધુ 2 માં)
3) સી.એચ. 4 + ઝેડ 2 + 2 એચ 2 ઓ + સીઓ 2 + ઓ 2 - લીન મિશ્રણ (વધારે 2 O).
આવા રાસાયણિક પ્રતિક્રિયા સમીકરણમાં પ્રત્યેક પ્રતીક પદાર્થના એક છિદ્ર સાથે મેળ ખાય છે. આમ, આ સમીકરણોમાંથી પ્રથમ અર્થ એ છે કે H 2 ની બે ભીંગડા O 2 ની એક છિદ્ર સાથે પ્રતિક્રિયા આપે છે જેથી H 2 O ના બે મોલ્સ બને છે.
જો રાસાયણિક પ્રતિક્રિયા સમીકરણ એવી રીતે લખવામાં આવે છે કે તે માત્ર બળતણના એક છિદ્રની પ્રતિક્રિયા વર્ણવે છે, તો સ્ટિઓચિઓમેટ્રિક મિશ્રણમાં બળતણનો છિદ્ર અપૂર્ણાંક સરળતાથી સંબંધથી નક્કી કરી શકાય છે.
એક્સ પર્વતો, stokh = 1 / ((1 + વી)
અહીં વીcO 2 અને H 2 O ની રચના સાથે પ્રતિક્રિયા સમીકરણમાં O 2 ની મોલ્સની સંખ્યા સૂચવે છે. ઉદાહરણ એ છે પ્રતિક્રિયા
એચ 2 + 0.5 ઓ 2 → એચ 2 ઓ, વી = 0.5, એક્સ એચ 2, સ્ટૉક = 2/3
જો ઓક્સિડેઝર હવા હોય, તો તે ધ્યાનમાં લેવું જોઈએ કે સુકા હવામાં ફક્ત 21% ઓક્સિજન, તેમજ 78% નાઇટ્રોજન અને 1% ઉમદા ગેસ છે. આમ, હવા માટે, એક્સ એન 2 = 3.762 એક્સ ઓ 2. અહીંથી હવા સાથે સ્ટેચોઇમેટ્રિક મિશ્રણ માટે દાઢ ભિન્નતા સમાન હશે
એક્સ પર્વતો, stokh = 1 / (((1 + વી ∙ 4.762), ![]() ,
,
ક્યાં વી પહેલાનો અર્થ એ છે કે બળતણના એક છિદ્રના CO 2 અને H 2 O માં સંપૂર્ણ રૂપાંતરણની પ્રતિક્રિયા સમીકરણમાં O 2 ની મોલ્સની સંખ્યાનો અર્થ છે. મૂલ્યોના કેટલાક ઉદાહરણો વી અને હવા સાથે ઇંધણના સ્ટિઓકોમેટ્રિક મિશ્રણ માટે બળતણના દાઢ ભિન્નતા કોષ્ટક 1 માં બતાવવામાં આવે છે.
ઇંધણ અને હવાના પૂર્વ-મિશ્રિત મિશ્રણો (આ કિસ્સામાં, પ્રતિક્રિયા સમીકરણમાં યોગ્ય એન 2 ને ઉમેરવામાં આવશ્યક છે, કોષ્ટક 1 જુઓ) હવા માટે સમાન ગુણોત્તર દ્વારા વર્ગીકૃત કરવામાં આવે છે:
λ = (x ડબલ્યુ / એક્સ પર્વતો) / (એક્સ ડબલ્યુ, સ્ટોચ / એક્સ પર્વતો, સ્ટોહ) = (ડબલ્યુ ડબલ્યુ / ડબલ્યુ પર્વતો) / (ડબલ્યુ ડબલ્યુ, સ્ટોચ / ડબલ્યુ પર્વતો, સ્ટૉક)
અથવા પારસ્પરિક - ઇંધણ માટે સમાન ગુણોત્તર એફ (એફ = 1 / λ). મૂલ્ય દ્વારા મિશ્રણના દાઢ ભિન્નતાની તીવ્રતા નક્કી કરવામાં સમર્થ થવા માટે આ સૂત્રને રૂપાંતરિત કરી શકાય છે એફ:
એક્સ પર્વતો = 1 / ((1+ (4,762 ∙ વી) / એફ), x ડબલ્યુ = 1 - એક્સ પર્વતો,
એક્સ વજન / 4,762, = ∙ 3,762
વી મૂલ્યો અને બળતણના છિદ્ર અપૂર્ણાંકના ઉદાહરણો એક્સ હવા સાથે ઇંધણના stoichiometric મિશ્રણ માટે પર્વતો, stoichi
સિંચાઇ હંમેશાં રાસાયણિક પરિવર્તન સાથે હોય છે. હવામાં દહન - ઑક્સિજન સાથે જ્વલનશીલ પદાર્થની ક્રિયાપ્રતિક્રિયા. જો કે, તે ધ્યાનમાં રાખવું જોઈએ કે નાઇટ્રોજન, હલાઇડ્સ અને ઓઝોનનું ઑકસાઈડ દહન પ્રક્રિયામાં ઑક્સીડાઇઝર્સ તરીકે કાર્ય કરી શકે છે. જાણીતા દહન પ્રક્રિયાઓ ઉત્પાદનના ફક્ત એક જ સ્રોતની ભાગીદારીને કારણે થાય છે - ઝડપી વિકલાંગતા માટે સક્ષમ સંયોજનો. આવા સંયોજનોના ઉદાહરણો એસેટીલીન અને હાઇડ્રાઝાઇન છે.
દહન દરમિયાન થતી કેમિકલ પ્રક્રિયાઓ અત્યંત જટિલ છે. સરળ કેસ માટે પણ - ઑક્સિજનમાં હાઇડ્રોજનનું દહન, જેનું સામાન્યકરણ સમીકરણ સ્વરૂપ ધરાવે છે.
2H 2 + 0 2 = 2H 2 0,
કેટલાક ડઝન પ્રારંભિક તબક્કાઓ અધ્યયન અને અભ્યાસ કરવામાં આવ્યા છે.
આજે, હાઈડ્રોજન, કાર્બન મોનોક્સાઇડ, મીથેન અને એથેન જેવી માત્ર થોડા જ પદાર્થોના દહન દરમિયાન રાસાયણિક પરિવર્તનની પદ્ધતિઓનો વિગતવાર અભ્યાસ કરવામાં આવ્યો છે. આ જ્ઞાનનો ઉપયોગ ઘણા પદાર્થોના ઇગ્નીશન અને દહનની સ્થિતિઓની આગાહી કરવા માટે થાય છે.
2.1. ચેઇન પ્રતિક્રિયાઓ
ચેઇન પ્રતિક્રિયાઓ, સામાન્ય રાસાયણિક પરિવર્તનોથી વિપરીત, સક્રિય કણોના દરેક પ્રારંભિક કાર્યમાં દેખાવ દ્વારા વર્ગીકૃત કરવામાં આવે છે: એક અણુ ઇલેક્ટ્રોન સાથેનું પરમાણુ, મુક્ત રેડિકલ અથવા આયન. સક્રિય કણોના દેખાવથી પ્રારંભિક પદાર્થોની પરિવર્તનની સાંકળ પ્રતિક્રિયા ઉત્પાદનોમાં પરિણમે છે. અણુઓ, મુક્ત રેડિકલ અને આયનો વેલેન્સ-સેચ્યુરેટેડ અણુઓ કરતાં વધુ પ્રતિક્રિયાશીલ હોય છે. તેથી, રાસાયણિક બોન્ડ્સ અને સક્રિય કણોના રચનાને તોડવા માટે જરૂરી ઉર્જાની કિંમતના હોવા છતાં પ્રતિક્રિયાના ચેઇન ડેવલપમેન્ટ પરમાણુ વચ્ચેની સીધી ક્રિયાપ્રતિક્રિયા કરતા વધુ લાભદાયી રીતે ફાયદાકારક બને છે.
દહન પ્રક્રિયા મુખ્યત્વે ચેઇન મિકેનિઝમ દ્વારા થાય છે. સાંકળ પ્રતિક્રિયાઓ - વિવિધ તબક્કામાં થાય છે તે જટિલ પ્રતિક્રિયાઓ, રજૂ કરે છે:
સાંકળો (દીક્ષા) ની ઉત્પત્તિ, જેમાં સક્રિય કણો બનાવવામાં આવે છે;
સાંકળો ચાલુ રાખવા, જેમાં સક્રિય કણો પ્રારંભિક સામગ્રી સાથે રાસાયણિક ક્રિયાપ્રતિક્રિયામાં દાખલ થાય છે, જેના પરિણામે નવા સક્રિય કણો બને છે;
ચેઇન્સનું તૂટવું જેમાં સક્રિય કણોની "મૃત્યુ" અંતિમ પ્રતિક્રિયા ઉત્પાદનોની રચના સાથે થાય છે
સાંકળોનો મૂળ વિવિધ પરિસ્થિતિઓમાં થઈ શકે છે. ઉદાહરણ તરીકે, ઇલેક્ટ્રિક ડિસ્ચાર્જમાં થર્મલ એનર્જી અથવા આયનોઇઝેશન રેડિયેશનની ક્રિયા હેઠળના અણુના વિસર્જનને પરિણામે. જ્યારે સક્રિય કણો સખત સપાટીઓ (ભિન્ન શ્રૃંખલા તોડવા) અથવા દહન અવરોધક સાથેની તેમની પ્રતિક્રિયાના પરિણામે સક્રિય કણો સંપર્ક કરે છે ત્યારે સક્રિય કણોનું મૃત્યુ થાય છે ત્યારે, જ્યારે તેઓ મુક્ત રેડિકલ્સ (એકીકૃત સાંકળ તોડે છે) સાથે સંપર્ક કરે છે ત્યારે સક્રિય કણોનું પુનરાવર્તન થાય છે.
ત્યાં અનબ્રાંડેડ અને બ્રાન્ડેડ ચેઇન પ્રતિક્રિયાઓ છે. સાંકળ ચાલુ રાખવા પ્રતિક્રિયાઓમાં વપરાતા પ્રત્યેક સક્રિય કણો માટે અનબ્રાંડેડમાં, એક ફરીથી ઉભરતા રહે છે. પ્રારંભિક સક્રિય કણો દીઠ બનેલા ઉત્પાદન પરમાણુઓની સંખ્યાને સાંકળની લંબાઈ કહેવામાં આવે છે. દહન પ્રતિક્રિયાઓમાં સાંકળોની લંબાઇ હજારોથી દસ લાખથી લઈને કરોડો સુધીની છે. અનબ્રાંડેડ સાંકળ પ્રતિક્રિયાઓના પદાર્થો પદાર્થોના નાનાં પ્રવેશ દ્વારા પ્રભાવિત થઈ શકે છે જે સક્રિય કણો સાથે અસરકારક રીતે ક્રિયાપ્રતિક્રિયા કરી શકે છે, જેમ કે દહન અવરોધક.
કેટલાક પદાર્થો - પ્રારંભિક - સક્રિય કણોના નિર્માણને સરળ બનાવે છે અને તે રીતે અનબ્રાંડેડ સાંકળ પ્રતિક્રિયાઓ વેગ આપે છે.
બ્રાન્ડેડ શૃંખલા પ્રતિક્રિયાઓમાં એક સક્રિય કણો, સાંકળની સાતત્ય સાથે ખવાય છે, બે અથવા વધુ સક્રિય કણો બનાવવામાં આવે છે. તેમાંથી એક પ્રાથમિક ચેઇન ચાલુ રાખે છે, જ્યારે અન્ય શાખાઓ બનાવતી નવી ચેઇન્સ શરૂ કરે છે (અંજીર 2.1).
"રીકોમ્બિનેશન એ ચાર્જ કણોમાંથી તટસ્થ અણુઓ અથવા પરમાણુઓની રચનાની પ્રક્રિયા છે. પુનર્નિર્માણ દરમિયાન બનેલા પરમાણુ અને પરમાણુઓ જમીન અથવા ઉત્સાહિત સ્થિતિમાં હોઈ શકે છે.
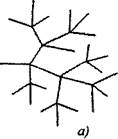
ફિગ. 2.1. પ્રતિક્રિયા સાંકળોની યોજનાકીય રજૂઆત:
એ) સાંકળની દરેક લિંકમાં શાખાઓ
6) દુર્લભ શાખાઓ
ઉદાહરણ તરીકે, ચેઇન દીક્ષા પ્રતિક્રિયામાં હાઇડ્રોજનના દહન દરમિયાન:
સક્રિય અણુ રચાય છે. સાંકળ સતત પ્રતિક્રિયામાં:

ત્યાં સક્રિય અણુઓની સંખ્યામાં વધારો થયો છે જે નવી ચેઇન્સની શરૂઆત છે.
બ્રાન્ડેડ ચેઇન પ્રતિક્રિયા સ્થિર સ્થિતિમાં ચાલુ થઈ શકે છે, જેમાં શાખાઓની ગતિ સક્રિય કણોની મૃત્યુ દર કરતાં ઓછી હોય છે અને બિન-સ્થિર સ્થિતિમાં, જેમાં શાખા કરતાં વધુ ધીમે ધીમે મૃત્યુ થાય છે. પછીના કિસ્સામાં, સાંકળ પ્રતિક્રિયાની ઝડપ ઝડપથી વધે છે અને પ્રારંભિક સામગ્રીના ઉપયોગ દ્વારા મર્યાદિત છે. સ્ટેશનરીથી નોન-સ્ટેશનરી મોડથી સંક્રમણ, પ્રતિક્રિયાઓની સ્થિતિમાં થોડો ફેરફાર સાથે અચાનક જ થાય છે: પ્રતિક્રિયાઓમાંથી તાપમાન, દબાણ અથવા એકાગ્રતા. આવા ઝડપી પ્રવેગકને પ્રતિક્રિયા મિશ્રણ અથવા ચેઇન વિસ્ફોટની સ્વ-ઇગ્નીશન તરીકે ગણવામાં આવે છે.
બ્રાન્ડેડ ચેઇન પ્રતિક્રિયાઓની શોધ દહન પ્રક્રિયાના સિદ્ધાંતની રચના માટે ખૂબ જ મહત્વપૂર્ણ હતી. તે સાબિત થયું છે કે બે પ્રકારની ઇગ્નીશન છે: થર્મલ અને સાંકળ. પેટર્ન સેટ
પ્રકરણ 2. પર રાસાયણિક પ્રક્રિયાઓ બર્નિંગ
સાંકળ પ્રક્રિયાઓનો સિદ્ધાંત, આગના સમયે દહન પ્રક્રિયાઓના વિકાસ અને દમનને અસરકારક રીતે પ્રભાવિત કરી શકે છે.
સાંકળોનો મૂળ.પ્રારંભિક સક્રિય કેન્દ્રોના ન્યુક્લિયેશનની પ્રક્રિયા અનબ્રાંડેડ સાંકળ પ્રતિક્રિયાઓના વિકાસમાં મોટી ભૂમિકા ભજવે છે. તે સાંકળ સમાપ્તિ પ્રતિક્રિયાઓ દરમિયાન સક્રિય કેન્દ્રોના નુકસાન માટે વળતર આપે છે. આ મિકેનિઝમ સક્રિય કેન્દ્રોના સંગ્રહની પ્રારંભિક અવધિમાં સ્થાયી શાસનની રચના માટેની શરતોને નિર્ધારિત કરે છે. પ્રારંભિક પગલા સાથે, આ સમયગાળો મહત્વપૂર્ણ હોઈ શકે છે.
જ્યોતમાં મોટા ભાગની રાસાયણિક પ્રતિક્રિયાઓ સક્રિય કેન્દ્રોનું નોંધપાત્ર ઊર્જા અનામત ધરાવે છે. આ સ્થિતિમાં, સક્રિય કેન્દ્રોની શરૂઆત નોંધપાત્ર ઉર્જા અવરોધને દૂર કરવા સાથે સંકળાયેલી છે.
આ કિસ્સામાં, મહત્ત્વની ભૂમિકા એવા પરિબળો દ્વારા ભજવવામાં આવે છે જે સક્રિય કેન્દ્રોના ઉદભવની નોંધપાત્ર દરને ખાતરી કરે છે: રાસાયણિક રીતે સક્રિય ઉમેરણો, કિરણોત્સર્ગ, વિદ્યુત સ્રાવ, કિરણોત્સર્ગી ક્ષાર ઉત્પાદનો.
સક્રિય કેન્દ્રોની જનરેશનને મોટેભાગે સરળતા આપતા પરિબળોમાં, વિષમ પ્રતિક્રિયાઓ ધ્યાનમાં લેવી જોઈએ. ઘન સપાટી પર શોષી શકાય તેવા જ્વલનશીલ પદાર્થોના અણુઓમાં, ઇન્ટરટોમિક બોન્ડ નબળી પડી જાય છે અને તેમના તોડવા માટે ઓછા ઊર્જા ખર્ચની જરૂર પડે છે. આ સ્થિતિમાં, સક્રિય કેન્દ્રો બનાવવાની દર ગેસના જથ્થા કરતાં નોંધપાત્ર રીતે વધારે છે. જ્વલનશીલ મિશ્રણના ઘટકોના ભિન્ન ક્રિયાપ્રતિક્રિયામાં સક્રિયકરણ ઉર્જા એ એકરૂપતાની સ્થિતિમાં કરતા પણ ઓછું છે. અસંખ્ય સાંકળ પ્રક્રિયાઓ સાથે સ્થાયી શાસનની ઝડપી સિદ્ધિઓમાં વાસ્તવિક દહન પ્રક્રિયાઓની પરિસ્થિતિઓ હેઠળ સક્રિય કેન્દ્રોની વિઘટનની શરૂઆત એ એક મહત્વપૂર્ણ પરિબળ છે.
કેટલાક લક્ષણો અણુ સાંકળ પ્રતિક્રિયાઓ દર્શાવે છે જે પરમાણુ ઘટકોની ભાગીદારી સાથે થાય છે. સક્રિય કેન્દ્રો સાથે પુનર્જીવન વિના અશુદ્ધિઓની ગેરહાજરીમાં, ચેઇન સમાપ્તિ ફક્ત ત્યારે જ શક્ય બને છે જ્યારે ત્રિકોણ અથડામણ અને સપાટી પર અણુઓ ફરીથી બને છે.
કોઈપણ તાપમાને, તમામ વાયુ પદાર્થો આંશિક રીતે અલગ થઈ જાય છે. કેટલાક પરમાણુ અણુઓમાં તૂટી જાય છે. આ કિસ્સામાં, વિનિમયની પ્રક્રિયાઓ અને પરમાણુઓમાં અણુઓના જોડાણ વચ્ચે સંતુલન છે. ડિસોસીએશનની માત્રા તાપમાન પર આધારિત છે.
જો જ્વલનશીલ મિશ્રણમાં કોઈ અશુદ્ધિ હોય તો સાંકળો તોડી નાખે છે, પ્રતિક્રિયાના પરમાણુ ઘટકોની સાંદ્રતા વ્યવહારિક રૂપે અપરિવર્તિત રહે છે. પ્રતિક્રિયામાં દાખલ થયેલા પરમાણુ તરત જ પુનર્જીવિત થાય છે
Korolchenko એવાય. દહન અને વિસ્ફોટ પ્રક્રિયાઓ
લીચી પ્રારંભિક દીક્ષા પ્રતિક્રિયાત્મક અણુઓને બિન-પ્રતિક્રિયાત્મક પ્રણાલીમાં જેટલી જ રકમમાં સરભર કરે છે. સ્થિર પ્રક્રિયા આ પ્રક્રિયાને અસર કરતી નથી. પ્રતિક્રિયાના ઘટકોમાંના એકનું સંતુલન, જે પરમાણુમાં પરમાણુ વચ્ચેના ઓછામાં ઓછા મજબૂત બંધનથી અલગ છે, તે આ મોડની લાક્ષણિકતા છે. આ કિસ્સામાં અન્ય પરમાણુ ઘટકની એકાગ્રતા ક્યુસિસ્ટનેશનરી છે, પરંતુ વધુ સંતુલન છે.
દહન પ્રતિક્રિયાઓની સમાન પ્રારંભ સાથે, સ્થાયી શાસન ફક્ત અમુક ચોક્કસ સમયગાળા પછી જ સ્થપાયેલી હશે, કારણ કે વિસર્જનને મોટી સક્રિયકરણ ઊર્જાની જરૂર છે. આ સમયગાળા દરમિયાન, ડિસોસીએશન રેટ રીકોમ્બિનેશન રેટ કરતા વધી જાય છે, અને સક્રિય કેન્દ્રો પ્રતિક્રિયા પ્રણાલીમાં એકત્રિત થાય છે. બન્ને પ્રક્રિયાઓની દરો ફક્ત સક્રિય કેન્દ્રોના સંતુલનને સંતુલિત કરવાના વધારા પછી જ સરખામણી કરવામાં આવે છે. આ સમયગાળાને ઇન્ડક્શન અવધિ કહેવામાં આવે છે.
પ્રતિક્રિયા ઝોનમાં ઉત્પ્રેરક તરીકે સખત સપાટીની હાજરી થર્મોમીનેમિક સંતુલનની સ્થિતિમાં બદલાતી નથી. ઉત્પ્રેરક આગળ અને પ્રતિકૂળ પ્રતિક્રિયાઓને સમાન રીતે અસર કરે છે. સક્રિય કેન્દ્રો માત્ર નક્કર સપાટી પર જ ઉદ્ભવતા નથી, પણ તેના પર તૂટી જાય છે. જો કે, ઉત્પ્રેરકની હાજરી સંતુલન વિઘટન સ્થિતિની પ્રાપ્તિને વેગ આપે છે.
જો સક્રિય પદાર્થો જ્વલનશીલ મિશ્રણમાં હાજર હોય છે, જે સાંકળ તોડવા પ્રતિક્રિયાઓમાં ભાગ લઈ શકે છે, તે સક્રિય કેન્દ્રોની સાંદ્રતાને ઘટાડે છે. આ કિસ્સામાં, પ્રારંભિક ઘટકોમાંથી એકનું સંતુલન વિસર્જન વિક્ષેપિત થાય છે, જે પ્રતિક્રિયા ધીમું કરે છે અને તેના સમાપ્તિ તરફ દોરી શકે છે.
પ્રયોગો દર્શાવે છે કે જ્યારે બાહ્ય સ્રોત (ઉદાહરણ તરીકે, પ્રકાશ સ્રોત) દ્વારા અનબ્રાંડેડ ચેઇન પ્રતિક્રિયા શરૂ કરવામાં આવે ત્યારે, દહન પ્રક્રિયા વિકાસના પ્રારંભિક તબક્કામાં સક્રિય કેન્દ્રોની સાંદ્રતા સંતુલન એક કરતાં નોંધપાત્ર રીતે વધી શકે છે.
બ્રાન્ડેડ ચેઇન પ્રતિક્રિયાઓ દરમિયાન, પ્રારંભિક પ્રારંભની શરતોની પ્રતિક્રિયાના વિકાસ પર નોંધપાત્ર અસર પડે છે. ધીમી ગતિએ ચાલતી પ્રક્રિયાઓમાં, પ્રારંભિકમાં આંશિક રીતે પ્રતિક્રિયાયુક્ત મિશ્રણનો ઉમેરો, ઇન્ડક્શન સમયગાળો ટૂંકાવે છે અને જ્યોત દહનના ક્ષણને વેગ આપે છે.
સાંકળો ચાલુ.અનબ્રાંડેડ સાંકળ પ્રતિક્રિયાઓની લાક્ષણિકતા એ સક્રિય કેન્દ્રોની સાંદ્રતાના અર્ધ-સ્થિરતા છે. ઓપન સર્કિટની ગેરહાજરીમાં સક્રિય કણો બનાવવામાં આવે છે
પ્રકરણ 2. દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
તે જ રકમ જેમાં તેઓ ખર્ચવામાં આવે છે. નવા પ્રારંભિક પ્રારંભમાં જ ઊભી થાય છે. સક્રિય કેન્દ્રો અને સાંકળ સમાપ્તિની સમાન દર સાથે, સક્રિય કેન્દ્રોની સતત એકાગ્રતા અને સ્થિર પ્રતિક્રિયા મોડની સ્થાપના કરવામાં આવે છે. પ્રારંભિક ઘટકોનો વપરાશ થાય છે તેમ પ્રતિક્રિયા દર ઘટશે.
બ્રાન્ડેડ શૃંખલાની પ્રતિક્રિયાના કિસ્સામાં, પ્રતિક્રિયા પ્રણાલીમાં સક્રિય કેન્દ્રોની સાંદ્રતા તેમના પ્રારંભિક પ્રારંભની શરતોને ધ્યાનમાં લીધા વગર વધી જાય છે. આત્મ-પ્રવેગક પ્રતિક્રિયા મોડ અમલમાં મૂક્યો, જેમાં હિમપ્રપાત પાત્ર છે. આ કિસ્સામાં, પ્રતિક્રિયાના અંતિમ ઉત્પાદનોમાં પ્રારંભિક ઘટકોના સંપૂર્ણ રૂપાંતર માટે, એક પ્રારંભિક સક્રિય કેન્દ્ર પૂરતો છે.
નીચે પ્રમાણે બ્રાંચેડ મૂલ્યવાન પ્રતિક્રિયાના ગતિિક સમીકરણ છે. સમય સાથે સ્થાયી પ્રારંભિક ઘટકોના સાંદ્રતામાં ફેરફાર પ્રથમ અનુમાનમાં અવગણવામાં આવે છે, અને સક્રિય કેન્દ્રોની સાંદ્રતામાં ફક્ત ઝડપી ફેરફારો ધ્યાનમાં લઈ શકાય છે. પી.આ ગતિમાં પરિવર્તન પ્રારંભિક પ્રારંભ અને શાખા અને સાંકળ સમાપ્તિની પ્રતિક્રિયાઓની દરના ગુણોત્તર દ્વારા નક્કી કરવામાં આવે છે. પ્રારંભિક પ્રારંભ દર એ સિસ્ટમમાં હાજર સક્રિય કેન્દ્રોની સાંદ્રતા પર આધારિત નથી. શાખાઓ અને તોડવાની પ્રક્રિયાઓના દર સક્રિય કેન્દ્રોના સાંદ્રતાને અનુરૂપ છે. આ સ્થિતિમાં, સક્રિય કેન્દ્રોની રચના અને ખર્ચનું એકંદર સંતુલન દાન, શાખાઓ અને તોડવાની પ્રક્રિયાઓની દરોના સરવાળે નક્કી કરવામાં આવે છે.
![]() (2.1)
(2.1)
શાખા અને ભંગાણ પ્રતિક્રિયાઓના દર નિર્ધારક અને ક્યાં છે. મતદાન, અમને મળે છે:
![]() (2.2)
(2.2)
જ્યારે સક્રિય કેન્દ્રોના એકાગ્રતાના સમયનો વ્યુત્પન્ન થાય છે
હકારાત્મક છે. સમય સાથે પ્રતિક્રિયા દર વધે છે. બ્રાન્ડેડ ચેઇન પ્રતિક્રિયાઓનું આ લક્ષણ આવા શાસનમાં સક્રિય કેન્દ્રોના ગુણાકારને કારણે છે જ્યારે શાખાની પ્રતિક્રિયાના દર સાંકળ સમાપ્તિની પ્રતિક્રિયાના દર કરતા વધી જાય છે.
Korolchenko એવાય. દહન અને વિસ્ફોટ પ્રક્રિયાઓ
જો પ્રતિક્રિયા શરૂ થાય તે પહેલા સિસ્ટમમાં સક્રિય કેન્દ્રો શામેલ નહોતા, દા.ત. અંતેટી= 0, સમીકરણ (2.2) નું એકીકરણ = 2.2 એકીકરણ આપે છે:
![]() (2.3)
(2.3)
CO ની કુલ પ્રતિક્રિયા દર શાખાની પ્રક્રિયાના દર દ્વારા નક્કી કરવામાં આવે છે. અંતિમ ઉત્પાદનો આ પ્રતિક્રિયા દરમિયાન જ બનાવવામાં આવે છે. દરેક પ્રારંભિક ચેઇન બ્રાન્ચિંગ ઇવેન્ટ માટે, અંતિમ ઉત્પાદનના પરમાણુ રચાય છે. તે નીચે મુજબ છે:
![]() (2.4)
(2.4)
સમયની સાંકળની પ્રતિક્રિયા વિકાસ શાખા અને સાંકળ સમાપ્તિની પ્રતિક્રિયાઓના દરના સ્થિરાંકોના પ્રમાણ દ્વારા નક્કી કરવામાં આવે છે, અને જ્યારે સમીકરણમાં ઘાત (2.4) હકારાત્મક અને ફરીથી-
ક્રિયા અમર્યાદિત વેગ આપે છે. પ્રતિક્રિયાના વિકાસની પ્રારંભિક અવધિમાં, નીચેના સંબંધો સાચું રહે છે:
શરૂઆતના પ્રારંભમાં પ્રારંભિક પ્રારંભની દર નાની હોવાના કારણે, ત્યાં કોઈ નોંધપાત્ર રાસાયણિક પરિવર્તન નથી. કેટલાક સમય પછી, મૂલ્ય એક કરતાં નોંધપાત્ર રીતે વધારે બને છે. તે પછી, સમીકરણ (2.4) અનુસાર પ્રતિક્રિયા દર ઝડપથી વધે છે અને ખૂબ મોટી મૂલ્યો સુધી પહોંચે છે, જોકે તે પહેલાં વ્યવહારિક રીતે અસ્પષ્ટ હતું.
સાંકળ પ્રતિક્રિયાના વિકાસ દરમિયાન વિલંબ અવધિ (ઇન્ડક્શન સમયગાળો) ની હાજરી પ્રતિક્રિયા પ્રણાલીમાં સક્રિય કેન્દ્રોની ચોક્કસ સંખ્યાને સંચયિત કરવાની આવશ્યકતા છે. આ રાસાયણિક પરિવર્તન પછી જ ધ્યાનપાત્ર બને છે.
સાંકળ પ્રતિક્રિયાઓના ઇન્ડક્શન સમયગાળાની તીવ્રતા શાખા અને સાંકળ સમાપ્તિની પ્રક્રિયાના દરના ગુણોત્તર નક્કી કરે છે, પ્રારંભિક પ્રારંભની દર નહીં. બદલામાં, શાખાઓ અને તોડવાની પ્રતિક્રિયાઓ દર દર પ્રતિક્રિયા પ્રણાલીની રાસાયણિક લાક્ષણિકતાઓને કારણે હોય છે; તે નિર્ધારણ દ્વારા નિર્ધારિત ઘટકો અને પ્રારંભિક ઘટકોની સાંદ્રતા દ્વારા નક્કી કરવામાં આવે છે. સાંકળ પ્રતિક્રિયાઓની વિશિષ્ટતા
એ છે કે શાખાઓની પ્રક્રિયામાં નોંધપાત્ર સક્રિયકરણ ઊર્જા જરૂરી છે, જ્યારે ભંગાણ પ્રક્રિયાના સતત દરની તાપમાન ગુણાંક શૂન્યની નજીક છે. તમામ ત્રણ પ્રકારોની સાંકળોને સમાપ્ત કરવાની પ્રતિક્રિયામાં: જથ્થાબંધ અને ભિન્ન સંકોચનના કિસ્સામાં, સક્રિય અશુદ્ધિઓ સાથે રેડિકલની ક્રિયાપ્રતિક્રિયામાં સક્રિયકરણ શક્તિ શૂન્ય છે.
તાપમાનમાં વધારો, મિશ્રણનો કુલ દબાણ, અથવા પ્રતિક્રિયાત્મક ઘટકોની સાંદ્રતામાં ફેરફાર સાથે, શાખા અને તૂટવાની દરના સ્થિરાંકોમાં ફેરફાર શક્ય છે, જેના પર પ્રતિક્રિયા સ્ટેશનરીથી નોન-સ્ટેશનરીમાં બદલાય છે. આ પ્રક્રિયાની વિશિષ્ટતા એક મોડથી બીજા મોડમાં અચાનક સંક્રમણમાં છે, એક નજીવી મૂલ્યથી પ્રતિક્રિયા દરને અમર્યાદિતપણે વધતી જતી એકમાં બદલવામાં.
કેટલીક સાંકળ પ્રતિક્રિયાઓનો પ્રવાહ મધ્યવર્તી ઉત્પાદનોની રચના સાથે છે જે પ્રમાણમાં સ્થિર છે, પરંતુ સક્રિય કેન્દ્રો જનરેટ કરવાની ક્ષમતા સાથે. આવી પ્રતિક્રિયાઓ, ઉદાહરણ તરીકે, હાઇડ્રોકાર્બન દહન પ્રતિક્રિયાઓ, મધ્યવર્તી જેમ કે પેરોક્સાઇડ્સ અને એલ્ડેહાઇડ્સ બને છે. આ સાંકળ શાખાઓ તરફ દોરી જાય છે. જો કે, મધ્યવર્તી ઉત્પાદનોની સાપેક્ષ સ્થિરતાને લીધે, પ્રતિક્રિયાના પ્રવેગક સમય સાથે વિસ્તરે છે. આવી ધીમી શાખાની સાંકળોને ડિજનરેટ કહેવામાં આવે છે.
નિયમ તરીકે સામાન્ય રેડિકલ બ્રાન્કીંગ મિકેનિઝમ સાથે ચેઇન પ્રતિક્રિયાઓ, રેડિકલની ઉચ્ચ પ્રવૃત્તિને કારણે, ઝડપથી આગળ વધે છે. પરિણામસ્વરૂપ રેડિકલ્સ કાં તો ઝડપી પ્રવેગક પ્રતિક્રિયા આપે છે, અથવા ફરીથી પ્રક્રિયા કરે છે અને પ્રક્રિયામાંથી બહાર નીકળી જાય છે.
ઓપન સર્કિટ સક્રિય કણો, જેમ કે કોઈપણ ગેસના પરમાણુ, પ્રતિક્રિયા પ્રણાલીમાં રેન્ડમ ગતિ બનાવે છે, અન્ય પરમાણુઓ સાથે અથડામણ કરે છે. તે જ સમયે, અન્ય સક્રિય કણો અથવા પરમાણુ સાથેની ક્રિયાપ્રતિક્રિયાના અથડામણ અને એક નવા સક્રિય કણોનું નિર્માણ, પાછલા એક માર્ગને ચાલુ રાખવાની ચોક્કસ સંભાવના છે. પ્રતિક્રિયા ચેઇનનો વિકાસ નિષ્ક્રિય પરમાણુઓની બ્રાઉનીયન ગતિ જેટલો જ છે, જો કે સક્રિય કેન્દ્રોનું સ્થાનાંતરણ રાસાયણિક પ્રતિક્રિયા સાથે થાય છે. સાંકળના વિકાસના માર્ગ પર બે અથવા વધુ પ્રકારનાં વૈકલ્પિક સક્રિય કેન્દ્રો.
Korolchenko એવાય. દહન અને વિસ્ફોટ પ્રક્રિયાઓ
પ્રતિક્રિયાઓની સાંકળ તે ક્ષણ સુધી ચાલુ રહે છે જ્યારે સક્રિય કણો પુનર્જીવન વિના પ્રતિક્રિયા આપતું નથી. આ કિસ્સામાં, કહેવાતા ઓપન સર્કિટ થાય છે. બ્રેઇન પ્રક્રિયાઓ સાંકળ પ્રતિક્રિયાઓ ના ગતિશાસ્ત્રમાં મોટી ભૂમિકા ભજવે છે. સક્રિય કેન્દ્રોની મૃત્યુ તરફ દોરી જવાના બે પ્રકારની પ્રતિક્રિયાઓ છે:
એકવિધ વિરામ (પ્રતિક્રિયા મિશ્રણની વોલ્યુમમાં મૃત્યુ);
વિષમ વિરામ (સખત સપાટી પર મૃત્યુ) સાંકળોનું એકરૂપ થવું એ બે પ્રક્રિયાઓમાંની એક સાથે શક્ય છે:
જ્યારે રેડિકલ ફરીથી સંમિશ્રણ કરે છે અથવા જ્યારે વિવિધ રાસાયણિક સક્રિય ઘટકો પછીના પુનર્જીવન વિના સક્રિય કેન્દ્રો સાથે ક્રિયાપ્રતિક્રિયા કરે છે.
જ્વલનશીલ ચેઇન તૂટવું દહન દરમિયાન રચાયેલી સૂક્ષ્મ કણો અથવા સખત બર્નિંગ સામગ્રીની સપાટી પર થાય છે. ઘન સપાટી પર ખુલ્લા સર્કિટને ગેસ મિશ્રણમાંથી સક્રિય કેન્દ્રોના પ્રસાર તરીકે આ સપાટી પર ફેલાવવામાં આવે છે, જેના પર તેઓ અદૃશ્ય થઈ જાય છે. નક્કર સપાટી પર ફરીથી સંયોજનની પદ્ધતિ એ છે કે સક્રિય કણો, જે વધતી પ્રતિક્રિયાશીલતા ધરાવે છે, તે સપાટી પર સોર્બેડ * છે. આ પ્રક્રિયા માટે કોઈ ઊર્જા અને અવકાશી અવરોધો નથી, કારણ કે આજુબાજુની સાઇટ્સ પર સોર્બડ થયેલા મૂળાક્ષરો એકબીજા સાથે ફરીથી જોડાયા છે. રિકોમ્બિનેશનના પરિણામે સ્થાયી સંયોજનોના પરમાણુ હવે સાંકળ પ્રતિક્રિયાના વિકાસમાં સામેલ નથી.
જો કે, નક્કર સપાટીવાળા સક્રિય કણોની દરેક અથડામણ તેના શોષણ તરફ દોરી જાય છે. કદાચ સપાટી પરથી તેના પ્રતિબિંબ. નક્કર સપાટી દ્વારા સક્રિય કેન્દ્રના શોષણની સંભાવનાને આવાસ ગુણાંક કહેવામાં આવે છે. આ ગુણાંક સક્રિય કણો અને સપાટીના રાસાયણિક સંબંધની લાક્ષણિકતા છે. વ્યવહારિક રીતે અગત્યના કિસ્સાઓમાં, દિવાલથી પ્રતિબિંબ પછી સક્રિય કણો દૂરથી દૂર જતો નથી. તેની રહેઠાણ થાય ત્યાં સુધી દિવાલ સાથે નવા અથડામણની શક્યતા છે. આ પ્રક્રિયાને લીધે, ચોક્કસ પરિસ્થિતિઓમાં, પ્રતિક્રિયા દર રહેવાસીઓ ગુણાંકથી વ્યવહારિક રીતે સ્વતંત્ર છે. આ પ્રક્રિયા ઇયુ જેવી રીતે આગળ વધે છે
* સૉર્પ્શન - પર્યાવરણના પદાર્થ હેક્ટરના નક્કર શરીર (અથવા પ્રવાહી) દ્વારા શોષણ. શોષક શરીરને સોર્બન્ટ કહેવાય છે, શોષાય છે- સોર્બેટ. સોર્બેન્ટ (શોષણ) અને સપાટી સ્તર (શોષણ) ના સમગ્ર સમૂહના શોષણમાં તફાવત કરો. ઘન સોર્બેન્ટ અને સોર્બેટની સપાટી વચ્ચેના રાસાયણિક પ્રકારની ક્રિયાપ્રતિક્રિયાને કારણે સૉપશનને કેમિસોર્પ્શન કહેવામાં આવે છે.
__________________________ પ્રકરણ 2. દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
જો દરેક અથડામણમાં ઓપન સર્કિટ થયું હોય. સપાટી પર સક્રિય કેન્દ્રોની સાંદ્રતા શૂન્ય હોઈ શકે છે.
પ્રતિક્રિયાત્મક મિશ્રણમાં સક્રિય અશુદ્ધિઓની ગેરહાજરીમાં, સાંકળોનો ભંગ જથ્થાબંધ સપાટી પર અથવા બલ્કમાં રેડિકલ દ્વારા ફરીથી એકરૂપ થઈ શકે છે. વાસ્તવિક આગમાં, બીજી રીતે મુખ્યત્વે અમલમાં મૂકવામાં આવે છે.
ચેઇન પ્રતિક્રિયાઓની ગતિવિજ્ઞાન પર કેટલાક પ્રભાવને નિષ્ક્રિય ગેસની પ્રતિક્રિયા પ્રણાલીમાં ઉમેરવામાં આવે છે. નિષ્ક્રિય ઉમેરણો સક્રિય કણો સાથે અથડામણની સંખ્યામાં વધારો કરે છે, સાંકળ તૂટી જવાની શક્યતામાં વધારો કરે છે અને તે મુજબ, એકંદર પ્રતિક્રિયાને અવરોધે છે.
પ્રતિક્રિયાત્મક મિશ્રણમાં પ્રતિક્રિયાશીલ ઉમેરણો - ઇન્હિબિટરની રજૂઆત સાથે સાંકળ પ્રતિક્રિયાઓની વધુ અસરકારક અવરોધ પ્રાપ્ત થાય છે. ઇન્હિબિટર સક્રિય કેન્દ્રો સાથે ક્રિયાપ્રતિક્રિયા કરે છે, પ્રતિક્રિયા તરફ દોરી જાય છે, સાંકળ ભંગ કરે છે. અવરોધિત મિશ્રણમાં પ્રતિક્રિયાના ગતિવિજ્ઞાન સક્રિય કેન્દ્રો સાથે ક્રિયાપ્રતિક્રિયા કરતી વખતે અવરોધક અને પ્રતિક્રિયાના મુખ્ય ઘટકો વચ્ચેની સ્પર્ધાના શરતો દ્વારા નક્કી કરવામાં આવે છે. અવરોધકની ઉચ્ચ કાર્યક્ષમતા અને નવા સક્રિય કેન્દ્રોની જનરેટની મધ્યમ દર સાથે, પહેલાથી જ અવરોધકના નાના ઉમેરણો ચેઇન પ્રતિક્રિયાના કોર્સને સંપૂર્ણપણે દબાવી શકે છે.
આગ અને વિસ્ફોટ સલામતીના પ્રથામાં અવરોધની પ્રક્રિયાઓ ખૂબ જ મહત્વપૂર્ણ છે. ઇનહિબિટરનો ઉપયોગ તમને દહન પ્રક્રિયાઓને અસરકારક રીતે પ્રભાવિત કરવા દે છે.
2.2. હાઇડ્રોજનના દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
ઓક્સિજનના પરમાણુ સાથે હાઇડ્રોજન પરમાણુની ક્રિયાપ્રતિક્રિયા અનુગામી તબક્કાઓની શ્રેણી દ્વારા એક જટિલ માર્ગે થાય છે. હવે તે નિર્ધારિત છે કે હાઇડ્રોજનનું દહન ચેઇન મિકેનિઝમ દ્વારા થાય છે, જેમાં કણો સક્રિય કેન્દ્રોની ભૂમિકા ભજવે છે. હાઇડ્રોજનના દહન દરમિયાન પ્રારંભિક પ્રતિક્રિયાઓનું અનુક્રમણિકા અને મહત્વ વર્ણવ્યું છે કે હાઇડ્રોજન જ્યોતના ઉદભવ અને વિકાસ માટે વિવિધ સ્થિતિઓ માટે વિગતવાર વિગતો છે.
પ્રાયોગિક અને કમ્પ્યુટેશનલ પદ્ધતિઓનો ઉપયોગ કરીને સ્વયંસંચાલિત મોડમાં હાઇડ્રોજન દહન પ્રક્રિયાના સૌથી વિગતવાર વિશ્લેષણ પ્રોફેસર એ. એન. બાતાટોવ દ્વારા કરવામાં આવ્યાં હતાં. તેમણે 14 મૂળભૂત પ્રાથમિક પ્રતિક્રિયાઓ સહિત પ્રક્રિયાના નીચેની યોજનાનો પ્રસ્તાવ મૂક્યો:
Korolchenko એવાય. દહન અને વિસ્ફોટ પ્રક્રિયાઓ
સક્રિય કેન્દ્રોનું મૂળ પ્રતિક્રિયા દ્વારા થાય છે
![]()
પ્રતિક્રિયાઓની સાંકળ ચાલુ રાખવી
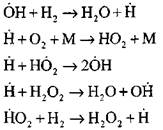
શાખાની સાંકળો
 |
ઓપન સર્કિટ
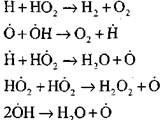 |
સ્વયંસંચાલિત પ્રક્રિયાના પ્રારંભિક તબક્કામાં હાઇડ્રોજન અણુઓની સાંદ્રતા પ્રારંભિક હાઇડ્રોજન સામગ્રીનું એક મહત્વનું ભાગ છે. સાંકળ પ્રતિક્રિયાના વિકાસ સાથે, પરમાણુ હાઇડ્રોજનનું રૂપાંતરણ દર એટલું ઊંચું થઈ જાય છે કે તે સેકન્ડના સોસમાં વપરાય છે.
2.3. કાર્બન મોનોક્સાઇડને બાળતા રાસાયણિક પ્રતિક્રિયાઓ
ઓક્સિજન સાથે કાર્બન મોનોક્સાઇડની ક્રિયાપ્રતિક્રિયા દહન પ્રક્રિયાઓ માટે મોટી પ્રતિક્રિયા છે. દરમિયાન આ પ્રતિક્રિયા કોર્સ
__________________________ પ્રકરણ 2. રાસાયણિક પ્રક્રિયાબર્નિંગ પર છે
ઘણા કિસ્સાઓમાં કાર્બનવાળા પદાર્થોના દહનના નિયમો નક્કી કરે છે. પ્રતિક્રિયા એક શાખવાળી સાંકળ મિકેનિઝમ દ્વારા વર્ગીકૃત થયેલ છે. તેમાં ઘણા બધા લક્ષણો છે.
લાંબા સમય સુધી એવી માન્યતા હતી કે CO અને 0 2 નું સંપૂર્ણ શુષ્ક મિશ્રણ સળગતું અને બર્ન કરી શકતું નથી. જો કે, સામૂહિક સ્પેક્ટ્રોગ્રાફનો ઉપયોગ કરીને પાણીની ગેરહાજરી પર નજર રાખતા પ્રયોગો કાળજીપૂર્વક સેટ કરો જે દર્શાવે છે કે સુકા મિશ્રણ માટે ઇગ્નીશન પણ શક્ય છે. એ નોંધવું જોઈએ કે સિસ્ટમમાં CO + 0 2 વોટર બાષ્પ અથવા હાઇડ્રોજનની હાજરી શક્ય સક્રિય કેન્દ્રોની સંખ્યા વધારીને ઇગ્નીશન અને દહનની પ્રક્રિયાને સક્રિય કરે છે. પાણીની તીવ્ર અસર ખાસ કરીને ઓછી સાંદ્રતા પર ધ્યાનપાત્ર છે.
પાણીની વરાળની હાજરીમાં કાર્બન મોનોક્સાઇડનું મિશ્રણ અથવા હાઇડ્રોજનના નાના ઉમેરાઓ નીચેની પ્રાથમિક પ્રક્રિયાઓની ભાગીદારી સાથે થાય છે:

રેડિકલ, H0 2, જે પ્રતિક્રિયા (VI) દ્વારા બનેલ છે, સાંકળ (પ્રતિક્રિયા VIII) ચાલુ રાખી શકે છે અથવા પ્રતિક્રિયા (આઇએક્સ-XII) દ્વારા તેના ભંગાણ તરફ દોરી શકે છે.
સાંકળના વિસ્ફોટમાં CO ની ધીમી ઓક્સિડેશનની શરતોનું મૂલ્યાંકન કરવા માટે, ચાલો રેડિકલ H0 2 દ્વારા ચેઇન બ્રેકની સંભાવનાનું અનુમાન કરીએ; અહીં આપણે ધ્યાનમાં લઈએ છીએ કે સાંકળ સમાપ્તિમાં પ્રતિક્રિયાઓ (X) અને (XI) ની ભૂમિકા, શરતોના સંદર્ભમાં અસ્પષ્ટ હશે.
પ્રતિક્રિયા (આઇએક્સ) ની તુલનામાં, 1000 કળના ઓર્ડરના તાપમાને પ્રક્રિયાઓ (IX-XI) ની દર એકબીજાના નજીક હોય છે, પરંતુ હાઈડ્રોજન અણુઓની સાંદ્રતા કરતાં રેડિકલનું એકાગ્રતા ઘણું ઓછું હોય છે, કેમ કે રેડિકલમાં ઉચ્ચ રાસાયણિક પ્રવૃત્તિ હોય છે. તેથી, રેડિકલ H0 2 દ્વારા ઓપન સર્કિટની સંભાવના ફોર્મમાં લખી શકાય છે:
1000K ની તાપમાને
તેથી, તે પૂરું પાડ્યું
![]()
![]()
તીવ્રતા અસર
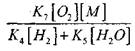
સમીકરણ (2.7) ઉકેલવા પર નબળા રહેશે.
પ્રકરણ 2. દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
કિસ્સામાં ![]() અથવા
અથવા ![]() (શું ધ્યાનમાં રાખવામાં આવે છે
(શું ધ્યાનમાં રાખવામાં આવે છે
વાસ્તવિક જ્યોત સાથે), સમીકરણ (2.7) ફોર્મમાં રૂપાંતરિત થાય છે:
![]() (2.8)
(2.8)
આમ, હવામાં કાર્બન મોનોક્સાઇડ બર્ન કરવાની સ્થિતિ મોટાભાગે હાઇડ્રોજન બર્નિંગની હાજરી અને પેટર્ન દ્વારા નક્કી કરવામાં આવે છે. પ્રતિક્રિયા દ્વારા CO (ઓ) નું ઓક્સિડેશન (I) હાઇડ્રોજનને સંડોવતા પ્રતિક્રિયાઓમાં બનેલા ઓએચ રેડિકલના એકાગ્રતા પર આધારિત છે.
કાર્બન મોનોક્સાઇડના દહન પ્રતિક્રિયાની વિશિષ્ટતા તેના ઝડપી અવરોધમાં આવે છે જ્યારે હાઇડ્રોજન પરમાણુ માટે ઉચ્ચ સંબંધ ધરાવતી પદાર્થોની પ્રતિક્રિયાશીલ પ્રક્રિયામાં નાના ઉમેરણો રજૂ કરવામાં આવે છે. CO ના દહનને અવરોધે છે તેવા પદાર્થો હાયડ્રોકાર્બનની હલાઇઝ અને હેલો-ડેરિવેટિવ્ઝ છે. પ્રતિક્રિયા દ્વારા હાઇડ્રોજન પરમાણુ સાથે ક્રિયાપ્રતિક્રિયા કરતી વખતે પ્રતિક્રિયા સાંકળોને સમાપ્ત થવાને કારણે તેમની અવરોધક અસર
2.4. હાઇડ્રોકાર્બન બર્નિંગ
હાઇડ્રોજન અને કાર્બન મોનોક્સાઇડના દહન પ્રક્રિયાઓની તપાસ દહન પ્રતિક્રિયા મિકેનિઝમની જટિલતા બતાવે છે. H2 અને CO ના કિસ્સામાં, પ્રતિક્રિયા ઘણા પ્રારંભિક તબક્કાઓ અને મધ્યવર્તી ઉત્પાદનોની ભાગીદારી સાથે ચેઇન તરીકે આગળ વધે છે. તેથી, એ અપેક્ષા રાખવી સ્વાભાવિક છે કે વધુ જટિલ પદાર્થોના દહન પ્રતિક્રિયાઓની પદ્ધતિ - હાઇડ્રોકાર્બન - તે વધુ જટિલ છે અને આ સંયોજનોની ઇગ્નીશન અને દહનની પ્રક્રિયાઓ સાથેની અસરો વધુ વૈવિધ્યસભર છે.
હાઈડ્રોકાર્બનની રાસાયણિક ઉન્નતીકરણની પ્રકૃતિ અંગે હાલમાં ઉપલબ્ધ માહિતી તેમના દહનની પ્રક્રિયામાં, અમને અંદાજિત અસરોને કેટલાક અંદાજ સાથે સમજાવવા માટે પરવાનગી આપે છે.
તે અધિષ્ઠાપિત થયું હતું કે હાઈડ્રોકાર્બન ફ્લેમ્સમાં, પહેલાથી જ જાણીતા સક્રિય કણો સાથે, વધુ જટિલ માળખાની મોટી સંખ્યામાં મધ્યવર્તી ઉત્પાદનો છે. કેટલાક કિસ્સાઓમાં, તેઓ નવી સાંકળોના ઉદભવના સ્રોત બને છે. હાઇડ્રોકાર્બન્સના ઇગ્નીશન અને દહનની પ્રક્રિયામાં મુખ્ય ભૂમિકા નીચે મુજબના મધ્યવર્તી સંયોજનો દ્વારા ભજવવામાં આવે છે:
Korolchenko એવાય. દહન અને વિસ્ફોટ પ્રક્રિયાઓ
1. હાઇડ્રોકાર્બન રેડિકલ, જેનો પરમાણુ છે
લેવોડોરોડા, કે જે એક અથવા વધુ હાઇડ્રોજન અણુઓને દૂર કરે છે. આ
અવશેષો એલ્કાયલ કહેવામાં આવે છે (સીએચ 3 - મીથિલ; સી 2 એચ 5 - એથિલ; સી 3 એચ 7 - પ્રોપાઇલ અને
વગેરે). તેના ઉચ્ચ પ્રતિક્રિયાશીલતાને કારણે, મફત એલ્કિલ્સ
લાંબા સમય સુધી અસ્તિત્વમાં નથી. મધ્યવર્તી તરીકે જ્યોતમાં હાજર
ઉત્પાદનો. જ્યારે અન્ય પરમાણુઓ સાથે વાતચીત કરે છે ત્યારે વર્તે છે
એક સ્વતંત્ર માળખાકીય જૂથ તરીકે. હાઇડ્રોકાર્બન રેડિકલ
સામાન્ય રીતે અક્ષર આર દ્વારા રજૂ થાય છે.
2. પેરોક્સાઇડ્સ - સામાન્ય ફોર્મ્યુલા આર -00-આરના સંયોજનો ".
3. એલ્ડેહાઇડ્સ - ટાઇપ કંપાઉન્ડ્સ
![]()
સૌથી સરળ એલ્ડેહાઇડ્સ ફોર્મિક (ફોર્માલ્ડેહાઇડ) અને એસીટિક (એસીટાલ્ડેહાઇડ) છે. ![]() . આ પદાર્થો બધા છે
. આ પદાર્થો બધા છે
હાઇડ્રોકાર્બનના અપૂર્ણ દહનના ઉત્પાદનોમાં હાજર છે.
હાઇડ્રોકાર્બન્સના દહન દરમિયાન ચેઇન રચના કોઈપણ પ્રતિક્રિયા હોઈ શકે છે જેમાં હાઇડ્રોકાર્બન રેડિકલ બનાવવામાં આવે છે. આ બે મુક્ત મિથાઈલ જૂથોની રચના સાથે ઇથેન પરમાણુની વિઘટન પ્રતિક્રિયા હોઈ શકે છે:
![]()
અથવા ઓક્સિજન સાથે હાઇડ્રોકાર્બનની પ્રતિક્રિયા:
![]()
બનાવટ પ્રતિક્રિયાઓના પરિણામે સાંકળો ચાલુ રહે છે પેરોક્સાઇડ અથવા હાઇડ્રોપેરૉક્સાઇડ:
![]()
હાઇડ્રોપેરૉક્સાઇડના વિઘટન દરમિયાન ચેઇનિંગ શાખાઓ હાથ ધરવામાં આવે છે:
પ્રકરણ 2. દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
પ્રતિક્રિયાઓ આપેલ અનુક્રમ પ્રતિક્રિયા પ્રણાલીમાં પેરોક્સાઇડ સંયોજનોની સાંદ્રતામાં ધીમે ધીમે વધારો તરફ દોરી જાય છે.
એક સાથે પેરોક્સાઈડ, રેડિકલ અને શરૂ થવાના સંચય સાથે
સમાંતર પ્રતિક્રિયાઓ છે:

આ પ્રતિક્રિયાઓ એટોથર્મિક છે; જ્યારે તેઓ મોટા જથ્થામાં ગરમી વહન કરે છે.
પ્રતિક્રિયા મિશ્રણના તાપમાનમાં વધારો સાથે, સક્રિય કેન્દ્રોની ભૂમિકા એક મધ્યવર્તી ઉત્પાદનથી બીજા ક્રમમાં નીચેના ક્રમમાં પસાર થાય છે: એલ્કાયલ હાઇડ્રોપેરૉક્સાઇડ્સ, ઍસીલ હાઇડ્રોપેરૉક્સાઇડ્સ, ફોર્મલ્ડેહાઇડ્સ.
ઉચ્ચ-તાપમાન ક્ષેત્ર (600-800 ડિગ્રી સે.) માં સમય સાથે પ્રતિક્રિયા મિશ્રણની રચનામાં ફેરફારોના પ્રાયોગિક અભ્યાસો દર્શાવે છે કે પ્રારંભિક હાઇડ્રોકાર્બનને અંતિમ દહન ઉત્પાદનોમાં તબદીલ કરવાની પ્રક્રિયા બે તબક્કામાં વહેંચાયેલી છે: પ્રથમ, ખૂબ ઊંચા દરે બને છે, તે હાઇડ્રોકાર્બનને CO માં ઓક્સિડેશન કરે છે. બીજા, ધીમી, તબક્કામાં, CO ને ઓક્સિડાઇઝ્ડ કરવામાં આવે છે. એક ખૂબ જ મહત્વપૂર્ણ નિષ્કર્ષ નીચે મુજબ છે: હાઇડ્રોકાર્બન્સના દહનના ઘણા નિયમો કાર્બન મોનોક્સાઇડના દહનની લાક્ષણિકતાઓ દ્વારા સમજાવી શકાય છે.
2.5. કાર્બન બર્નિંગ
કાર્બન બર્નિંગ વિવિધ પ્રક્રિયાના મિકેનિઝમ પ્રમાણે મળે છે, જેનો વિશિષ્ટતા એ છે કે રાસાયણિક તબક્કાની આસપાસના અવકાશમાંથી ગેસયુક્ત ઓક્સિડેન્ટ (હવાના ઓક્સિજન) ના સ્થાનાંતરણની પ્રક્રિયામાંથી સળગી ગયેલી ઘનની સપાટીથી એકાંતમાં માનવામાં આવતું નથી. બળતણનો દર કાર્બનના રાસાયણિક ગુણધર્મો અને બળતણ સપાટી પર ઑક્સિજન પૂરો પાડવાની પ્રક્રિયાને નિર્ધારિત કરતી લાક્ષણિકતાઓ પર આધારિત છે. જ્વલન ઝોનને ઑક્સિજન પુરવઠો પ્રસાર દ્વારા કરવામાં આવે છે અને તેથી
Korolchenko એવાય. દહન અને વિસ્ફોટ પ્રક્રિયાઓ
ઘણા પરિબળો પર આધાર રાખે છે: બર્નિંગ બોડીનું આકાર અને કદ, વાયુમંડળની હિલચાલ, ઓક્સિજનના પ્રસરણ ગુણોત્તર અને બળતણ સપાટી ઉપરની જગ્યા અને કોલસો અને કોકમાં નોંધપાત્ર પ્રમાણમાં રહેલા ક્રેક્સ અને છિદ્રોમાં પ્રતિક્રિયા ઉત્પાદનો.
વિવિધ કાર્બન બર્નિંગની લાક્ષણિકતાઓને સમજાવવા માટે, અમે ભઠ્ઠામાં રાખેલા કોલસાના અલગ ભાગના 900 ડિગ્રી સે. તાપમાને ગરમ કરેલું વર્તન ધ્યાનમાં રાખીએ છીએ. પ્રારંભિક ક્ષણે, તેની સપાટીની નજીક સ્થિત ઑક્સિજનના ખર્ચ પર કોલસાનું દહન થાય છે. તેનો ઉપયોગ થાય તે પછી, જ્વલન ઉત્પાદનોની એક સ્તર ગરમ સપાટીની આસપાસ રચાય છે. બર્નિંગ રેટ ઘટશે, અને ગેસ અવકાશના વધુ દૂરના વિસ્તારોમાંથી ઑક્સિજન ન આવે તો પ્રક્રિયા બંધ થઈ શકે છે.
આ પ્રવાહ પ્રસરણ દ્વારા થાય છે, અને બર્નિંગ દર પ્રસરણ પ્રવાહ દ્વારા નિર્ધારિત કરવામાં આવશે. પ્રસરણ તીવ્રતા મોટા પ્રમાણમાં સળગતી સપાટીની નજીકના ગેસ માધ્યમના ચળવળની તીવ્રતા અને પ્રકૃતિ પર આધારિત છે. રાસાયણિક પ્રતિક્રિયા દર મુખ્યત્વે તાપમાન દ્વારા નક્કી કરવામાં આવે છે. અતિશય પ્રતિક્રિયાઓ, સાથે સાથે સમર્પિત, એરે-નિયસ કાયદાનું પાલન કરે છે.
ઊંચા તાપમાને, કાર્બનનું ઓક્સિડેશન પ્રતિક્રિયા ખૂબ ઝડપથી થાય છે, અને પ્રક્રિયાની કુલ ગતિ સપાટી પર ઓક્સિજનના પ્રસાર દ્વારા મર્યાદિત રહેશે.
આમ, કાર્બન બર્નિંગની પ્રક્રિયામાં વિવિધ પ્રકૃતિની બે પ્રક્રિયાઓ છે: ગેસની જગ્યાથી તેની વપરાશના સ્થળે હવા ઓક્સિજન પરિવહનની પ્રક્રિયા અને ઘન કાર્બનની સપાટી સાથે તેના રાસાયણિક ક્રિયાપ્રતિક્રિયાની પ્રક્રિયા. આ બંને પ્રક્રિયાઓ એકબીજા સાથે સંકળાયેલી છે, પરંતુ દરેકના પોતાના કાયદા છે. આ પ્રક્રિયાઓમાંની સૌથી મહત્વપૂર્ણ પ્રક્રિયા ઓક્સિજન વપરાશની પ્રક્રિયા છે, જે વિવિધ રાસાયણિક પ્રતિક્રિયાઓ દ્વારા વર્ગીકૃત કરવામાં આવે છે.
કાર્બન સાથે ઓક્સિજનને સંયોજિત કરવાની જટીલ પ્રતિક્રિયાની પદ્ધતિમાં સી સી અને 0 ની બે ઓક્સાઇડ્સનું એક સાથે રચના કરવામાં આવી છે, જે પ્રકાર સી X 0 વાયના ઇન્ટરમિડિયેટ ભૌતિક કેમિકલ કેમિકલ દ્વારા બનાવવામાં આવે છે, જેને પછી CO માં વિભાજિત કરવામાં આવે છે. આ ઑક્સાઇડ્સનો ગુણોત્તર બર્નિંગ સ્થિતિ પર આધારિત છે. તદનુસાર, બર્નિંગ કાર્બનની પ્રતિક્રિયા માટે સમીકરણ નીચે પ્રમાણે લખી શકાય છે:
પ્રકરણ 2. દહન દરમિયાન રાસાયણિક પ્રક્રિયાઓ
પછી બર્નિંગ કાર્બન મોનોક્સાઇડની આવકની એક સમાન પ્રતિક્રિયા:
જે પદ્ધતિની કલમ 2.3 માં ચર્ચા કરવામાં આવી છે.
આ પ્રતિક્રિયા કાર્બન સપાટીની નજીક થઈ શકે છે, તેથીઅને કોલસો માસ અંદર, તેના છિદ્રો અને ક્રેક્સ માં.
બીજી પ્રતિક્રિયા એ ગરમ કાર્બન અને કાર્બન ડાયોક્સાઇડ વચ્ચેની વિવિધ પ્રતિક્રિયા છે:
![]()
તે ઓક્સિજનની અછત હોય તેવા સ્થાને નોંધપાત્ર ગતિએ વહે છે, પરંતુ જ્યાં કાર્બનનું તાપમાન ખૂબ ઊંચું હોય છે.
વર્ણવેલ પ્રતિક્રિયાઓનું મિશ્રણ કાર્બનના દહનના ઉત્પાદનોની રચના નક્કી કરે છે.
સંમિશ્રણ પ્રક્રિયાઓની તીવ્રતા
| આર |
બળતણયુક્ત મિશ્રણમાં સિંચાઈ તેમના સ્વ-ઇગ્નીશન, બાહ્ય સ્રોત અથવા સ્વયંસંચાલિત દહન દ્વારા ઇગ્નીશનના પરિણામે થઈ શકે છે. જો આત્મ-ઇગ્નીશન અને ઇગ્નીશનની પ્રક્રિયાઓ વાયુઓ, પ્રવાહી અથવા નક્કર સ્થિતિમાં હોય તેવા પદાર્થોની લાક્ષણિકતા હોય, તો સ્વયંસ્ફુરિત દહન ઘન પદાર્થોની લાક્ષણિકતા (ખાસ કરીને તે સૂક્ષ્મ વિભાજિત રાજ્યમાં હોય છે) અથવા વિકસિત સપાટી સાથે સામગ્રી પર વિતરિત ઉચ્ચ ઉકળતા પ્રવાહી હોય છે.
3.1. આત્મ-ઇગ્નીશન. સ્થાયી થિયરી
અગ્નિ એક અનિયંત્રિત બર્ન છે જે સમય અને જગ્યામાં વિકાસ પામે છે, જે લોકોને જોખમી બનાવે છે અને સામગ્રીને નુકસાન પહોંચાડે છે.
મનુષ્યો માટે આગના જોખમો ખુલ્લી આગ, સ્પાર્કસ, તાવ, દહનના ઝેરી ઉત્પાદનો, ધૂમ્રપાન, ઘટાડો ઓક્સિજન, ઇમારતોના પતન અથવા સ્થાપનો છે.
જ્વલન એ ઝડપથી કાર્યરત છે, ભૌતિક-રાસાયણિક પ્રતિક્રિયા, ગરમી અને ધૂમ્રપાન, જ્યોત અથવા સ્મોલ્ડરિંગની રજૂઆત સાથે. સામાન્ય પરિસ્થિતિઓમાં, જ્વલન એ વાતાવરણમાં ઓક્સિજન સાથે જ્વલનશીલ પદાર્થને ઑક્સિડાઇઝ કરવાની અથવા સંયોજિત કરવાની પ્રક્રિયા છે. જો કે, કેટલાક પદાર્થો (ઉદાહરણ તરીકે, કમ્પ્રેસ્ડ એસેટીલીન, નાઇટ્રોજન ક્લોરાઇડ, ઓઝોન) ગરમી અને જ્યોત રચવા માટે ઓક્સિજન વિના વિસ્ફોટ કરી શકે છે. પરિણામે, જ્વલન માત્ર સંયોજનની જ નહીં, પણ વિઘટનની પ્રતિક્રિયાઓમાંથી પરિણમી શકે છે. તે પણ જાણીતું છે કે હાઇડ્રોજન અને ઘણાં ધાતુઓ ક્લોરિનના વાતાવરણમાં, સલ્ફર વરાળમાં કોપર, કાર્બન ડાયોક્સાઇડમાં મેગ્નેશિયમ વગેરેમાં બાળી શકે છે.
ઓક્સિજન સાથે જ્વલનશીલ પદાર્થના ઓક્સિડેશન દરમિયાન થાય છે તે સૌથી ખતરનાક દહન. તે જ સમયે, ઇંધણ પ્રણાલીને જરૂરી ઉર્જાની સપ્લાય કરવા માટે ઇગ્નીશન સ્ત્રોત હોવું જરૂરી છે. ઇગ્નીશનના સૌથી સામાન્ય સ્રોત આ પ્રમાણે છે: જ્યારે સ્પ્રૅક્સ દેખાય છે ત્યારે વિદ્યુત ઉપકરણોની ખામી, ધ્રુવીય ધાતુના પદાર્થો, વેલ્ડીંગ, ફોર્જિંગ કાર્યો; ગરબડ દ્વારા પેદા ગરમી; તકનીકી ગરમી ઉપકરણો; આગ ઉપકરણો એડિએબેટિક કમ્પ્રેશનની ગરમી; સ્ટેટિક વીજળીની સ્પાર્ક સ્રાવ; વિદ્યુત સંપર્કોને ગરમ કરવી; ગરમીને છોડવાની પ્રક્રિયા સાથે આગળ વધતા રાસાયણિક પ્રતિક્રિયાઓ.
આ સ્રોતોનું ગરમીનું તાપમાન અલગ છે. તેથી, જ્યારે ધાતુનું શરીર ત્રાટક્યું હોય ત્યારે તે સ્પાર્ક 1900 ડિગ્રી સેલ્સિયસનું તાપમાન ધરાવે છે, મેચની જ્યોત લગભગ છે. 800 ડિગ્રી સેલ્સિયસ, સ્લિપજ દરમિયાન બેલ્ટ કન્વેયરનું અગ્રણી ડ્રમ 600 ડિગ્રી સેલ્સિયસ છે અને ઇલેક્ટ્રિક ડિસ્ચાર્જની ગરમીમાં તાપમાન આશરે તાત્કાલિક રાસાયણિક પ્રતિક્રિયાઓ સાથે 10,000 ડિગ્રી સેલ્સિયસ સુધી પહોંચે છે.
બર્નિંગ સંપૂર્ણ અને અપૂર્ણ હોઈ શકે છે. સંપૂર્ણ દહન સાથે, ઓક્સિજનની વધારે પડતી સાથે, પ્રતિક્રિયા ઉત્પાદનો કાર્બન ડાયોક્સાઇડ, પાણી, નાઇટ્રોજન, સલ્ફર ડાયોક્સાઇડ હોય છે. ઓક્સિજનની અછત સાથે અપૂર્ણ દહન થાય છે, આ કિસ્સામાં દહન ઉત્પાદનો ઝેરી અને જ્વલનશીલ પદાર્થો છે - કાર્બન મોનોક્સાઇડ, આલ્કોહોલ, કેટોન્સ, એલ્ડેહાઇડ્સ વગેરે. દહન પદાર્થના સંપૂર્ણ દહન માટે અમુક ચોક્કસ હવા જરૂરી છે: લાકડાનું 1 કિલો - 4.18, પીટ - 5 , 8, પ્રોપેન - 23.8 એમ 3.
નીચે મુજબ દહન પ્રક્રિયાને કલ્પના કરી શકાય છે. ઉષ્ણકટિબંધના પ્રવાહની રજૂઆત સાથે ઠંડક દહનશીલ માધ્યમ ગરમ થાય છે, ત્યાં ઓક્સિજન સાથેના જ્વલનશીલ માધ્યમનું ઘન ઓક્સિડેશન અને વધારાના ગરમીને મુક્ત કરવામાં આવે છે. આ બદલામાં, જ્વલનશીલ પદાર્થની નજીકના સ્તરની ગરમી તરફ દોરી જાય છે, જેમાં તીવ્ર રાસાયણિક પ્રતિક્રિયા પણ થાય છે. જ્વલનશીલ પદાર્થની જેમ લેયર-બાય-લેયર દહન સાથે, દહન ઝોન ચાલે છે; આ ચળવળની ઝડપ દહન પ્રક્રિયાની તીવ્રતા નક્કી કરે છે અને તે તેની સૌથી મહત્વપૂર્ણ લાક્ષણિકતા છે. સ્તર-દ્વારા-સ્તર ગરમી, ઓક્સિડેશન અને દહન પ્રક્રિયા ચાલુ રહે ત્યાં સુધી જ્વલનશીલ પદાર્થની સંપૂર્ણ માત્રા થાકી જાય છે.
સાંકડી વિસ્તાર જેમાં પદાર્થ ગરમ થાય છે અને રાસાયણિક પ્રતિક્રિયા થાય છે તેને ફ્લેમ ફ્રન્ટ કહેવામાં આવે છે.
જ્વલનશીલ સિસ્ટમો રાસાયણિક રીતે એકરૂપ અને વિવિધતા હોઈ શકે છે. રાસાયણિક એકસરખી પદ્ધતિઓ એ જ્વલનશીલ વાયુઓ, બાષ્પીભવન અથવા વાયુ સાથેના ધૂળ મિશ્રણ છે, જેમાં દહનક્ષમ પદાર્થ અને હવા એકસરખા મિશ્રિત છે. આવી સિસ્ટમોને બાળી દેવાથી એકરૂપ કહેવાય છે. રાસાયણિક રીતે ભ્રમિત પ્રણાલીમાં, જ્વલનશીલ પદાર્થ અને હવા મિશ્રિત નથી અને તેમાં એક ઇન્ટરફેસ છે. આ ઘણીવાર સખત દહનકારી સામગ્રી હોય છે અને તેમના દહનને વિષુવવૃત્તીય કહેવામાં આવે છે.
જ્વલનશીલ મિશ્રણના દહનનો સંપૂર્ણ સમય ટીજી એ જ્વલનશીલ પદાર્થ અને ઓક્સિજન τ ક વચ્ચેના સંપર્ક માટે આવશ્યક સમયનો સરવાળો છે અને તે સમય જે દરમિયાન રાસાયણિક પોતે થાય છે, ઓક્સિડેશન પ્રતિક્રિયા τ x
આ બે શબ્દોના ગુણોત્તરના આધારે, પ્રસરણ અને ગતિશીલ દહન અલગ પાડવામાં આવે છે. સખત દ્વિતિય પદાર્થો સળગાવીને, પદાર્થની સપાટી પર ફેલાવા (ફેફસાં) કરવા માટે ઓક્સિજન માટે જરૂરી સમય રાસાયણિક પ્રતિક્રિયા સમય કરતાં ઘણો લાંબો સમય છે; તેથી, કુલ બર્નિંગ દર જ્વલનશીલ પદાર્થને ઓક્સિજન પ્રસરણ દર દ્વારા સંપૂર્ણપણે નિર્ધારિત કરવામાં આવે છે. આવા પદાર્થોનો બર્નિંગ મોટાભાગે અગ્નિમાં જોવા મળે છે અને તેને વિખેરવામાં આવે છે. દહન, જે દર રાસાયણિક પ્રતિક્રિયાના દર દ્વારા નિર્ધારિત કરવામાં આવે છે, તેને ગતિિક કહેવામાં આવે છે. આ પ્રકારના દહન એકવિધ જ્વલનશીલ સિસ્ટમ્સની લાક્ષણિકતા છે.
બર્નિંગના કેલોરીમેટ્રીક, સૈદ્ધાંતિક અને વાસ્તવિક તાપમાનને અલગ કરો.
દહનનું કેલરીમેટ્રીક તાપમાન તાપમાનને સંદર્ભિત કરે છે જે સંપૂર્ણ દહનના ઉત્પાદનો ગરમ થાય છે, જો બધી ગરમી છોડવામાં આવે તો તેને ગરમ કરવા માટે ખર્ચવામાં આવે છે, હવાની માત્રા સૈદ્ધાંતિકરૂપે આવશ્યક છે, પદાર્થો સંપૂર્ણપણે બળી જાય છે અને પ્રારંભિક તાપમાન 0 ° સે હોય છે. હીટ ખોટ શૂન્ય હોવાનું માનવામાં આવે છે. જો ઇંધણ અને હવાનું પ્રારંભિક તાપમાન 0 ડિગ્રી સેલ્સિયસ હોય, તો પછી દહનના કેલરીમેટ્રીક તાપમાન
![]()
જ્યાં ક્યૂન એ જ્વલનશીલ પદાર્થ, કે.સી.સી. / કેજીનું ચોખ્ખું કેલરીફ મૂલ્ય છે; વી એ દહન ઉત્પાદનોનું કદ છે, એમ 3 / કિલો; સી એ દહન ઉત્પાદનોની સરેરાશ વોલ્યુમેટ્રીક ગરમી ક્ષમતા, કેકેસી / એમ 3 ડીગ્રી છે.
પરિણામે, કેલરીમિટીક બર્નિંગ તાપમાન માત્ર જ્વલનશીલ પદાર્થના ગુણધર્મો પર આધાર રાખે છે અને તેના જથ્થા પર આધાર રાખે છે. સૈદ્ધાંતિક દહન તાપમાનમાં જ્વલન દરમિયાન ગરમી ગુમાવવાનું ધ્યાનમાં લેવામાં આવે છે. કેલરીમિટીક બર્નિંગ તાપમાન જ્વલનશીલ પદાર્થ માટે સૌથી વધારે છે અને ગુણાત્મક મૂલ્યાંકન માટે તેનો ઉપયોગ થાય છે. વાસ્તવમાં, જ્યારે બર્નિંગ થાય છે ત્યારે કિરણોત્સર્ગ, વધારાની હવા અને પર્યાવરણને ગરમ કરવાના કારણે ગરમીના નુકશાન થાય છે.
વાસ્તવિક બર્નિંગ તાપમાન આગ તાપમાન છે. આંતરિક અને બાહ્ય આગના તાપમાનમાં તફાવત કરો. બાહ્ય અગ્નિનું તાપમાન જ્યોતનું તાપમાન છે, અને આંતરિક તાપમાન રૂમમાં ધુમાડાના તાપમાને છે. પર્યાવરણમાં ઉષ્ણતા ગુમાવવા, દહન ઉત્પાદનો અને માળખાંને ગરમ કરવાને લીધે આગના કિસ્સામાં વિકાસ થતો વાસ્તવિક તાપમાન
હંમેશા સૈદ્ધાંતિક કરતાં ઓછા 30 ... 50%. ઉદાહરણ તરીકે, ગેસોલિનનો સૈદ્ધાંતિક બર્નિંગ તાપમાન 1730 ડિગ્રી સેલ્સિયસ છે, અને વાસ્તવિક તાપમાન 1400 ડિગ્રી સેલ્સિયસ છે.
ઓક્સિડાઇઝિંગ એજન્ટ સાથે દહનશીલ બાષ્પ અને ગેસનું મિશ્રણ માત્ર તેમાં બળતણની ચોક્કસ સામગ્રી સાથે જ બર્ન કરી શકે છે.
જ્વલનશીલ ગેસની સૌથી ઓછી સાંદ્રતા કે જેના પર દહન પહેલાથી શક્ય છે તેને ઇગ્નીશન (એલઇએલ) ની નીચી સાંદ્રતા મર્યાદા કહેવામાં આવે છે. સૌથી વધુ એકાગ્રતા કે જેના પર દહન શક્ય છે તે ઉચ્ચ ઇક્વિશન સીમા (એઆઇપડબ્લ્યુડબલ્યુ) કહેવામાં આવે છે. આ સીમાઓની અંદર આવેલ એકાગ્રતાના પ્રદેશને ઇગ્નીશનનો વિસ્તાર કહેવામાં આવે છે. ઇગ્નીશન આગની (આગવાની શરૂઆત) છે, જે જ્યોતની રજૂઆત સાથે છે. આ એક સ્થિર લાંબી બર્નિંગ છે, જે ઇગ્નીશન સ્રોતને દૂર કર્યા પછી પણ બંધ થતું નથી. ઇગ્નીશન ની નીચલા અને ઉપલા સીમાઓની કિંમતો ગેસ, બાષ્પીભવન અને હવા મિશ્રણની ધૂળ, દહનશીલ મિશ્રણમાં નિષ્ક્રિય ઘટકોની સામગ્રી પર આધારિત છે. જ્વલનશીલ મિશ્રણમાં નિષ્ક્રિય ગેસના ઉમેરાથી ઇગ્નીશનના ક્ષેત્રનો સમાવેશ થાય છે અને આખરે તે બિન-જ્વલનશીલ બને છે. ઇગ્નીશનની મર્યાદાઓને નોંધપાત્ર રીતે સાંકડી કરો, કેટલીક અશુદ્ધિઓ કે જે દહન પ્રતિક્રિયા ધીમું કરે છે. આમાંથી સૌથી સક્રિય હોલોજેક્ટેડ હાઇડ્રોકાર્બન છે. બન્ને ચિહ્નિત ગુણધર્મોનો ઉપયોગ બર્નિંગ રોકવા માટે થાય છે. વાતાવરણીય દબાણ નીચેના મિશ્રણના દબાણને ઓછું કરવાથી ઇગ્નીશનના ક્ષેત્રનો પણ સમાવેશ થાય છે, અને ચોક્કસ દબાણથી મિશ્રણ અવિશ્વસનીય બને છે. જ્વલનશીલ મિશ્રણના દબાણમાં વધારો ઇગ્નીશનના ક્ષેત્રને વિસ્તૃત કરે છે, પરંતુ નિયમ રૂપે સહેજ. દહનશીલ મિશ્રણના તાપમાનમાં વધારો એ ઇગ્નીશનના વિસ્તારને વિસ્તૃત કરે છે. ઇગ્નીશનનો એકાગ્રતા ઇગ્નીશન સ્રોતની શક્તિથી પણ પ્રભાવિત થાય છે.
માત્ર એકાગ્રતા નથી, પણ ઇગ્નીશનની તાપમાન મર્યાદા પણ હોય છે.
વાયુમાં બાષ્પીભવનની ઇગ્નીશન માટે તાપમાન મર્યાદા એ જ્વલનશીલ પદાર્થના તે તાપમાને છે જેના પર સંતૃપ્ત બાષ્પગ્રસ્ત તત્વો ઇગ્નીશનની નિમ્ન અથવા ઉચ્ચ સાંદ્રતા મર્યાદાને અનુરૂપ સાંદ્રતા બનાવે છે. ઇગ્નીશન તાપમાન એ સૌથી નીચું તાપમાન છે જેમાં પદાર્થ સળગાવે છે અથવા ધૂમ્રપાન કરે છે અને ઇગ્નીશનના સ્ત્રોતને દૂર કર્યા પછી બળતરા અથવા સ્મોલ્ડર ચાલુ રાખે છે. ઇગ્નીશન તાપમાન સ્વ-દહન માટે પદાર્થની ક્ષમતાને પાત્ર બનાવે છે. જો પદાર્થનો ઇગ્નીશન તાપમાન ગેરહાજર હોય, તો તે ધીમી-બર્નિંગ અથવા બિન-દહનશીલ તરીકે ઓળખાય છે.
તાપમાનની ક્રિયા હેઠળ ઓક્સિડેશન પ્રતિક્રિયાના પ્રવેગક સ્વ-ઇગ્નીશન તરફ દોરી જાય છે. ઇગ્નીશન પ્રક્રિયાથી વિપરીત, જેમાં માત્ર જથ્થાના મર્યાદિત ભાગ - સપાટી - સળગાવશે, પદાર્થની સંપૂર્ણ માત્રામાં સ્વ-ઇગ્નીશન થાય છે. આત્મ-ઇગ્નીશનનું તાપમાન સૌથી નીચું તાપમાન ગણવામાં આવે છે, જેના માટે પદાર્થ ગરમ થવો જોઈએ, જેથી તે વધુ સ્વતઃ-ઓક્સિડેશનના પરિણામ સ્વરૂપે સળગાવશે. સ્વયં-ઇગ્નીશન ફક્ત ત્યારે જ શક્ય છે જ્યારે ઓક્સિડેશન પ્રક્રિયા દરમિયાન પ્રકાશિત થતી ગરમીની માત્રા ઉષ્ણતામાનને ઉષ્ણતામાનથી મુક્ત કરે.
ઑટો-ઇગ્નીશન તાપમાન પદાર્થ માટે સતત નથી, કારણ કે તે મોટે ભાગે તેના નિર્ણયની શરતો પર આધારિત છે. તુલનાત્મક ડેટા મેળવવા માટે, પરીક્ષણ સાધનો અને વાયુઓ અને બાષ્પીભવનના સ્વયં-ઇગ્નીશનના તાપમાનને નક્કી કરવા માટેની પદ્ધતિ પ્રમાણિત કરવામાં આવે છે (ગોસ્ટ 13920-68). પ્રમાણભૂત પદ્ધતિ દ્વારા નક્કી કરાયેલું સૌથી નીચું તાપમાન, જેમાં વાયુ અને વાયુ સાથે હવાનું મિશ્રણ સમાન હોવું આવશ્યક છે, જેથી તેમાં બાહ્ય ઇગ્નીશન સ્રોત દાખલ કર્યા વગર તેને સળગાવી શકાય, તેને માનક ઓટો ઇગ્નીશન તાપમાન કહેવામાં આવે છે.
એક સ્વયંસંચાલિત ઇગ્નીશન એ સ્વયંસંચાલિત દહન છે, દા.ત., ઇગ્નીશન સ્રોતના પ્રભાવ વિના સ્વ-હીટિંગના પરિણામે દહન. સ્વયંસંચાલિત ઇગ્નીશન અને સ્વયંસંચાલિત દહન વચ્ચેના તફાવત તાપમાનની તીવ્રતામાં હોય છે. સ્વયંસ્ફુરિત દહન આસપાસના તાપમાને થાય છે, અને આત્મ-ઇગ્નીશન માટે બહારથી પદાર્થને ગરમી આપવો જરૂરી છે.

 ગરમ અને ઠંડા જળ પુરવઠોના કાઉન્ટરોના સંકેતોની રીસેપ્શન
ગરમ અને ઠંડા જળ પુરવઠોના કાઉન્ટરોના સંકેતોની રીસેપ્શન વિવિધ આકાર અને ફિટિંગની હવા નળીના ક્ષેત્રની ગણતરી
વિવિધ આકાર અને ફિટિંગની હવા નળીના ક્ષેત્રની ગણતરી દહન પ્રક્રિયાઓની રસાયણશાસ્ત્ર. વિસ્ફોટ ઊર્જા
દહન પ્રક્રિયાઓની રસાયણશાસ્ત્ર. વિસ્ફોટ ઊર્જા જો તમે મીટર રીડિંગ્સ મોકલશો નહીં તો શું થશે
જો તમે મીટર રીડિંગ્સ મોકલશો નહીં તો શું થશે